siRNA
siRNA son las siglas en inglés de small interfering RNA, en español ARN pequeño de interferencia (ARNpi) o ARN de silenciamiento, una clase de ARN bicatenario.
Es un tipo de ARN interferente con una longitud de 20 a 25 nucleótidos que es altamente específico para la secuencia de nucleótidos de su ARN mensajero diana, interfiriendo por ello con la expresión del gen respectivo. Interviene en el mecanismo denominado interferencia de ARN (RNA interference, RNAi), donde el siRNA interfiere con la expresión de un gen específico, reduciéndola. Además, los siRNAs también actúan en otras rutas relacionadas con el RNAi, como en la defensa antiviral o en la organización de la estructura de la cromatina en un genoma. La complejidad de estas rutas es el objeto de intensos estudios, y su descubrimiento fue la razón por la cual Craig C. Mello y Andrew Fire recibieron el Premio Nobel de Fisiología o Medicina 2006.

Definición y modo de funcionamiento
[editar]Los siRNAs son moléculas de ARN doble hebra de 20-25 nucleótidos (nt) perfectamente complementarias, que se originan a partir de un ARN largo de doble hebra (dsRNA, double strand RNA). Los dsRNAs pueden ser de origen endógeno (por ejemplo los tránscritos generados a partir de secuencias de ADN repetidas en tándem), o de origen exógeno (como virus o transgenes). La enzima responsable del procesamiento del dsRNA en moléculas de siRNAs es Dicer, una enzima citoplásmica de la familia ARNasa III, que procesa el dsRNA en fragmentos de ARN doble hebra con extremos 5' fosfato y 2 nucleótidos libres con extremo hidroxilo (-OH) en 3'.[1]
Los siRNAs suprimen la expresión de los genes diana mediante el corte del ARN mensajero (ARNm) complementario en dos mitades, a través de la interacción de la hebra antisentido del siRNA con el complejo RISC (RNA-induced silencing complex). Las dos mitades del ARNm son posteriormente degradadas por la maquinaria celular, lo que conlleva la supresión de la expresión del gen.[2]
Por otro lado, los siRNAs promueven la modificación del ADN, facilitando el silenciamiento de la cromatina, puesto que favorecen la expansión de los segmentos de heterocromatina, a través del complejo RITS (RNA-induced transcriptional silencing).[3]
Descubrimiento
[editar]PTGS en plantas
[editar]
El mecanismo de interferencia de ARN (RNAi) se observó por primera vez en plantas como parte del silenciamiento post-transcripcional de genes (PTGS). Investigadores que trataban de introducir transgenes en petunias para conseguir flores de un color violeta más intenso, obtuvieron flores con zonas blancas, lo que indicaba que tanto los transgenes introducidos como los genes endógenos habían sido silenciados.[5] Este efecto se denominó co-supresión, y se observó que podía inducirse por:
- la expresión de un transgén en altos niveles
- transgenes que se expresan en niveles menores, pero que se integran en el genoma de la planta en copias múltiples
- por secuencias homólogas a un gen endógeno que se han introducido mediante un virus
Por esta razón, se supuso que este era un mecanismo de defensa en las plantas, de forma que estas responden a la infección de los retrovirus mediante la destrucción de los ARN virales. Sin embargo, el mecanismo de acción era desconocido.
La tecnología anti-sense en gusanos
[editar]
Por otro lado, los investigadores que trabajaban en la década de los 90 en el gusano C. elegans, inyectaban ARN-antisense en las gónadas del gusano para tratar de interferir con la expresión de los genes, puesto que pensaban que el ARN-antisense se aparearía con el ARNm (sense), evitando de esta forma la traducción del ARNm y suprimiendo la expresión del gen objetivo. Sin embargo, Guo y Kemphues,[7] observaron que la inyección de ARN-sense en el gusano era igualmente eficaz que el ARN-antisense para la supresión de la expresión génica. Pero no podían explicar por qué razón.
En 1998, Andrew Fire, Craig C. Mello y colaboradores publicaron un trabajo en Nature,[8] en el cual indicaban que, si inyectaban solo ARN de hebra simple en el gusano, tanto sense como antisense, no se observaba ningún efecto. Sin embargo, si inyectaban ARN doble hebra (dsRNA), observaban la supresión específica del gen objetivo. Esto puede parecer contradictorio con los resultados de Guo y Kemphues,[7] pero estos inyectaron ARN de hebra simple (sense o antisense) que no había sido purificado, de forma que en el proceso de producción se producen segmentos de doble hebra, que son los que generan la supresión observada por Guo y Kemphues. Sin embargo, Fire y Mello utilizaron ARN purificado, que no contiene dsRNA y por tanto es inactivo. Cuando las hebras sense y antisense se aparean para producir dsRNA, el efecto de supresión es 100 veces mayor al observado con las hebras simples por separado.
Asimismo, en el mismo reporte, Fire y Mello establecieron que la interferencia de la expresión del gen objetivo se produce a nivel del ARNm: cuando inyectaron en gusanos dsRNA contra el gen mex-3, detectaron que el ARNm de mex-3 desaparece, y por tanto los gusanos no son viables. Sin embargo, cuando inyectaban ARN de hebra simple (sense o antisense) contra mex-3, la mayor parte del ARNm de mex-3 permanecía intacto, y por ello no se observa fenotipo.[8]
Igualmente, también establecieron que el efecto de supresión solo ocurre si el dsRNA que se introduce en el gusano es complementaria de una región codificante (exones), pero no si es complementaria de una región no codificante (intrones o el promotor). Esto indica que la interferencia se produce a nivel del ARNm, cuando ya se han eliminado los intrones del pre-ARNm, y por tanto es un mecanismo post-transcripcional.[8]
Inicialmente los dsRNAs se inyectaban en las gónadas de los gusanos, pero también pueden ser inyectados en el intestino o en la cabeza. Incluso se observa efecto cuando los gusanos son alimentados con cepas de E. coli portadoras de un plásmido a partir del cual se transcribe el dsRNA. En este caso el efecto es un poco más débil, pero todavía evidente. En todos los casos el efecto sobre la expresión del gen diana se observa no solo en el tejido inyectado, sino en la mayoría de los tejidos, lo que indica que la señal puede transmitirse de una célula a otra.
Prueba de la existencia de los siRNAs
[editar]Una vez que estuvo claro que el mecanismo de RNAi actúa directamente sobre el ARNm, permanecía una importante cuestión: ¿qué es lo que causaba la degradación del ARNm? Los experimentos descritos a continuación explican cómo se descubrieron los siRNAs.
Para explicar la co-supresión observada en plantas, se propuso la existencia de ARNs anti-sense, que mediante apareamiento de bases con el ARNm diana, de alguna manera promoverían la degradación del ARNm o interferirían con la traducción del mismo. Sin embargo, en las células afectadas no se detectaron ARNs anti-sense que tuvieran el tamaño de los ARNm, de manera que los investigadores analizaron si en las plantas transgénicas afectadas aparecían moléculas de ARN de menor tamaño.
En uno de estos experimentos, realizado por Hamilton y Baulcombe[9] en 1999, se analizó la presencia de pequeños ARNs en cinco líneas de plantas de tomate, que habían sido transformadas con un plásmido que codificaba para ACO (aminocyclopropane-carboxylate oxidase). En dos de las líneas analizadas la expresión del ARNm de ACO había sido suprimida, y consecuentemente el ARNm no se detectaba en Northern blots.[10] Para detectar la posible presencia de ARN pequeños se utilizaron geles de Northern blot con mayor concentración de poliacrilamida, utilizando como sonda tránscritos sense o anti-sense. Sólo en las plantas en las que la expresión de ACO había sido suprimida se detectaron ARNs de aproximadamente 25 nt con ambas sondas, pero no se detectaron en las plantas en las que el ARNm de ACO estaba aún presente. Por tanto, se demostró la presencia de los pequeños ARN propuestos, en plantas en las que la expresión de ACO estaba afectada. Con experimentos similares se demostró que plantas infectadas con virus también contienen pequeños ARNs con secuencias virales.
Es importante notar que estos pequeños ARNs no son productos de la degradación del ARNm, porque se encontraron no sólo moléculas sense, sino también anti-sense.

Para estudiar en más profundidad el mecanismo de RNAi, se utilizaron sistemas in vitro. En 2000, Phil Zamore, Tom Tuschl y colaboradores[11] desarrollaron un sistema in vitro para estudiar embriones de Drosophila. El grupo de Greg Hannon[12] desarrolló otro sistema in vitro, utilizando extractos de células de Drosophila en cultivo.
Zamore, Tuschl y colaboradores fueron los primeros en mostrar que el ARNm incubado en un extracto se degrada en presencia de dsRNA. Para ello, añadieron al extracto dos ARNm modelo que codifican para proteínas luciferasa de 2 especies diferentes (Drosophila no codifica la proteína luciferasa). Cuando se añadió al extracto dsRNA contra el ARNm de luciferasa, el ARNm fue degradado eficientemente. Cuando se añadió ARN antisense, sólo se degradó una pequeña cantidad del ARNm, y la adición de tampón únicamente (control negativo) no produjo ningún efecto.[11] Estos resultados son similares a los obtenidos en los experimentos in vivo con C.elegans, donde se demostró que los dsRNAs son mucho más eficientes que el ARN antisense en la producción de un efecto de RNAi.[8]
En otro experimento, Zamore, Tuschl y colaboradores[11] comprobaron si los dsRNAs son procesados en pequeños fragmentos de ~25 nt (como ocurre en plantas). En este experimento, dsRNAs marcados radiactivamente bien en la hebra sense, en la antisense o en las dos, se incubaron en los extractos de Drosophila en presencia o ausencia de ARNm. Cuando los dsRNA se incubaron en el extracto, aparecieron fragmentos de 21 a 23 nts, independientemente de la presencia de ARNm, indicando que los pequeños ARNs proceden del dsRNA y no del ARNm. Este experimento mostraba además que ambas hebras del dsRNA (la sense y la antisense) se cortan en pequeños fragmentos, porque los fragmentos aparecen tanto cuando los dsRNAs han sido marcados solo en la hebra sense, como cuando has sido marcados sólo en la antisense. Este experimento muestra que los dsRNAs incubados en el extracto son procesados en pequeños fragmentos de ~21-22 nts. Este resultado es similar al resultado en plantas[9] mencionado anteriormente.
Por tanto, la conclusión de los estudios precedentes es que fragmentos de dsRNA (introducidos en las plantas o añadidos a los extractos) son degradados en fragmentos de ~21-25 nts, que son capaces de reconocer el ARNm diana presente en la planta o en el extracto, induciendo a su vez la degradación de éste.
Los componentes del mecanismo de RNAi
[editar]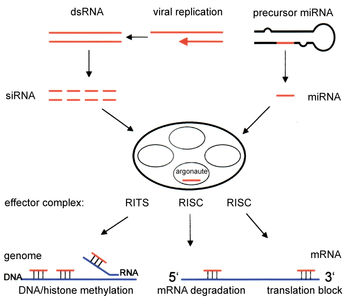
Estudios posteriores permitieron elucidar con más detalle el mecanismo de RNAi.[13] Cuando se introducen en un organismo (por ejemplo, en plantas tras la infección con un virus de ARN, o simplemente inyectando dsRNA en plantas o nemátodos), el ARN exógeno es reconocido por la célula y unido a una enzima llamada Dicer, que contiene diferentes dominios. Dicer corta el dsRNA en fragmentos de alrededor de 22 nts. Estos pequeños dsRNAs (siRNAs) se incorporan en un complejo con múltiples componentes, denominado RISC (RNA-induced silencing complex). El complejo RISC tiene que ser activado (RISC*) a partir de una forma latente, mediante el desapareamiento de las dos hebras de los siRNAs. RISC* utiliza la hebra antisentido del siRNA como guía para seleccionar su substrato: el ARNm complementario de la hebra de siRNA presente en el complejo. A continuación, RISC* promueve el corte y posterior destrucción del ARNm diana, provocando la supresión de la expresión del gen (en la imagen de la derecha, el mecanismo que utilizan los siRNAs corresponde a la parte central e izquierda).
Identificación de Dicer
[editar]La siguiente cuestión que necesitaba resolverse era identificar la enzima ribonucleasa (ARNasa) involucrada en la fragmentación de los dsRNAs. Puesto que se habían purificado previamente los fragmentos de la degradación (los siRNAs), se sabía que la enzima tenía que ser capaz de producir fragmentos con grupos 5' fosfato y 3' hidroxilo, lo cual reducía el número de candidatos: en concreto, las ARNasas de la familia de la ARNasa III fragmentan dsRNAs de esta forma. Se conocían tres tipos de ARNasa III:
- ARNasa III canónica (E. coli): 1 motivo ARNasaIII y 1 dsRBD (en inglés, double strand RNA binding domain)
- Drosha: 2 motivos ARNasa III y 1 dsRBD
- Dicer: 2 motivos ARNAsa III, 1 dominio helicasa y 1 dsRBD
Para probar cuál de estas ARNasas podía degradar dsRNA en fragmentos de ~22 nt, en 2001 Bernstein y colaboradores[1] expresaron en células S2 de Drosophila todas las proteínas candidatas como proteínas marcadas con una etiqueta (como GST, glutathione S-transferase). Las proteínas fueron purificadas con un anticuerpo dirigido contra la etiqueta e incubadas con un dsRNA dirigido contra ciclina E. El resultado de este experimento mostró que solo Dicer es capaz de cortar el dsRNA largo en fragmentos pequeños. Las otras ARNasas no fragmentaron el dsRNA. Como control negativo se utilizó la proteína "homeless", para probar si el dominio helicasa de Dicer podría estar implicado en la reacción. Además el experimento probó que la reacción precisa ATP.
Para poder unirse a las moléculas de dsRNA, Dicer necesita formar un complejo con otras proteínas que la asisten en sus funciones, como la proteína R2D2 en Drosophila o RDE-4 y RDE-1 en C.elegans.[14]
El complejo RISC
[editar]
Los siRNAs generados por Dicer se ensamblan en el complejo RISC (siglas en inglés de RNA-induced silencing complex) que contiene diferentes factores celulares.[15][16]
El componente activo del complejo RISC es una proteína de la familia de las endonucleasas denominadas Argonautas, que cortan la hebra de ARNm diana complementaria al siRNA que está asociado a RISC.[17] Como los fragmentos producidos por Dicer son de doble hebra, en teoría ambas hebras podrían producir un siRNA funcional. Sin embargo, solo una de las dos hebras (la antisense), denominada la hebra guía, se une a la proteína Argonauta y dirige el proceso de degradación del ARNm complementario. La otra hebra (la sense), denominada hebra pasajera, es degradada durante el proceso de activación de RISC.[18] Aunque en principio se supuso que una helicasa dependiente de ATP separaba ambas hebras,[19] en realidad el proceso es independiente de ATP y realizado directamente por proteínas que componen el complejo RISC.[20][21] La hebra seleccionada como guía tiende a ser aquella cuyo extremo 5' se aparea menos con su complementaria,[22] aunque la selección de la hebra guía no resulta afectada por la dirección en la que Dicer corta el dsRNA antes de su incorporación al complejo RISC.[23] Sin embargo, la proteína R2D2 podría servir como el factor identificador, al unirse al extremo 5' más estable de la hebra pasajera.[24]
Aunque existen diferentes proteínas de la familia Argonauta (Ago1, Ago2, Ago3 en mamíferos), sólo Ago2 puede formar complejos RISC capaces de fragmentar el ARNm diana.[25] En el mismo estudio, se demostró asimismo que Ago2 es capaz de cortar el ARNm diana in vitro en presencia de un siRNA de hebra simple, pero no de un dsRNA, y que la reacción es independiente de ATP. Asimismo, se identificaron dos residuos de Ago2 necesarios para la actividad enzimática: D597 y D669.
La base estructural para la unión del ARN a la proteína Ago2 ha sido examinada mediante cristalografía de rayos X de la unión del dominio estructural de una proteína Argonauta unida a ARN. En este estudio, el extremo 5' fosforilado de la hebra de ARN se introduce en una hendidura de superficie básica conservada (presente en proteínas homólogas de diferentes especies) y hace contacto a través de un catión divalente (un átomo con dos cargas positivas) como el magnesio, y por apilamiento aromático (un proceso que permite a más de un átomo compartir un electrón, pasándolo adelante y atrás) entre el nucleótido 5' en el siRNA y un residuo conservado de tirosina. Se piensa que este sitio forma un sitio de nucleación para la unión del siRNA a su ARNm complementario.[26]
Todavía no está claro cómo el complejo RISC activado localiza los ARNm complementarios en el interior celular. Aunque se ha propuesto que el proceso de fragmentación podría estar ligado a la traducción, la traducción del ARNm diana no es esencial para la degradación mediada por RNAi.[27] De hecho, el proceso de RNAi puede ser más efectivo contra ARNm dianas que no son traducidos.[28] Las proteínas Argonauta, los componentes catalíticos de RISC, están localizadas en regiones específicas del citoplasma denominadas P-bodies (cuerpos-P, también cuerpos citoplásmicos o cuerpos GW, porque contienen la proteína GW182), los cuales son regiones con altas tasas de degradación de ARNm;[29] también se ha detectado actividad miRNA en los P-bodies.[30] Alteración de los P-bodies disminuye la eficiencia del proceso de RNAi, lo que sugería que los P-bodies podrían ser un lugar crítico para el proceso de RNAi.[31] Sin embargo, estudios posteriores han demostrado que los P-bodies no son imprescindibles para el proceso de RNAi, puesto que células sin P-bodies pueden producir silenciamiento tanto con siRNAs como con miRNAs.[32]
Mecanismo de interferencia de ARN (RNAi) mediado por siRNAs
[editar]El mecanismo de RNAi[33] se inicia cuando una célula recibe un ARN de doble hebra largo (dsRNA), que puede generarse a partir de un transgén exógeno, un intruso viral o un elemento genético propio. Este dsRNA largo se fragmenta en siRNAs por una enzima denominada Dicer. Un complejo de silenciamiento inducido por ARN (el complejo RISC) selecciona entre ambas hebras del siRNA: la hebra sense (pasajera) se degrada, mientras que la antisense (guía) se utiliza para localizar el ARNm complementario, y puede tener distintos destinos según el organismo.
En Drosophila y en mamíferos, la hebra antisense se incorpora directamente en el complejo RISC para identificar el mRNA complementario, que será destruido. En ausencia de siRNAs, el complejo RISC carece de especificidad para unirse a ninguna molécula de ARNm. Pero cuando se une a la hebra guía del siRNA, el complejo RISC (ahora activado) puede participar en repetidos ciclos de degradación específica del ARNm diana, produciendo el silenciamiento de la expresión del gen correspondiente. En la mayor parte de los casos, la supresión no es completa, por lo que produce una reducción de la expresión, denominada knock-down.
En plantas y en gusanos, después de que Dicer haya procesado el dsRNA originario, la hebra antisense de los siRNAs (primarios) se utiliza en un proceso de amplificación. La hebra antisense, unida a una ARN polimerasa-dependiente de ARN (RdRP, del inglés RNA-dependent RNA polymerase), puede aparearse con un ARNm complementario, y actuar como punto de inicio para la síntesis de una nueva molécula larga de dsRNA. Dicer actúa entonces sobre este dsRNA, fragmentándolo para generar nuevas moléculas de siRNA (secundarias), que son específicas para diferentes secuencias del mismo ARNm, generando un efecto de amplificación. También en este caso, el ARNm unido a siRNAs es destruido, produciendo el silenciamiento (knock-down) del gen correspondiente.
Esta amplificación en plantas y gusanos permite que el efecto de silenciamiento producido por RNAi se extienda a través de los tejidos somáticos, no reproductivos, por transferencia de dsRNAs directa de célula a célula, generando una amplia resistencia a las infecciones virales.
RNAi transitivo por amplificación de la señal
[editar]Otro descubrimiento sorprendente fue el realizado por Hannon[13] en 2002. Cuando se introducía en C. elegans un transgén que contenía una molécula GFP fusionada al gen UNC-22 (un gen responsable de la coordinación motora), seguido de una inyección de dsRNA contra GFP, el resultado era diferente según la posición de la molécula GFP con respecto a UNC-22 en el transgén:
- si la molécula GFP estaba unida delante de UNC-22 (GFP--UNC22), los gusanos de la progenie eran blancos, pero normales
- si la molécula de GFP estaba unida detrás de UNC-22 (UNC-22--GFP), los gusanos de la progenie eran blancos, y además presentaban fenotipo unc-22 mutante: descoordinación motora
La explicación a este fenómeno se debe a la presencia en gusanos de la enzima ARN polimerasa-dependiente de ARN (RdRP), que usa como cebador la hebra antisense de los siRNAs generados a partir del dsRNA contra GFP inyectado (primarios), para la producción de un ARN-antisense largo. Como la enzima RdRP sólo sintetiza ARN en dirección 3'-5', cuando el transgén es UNC-22--GFP, los siRNAs se unen a la molécula de GFP, y amplifican un ARN que contiene ambos genes, UNC-22 y GFP. Este ARN puede aparear con el ARNm del transgén UNC-22--GFP o con el ARNm UNC-22 endógeno del gusano, de forma que al ser fragmentado por Dicer, se generan siRNAs secundarios tanto contra GFP como contra UNC-22, lo que produce el silenciamiento de ambos genes: los gusanos de la progenie son, por tanto blancos (por silenciamiento de GFP) y con descoordinación motora (fenotipo mutante unc-22).
Sin embargo, cuando el transgén presente es GFP--UNC-22, los siRNAs primarios se unen a GFP y el ARN-antisense largo que se genera sólo incluye la molécula de GFP. Esta molécula sólo se puede aparear con el transgén GFP--UNC-22, pero no con el ARNm UNC-22 endógeno. Por ello, tras la acción de Dicer sólo se generan siRNAs secundarios contra GFP, de manera que los gusanos de la progenie son blancos (por silenciamiento de GFP), pero normales, porque UNC-22 se expresa a partir del gen endógeno.
Relación entre la dosis de ARN y la respuesta fenotípica
[editar]La relación entre la dosis de ARN y el fenotipo se analizó mediante la inyección de una serie de diferentes concentraciones de ARN de hebra simple o doble en C. elegans.[13] Utilizando la concentración más elevada de los ARN sense y antisense individuales contra el gen UNC-22 (3,6 millones de moléculas por gónada) se observó fenotipo mutante en, respectivamente, el 1% y el 11% de los descendientes. La inyección de dosis comparables de ARN de doble hebra produjo, sin embargo, fenotipo mutante en el 100% de los descendientes. Por tanto, la inyección de ARN de doble hebra es al menos 100 veces más eficaz produciendo RNAi que la inyección de ARN de hebra simple.
En otro experimento, se observó que la inyección de 60.000 (sesenta mil) moléculas de cada hebra de ARN por gusano adulto provocaba el fenotipo mutante en alrededor de 100 descendientes. La expresión de UNC-22 comienza en el embrión cuando este consta de unas 500 células. En este momento, el material inyectado se diluye hasta solamente algunas moléculas de ARN doble hebra por célula. Este resultado sugirió que el ARN doble hebra funciona de una manera catalítica y no estequiométrica, puesto que unas pocas moléculas de ARN doble hebra pueden inducir RNAi. También indicaba que existen etapas de amplificación en el mecanismo de RNAi.
RNAi mediado por siRNAs: resumen
[editar]En las células, un dsRNA largo (inyectado, procedente de un virus...) es fragmentado por Dicer, que genera fragmentos cortos de dsRNA (los siRNAs). La hebra antisense se incorpora al complejo RISC, activándolo. Este complejo identifica el ARNm homólogo del siRNA, cortándolo en dos mitades que son después degradadas por la maquinaria celular.
Por tanto, el mecanismo de RNAi mediado por siRNAs suprime la expresión génica a nivel post-trancripcional (puesto que la molécula diana es el ARNm), de manera específica a la secuencia. Los resultados de este tipo de supresión son similares (a veces idénticos) a los fenotipos de los mutantes nulos: la supresión puede producir una reducción significativa (knock-down) o completa (knock-out) de los niveles de la proteína diana.
La supresión génica (también llamada silenciamiento) realizada por los siRNAs es extremadamente específica, y solo afecta al ARNm homólogo (aunque con siRNAs sintéticos pueden producirse efectos inespecíficos, denominados efectos off-target; ver más adelante).
En plantas, el RNAi se denomina "silenciamiento génico post-transcripcional" (PTGS, del inglés post-transcriptional gene silencing), mientras que en Neurospora (un hongo también utilizado como organismo modelo) se denomina quelling. Estos mecanismos permiten la defensa contra la invasión viríca o de elementos transponibles.
Los efectos sistémicos probablemente se explican por el pequeño tamaño de los siRNAs, que pueden pasar de una célula a otra.
La amplificación de la señal que se observa en ciertos organismos (plantas, C. elegans) resulta de un mecanismo por el cual los siRNAs antisense se aparean al ARNm homólogo y funcionan como cebador para la transcripción de un ARN antisense por una ARN-polimerasa dependiente de ARN (RdRP), que se aparea con el ARNm homólogo y da lugar, tras la acción de Dicer, a la aparición de siRNAs secundarios.
Ensamblaje de heterocromatina mediante RNAi en S. pombe
[editar]Schizosaccharomyces pombe (la levadura de fisión) es una levadura ampliamente utilizada en estudios genéticos como organismo modelo (por ejemplo, es el organismo en el que Paul Nurse realizó los estudios sobre el ciclo celular que le permitieron obtener el Premio Nobel de Fisiología o Medicina en 2001). A diferencia de Saccharomyces cerevisiae (la levadura del pan, también muy utilizada en estudios genéticos), que tiene pequeños centrómeros puntuales de unos 100bp, S. pombe tiene centrómeros más largos (40-100kb), con secuencias repetitivas, similares a los centrómeros de mamíferos.
Los elementos repetitivos que rodean al centrómero (cen) son transcritos en S. pombe para producir cenRNAs no-codificantes.[3] Estas secuencias repetitivas y los cenRNAs atraen enzimas Histona Metil-Transferasa (HTMasas, de las siglas en inglés) tipo H3K9 (metilan la lisina9 de la histona H3), proteínas HP1 y otros complejos que median la formación de heterocromatina. La proteína HP1 recluta cohesinas para promover la cohesión de las cromátidas hermanas en los centrómeros. Los nucleosomas asociados con regiones de heterocromatina presentan metilación H3K9 y están hipoacetilados (es decir, presentan pocos grupos acetilo -CO-CH3 asociados), mientras que los nucleosomas de las regiones de eucromatina portan metilación en H3K4 (en lisina4 de la histona H3) y están hiperacetilados. Las regiones heterocromáticas de los telómeros y otras regiones cromosómicas comparten muchas propiedades con la heterocromatina centromérica.
En S. pombe, se han identificado algunos componentes de la maquinaria de RNAi asociados a la generación de heterocromatina centromérica:[34]
- un complejo similar al RISC, denominado RITS (del inglés RNA-induced transcriptional silencing)
- el complejo RDRC (RNA-directed RNA polymerase complex)
- Dicer
- ARC, un complejo que funciona como chaperona de la proteína Ago1 y que contiene siRNA dúplex (doble hebra)
- el complejo CLRC, que contiene la histona metil-transferasa en H3K9 denominada Clr4, necesario para la metilación de los nucleosomas en H3K9 y para la generación de siRNAs
El modelo de tránscrito naciente[3] propone que el complejo RITS interviene en la formación de heterocromatina, asociándose con los tránscritos nacientes a través del apareamiento de bases con los siRNAs de hebra simple presentes en el complejo, además de asociarse con los grupos metilo H3K9 de los nucleosomas a través del dominio cromo de su subunidad Chp1. La síntesis de dsRNA y generación de siRNAs ocurre en asociación con regiones cromosómicas específicas y esto puede ser la causa de la restricción en cis (es decir, en la misma molécula de ADN donde se genera) del silenciamiento mediado por siRNAs. El circuito de síntesis de siRNA asociado a los cromosomas es esencial para la difusión de la metilación en H3K9 y el silenciamiento en los centrómeros. El acoplamienteo del circuito de síntesis de siRNAs con la metilación en H3K9 forma un circuito de retroalimentación (feedback loop) que mantiene la heterocromatina de manera epigenética.
Por el momento (2008), el papel de los cenRNAs no codificantes en el ensamblaje de la heterocromatina centromérica sólo se ha demostrado en S. pombe, aunque algunos componentes del mecanismo de RNAi contribuyen al silenciamiento de genes en las zonas pericentroméricas en Drosophila melanogaster.
Utilización en el laboratorio
[editar]Herramientas para el silenciamiento de genes
[editar]Los tipos de herramientas que se utilizan para obtener RNAi en el laboratorio son diferentes según los organismos:[35]
- En C. elegans se utilizan dsRNAs largos, que pueden introducirse en los gusanos:[36]
- por microinyección (en las gónadas, en la cabeza o en el intestino)
- sumergiendo los gusanos en una solución que contenga los dsRNAS
- alimentándolos con cepas de E. coli portadoras de un plásmido a partir del cual se transcribe el dsRNA.
- En Drosophila melanogaster se utilizan también dsRNAs largos, que pueden:
- inyectarse en los embriones
- introducirse en forma de transgenes que expresan una horquilla de dsRNA
- en el caso de células de Drosophila en cultivo, el dsRNA puede añadirse directamente al medio de cultivo, de donde lo absorberán las células
- En plantas, se puede:
- sobreexpresar un dsRNA o una horquilla de dsRNA a partir de un transgén
- sobreexpresar un ARN de hebra simple a partir de un transgén o un virus para provocar la co-supresión
- En mamíferos:
- en células embrionarias en cultivo, ovocitos o embriones precoces, se puede transfectar o inyectar dsRNA
- en células diferenciadas en cultivo o en animales (in vivo), se puede:
- transfectar o inyectar moléculas de siRNA sintéticos
- transfectar un plásmido,[37] un lentivirus (un vector generado a partir de una versión desactivada del VIH)[38] u otro vector viral que exprese una horquilla que contenga los siRNAs.
RNAi en mamíferos
[editar]Aunque las moléculas de dsRNA pueden inducir RNAi específico en embriones tempranos de ratón y en ovocitos de ratón, en células somáticas de mamíferos los dsRNAs también activan muchas rutas celulares,[39] algunas de las cuales pueden producir apoptosis.
La proteína kinasa dependiente de dsRNA (PKR) es un importante "detector" antiviral, que se activa al unirse a dsRNAs largos, como los producidos por los virus. Una vez que se activa PKR, ésta inhibe la traducción de proteínas a través de la fosforilación de una de las subunidades del factor de iniciación de la traducción (EIF2). La fosforilación de EIF2 produce una supresión general de la síntesis proteica que dirige a la célula hacia la apoptosis. PKR también activa las enzimas 2',5'-OligoA sintetasa y ARNasa L, que son componentes centrales de una importante vía antiviral. Cuando se unen a los dsRNAs, la 2',5'-OligoA sintetasa se activa, generando oligo-adenilatos que activan la ARNasa L, que a su vez degrada el ARN. Los dsRNAs también pueden inducir la expresión de interferón que, conjuntamente con otras señales, pueden estimular la apoptosis.
Sin embargo, en 2001, Thomas Tuschl y sus colegas demostraron que siRNAs sintéticos de tamaño inferior a 30pb son capaces de inducir RNAi en células de mamífero sin activar las vías de PKR e interferón, un trabajo que fue publicado en Nature.[40] Este descubrimiento suscitó un gran interés en la utilización de la técnica de RNAi para investigación biomédica y desarrollo de nuevos fármacos.
siRNAs y shRNAs
[editar]Como se indica en el punto "Herramientas para el silenciamiento de genes", en el caso de células somáticas de mamíferos se pueden introducir bien directamente siRNAs sintéticos o bien un plásmido (o un vector viral) que contenga una horquilla que exprese el siRNA. En este segundo caso se habla de expresión de "shRNAs" (siglas en inglés de short hairpin RNA),[38] que son procesados por la enzima Dicer para generar siRNAs funcionales (ver miRNAs).
Los siRNAs son moléculas de dsRNA de alrededor de 22 nts, con un grupo fosfato en el extremo 5' y un grupo hidroxilo en el extremo 3'. El corte del ARNm diana se produce a nivel de la posición 10 a 11 a partir del extremo 5' de los nucleótidos apareados (no se produce ningún otro corte fuera de esta zona), y el corte del ARNm es más eficiente si en sus extremos 3' los siRNAs presentan de 2 a 3 nucleótidos libres. Asimismo, la eficacia del siRNA depende de la accesibilidad de la zona de apareamiento en el ARNm diana: la presencia de estructuras secundarias en dicha zona del ARNm o la unión de proteínas en esa zona puede impedir la unión del siRNA, disminuyendo su eficacia.
En la actualidad, existen muchos algoritmos disponibles para el diseño de siRNAs, tanto comerciales en empresas especializadas (Dharmacon [35], Ambion [36], Qiagen [37], InvitrogenArchivado el 1 de marzo de 2010 en Wayback Machine., Sigma [38], etc.) como en entornos académicos[41][42] (ver también la página web de Nature sobre RNAi [39]).
Los siRNAs sintéticos pueden obtenerse de diversas formas:
- pueden ser sintetizados químicamente por empresas especializadas (como Dharmacon, Ambion, Sigma, etc.); presentan la ventaja para el investigador de su facilidad de utilización, la rapidez en la obtención (algunos días), así como su homogeneidad y pureza; el inconveniente es el coste.
- pueden ser sintetizados in vitro por el propio investigador utilizando ARN polimerasa T7;[43] más económico, pero los siRNAs obtenidos son menos homogéneos, lo que puede producir una menor eficacia.
- pueden obtenerse por fragmentación de dsRNAs sintetizados in vitro, utilizando ARNasa III purificada ("esiRNAs"); también es más económico, pero el resultado es menos homogéneo.[44]
Las moléculas de siRNA o shRNA se introducen en las células mediante técnicas de transfección. Es interesante destacar que la ruta del RNAi se puede modular extracelularmente utilizando moléculas químicas pequeñas. En un estudio publicado en agosto de 2008, se desarrolló un ensayo basado en células para monitorizar la actividad de la ruta del RNAi, y los autores detectaron que la molécula enoxacin (Penetrex) mejora la degradación del ARNm mediada por siRNA, y promueve la biogénesis de los miRNAs endógenos.[45] Este artículo prueba que pequeñas moléculas químicas pueden mejorar la eficacia de la ruta del RNAi, lo que podría ser útil en el desarrollo de herramientas para la investigación y terapéuticas.
Efectos inespecíficos (off-target)
[editar]Los siRNAs (y los shRNAs) pueden producir una reducción no intencionada de la expresión de ciertos genes cuya secuencia es próxima a la del siRNA, por corte del ARNm correspondiente o por la inhibición de su traducción.[46][47] Los efectos off-target pueden aparecer si los siRNAs imitan el reconocimiento del ARNm diana por los microRNA.[46]
Estos efectos inespecíficos pueden reducirse mediante la modificación química del segundo residuo de la hebra activa del siRNA (que es muy importante para la actividad del microRNA) sin afectar al silenciamiento del ARNm diana específico.[48]
La predicción de los efectos off-target no es muy útil por el momento, pero durante el proceso de diseño es necesario eliminar todos los siRNAs que presenten una similitud significativa a moléculas de ARNm no deseadas, mediante la utilización de BLAST [40]. Asimismo es aconsejable utilizar una concentración de siRNAs en el medio de transfección inferior a 100 micromolar, puesto que por encima de dicho valor, aumenta la probabilidad de obtener efectos inespecíficos. Por esta razón, es más sencillo controlar la aparición de efectos off-target con siRNAs sintéticos (puesto que se puede controlar su concentración en el medio de cultivo) que con shRNAs, puesto que en este caso el nivel de expresión (que depende del tipo de promotor utilizado) puede variar mucho de célula a célula.
Aplicaciones
[editar]La especificidad y la robustez del efecto de RNAi sobre la expresión génica hace de este mecanismo una valiosa herramienta en investigación, tanto en cultivos celulares como en organismos vivos, puesto que dsRNAs o siRNAs sintéticos o transgénicos pueden introducirse en las células para inducir el silenciamiento selectivo de genes específicos de interés. Esto ha permitido un avance espectacular en el desarrollo de la biología celular, puesto que el RNAi es una herramienta simple y rápida para la comprensión de la función de los genes (a pesar de que en último término es conveniente desarrollar el organismo knockout para asegurar la consistencia de los resultados).
La técnica de RNAi en el laboratorio también puede utilizarse para silenciar sistemáticamente cada uno de los genes de la célula (análisis genómico), lo que puede ayudar a identificar los componentes necesarios para un proceso celular en particular, como la división celular o las vías de señalización, por ejemplo.[35][49] De hecho, en la actualidad existen colecciones a gran escala de RNAi de mamíferos disponibles públicamente, tanto en empresas comerciales (Dharmacon, Ambion, Qiagen o Sigma, ver enlaces en el apartado "siRNAs y shRNAs") como en instituciones académicas (de ratón o de humano: [41], [42], [43]).
Por otro lado, la explotación de la vía de RNAi es también una herramienta prometedora en biotecnología y medicina. Como comparación en la generación de modelos animales para el estudio de enfermedades:[50]
- la obtención de una línea de ratones knockout puede precisar años, aunque una vez obtenidos, se pueden mantener indefinidamente, mediante cruces
- la obtención de una línea de ratones transgénicos para RNAi (a los que se les ha introducido un vector que exprese una molécula de siRNA para silenciar un gen específico, de forma constitutiva o condicional), puede conseguirse en meses, y también pueden mantenerse indefinidamente, mediante cruces
- por otro lado, se pueden inyectar localmente moléculas de siRNA (por ejemplo en la retina), lo cual puede realizarse en un tiempo corto (semanas), y puede mantenerse durante meses o indefinidamente (si los siRNAs se introducen en forma de vectores virales) o bien durante algunas semanas (si se utilizan siRNAs sintéticos)
- finalmente, los siRNAs se pueden inyectar de forma sistémica (en el sistema circulatorio), y como en el caso anterior, pueden mantenerse durante semanas, meses o indefinidamente, según la forma en la que se introduzcan en el organismo.
Silenciamiento de genes ("knockdown")
[editar]La ruta del RNAi se utiliza a menudo en biología molecular y celular para estudiar la función de los genes en cultivos celulares e in vivo en organismos modelo.[17] Para ello, se sintetiza dsRNA (o siRNAs/shRNAs en mamíferos) con una secuencia complementaria a la del gen de interés y se introduce en una célula u organismo, donde se reconoce como material genético extraño, lo que activa la ruta del RNAi. Utilizando este mecanismo, los investigadores pueden producir una reducción drástica en la expresión del gen diana. Estudiando los efectos de esta disminución se pueden dilucidar las funciones fisiológicas del producto de ese gen (la proteína correspondiente).[51] Puesto que el RNAi puede no bloquear completamente la expresión del gen de interés, normalmente suele referirse a esta técnica como "knockdown", para distinguirla de los procedimientos de "knockout" en la que la expresión del gen es completamente suprimida.[52]
Genómica funcional
[editar]La mayoría de las aplicaciones de RNAi en genómica funcional en animales han utilizado C. elegans[53] y Drosophila,[54] puesto que estos son los organismos modelo en los que el mecanismo de RNAi es más efectivo. C. elegans es particularmente útil para la investigación con RNAi por dos razones: primero, los efectos de silenciamiento de genes son normalmente heredables, y segundo, porque la administración de dsRNA es extremadamente simple (ver Herramientas para el silenciamiento de genes). Aunque la administración es más difícil en otros organismos, también se están haciendo esfuerzos para realizar estudios genómicos a gran escala en células de mamíferos.[55]
Las aproximaciones para el diseño de librerías genómicas de RNAi pueden requerir mucha más sofisticación que el diseño de un solo siRNA para un conjunto definido de condiciones experimentales. Frecuentemente se utilizan redes neuronales artificiales para diseñar librerías de siRNA[56] y para predecir la probabilidad de su eficiencia en el silenciamiento de genes.[57] El screening genómico masivo se ve generalmente como un método prometedor para avanzar en la anotación del genoma y ha desencadenado el desarrollo de métodos de screening a gran escala (high-throughput) basados en microarrays.[58][59] Sin embargo, la utilidad de esos screens y la posibilidad de aplicar las técnicas desarrolladas en organismos modelo incluso a especies relacionadas es cuestionable, por ejemplo desde C. elegans a nemátodos parasíticos relacionados.[60][61]
La genómica funcional utilizando RNAi es una técnica particularmente atractiva para el mapeo y anotación genómicos en plantas, porque muchas plantas son poliploides, lo que representa un reto significativo para métodos genéticos más tradicionales. Por ejemplo, el RNAi ha sido utilizado con éxito para estudios genómicos funcionales en el trigo del pan (que es hexaploide),[62] así como en los sistemas modelos de plantas más comunes, como Arabidopsis y el maíz.[63]
Medicina
[editar]Una posibilidad muy interesante es la utilización del mecanismo de RNAi en terapia. Aunque es difícil introducir dsRNAs largos en células de mamíferos debido a que estos desencadenan la respuesta de interferón, el uso de siRNAs (sintéticos o shRNAs) ha tenido más éxito.[64] Entre las primeras aplicaciones en llegar a la fase de ensayos clínicos, se encuentra el tratamiento de la degeneración macular y el virus respiratorio sincitial.[65] El RNAi también se ha mostrado efectivo en la reversión de fallo hepático inducido en modelos de ratón.[66]
Otros usos clínicos propuestos se centran en terapias antivirales, incluyendo la inhibición de la expresión génica viral en células cancerosas,[67] silenciamiento de los receptores y correceptores del HIV en el huésped,[68] el silenciamiento del virus de la hepatitis A[69] y de la hepatitis B,[70] el silenciamiento de la expresión del virus de la gripe[71] y la inhibición de la replicación del virus del sarampión.[72]
También se han propuesto tratamientos potenciales para enfermedades neurodegenerativas, prestando atención particular a las enfermedades de poliglutaminas tales como la enfermedad de Huntington.[73] La interferencia de ARN también se considera una alternativa prometedora para tratar el cáncer, mediante el silenciamiento diferencial de genes sobreexpresados en células tumorales o genes involucrados en la división cellular (mitosis).[74][75]
En la revista Molecular Therapy (del grupo Nature), puede encontrarse una serie de artículos de acceso libre que tratan sobre la técnica de RNAi como estrategia terapéutica, que resume diferentes áreas de investigación publicadas en diferentes revistas.[76]
Un área clave de investigación en el uso de RNAi en aplicaciones clínicas es el desarrollo de un método de administración seguro, que hasta el momento implica sobre todo el uso de sistemas de vectores virales similares a los que se utilizan en terapia génica,[77][78] aunque también se utilizan otros mecanismos como aerosoles, siRNAs encapsulados en liposomas, conjugados con colesterol o asociados a complejos anticuerpo-protamina.[47]
A pesar de la proliferación de estudios en cultivos celulares para drogas basadas en RNAi, existen algunas preocupaciones con relación a la seguridad del RNAi, especialmente debido a los posibles efectos off-target (ver Efectos inespecíficos (off-target)), en los que un gen con una secuencia similar al gen diana es también silenciado.[79] Un estudio de genómica computacional ha estimado que la tasa de error debido a efectos off-target es aproximadamente del 10%.[80] Un importante estudio de enfermedad hepática en ratón produjo una alta tasa de mortalidad en los ratones experimentales, debido según los investigadores a la sobresaturación de la vía del RNAi,[81] a causa de la utilización de shRNAs que deben procesarse en el núcleo y exportarse al citoplasma por un mecanismo activo. Todas estas son consideraciones que están bajo intenso estudio en la actualidad, para reducir su impacto en la utilización terapéutica del RNAi.
Biotecnología
[editar]La interferencia de ARN se ha utilizado en aplicaciones de biotecnología, particularmente en el diseño de plantas alimenticias que producen niveles bajos de toxinas naturales de plantas. Esta técnica aprovecha el fenotipo estable y heredable del RNAi en plantas. Por ejemplo, las semillas de algodón son ricas en proteínas nutritivas, pero contienen de forma natural el producto terpenoide tóxico gossypol, haciéndolo no apto para el consumo humano. Se ha utilizado RNAi para producir cepas de algodón cuyas semillas contienen niveles reducidos de delta-cadineno sintetasa, una enzima clave en la producción de gossypol, sin afectar la producción de gossypol en otras partes de la planta, donde el gossypol es importante en la prevención del daño producido por los agentes infecciosos de la planta.[82] Esfuerzos similares se han dirigido hacia la reducción del producto natural cianogénico linamarino en plantas de yuca.[83]
Aunque ningún producto vegetal que utilice ingeniería genética basada en RNAi ha pasado todavía la fase experimental, los esfuerzos en el desarrollo de estos productos han reducido con éxito los niveles de alérgenos en plantas de tomate[84] y han disminuido los precursores de carcinógenos probables en plantas de tabaco.[85] Otras características vegetales que han sido modificadas en el laboratorio incluyen la producción de productos naturales no-narcóticos en opium poppy,[86] resistencia a virus de plantas comunes[87] y refuerzo de plantas como los tomates con antioxidantes dietéticos.[88] Productos comerciales previos, como el tomate Flavr Savr y dos cultivares de papaya resistentes al virus anillado de la papaya, fueron originalmente desarrollados utilizando tecnología antisense, pero probablemente explotaban la ruta del RNAi.[89][90]
Referencias
[editar]- ↑ a b Bernstein E, Caudy AA, Hammond SM, Hannon GJ. Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature. 2001 Jan 18;409(6818):363-6 [1]
- ↑ Rana TM. Illuminating the silence: understanding the structure and function of small RNAs. Nat Rev Mol Cell Biol. 2007 Jan;8(1):23-36 [2]
- ↑ a b c Bühler M, Moazed D.Transcription and RNAi in heterochromatic gene silencing. Nat Struct Mol Biol. 2007 Nov 5;14(11):1041-1048[3]
- ↑ Matzke MA, Matzke AJM. (2004). «Planting the Seeds of a New Paradigm.». PLoS Biol 2 (5): e133. PMID 15138502. doi:10.1371/journal.pbio.0020133.
- ↑ Napoli C, Lemieux C, Jorgensen R. Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes in trans. Plant Cell. 1990 Apr;2(4):279-289 [4]
- ↑ Brock T, Browse J, Watts J (2006). «Genetic regulation of unsaturated fatty acid composition in C. elegans». PLoS Genet 2 (7): e108. PMID 16839188. doi:10.1371/journal.pgen.0020108. Archivado desde el original el 22 de febrero de 2008. Consultado el 22 de julio de 2019.
- ↑ a b Guo S, Kemphues KJ. par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed. Cell. 1995 May 19;81(4):611-20 [5]
- ↑ a b c d Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998 Feb 19;391(6669):806-11 [6]
- ↑ a b Hamilton AJ, Baulcombe DC. A species of small antisense RNA in posttranscriptional gene silencing in plants.Science 1999 Oct 29;286(5441):950-2 [7]
- ↑ Alwine JC, Kemp DJ, Stark GR (1977). «Method for detection of specific RNAs in agarose gels by transfer to diazobenzyloxymethyl-paper and hybridization with DNA probes». Proc. Natl. Acad. Sci. U.S.A. 74 (12): 5350-4. PMID 414220. doi:10.1073/pnas.74.12.5350.
- ↑ a b c Zamore PD, Tuschl T, Sharp PA, Bartel DP. RNAi: double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals.Cell 2000 Mar 31;101(1):25-33 [8]
- ↑ a b Hammond SM, Bernstein E, Beach D, Hannon GJ. An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells.Nature 2000 Mar 16;404(6775):293-6 [9]
- ↑ a b c Hannon GJ. RNA interference. Nature 2002 Jul 11;418(6894):244-51 [10]
- ↑ Filipowicz W, Jaskiewicz L, Kolb FA, Pillai RS. Post-transcriptional gene silencing by siRNAs and miRNAs. Curr Opin Struct Biol. 2005 Jun;15(3):331-41 [11]
- ↑ Hammond SM, Boettcher S, Caudy AA, Kobayashi R, Hannon GJ. Argonaute2, a link between genetic and iochemical analyses of RNAi. Science 2001 Aug 10;293(5532):1146-5 [12]
- ↑ Caudy AA, Myers M, Hannon GJ, Hammond SM. Fragile X-related protein and VIG associate with the RNA interference machinery. Genes Dev. 2002 Oct 1;16(19):2491-6 [13]
- ↑ a b Daneholt, Bertil. «Advanced Information: RNA interference». The Nobel Prize in Physiology or Medicine 2006. Archivado desde el original el 25 de enero de 2007. Consultado el 25 de enero de 2007.
- ↑ Gregory R, Chendrimada T, Cooch N, Shiekhattar R (2005). «Human RISC couples microRNA biogenesis and posttranscriptional gene silencing». Cell 123 (4): 631-40. PMID 16271387. doi:10.1016/j.cell.2005.10.022.
- ↑ Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipurksy SL, Darnell J (2004). Molecular Cell Biology (5th ed. edición). WH Freeman: New York, NY. ISBN 978-0-7167-4366-8.
- ↑ Matranga C, Tomari Y, Shin C, Bartel D, Zamore P (2005). «Passenger-strand cleavage facilitates assembly of siRNA into Ago2-containing RNAi enzyme complexes». Cell 123 (4): 607-20. PMID 16271386. doi:10.1016/j.cell.2005.08.044.
- ↑ Leuschner P, Ameres S, Kueng S, Martínez J (2006). «Cleavage of the siRNA passenger strand during RISC assembly in human cells». EMBO Rep 7 (3): 314-20. PMID 16439995. doi:10.1038/sj.embor.7400637.
- ↑ Schwarz DS, Hutvágner G, Du T, Xu Z, Aronin N, Zamore PD (2003). «Asymmetry in the assembly of the RNAi enzyme complex». Cell 115 (2): 199-208. PMID 14567917. doi:10.1016/S0092-8674(03)00759-1.
- ↑ Preall J, He Z, Gorra J, Sontheimer E (2006). «Short interfering RNA strand selection is independent of dsRNA processing polarity during RNAi in Drosophila». Curr Biol 16 (5): 530-5. PMID 16527750. doi:10.1016/j.cub.2006.01.061.
- ↑ Tomari Y, Matranga C, Haley B, Martínez N, Zamore P (2004). «A protein sensor for siRNA asymmetry». Science 306 (5700): 1377-80. PMID 15550672. doi:10.1126/science.1102755.
- ↑ Liu J, Carmell MA, Rivas FV, Marsden CG, Thomson JM, Song JJ, Hammond SM, Joshua-Tor L, Hannon GJ. Argonaute2 is the catalytic engine of mammalian RNAi. Science 2004 Sep 3;305(5689):1437-41 [14]
- ↑ Ma J, Yuan Y, Meister G, Pei Y, Tuschl T, Patel D (2005). «Structural basis for 5'-end-specific recognition of guide RNA by the A. fulgidus Piwi protein». Nature 434 (7033): 666-70. PMID 15800629. doi:10.1038/nature03514.
- ↑ Sen G, Wehrman T, Blau H (2005). «mRNA translation is not a prerequisite for small interfering RNA-mediated mRNA cleavage». Differentiation 73 (6): 287-93. PMID 16138829. doi:10.1111/j.1432-0436.2005.00029.x.
- ↑ Gu S, Rossi J (2005). «Uncoupling of RNAi from active translation in mammalian cells». RNA 11 (1): 38-44. PMID 15574516. doi:10.1261/rna.7158605.
- ↑ Sen G, Blau H (2005). «Argonaute 2/RISC resides in sites of mammalian mRNA decay known as cytoplasmic bodies». Nat Cell Biol 7 (6): 633-6. PMID 15908945. doi:10.1038/ncb1265.
- ↑ Lian S, Jakymiw A, Eystathioy T, Hamel J, Fritzler M, Chan E (2006). «GW bodies, microRNAs and the cell cycle». Cell Cycle 5 (3): 242-5. PMID 16418578.
- ↑ Jakymiw A, Lian S, Eystathioy T, Li S, Satoh M, Hamel J, Fritzler M, Chan E (2005). «Disruption of P bodies impairs mammalian RNA interference». Nat Cell Biol 7 (12): 1267-74. PMID 16284622. doi:10.1038/ncb1334.
- ↑ Eulalio A, Behm-Ansmant I, Schweizer D, Izaurralde E. P-body formation is a consequence, not the cause, of RNA-mediated gene silencing. Mol Cell Biol. 2007 Jun;27(11):3970-81 [15]
- ↑ Novina CD, Sharp PA. The RNAi revolution. Nature 2004 Jul 8;430(6996):161-4 [16]
- ↑ Motamedi MR, Verdel A, Colmenares SU, Gerber SA, Gygi SP, Moazed D. Two RNAi complexes, RITS and RDRC, physically interact and localize to noncoding centromeric RNAs. Cell. 2004 Dec 17;119(6):789-802 [17]
- ↑ a b Dykxhoorn DM, Novina CD, Sharp PA.Killing the messenger: short RNAs that silence gene expression. Nature Rev Mol Cell Biol. 2003, 457 - 467 [18]
- ↑ Fortunato A, Fraser A (2005). «Uncover genetic interactions in Caenorhabditis elegans by RNA interference». Biosci Rep 25 (5–6): 299-307. PMID 16307378. doi:10.1007/s10540-005-2892-7.
- ↑ Shi Y. Mammalian RNAi for the masses.Trends Genet. 2003 Jan;19(1):9-12 [19]
- ↑ a b Snøve O Jr, Rossi JJ. Expressing short hairpin RNAs in vivo. Nat Methods 2006 Sep;3(9):689-95 [20]
- ↑ McManus MT, Sharp PA. Gene silencing in mammals by small interfering RNAs. Nat Rev Genet. 2002 Oct;3(10):737-47 [21]
- ↑ Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001 May 24;411(6836):494-8[22]
- ↑ Patzel V. In silico selection of active siRNA. Drug Discov Today 2007 Feb;12(3-4):139-48 [23]
- ↑ Pei Y, Tuschl T. On the art of identifying effective and specific siRNAs. Nature Methods 2006 3, 670-676 [24]
- ↑ Donzé O, Picard D.RNA interference in mammalian cells using siRNAs synthesized with T7 RNA polymerase. Nucleic Acids Res. 2002 May 15;30(10):e46 [25]
- ↑ Calegari F, Haubensak W, Yang D, Huttner WB, Buchholz F. Tissue-specific RNA interference in postimplantation mouse embryos with endoribonuclease-prepared short interfering RNA. Proc Natl Acad Sci U S A 2002 Oct 29;99(22):14236-40 [26]
- ↑ Shan G, Li Y, Zhang J, Li W, Szulwach KE, Duan R, Faghihi MA, Khalil AM, Lu L, Paroo Z, Chan AW, Shi Z, Liu Q, Wahlestedt C, He C, Jin P. (2008). «A small molecule enhances RNA interference and promotes microRNA processing.». Nat Biotechnol. 26 (8). 933-40. [27]
- ↑ a b Jackson AL, Bartz SR, Schelter J, Kobayashi SV, Burchard J, Mao M, Li B, Cavet G, Linsley PS. Expression profiling reveals off-target gene regulation by RNAi. Nat Biotechnol. 2003 Jun;21(6):635-7 [28]
- ↑ a b Dykxhoorn DM, Lieberman J. Knocking down disease with siRNAs. Cell 2006 Jul 28;126(2):231-5 [29]
- ↑ Jackson AL, Burchard J, Leake D, Reynolds A, Schelter J, Guo J, Johnson JM, Lim L, Karpilow J, Nichols K, Marshall W, Khvorova A, Linsley PS. Position-specific chemical modification of siRNAs reduces "off-target" transcript silencing. RNA 2006 Jul;12(7):1197-205 [30]
- ↑ Moffat J, Sabatini DM. Building mammalian signalling pathways with RNAi screens. Nat Rev Mol Cell Biol. 2006 Mar;7(3):177-87 [31]
- ↑ Dorsett Y, Tuschl T. siRNAs: applications in functional genomics and potential as therapeutics. Nat Rev Drug Discov. 2004 Apr;3(4):318-29 [32]
- ↑ Harborth J, Elbashir SM, Bechert K, Tuschl T, Weber K. Identification of essential genes in cultured mammalian cells using small interfering RNAs. J Cell Sci. 2001 Dec;114(Pt 24):4557-65 [33]
- ↑ Voorhoeve PM, Agami R (2003). «Knockdown stands up». Trends Biotechnol. 21 (1): 2-4. PMID 12480342. doi:10.1016/S0167-7799(02)00002-1.
- ↑ Kamath R, Ahringer J (2003). «Genome-wide RNAi screening in Caenorhabditis elegans». Methods 30 (4): 313-21. PMID 12828945. doi:10.1016/S1046-2023(03)00050-1.
- ↑ Boutros M, Kiger A, Armknecht S, Kerr K, Hild M, Koch B, Haas S, Paro R, Perrimon N (2004). «Genome-wide RNAi analysis of growth and viability in Drosophila cells». Science 303 (5659): 832-5. PMID 14764878. doi:10.1126/science.1091266.
- ↑ Cullen L, Arndt G (2005). «Genome-wide screening for gene function using RNAi in mammalian cells». Immunol Cell Biol 83 (3): 217-23. PMID 15877598. doi:10.1111/j.1440-1711.2005.01332.x.
- ↑ Huesken D, Lange J, Mickanin C, Weiler J, Asselbergs F, Warner J, Meloon B, Engel S, Rosenberg A, Cohen D, Labow M, Reinhardt M, Natt F, Hall J (2005). «Design of a genome-wide siRNA library using an artificial neural network». Nat Biotechnol 23 (8): 995-1001. PMID 16025102. doi:10.1038/nbt1118.
- ↑ Ge G, Wong G, Luo B (2005). «Prediction of siRNA knockdown efficiency using artificial neural network models». Biochem Biophys Res Commun 336 (2): 723-8. PMID 16153609. doi:10.1016/j.bbrc.2005.08.147.
- ↑ Janitz M, Vanhecke D, Lehrach H (2006). «High-throughput RNA interference in functional genomics». Handb Exp Pharmacol: 97-104. PMID 16594612.
- ↑ Vanhecke D, Janitz M (2005). «Functional genomics using high-throughput RNA interference». Drug Discov Today 10 (3): 205-12. PMID 15708535. doi:10.1016/S1359-6446(04)03352-5.
- ↑ Geldhof P, Murray L, Couthier A, Gilleard J, McLauchlan G, Knox D, Britton C (2006). «Testing the efficacy of RNA interference in Haemonchus contortus». Int J Parasitol 36 (7): 801-10. PMID 16469321. doi:10.1016/j.ijpara.2005.12.004.
- ↑ Geldhof P, Visser A, Clark D, Saunders G, Britton C, Gilleard J, Berriman M, Knox D. (2007). «RNA interference in parasitic helminths: current situation, potential pitfalls and future prospects». Parasitology 134: 1-11. PMID 17201997. doi:10.1017/S0031182006002071.
- ↑ Travella S, Klimm T, Keller B (2006). «RNA interference-based gene silencing as an efficient tool for functional genomics in hexaploid bread wheat». Plant Physiol 142 (1): 6-20. PMID 16861570. doi:10.1104/pp.106.084517.
- ↑ McGinnis K, Chandler V, Cone K, Kaeppler H, Kaeppler S, Kerschen A, Pikaard C, Richards E, Sidorenko L, Smith T, Springer N, Wulan T (2005). «Transgene-induced RNA interference as a tool for plant functional genomics». Methods Enzymol 392: 1-24. PMID 15644172. doi:10.1016/S0076-6879(04)92001-0.
- ↑ Paddison P, Caudy A, Hannon G (2002). «Stable suppression of gene expression by RNAi in mammalian cells». Proc Natl Acad Sci USA 99 (3): 1443-8. PMID 11818553. doi:10.1073/pnas.032652399.
- ↑ Sah D (2006). «Therapeutic potential of RNA interference for neurological disorders». Life Sci 79 (19): 1773-80. PMID 16815477. doi:10.1016/j.lfs.2006.06.011.
- ↑ Zender L, Hutker S, Liedtke C, Tillmann H, Zender S, Mundt B, Waltemathe M, Gosling T, Flemming P, Malek N, Trautwein C, Manns M, Kuhnel F, Kubicka S (2003). «Caspase 8 small interfering RNA prevents acute liver failure in mice». Proc Natl Acad Sci USA 100 (13): 7797-802. PMID 12810955. doi:10.1073/pnas.1330920100.
- ↑ Jiang M, Milner J (2002). «Selective silencing of viral gene expression in HPV-positive human cervical carcinoma cells treated with siRNA, a primer of RNA interference». Oncogene 21 (39): 6041-8. PMID 12203116. doi:10.1038/sj.onc.1205878.
- ↑ Crowe S (2003). «Suppression of chemokine receptor expression by RNA interference allows for inhibition of HIV-1 replication, by Martínez et al». AIDS. 17 Suppl 4: S103-5. PMID 15080188.
- ↑ Kusov Y, Kanda T, Palmenberg A, Sgro J, Gauss-Müller V (2006). «Silencing of hepatitis A virus infection by small interfering RNAs». J Virol 80 (11): 5599-610. PMID 16699041. doi:10.1128/JVI.01773-05.
- ↑ Jia F, Zhang Y, Liu C (2006). «A retrovirus-based system to stably silence hepatitis B virus genes by RNA interference». Biotechnol Lett 28 (20): 1679-85. PMID 16900331. doi:10.1007/s10529-006-9138-z.
- ↑ Li Y, Kong L, Cheng B, Li K (2005). «Construction of influenza virus siRNA expression vectors and their inhibitory effects on multiplication of influenza virus». Avian Dis 49 (4): 562-73. PMID 16405000. doi:10.1637/7365-041205R2.1.
- ↑ Hu L, Wang Z, Hu C, Liu X, Yao L, Li W, Qi Y (2005). «Inhibition of Measles virus multiplication in cell culture by RNA interference». Acta Virol 49 (4): 227-34. PMID 16402679.
- ↑ Raoul C, Barker S, Aebischer P (2006). «Viral-based modelling and correction of neurodegenerative diseases by RNA interference». Gene Ther 13 (6): 487-95. PMID 16319945. doi:10.1038/sj.gt.3302690.
- ↑ Putral L, Gu W, McMillan N (2006). «RNA interference for the treatment of cancer». Drug News Perspect 19 (6): 317-24. PMID 16971967. doi:10.1358/dnp.2006.19.6.985937.
- ↑ Izquierdo M (2005). «Short interfering RNAs as a tool for cancer gene therapy». Cancer Gene Ther 12 (3): 217-27. PMID 15550938. doi:10.1038/sj.cgt.7700791.
- ↑ Molecular Therapy web focus: "The development of RNAi as a therapeutic strategy" [34]
- ↑ Li C, Parker A, Menocal E, Xiang S, Borodyansky L, Fruehauf J (2006). «Delivery of RNA interference». Cell Cycle 5 (18): 2103-9. PMID 16940756.
- ↑ Takeshita F, Ochiya T (2006). «Therapeutic potential of RNA interference against cancer». Cancer Sci 97 (8): 689-96. PMID 16863503. doi:10.1111/j.1349-7006.2006.00234.x.
- ↑ Tong A, Zhang Y, Nemunaitis J (2005). «Small interfering RNA for experimental cancer therapy». Curr Opin Mol Ther 7 (2): 114-24. PMID 15844618.
- ↑ Qiu S, Adema C, Lane T (2005). «A computational study of off-target effects of RNA interference». Nucleic Acids Res 33 (6): 1834-47. PMID 15800213. doi:10.1093/nar/gki324.
- ↑ Grimm D, Streetz K, Jopling C, Storm T, Pandey K, Davis C, Marion P, Salazar F, Kay M (2006). «Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways». Nature 441 (7092): 537-41. PMID 16724069. doi:10.1038/nature04791.
- ↑ Sunilkumar G, Campbell L, Puckhaber L, Stipanovic R, Rathore K (2006). «Engineering cottonseed for use in human nutrition by tissue-specific reduction of toxic gossypol». Proc Natl Acad Sci USA 103 (48): 18054-9. PMID 17110445. doi:10.1073/pnas.0605389103.
- ↑ Siritunga D, Sayre R (2003). «Generation of cyanogen-free transgenic cassava». Planta 217 (3): 367-73. PMID 14520563. doi:10.1007/s00425-003-1005-8.
- ↑ Le L, Lorenz Y, Scheurer S, Fötisch K, Enrique E, Bartra J, Biemelt S, Vieths S, Sonnewald U (2006). «Design of tomato fruits with reduced allergenicity by dsRNAi-mediated inhibition of ns-LTP (Lyc e 3) expression». Plant Biotechnol J 4 (2): 231-42. PMID 17177799. doi:10.1111/j.1467-7652.2005.00175.x.
- ↑ Gavilano L, Coleman N, Burnley L, Bowman M, Kalengamaliro N, Hayes A, Bush L, Siminszky B (2006). «Genetic engineering of Nicotiana tabacum for reduced nornicotine content». J Agric Food Chem 54 (24): 9071-8. PMID 17117792. doi:10.1021/jf0610458.
- ↑ Allen R, Millgate A, Chitty J, Thisleton J, Miller J, Fist A, Gerlach W, Larkin P (2004). «RNAi-mediated replacement of morphine with the nonnarcotic alkaloid reticuline in opium poppy». Nat Biotechnol 22 (12): 1559-66. PMID 15543134. doi:10.1038/nbt1033.
- ↑ Zadeh A, Foster G (2004). «Transgenic resistance to tobacco ringspot virus». Acta Virol 48 (3): 145-52. PMID 15595207.
- ↑ Niggeweg R, Michael A, Martin C (2004). «Engineering plants with increased levels of the antioxidant chlorogenic acid». Nat Biotechnol 22 (6): 746-54. PMID 15107863. doi:10.1038/nbt966.
- ↑ Sanders R, Hiatt W (2005). «Tomato transgene structure and silencing». Nat Biotechnol 23 (3): 287-9. PMID 15765076. doi:10.1038/nbt0305-287b.
- ↑ Chiang C, Wang J, Jan F, Yeh S, Gonsalves D (2001). «Comparative reactions of recombinant papaya ringspot viruses with chimeric coat protein (CP) genes and wild-type viruses on CP-transgenic papaya». J Gen Virol 82 (Pt 11): 2827-36. PMID 11602796.
Bibliografía
[editar]- Claros G, Saladrigas V (2003): Vocabulario inglés-español de bioquímica y biología molecular (2.ª entrega) Panace@ IV (11): 18-29. Vocabulario completo en BioROM (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última)..
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre SiRNA.
Wikimedia Commons alberga una categoría multimedia sobre SiRNA. Wikiversidad alberga proyectos de aprendizaje sobre SiRNA.
Wikiversidad alberga proyectos de aprendizaje sobre SiRNA.- Animación del proceso de RNAi (en inglés), de Nature
- NOVA scienceNOW explains RNAi – Un video de 15 minutos (en inglés) del magacín Nova que se emitió en PBS, July 26, 2005
- Silencing Genomes Archivado el 10 de agosto de 2019 en Wayback Machine. Experimentos de interferencia de ARN (RNAi) y bioinformática en C. elegans para alumnos. Del Dolan DNA Learning Center of Cold Spring Harbor Laboratory (en inglés).
- RNAi screens in C. elegans in a 96-well liquid format and their application to the systematic identification of genetic interactions (a protocol)
- 2 American ‘Worm People’ Win Nobel for RNA Work, from NY Times
- colecciones a gran escala de RNAi de mamíferos disponibles públicamente en instituciones académicas (de ratón o de humano): [44], [45], [46]

