Diferencia entre revisiones de «Cromosoma»
Sin resumen de edición |
→Véase también: procariotas |
||
| Línea 393: | Línea 393: | ||
| unplaced various || ? || 25,263,157 || 25,062,835 |
| unplaced various || ? || 25,263,157 || 25,062,835 |
||
|} |
|} |
||
==El cromosoma en organismos procariotas== |
|||
Los procariotas, [[bacteria]] y [[archaea]], presentan típicamente un solo cromosoma circular, si bien existen algunas variantes a esta regla.<ref>{{cite journal |author=Thanbichler M, Shapiro L |title=Chromosome organization and segregation in bacteria |journal=J. Struct. Biol. |volume=156 |issue=2 |pages=292–303 |year=2006 |pmid=16860572 |doi=10.1016/j.jsb.2006.05.007}}</ref> El cromosoma bacteriano puede tener un tamaño desde 160.000 pares de bases (como en el endosimbionte ''[[Carsonella ruddii]]'',<ref>{{cite journal |author=Nakabachi A, Yamashita A, Toh H, Ishikawa H, Dunbar H, Moran N, Hattori M |title=The 160-kilobase genome of the bacterial endosymbiont ''Carsonella'' |journal=Science |volume=314 |issue=5797 |pages=267 |year=2006 |pmid=17038615 |doi=10.1126/science.1134196}}</ref> a 12.200.000 pares de bases en la bacteria del suelo ''[[Sorangium cellulosum]]''.<ref>{{cite journal |author=Pradella S, Hans A, Spröer C, Reichenbach H, Gerth K, Beyer S |title=Characterisation, genome size and genetic manipulation of the myxobacterium ''Sorangium cellulosum'' So ce56 |journal=Arch Microbiol |volume=178 |issue=6 |pages=484–92 |year=2002 |pmid=12420170 | doi = 10.1007/s00203-002-0479-2 }}</ref> |
|||
Las bacterias usualmente tienen un solo punto en su cromosoma desde el cual se inicia la duplicación, mientras que algunas archeas presentan mñultiples sitios de incio de la duplicación.<ref>{{cite journal |author=Kelman LM, Kelman Z |title=Multiple origins of replication in archaea |journal=Trends Microbiol. |volume=12 |issue=9 |pages=399–401 |year=2004 |pmid=15337158 |doi=10.1016/j.tim.2004.07.001}}</ref> Por otro lado, los genes de los procariotas están organizados en operones y no contienen intrones. |
|||
Los procariotas no poseen un núcleo verdadero, en cambio su ADN está organizado en una estructura denominada ''nucleoide''.<ref>{{cite journal |author=Thanbichler M, Wang SC, Shapiro L |title=The bacterial nucleoid: a highly organized and dynamic structure |journal=J. Cell. Biochem. |volume=96 |issue=3 |pages=506–21 |year=2005 |pmid=15988757 | doi = 10.1002/jcb.20519 <!--Retrieved from PMID by DOI bot-->}}</ref> El nucleoide es una estrutura distintivay ocupa una región definida en la célula bacteriana. Esta estructura es muy dinámica y se halla mantenida y remodelada a través de la acción de proteínas similares a histonas, las cuales se asocian al cromosoma bactaetiano.<ref>{{cite journal |author=Sandman K, Pereira SL, Reeve JN |title=Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome |journal=Cell. Mol. Life Sci. |volume=54 |issue=12 |pages=1350–64 |year=1998 |pmid=9893710 |doi=10.1007/s000180050259}}</ref> En archaea, el ADN en el cromosoma se halla todavía más organizado, con el ADN empacado dentro de estructuras similares a los nucleosomas eucarióticos.<ref>{{cite journal |author=Sandman K, Reeve JN |title=Structure and functional relationships of archaeal and eukaryal histones and nucleosomes | doi = 10.1007/s002039900122 <!--Retrieved from Yahoo! by DOI bot-->|journal=Arch. Microbiol. |volume=173 |issue=3 |pages=165–9 |year=2000 |pmid=10763747}}</ref><ref>{{cite journal |author=Pereira SL, Grayling RA, Lurz R, Reeve JN |title=Archaeal nucleosomes | doi = 10.1073/pnas.94.23.12633 <!--Retrieved from URL by DOI bot-->|journal=Proc. Natl. Acad. Sci. U.S.A. |volume=94 |issue=23 |pages=12633–7 |year=1997 |pmid=9356501 |url=http://www.pnas.org/cgi/pmidlookup?view=long&pmid=9356501}}</ref> |
|||
== Véase también == |
== Véase también == |
||
Revisión del 22:33 5 ago 2008
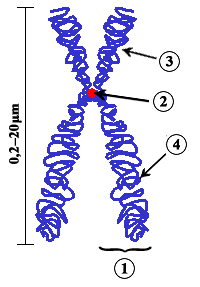
Cromosoma (del griego chroma, color, y soma, cuerpo o elemento) es cada uno de los pequeños cuerpos en forma de bastoncillos en que se organiza la cromatina del núcleo celular en la mitosis y la meiosis, cada uno de los cuales se divide longitudinalmente, dando origen a dos cadenas gemelas (iguales). Su número es constante para una especie determinada; en Homo sapiens sapiens (el ser humano) se tienen 46. De ellos 44 son autosómicos y 2 son sexuales o gonosomas.
Se llama cromatina al material microscópico constituido del ADN y de proteínas especiales llamadas histonas que se encuentra en el núcleo de las células eucariotas en las cuales los cromosomas se ven como una maraña de hilos delgados. Cuando la célula comienza su proceso de división (cariocinesis), la cromatina se condensa y los cromosomas se hacen visibles como entidades independientes. La unidad básica de la cromatina son los nucleosomas. Los cromosomas se suelen representar por pares, en paralelo con su homólogo.
Definiciones
Desde un punto de vista etimológico, la palabra cromosoma procede del griego y significa "cuerpo que se tiñe"; mientras que la palabra cromatina significa "sustancia que se tiñe". Los cromosomas fueron observados en células de plantas por el botánico suizo Karl Wilhelm von Nägeli en 1842 e, independientemente, por el científico belga Edouard Van Beneden en lombrices del género Ascaris.[1][2] El uso de drogas basofílicas como las anilinas como técnica citológica para observar el material nuclear fue fundamental para los descubrimientos posteriores. Así, el citólogo alemán Walther Flemming en 1882 definió inicialmente a la cromatina como "la sustancia que constituye los núcleos interfásicos y que muestra determinadas propiedades de tinción".[3]
Esta definición, al igual que la inicial de cromosoma, es puramente citológica. Décadas más tarde de la observación inicial de Flemming, el re-descubrimiento de las Leyes de Mendel permitió arribar a una definición biológica del término: tanto la cromatina como el cromosoma constituyen el material genético organizado. Un breve resumen de la historia del concepto de cromosoma se provee a continuación.
Entre 1868 y 1869, el suizo Friedrich Miescher, siendo estudiante postdoctoral en el laboratorio de Frierich Hoppe-Seyler (el padre del término "Bioquímica") en Tübingen, aisló núcleos a partir de la pus de los vendajes usados del hospital. Comprobó luego que los mismos estaban formados por una única sustancia química muy homogénea, no proteica, a la que denominó nucleína. El término ácido nucleico fue acuñado posteriormente por R. Altman en 1889. E. Zacharias demostró en 1881 que los cromosomas estaban químicamente formados por nucleína. Entre 1879 y 1882 Walther Flemming y Robert Feulgen, independientemente, desarrollan nuevas técnicas de tinción y logran visualizar los cromosomas en división, lo que les permitió describir la manera en que se dividen los cromosomas (la mitosis). En 1889, August Weissman asoció de manera teórica, casi intuitiva, la herencia y los cromosomas. De hecho, hubo que esperar hasta 1902 para que Walter S. Sutton propusiera, basado en evidencias experimentales, que los "factores" de Mendel eran unidades físicas que se localizan en los cromosomas. Parte del trabajo que permitió a Sutton proponer ese modelo se debió a su descubrimiento de la meiosis junto a Theodor Boveri. A su vez, Thomas Hunt Morgan en la Universidad de Columbia publicó en 1910 los experimentos que hoy se consideran clásicos sobre los rasgos genéticos ligados al sexo, lo que le valió el Premio Nobel en 1933.[4] En 1913, Calvin Bridges demostró que los genes están en los cromosomas, y Alfred Henry Sturtevant que los genes se hallan dispuestos linealmente a lo largo del cromosoma, elaborando el primer mapa genético de un organismo: Drosophila melanogaster. En 1915 quedaron definitivamente establecidas las bases fundamentales de la herencia fenotípica al aparecer el libro "El mecanismo de la herencia mendeliana" escrito por Thomas H. Morgan, Alfred Strurtevant, Hermann Muller y Calvin Bridges. En este contexto se inicia la teoría cromosómica de la herencia a pesar de no conocerse su naturaleza química.[5]
En el caso de los organismos eucariontes el cromosoma está formado por tres tipos diferentes de moléculas: el ADN, las histonas y las proteínas no histónicas. De hecho, los cromosomas eucarióticos son moléculas muy largas de ADN de doble hélice que interactúan con proteínas (histonas y no histonas) y se pueden hallar en estados relajados o poco compactados, como en los núcleos de las células en interfase, hasta en estados altamente compactados, como sucede en la metafase mitótica.
Cronología de descubrimientos

- 1841, los cromosomas fueron descubiertos por Karl Wilhelm von Nägeli.
- 1869, F. Miescher descubre el ADN.
- 1889, Wilhelm von Waldeyer les dio el nombre de cromosoma que significa cuerpo coloreado en idioma griego.
- 1910, Thomas Hunt Morgan describió que son los portadores de los genes.
- 1943, Avery, C. McLeod y M. McCarty: ADN como material hereditario.
- 1953, James Dewey Watson y Francis Harry Compton Crick descubren la estructura del ADN. (La doble hélice).
- 1966, Severo Ochoa completa el código genético.
- 1972, D. Jackson, R. Symons, P. Berg: molécula artificial.
- 1973, J. Boyer, S. Cohen: clonación de bacterias.
- 1977, F. Sanger: secuenciación del ADN.
- 1978, producción de proteína humana en bacterias.
- 1981, se hace el primer diagnóstico prenatal.
- 1982, organismos transgénicos.
- 1983, secuenciación de los primeros genomas enteros.
- 2001, secuenciación del genoma humano
Composición química de la cromatina: el nucleosoma
Los principales componentes que se obtienen cuando se aísla la cromatina de los núcleos interfásicos son el ADN, las proteínas histónicas, las proteínas no histónicas y el ARN. La cantidad de proteínas no histónicas puede variar de unos tejidos a otros en el mismo individuo y dentro del mismo tejido a lo largo del desarrollo.
Las histonas
Las histonas son proteínas básicas, ricas en residuos de lisina y arginina, que muestran una elevado conservación evolutiva y que interaccionan con el ADN formando una subunidad que se repite a lo largo de la cromatina denominada nucleosoma. Los principales tipos de histonas que se han aislado en los núcleos interfásicos en diferentes especies eucariontes son: H1, H2A, H2B, H3 y H4. Además de estas histonas, también existen otras que son específicas de tejido como es la histona H5 muy rica en lisina (25 moles%) específica de eritrocitos nucleados de vertebrados no mamíferos, y de las histonas del endosperma.
Una de las características más destacables es su elevado conservadurismo evolutivo, sobre todo de las histonas H3 y H4. La histona H4 de guisante y de timo de ternera se diferencian solamente en dos aminoácidos. Esta dato, indica que las interacciones entre el ADN y las histonas para formar la cromatina deben ser muy semejantes en todos los organismos eucariontes.
Los genes para las histonas se encuentran agrupados en nichos (o clusters) que se repiten decenas o centenas de veces (como por ejemplo en el erizo de mar). Cada cluster o grupo contiene el siguiente orden de los genes para histonas: H1-H2A-H3-H2B-H4. Los genes para las histonas son ricos en pares G-C ya que codifican proteínas con elevado contenido en lisina y arginina, pero están separados por secuencias espaciadoras ricas en pares A-T.
El nucleosoma

La observación de la cromatina interfásica mediante técnicas de microscopia electrónica podría describirse como la repetición de una subunidad esférica o globular (los nucleosomas) que estarían unidos por fibras de ADN. Esto le da un aspecto como de cuentas de un collar o de un rosario. Un nucleosoma típico está asociado a 200 pares de bases (pb) y está formado por una médula ("core") y un ligador (o "linker"). La médula está formada por un octámero constituido por dos subunidades de las siguientes histonas: H2A, H2B, H3 y H4. Se trata de un dímero de las histonas (H2A, H2B, H3 y H4)2. Los trabajos de A. Klug y colaboradores[6][7] sobre la disposición de las histonas en la médula del nucleosoma le valieron el Premio Nobel de Química en 1982. Alrededor de la médula se enrolla el ADN (140 pb) dando casi dos vueltas (una vuelta y tres cuartos). El resto del ADN (60 pb) forma parte del ligador ("linker") y está interaccionando con la histona H1. La cantidad de ADN asociado con un nucleosoma varia de una especie a otra, de 154 pb a 241 pb, esta variación se debe fundamentalmente a la cantidad de ADN asociada al ligador ("linker").
Las fibras de ADN dúplex desnudo tienen un grosor de 20 Å. La asociación del ADN con las histonas genera los nucleosomas que muestran unos 100 Å de diámetro, a su vez los nucleosomas se pueden enrollar helicoidalmente para formar un solenoide (una especie de muelle) que constituye las fibras de cromatina de los núcleos intefásicos con un diámetro aproximado de 300 Å. Los solenoides pueden volverse a enrollar para dar lugar a supersolenoides con un diámetro de 4.000 Å a 6.000 Å que constituirían las fibras de los cromosomas metafásicos.[6][7]
Proteínas cromosómicas no histónicas: el armazón proteico
Las proteínas cromosómicas no histónicas son proteínas diferentes de las histonas que se extraen de la cromatina de los núcleos con ClNa 0.35M (solución salina), tienen un alto contenido en aminoácidos básicos (25% o más), alto contenido en aminoácidos ácidos (20-30%), una elevada proporción de prolina (7%), bajo contenido en aminoácidos hidrofóbicos y una alta movilidad electroforética. Las proteínas cromosómicas no histónicas que se extraen de la cromatina de los núcleos varían mucho dependiendo de la técnica de aislamiento empleada. Un grupo de estas proteínas cromosómicas no histónicas presentan alta movilidad electrofóretica y se denominan abreviadamente HMG (grupo de alta movilidad). Se han detectado más de 20 proteínas HMG, habiéndose encontrado las proteínas HMG-1, HMG-2 , HMG-14 y HMG-17 en todas las especies de mamíferos, aves y peces estudiadas hasta el momento. Las proteínas HMG-1 y HMG-2 se encuentran sólo en el núcleo, están implicadas en la replicación, se unen preferentemente a ADN de hélice sencilla, desenrollan el ADN dúplex y se estima que existe una molécula de HMG-1 ó HMG-2 por cada 15 nucleosomas. Las proteínas HMG-14 y HMG-17 se encuentran en el núcleo y en el citoplasma, están relacionadas con la regulación de la transcripción y se estima que existe una molécula de HMG14 ó HMG-17 por cada 10 nucleosomas.
Muchos estudios citogenéticos muestran que los cromosomas están claramente enrollados cuando se observan al microscopio, un buen ejemplo de esta situación son los cromosomas de los núcleos de algunos protozoos. El diámetro de las fibras de solenoides (enrollamiento helicoidal de las fibras de nucleosomas) observadas en núcleos en interfase es de 30 nm, sin embargo, el diámetro observado al microscopio para las fibras cromosómicas durante la división celular es de 700 nm. Por tanto, se han tenido que producir nuevos superenrollamientos. Laemmli y colaboradores en 1977 consiguieron aislar cromosomas metafásicos desprovistos de histonas mediante un tratamiento con sulfato de dextrano y heparina.[8] Estos cromosomas metafásicos desprovistos de histonas presentan una médula central densamente teñida que ha sido denominada “scaffold” (armazón). Este armazón proteico (“scaffold”) es resistente a la acción de la ADN asa, ARN asa y también a soluciones de ClNa 2M. Sin embargo, desaparece por tratamientos con urea 4M y dodecil sulfato sódico o por tratamiento con enzimas proteolíticas. Por tanto, se trata de un armazón proteíco. La observación a microscopía electrónica pone de manifiesto que de este armazón proteico (“scaffold”) salen y llegan lazos o fibras que pueden hacerse desaparecer mediante tratamiento con ADNasa. Por tanto, estos lazos o dominios que arrancan del armazón proteico son lazos de ADN. Uno de los principales componentes del armazón proteico es la enzima topoisomerasa II que produce cortes en el ADN dúplex a nivel de ambas hélices. La toposiomerasa II (girasa) interviene durante la replicación del ADN creando o relajando los superenrollamientos. La aparición de la topoisomerasa II (girasa) sólo en el armazón proteico sugiere que se encuentra en la base de los lazos o dominios de ADN, indicando que esta organización en dominios podría estar relacionada con la replicación y transcrpción. Otras enzimas como la topoisomerasa I que produce cortes en el ADN dúplex a nivel de una sola hélice y la HMG-17 se encuentran sólo en los lazos o dominios y no en el armazón proteico. La evidencia existente hasta el momento sugiere que las fibras de solenoides (30 nm) formarían los lazos o dominios que emanan del armazón proteico y que este armazón estaría a su vez enrollado formando una espiral.[8]
Los dominios de ADN parecen estar unidos al armazón proteico por unas regiones específicas denominadas abreviadamente SARs (regiones de asociación específicas) que se detectan cuando los cromosomas metafásicos desprovistos de histonas se tratan con endonucleasas de restricción. Después de este tratamiento quedan regiones de ADN unidas al armazón que a su vez resisten la digestión con exonucleasas gracias a que están protegidas por una proteína. Cuando se digiere esta proteína, las regiones de ADN protegidas contienen secuencias que se sabe que son especificas para la unión de topoisomerasas. Estas regiones regiones de unión especificas de los dominios al armazón proteico son las regiones SARs.
ARN
El ARN parece jugar algún papel en el plegamiento del cromosoma eucariótico. Al menos en humanos y en Drosophila se han encontrado evidencias de este papel estructural del ARN. Sin embargo, hay que tener en cuenta que el armazón proteico descrito por Laemmli y colaboradores (1977) no se ve afectado por el tratamiento con ARNasa. Podría ser que las propias proteínas del armazón protegieran al ARN de la acción de la ARNasa. En cualquier caso, es conveniente recordar que el ADN del cromosoma bacteriano también está organizado en dominios y que el ARN podría jugar algún papel en el mantenimiento de dicha estructura. En organismos con características intermedias entre las de procariontes y eucariontes como los dinoflagelados, también existen existen datos que apoyan el papel estructural del ARN en la organización cromosómica.
Eucromatina y heterocromatina
La cromatina o sustancia que compone los núcleos de las células y que resulta de la interacción del ADN con las proteínas histónicas, no histónicas y ARN; puede presentar distintos grados de empaquetamiento o contracción.
Cuando los cromosomas se tiñen con sustancias químicas que se unen al ADN aparecen regiones densamente teñidas y regiones menos densamente teñidas.
La cromatina mayoritaria, la que constituye la mayor parte del núcleo recibe el nombre de eucromatina y la minoritaria el de heterocromatina. La heterocromatina puede aparecer más densamente teñida que la eucromatina (heteropicnosis positiva) o menos densamente teñida que la eucromatina (heteropicnosis negativa). La aplicación de determinados tratamientos experimentales en combinación con diferentes tipos de tinción de los cromosomas, puede producir la aparición de zonas heterocromáticas en los cromosomas de muchas especies.
Estas zonas heterocromáticas presentan una distribución característica o patrón de bandas típico de cada cromosoma que permite identificar cromosomas distintos. Estas técnicas reciben el nombre de técnicas de bandeo cromosómico y son enormemente útiles en la identificación individual de los cromosomas y en la construcción de cariotipos.
Diferencias
- Diferencias genéticas: Los experimentos de construcción de mapas demuestran que la mayor parte de los genes activos se localizan en la eucromatina. En los nucleos interfásicos, la eucromatina se tiñe menos densamente debido al menor grado de empaquetamiento, en general se acepta que este es el estado más compatible con la actividad génica y la transcripción. La heterocromatina se encuentra en muchos organismos flanqueando las regiones céntromericas, algunas veces tambien se encuentra en regiones teloméricas, e incluso se ha observado en algunos casos la existencia de cromosomas completos heterocromáticos, por ejemplo, el cromosoma Y de Drosophila melanogater. La función de la heterocromatina no es aún conocida, se han detectado muy pocos genes activos en la heterocromatina, en Drodophila existen mutaciones letales en genes que se localizan en regiones heterocromáticas, por tanto, estos genes deben poseer alguna actividad. En cualquier caso, el porcentaje de genes activos localizados en regiones heterocromaticas es muy bajo comparado con el de genes activos situados en la eucromatina. La principal diferencia entre la eucromatina y la heterocromatina radica por tanto en la actividad de estos dos tipos de cromatina.
- Diferencias citológicas: A nivel estructural, en los nucleos interfásicos, existe una mayor grado de enrollamiento o empaquetamiento en la heterocromatina que en la eucromatina. La forma en la que se mantiene esta diferencia aun no es conocida.
- Alociclia: la heterocromatina sigue un ciclo de condensación y descondensación distinto a la eucromatina. La heterocromatina puede aparecer más intensamente teñida que la eucromatina o menos intensamente teñida dependiendo del estado celular (alociclia). La alociclia a su vez esta relacionada con la replicación del ADN. La heterocromatina se replica más tarde que la eucromatina.
Tipos de heterocromatina
Se pueden distinguir dos clases de heterocromatina:
- Heterocromatina constitutiva: cromatina que aparece siempre más intensamente teñida que la eucromatina (heteropicnosis positiva), o menos intensamente teñida que la eucromatina (heteropicnosis negativa), independientemente del estado de desarrollo o fisiológico. Un ejemplo es el ADN satélite de las regiones centroméricas.
- Heterocromatina facultativa: cromatina que aparece más intensamente teñida que la eucromatina, o menos intensamente teñida que la eucromatina dependiendo del estado fisiológico o del momento de desarrollo. El cromosoma X, en algunas especies animales, como el saltamontes Schistocerca gregaria, aparece más intensamente teñido que el resto de los cromosomas durante la Diplotena de la Profase I de meiosis.
En la especie humana, todos los cromosomas X que están en exceso de uno aparecen más intensamente teñido que el resto de los cromosomas (heteropicnosis positiva) en los núcleos de células en interfase. Por tanto, las mujeres normales que tienen dos cromosomas X, tienen un cromosoma X que aparece más intensamente teñido y que está inactivado. Sin embargo, durante las primeras etapas del desarrollo embrionario (durante los 16 primeros días de gestación en la especie humana) ambos cromosomas X son activos.
En algunas especies eucariontes, el ADN satélite o ADN minoritario que presenta un contenido en G+C distinto al ADN principal o mayoritario, está constituido por unas secuencias cortas de ADN que están repetidas millones de veces. En concreto en ratón se ha demostrado que el ADN satélite esta localizado en la zona centrómerica, este ADN satélite constituye un ejemplo de heterocromatina constitutiva cuya presencia y acción es constante en el cromosoma.
Telómeros y centrómeros
Telómeros

La palabra telómero procede del griego telos, "final" y meros, "parte". Los telómeros son los extremos de los cromosomas. Son regiones de ADN no codificante, altamente repetitivas, cuya función principal es la estabilidad estructural de los cromosomas en las células eucariotas, la división celular y el tiempo de vida de las estirpes celulares. Además están involucradas en enfermedades tan importantes como el cáncer. En los organismos procariotes, los cromosomas son circulares y no poseen telómeros.
Los telómeros fueron descubiertos por Hermann Joseph Muller durante la década de los años 30. Desde entonces, se ha avanzado mucho en el conocimiento de los telómeros, gracias a las técnicas de la genética molecular.
| Grupo | Organismo | Secuencia del telómero (Dirección 5'a 3' hasta el fin) |
|---|---|---|
| Vertebrados | Humanos, ratón, Xenopus | TTAGGG |
| Hongos filamentosos | Neurospora crassa | TTAGGG |
| Mohos del fango | Physarum, Didymium Dictyostelium |
TTAGGG AG(1-8) |
| Protozoos cinetoplástidos | Trypanosoma, Crithidia | TTAGGG |
| Protozoos ciliados | Tetrahymena, Glaucoma Paramecium Oxytricha, Stylonychia, Euplotes |
TTGGGG TTGGG(T/G) TTTTGGGG |
| Protozoos apicomplexa | Plasmodium | TTAGGG(T/C) |
| Plantas superiores | Arabidopsis thaliana | TTTAGGG |
| Algas verdes | Chlamydomonas | TTTTAGGG |
| Insectos | Bombyx mori | TTAGG |
| Ascáridos | Ascaris lumbricoides | TTAGGC |
| Levaduras aisladas | Schizosaccharomyces pombe | TTAC(A)(C)G(1-8) |
| Levaduras agregadas | Saccharomyces cerevisiae Candida glabrata |
TGTGGGTGTGGTG (de copias de ARN) or G(2-3)(TG)(1-6)T (consenso) |
Centrómeros
El centrómero es la zona por la que el cromosoma interacciona con las fibras del huso acromático en las anafases mitóticas y meióticas y que es responsable de los movimientos cromosómicos que tienen lugar durante estas fases. Las estructuras centroméricas que interaccionan con las fibras del huso se denominan cinetocoros. En la estructura del centrómero también intervienen proteínas centroméricas. Es la constricción primaria y aparece menos teñida que el resto del cromosoma.
Los análisis llevados a cabo en Saccharomyces cerevisiae (levadura) han permitido aislar el ADN centromérico (ADN CEN) de todos sus cromosomas, habiéndose encontrado que en todos los centrómeros estudiados existen tres regiones muy conservadas:
- La región I, secuencia de 8-9 bp (PuTCACPuTG)
que se encuentra en el límite izquierdo de todos los centrómeros.
- La región II con 76-86 pb rica en pares AT (87-95%).
- La región III secuencia de 25 bp altamente conservada en el extremo derecho de los centrómeros. Presenta una secuencia palindrómica TGTTT(T/A)TGNTTTCCGAAANNNAAAA.
Las mutaciones en las regiones I y II reducen pero no inactivan la función del centrómero mientras que las que ocurren en la región III lo inactivan completamente.
Estructura externa de los cromosomas: número, forma y tamaño
El estudio de la estructura externa de los cromosomas de cualquier especie eucariótica consiste en analizar la forma tamaño y número de los cromosomas que posee. El mejor momento para llevar a cabo dicho estudio suele ser aquel en el que los cromosomas han alcanzado su máximo grado de contracción y tienen sus bordes perfectamente definidos. Dicho momento suele ser la metafase mitótica. El estudio de la estructura externa de los cromosomas culmina con la obtención del cariotipo. Naturalmente, los cromosomas se pueden estudiar en distintos momentos según la especie y dependiendo de los objetivos planteados. Algunas especies tienen cromosomas que se pueden observar con gran detalle en interfase, tal es el caso de Drosophila melanogaster, que posee cromosomas politénicos gigantes que se observan en las glándulas salivales de dicho insecto y el de Chironomus tentans otro diptero.
Constancia del número de cromosomas

| Especie | Número de cromosomas |
|---|---|
| Hormiga Myrmecia pilosula, hembra | 1 |
| Mosca de la fruta (Drosophila melanogaster) | 5 |
| Centeno (Secale cereale) | 14 |
| Cebra | 19 |
| Paloma | 16 |
| Caracol | 24 |
| Gusano | 36 |
| Gato | 38 |
| Cerdo | 40 |
| Ratón | 40 |
| Trigo (Triticum aestivum) | 42 |
| Rata | 42 |
| Conejo | 44 |
| Hamster | 44 |
| Liebre | 46 |
| Hombre | 46 |
| Simio | 48 |
| Papa (Solanum tuberosum) | 48 |
| Oveja (Ovis aries) | 54 |
| Vaca (Bos taurus) | 60 |
| Asno (Equus asinus) | 64 |
| Caballo (Equus caballus) | 64 |
| Camello ( Camelus bactrianus) | 74 |
| Llama (Lama glama) | 74 |
| Perro (Canis lupus familiaris) | 78 |
| Gallina (Gallus gallus) | 78 |
| Paloma Columbia livia | 80 |
| Pez Carassius auratus | 94 |
| Mariposa | ~380 |
| Helecho Ophioglussum reticulatum | 1260 |
| Protozoario Aulacantha scolymantha | 1600 |
Usualmente las especies animales y vegetales tienen un número de cromosomas constante y determinado que constituyen su cariotipo (ley de la constancia numérica de los cromosomas), aunque existen especies con una alta variabilidad cariotípica, no sólo en número sino en forma y tamaño de los cromosomas.
El número de cromosomas de una especie (o fase vital) diploide se identifica como 2n mientras que ese número en una especie (o fase vital) haploide se identifica con la letra n. En aquellas especies que presentan un número repetido de cromosomas superior a dos complementos se habla de poliploidía, representándose el múltiplo por delante de la letra n. Así: 3n indicaría un complemento cromosómico triploide, 4n un tetraploide, etc. Todas estas son situaciones euploides. Con la indicación x se quiere expresar el número básico de cromosomas de una especie que presenta individuos con diversos grados de ploidía o el de una línea filogenética a partir de la cual diversos táxones han alcanzado situaciones aneuploides variadas, siendo en este caso el número cromosómico una variación del número original con aumento o disminución del número básico, por pérdida, fusión o división de cromosomas (p. ej., n+1 o n-1). Un ejemplo de esta situación anormal la tenemos en los individuos de la especie humana que presentan el llamado síndrome de Down, situación de aneuploidía (2n=47) por la presencia de un ejemplar más de lo habitual del cromosoma 21 (trisomía).
El número de cromosomas 2n varía mucho de unas especies a otras y no existe relación entre el número de cromosomas, existen especies vegetales con pocos cromosomas como Haplopappus gracilis (2n=4), Crepis capillaris (2n=6) y Secale cereale (2n=14) , especies vegetales con bastantes cromosomas como Triticum aestivum (2n=42) y especies vegetales con muchos cromosomas como Ophioglossum petiolatum (n >500). En animales sucede algo semejante, hay especies con pocos cromosomas como la hormiga australiana Myrmecia pilosula cuyos machos tienen un cromosoma (2N=1) y las hembras dos cromosomas (2n=2), especies con bastantes cromosomas como la humana Homo sapiens (2n=46) y especies con muchos cromosomas como el lepidoptero Lysandra atlantica (2n=434-466). No existe ninguna relación entre el número de cromosomas 2n y la complejidad evolutiva, ni entre el número de cromosomas y la cantidad de ADN. Un ejemplo claro de esta situación es el de los ciervos del género Muntiacus en el que hay especies muy similares (denominadas especies gemelas) una con 2n=6 (M. muntjak) y otra con 2n=46 (M. reevesi).
Cromosomas sexuales
En muchos organismos, uno de los pares de los cromosomas homólogos es distinto al resto, realizando la determinación genética del individuo. A estos cromosomas se les llama cromosomas sexuales o heterocromosomas e incluso gonosomas, porque determinan el sexo por la proporción de los dos cromosomas homólogos.
- Sistema de determinación XY: es propio del ser humano y muchos otros animales. Las hembras, siendo XX, darán gametos iguales con cromosoma X, sexo homogamético y los machos, siendo XY, darán dos tipos de gametos, uno con el cromosoma X y otro con el cromosoma Y. La probabilidad de que en la fecundación, al unirse los gametos, resulte una combinación XX (hembra) o XY (macho) es aproximadamente del 50%.
- Sistema de determinación ZW: en otras especies (mariposas, p.e.) ocurre lo contrario, el sexo masculino es homogamético (ZZ) y el femenino heterogamético (ZW).
- Sistema de determinación XO: otras especies (peces, insectos, anfibios) que no tienen el cromosoma Y, determinándose el sexo por el número de cromosomas X, macho XO y hembra XX.
Forma de los cromosomas
La forma de los cromosomas es para todas las células somáticas constante y característica de cada especie. La forma depende fundamentalmente de las constricciones que presente el cromosoma y de su localización en la cromátida.
El cromosoma se encuentra constituido básicamente por el centrómero que divide el cromosoma en un brazo corto o brazo p y un brazo largo o brazo q. Algunos cromosomas presentan satélites en el brazo corto.
Según la posición del centrómero, los cromosomas se clasifican en:
- Metacéntricos
- El centrómero se localiza a mitad del cromosoma y los dos brazos presentan igual longitud.
- Submetacéntricos
- La longitud de un brazo del cromosoma es algo mayor que la del otro.
- Acrocéntricos
- Un brazo es muy corto (p) y el otro largo (q).
- Telocéntricos
- Sólo se aprecia un brazo del cromosoma al estar el centrómero en el extremo.
-
El cromosoma humano 19 es metacéntrico
-
El cromosoma humano 14 es acrocéntrico
-
Cariotipo espectral, el cariograma se obtiene luego de la identificación y clasifciación de los cromosomas. El cariotipo que se muestra corresponde a un individuo de sexo femenino ya que se observan dos cromosomas X
Es posible visualizar los cromosomas por medio de la microscopía de luz y de tinciones especiales, el proceso para obtener el material cromosómico se realiza en diversos pasos:
- Obtención de la muestra: Se realiza exclusivamente de tejidos vivos que contengan células con núcleo.Principalmente se emplean los glóbulos blancos que encontramos en la sangre por su fácil accesibilidad.
- Siembra: La cual se realiza agregando aproximadamente 1 mililitro de sangre entera heparinizada a un medio de cultivo enriquecido con suero fetal bovino, antibióticos y mitógenos, lo cual estimulará el crecimiento y división de las células.
- Incubación: Se mantiene a 38.0 grados centígrados con una atmósfera de CO2 al 5 % y humedad por 72 horas idealmente.
- Cosecha: Se agrega colchicina a la muestra para detener los núcleos ceulares en metafase, posteriormente se cenfrifuga la mezcla para retirar el sobrenadante (suero sanguíneo y medio de cultivo). Se agrega solución hipotónica de cloruro de potasio para romper las membranas celulares y para finalizar el paso de la cosecha se realizan 3 lavados con una solución de metanol-ácido acético 3:1.
- Goteo: Posterior a los lavados, por medio de centrifugación, se obtiene un botón celular blanco, el cual se suspende en la misma solución fijadora metanol-ácido acético 3:1 y se procede a gotear en un portaobjetos a unos cuantos centímetros, esto es con el objetivo de "reventar" las células y obtener los cromosomas.
- Envejecimiento: En este paso se espera a que los cromosomas pierdan humedad. Se puede aplicar calor al portaobjetos para deshidratar la muestra.
- Tinción: Existen muchos tipos de tinciones para observar los cromosomas. La más utilizada es la tinción con colorante Giemsa, se conoce como técnica de bandas GTG. En este caso se expone la muestra del portaobjetos a tripsina, con el objetivo de desnaturalizar algunas de las proteínas constitucionales de los cromosomas. Posteriormente se tiñen con dos colorantes, Giemsa y Wrigth, en algunos laboratorios puede emplearse un solo colorante, pero el empleo de los dos mejora la calidad del resultado, puesto que facilita el análisis al microscopio para el citogenetista creando un contraste de color en las bandas que se formaron al emplear la tripsina. Por medio de estas bandas podemos distinguir las características de un cromosoma y determinar si es normal o presenta alguna anomalía estructural. Existen otras técnicas de tinción, como bandas NOR, ICH, bandas Q, bandas R, técnicas para teñir centrómero y heterocromatina. Con este tipo de técnicas se puede llegar a realizar un diagnóstico citogenético acerca de una enfermedad cromosómica.
- Lectura: El último paso consiste en leer por lo menos 20 metafases, es decir 20 células reventadas y formar un cariotipo o cariograma, donde se acomodan los cromosomas por grúpos según el tamaño y la localización del centrómero.
En el grupo A se tienen los cromosomas 1, 2, 3. Grandes metacéntricos, excepto el 2, el cual es un cromosoma grande submetacéntrico.
En el grupo B se tienen los cromosomas 4 y 5, que son submetacéntricos grandes.
En el grupo C se tienen los cromosomas 6,7,8,9,10,11 y 12, que son los submetacéntricos medianos.
En el grupo D se tienen a los cromosomas 13,14 y 15, que son acrocéntricos medianos y presentan satélites en sus brazos cortos.
El grupo E se encuentra constituido por los cromosomas 16, 17, 18, submetacéntricos pequeños.
En el grupo F se tienen a los cromosomas 19 y 20, metacéntricos pequeños.
El grúpo G se constituye por los cromosomas 21 y 22, acrocéntricos pequeños.
El par de gonosomas o sexocromosomas se constituyen por X (submetacéntrico mediano) e Y considerado acrocéntrico sin satélites, aunque en algunas revisiones de la literatura se le refiere como submetacéntrico.
Los cromosomas son los portadores del ADN, por lo tanto son parte integral estructural imprescindible de los seres vivos.
Algunas entidades se encuentran formadas por hebras de ADN o ARN sin formar estructruras complejas como la de los cromosomas, un ejemplo claro son los virus.
Tamaño cromosómico
Los cromosomas sufren grandes variaciones en su tamaño a lo largo del ciclo celular, pasando de estar muy poco compactados (interfase) a estar muy compactados (metafase), por tal motivo, los estudios sobre el tamaño suelen realizarse en metafase mitótica. Además, es necesario tener en cuenta que los tratamientos para teñir los cromosomas y para obtener las metafase mitóticas influyen de manera muy importante en el tamaño de los cromosomas. En cualquier caso, en general es posible decir que hay especies eucarióticas con cromosomas grandes y especies con cromosomas pequeños. Lasmonocotiledóneas (vegetales) y los anfibios y ortópteros (animales) poseen cromosomas muy largos (de 10 a 20 micras). Las dicotiledóneas, las algas, los hongos y la mayoría de las especies animales poseen cromosomas pequeños (longitud inferior a 5 micras). Naturalmente, existen algunas excepciones en los ejemplos citados. El cromosoma 1 humano tiene 0,235 pg de ADN, que equivalen a una longitud total de ADN doble hélice de 7,3 cm y en metafase mitótica presenta una longitud aproximada de 0,001 cm.
Cromosomas humanos
| Cromosoma | Genes | Bases | Bases determinadas † |
|---|---|---|---|
| 1 | 2968 | 245.203.898 | 218,712,898 |
| 2 | 2288 | 243,315,028 | 237,043,673 |
| 3 | 2032 | 199,411,731 | 193,607,218 |
| 4 | 1297 | 191,610,523 | 186,580,523 |
| 5 | 1643 | 180,967,295 | 177,524,972 |
| 6 | 1963 | 170,740,541 | 166,880,540 |
| 7 | 1443 | 158,431,299 | 154,546,299 |
| 8 | 1127 | 145,908,738 | 141,694,337 |
| 9 | 1299 | 134,505,819 | 115,187,714 |
| 10 | 1440 | 135,480,874 | 130,710,865 |
| 11 | 2093 | 134,978,784 | 130,709,420 |
| 12 | 1652 | 133,464,434 | 129,328,332 |
| 13 | 748 | 114,151,656 | 95,511,656 |
| 14 | 1050 | 105,311,216 | 87,410,661 |
| 15 | 1122 | 100,114,055 | 81,117,055 |
| 16 | 1098 | 89,995,999 | 79,890,791 |
| 17 | 1576 | 81,691,216 | 77,480,855 |
| 18 | 766 | 77,753,510 | 74,534,531 |
| 19 | 1454 | 63,790,860 | 55,780,860 |
| 20 | 927 | 63,644,868 | 59,424,990 |
| 21 | 303 | 46,976,537 | 33,924,742 |
| 22 | 288 | 49,476,972 | 34,352,051 |
| Cromosoma X | 1184 | 152,634,166 | 147,686,664 |
| Cromosoma Y | 231 | 50,961,097 | 22,761,097 |
| unplaced various | ? | 25,263,157 | 25,062,835 |
El cromosoma en organismos procariotas
Los procariotas, bacteria y archaea, presentan típicamente un solo cromosoma circular, si bien existen algunas variantes a esta regla.[10] El cromosoma bacteriano puede tener un tamaño desde 160.000 pares de bases (como en el endosimbionte Carsonella ruddii,[11] a 12.200.000 pares de bases en la bacteria del suelo Sorangium cellulosum.[12]
Las bacterias usualmente tienen un solo punto en su cromosoma desde el cual se inicia la duplicación, mientras que algunas archeas presentan mñultiples sitios de incio de la duplicación.[13] Por otro lado, los genes de los procariotas están organizados en operones y no contienen intrones.
Los procariotas no poseen un núcleo verdadero, en cambio su ADN está organizado en una estructura denominada nucleoide.[14] El nucleoide es una estrutura distintivay ocupa una región definida en la célula bacteriana. Esta estructura es muy dinámica y se halla mantenida y remodelada a través de la acción de proteínas similares a histonas, las cuales se asocian al cromosoma bactaetiano.[15] En archaea, el ADN en el cromosoma se halla todavía más organizado, con el ADN empacado dentro de estructuras similares a los nucleosomas eucarióticos.[16][17]
Véase también
Referencias
- ↑ Nägeli, Carl, "Memoir on the nuclei, formation, and growth of vegetable cells (A. Henfrey, trans.), in C. and J. Adlard, eds, Reports and Papers on Botany. London: The Ray Society, 1846.
- ↑ Daintith, John, et al., (eds), Biographical Encyclopedia of Scientists, second edition. Bristol, UK: Institute of Physics Publishing, 1994.
- ↑ Flemming, W. 1882. Zell-substanz, Kern und Zelltheilung ("Citoplasma, núcelo y división celular").
- ↑ Morgan, Thomas Hunt, "Chromosomes and Heredity," The American Naturalist, 44(524):449-496, 1910.
- ↑ Gonzalo Claros, M. Historia de la Biologìa (V): La naturaleza química del DNA (hasta el primer tercio del siglo XX). Edición para Internet de la revista Encuentros en la Biología, editada en la Facultad de Ciencias de la Universidad de Málaga. ISSN 1134-8496
- ↑ a b Klug A, Rhodes D, Smith J, Finch JT, Thomas JO. A low resolution structure for the histone core of the nucleosome. Nature. 1980 Oct 9;287(5782):509–516.
- ↑ a b Klug, A. & L C Lutter.1981. The helical periodicity of DNA on the nucleosome. Nucleic Acids Res. September 11; 9(17): 4267–4283. Error en la cita: Etiqueta
<ref>no válida; el nombre «kñug81» está definido varias veces con contenidos diferentes - ↑ a b Paulson J.R., Laemmli U.K. 1977. The structure of histone depleted metaphase chromosomes. Cell, 12 (3), pp. 817-828.
- ↑ Arnold J. Bendich, Karl Drlica. 2000. Prokaryotic and eukaryotic chromosomes: what's the difference?. BioEssays 22: 481-486.
- ↑ Thanbichler M, Shapiro L (2006). «Chromosome organization and segregation in bacteria». J. Struct. Biol. 156 (2): 292-303. PMID 16860572. doi:10.1016/j.jsb.2006.05.007.
- ↑ Nakabachi A, Yamashita A, Toh H, Ishikawa H, Dunbar H, Moran N, Hattori M (2006). «The 160-kilobase genome of the bacterial endosymbiont Carsonella». Science 314 (5797): 267. PMID 17038615. doi:10.1126/science.1134196.
- ↑ Pradella S, Hans A, Spröer C, Reichenbach H, Gerth K, Beyer S (2002). «Characterisation, genome size and genetic manipulation of the myxobacterium Sorangium cellulosum So ce56». Arch Microbiol 178 (6): 484-92. PMID 12420170. doi:10.1007/s00203-002-0479-2.
- ↑ Kelman LM, Kelman Z (2004). «Multiple origins of replication in archaea». Trends Microbiol. 12 (9): 399-401. PMID 15337158. doi:10.1016/j.tim.2004.07.001.
- ↑ Thanbichler M, Wang SC, Shapiro L (2005). «The bacterial nucleoid: a highly organized and dynamic structure». J. Cell. Biochem. 96 (3): 506-21. PMID 15988757. doi:10.1002/jcb.20519.
- ↑ Sandman K, Pereira SL, Reeve JN (1998). «Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome». Cell. Mol. Life Sci. 54 (12): 1350-64. PMID 9893710. doi:10.1007/s000180050259.
- ↑ Sandman K, Reeve JN (2000). «Structure and functional relationships of archaeal and eukaryal histones and nucleosomes». Arch. Microbiol. 173 (3): 165-9. PMID 10763747. doi:10.1007/s002039900122.
- ↑ Pereira SL, Grayling RA, Lurz R, Reeve JN (1997). «Archaeal nucleosomes». Proc. Natl. Acad. Sci. U.S.A. 94 (23): 12633-7. PMID 9356501. doi:10.1073/pnas.94.23.12633.
Bibliografía
- Adolph, K. (ed.) 1988. Chromosomes and chromatin, Vols. 1-3, Boca RAton, FL; CRC Press.
- Hsu, T.C. 1979. Human and mammalian cytogenetics: an historical perspective. New York, Springer Verlag.
- Stewart, A. 1990. The functional organization of chromosomes and the nucleus, a special issue. Trends Genet. 6:377-379
- Price, C.M. 1992. Centromeres and telomeres. Curr. Opin. Cell Biol. 4: 379-384.
- Gall, J.G. 1981. Chromosome structure and the C-value paradox. J. Cell Biol. 91:3-14
- Blackburn, E.H., Szostak, J.W. 1984. The molecular structure of centromeres and telomeres. Annu. Rev. Biochem. 53: 163-194.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre cromosomas.
Wikimedia Commons alberga una categoría multimedia sobre cromosomas.
¹Se pueden encontrar detallados gráficos de los cromosomas humanos así como algunas enfermedades asociadas en Exploring Genes and Genetic Disorders (en inglés).



