Helicobacter pylori
| Helicobacter pylori | ||
|---|---|---|
 | ||
| Taxonomía | ||
| Dominio: | Bacteria | |
| Filo: | Pseudomonadota | |
| Clase: | Epsilonproteobacteria | |
| Orden: | Campylobacterales | |
| Familia: | Helicobacteraceae | |
| Género: | Helicobacter | |
| Especie: |
H. pylori (Marshall et al. 1985) Goodwin et al. 1989 | |
Helicobacter pylori es un bacilo gramnegativo helicoidal caracterizado por proliferar en la mucosa gástrica humana. La denominación del género Helicobacter hace referencia a su morfología en espiral, en tanto que la designación "pylori" alude al origen anatómico de las células por las que ésta tiene afinidad.[1]
Su característica forma espiral le facilita invadir e infectar el epitelio gástrico humano, mientras que la producción de la enzima ureasa, neutraliza el entorno ácido permitiéndole multiplicarse de forma más exitosa. Dicho proceso genera una respuesta inflamatoria local, usualmente es asintomática en un inicio. Sin embargo, la infección por este microorganismo se asocia a largo plazo con la presencia de gastritis y úlceras, (enfermedad ácido péptica) así como con el desarrollo de Linfomas MALT (mucose asociated lymphoid tissue o tejido linfoide asociado a mucosas).[2]
Origen del nombre
[editar]La bacteria fue llamada inicialmente Campylobacter pyloridis, después Campylobacter pylori (al corregirse la gramática latina) y, en 1989, al secuenciarse su ADN; se vio que no pertenecía al género Campylobacter sino a Helicobacter. El nombre pylori hace referencia al píloro, la válvula que separa al estómago del duodeno.
Historia
[editar]Primeras evidencias
[editar]En 1875, científicos alemanes descubrieron bacterias espirales en el epitelio del estómago humano. Estas bacterias no podían ser cultivadas, cayendo en el olvido su descubrimiento.[3] En 1892, el investigador italiano Giulio Bizzozero describió una serie de bacterias espirales que vivían en el ambiente ácido del estómago de perros.
El profesor Walery Jaworski, de la Universidad Jaguelónica en Cracovia, investigó sedimentos de lavados gástricos obtenidos de humanos en 1899. Además de unas bacterias alargadas, también encontró bacterias con una característica forma espiral, a las cuales llamó Vibrio rugula. Este investigador fue el primero en sugerir la participación de este microorganismo en enfermedades gástricas. Aunque este trabajo fue incluido en el Manual de enfermedades gástricas no tuvo mucho impacto debido a que estaba escrito en polaco.[4]
Redescubrimiento y caracterización
[editar]Esta bacteria fue redescubierta en 1979 por el patólogo australiano Robin Warren, quien en investigaciones iniciadas a partir de 1981 junto a Barry Marshall, aisló este microorganismo de las mucosas de estómagos humanos y fue el primero que consiguió cultivarla.[5] En el trabajo original, Warren y Marshall afirmaron que muchas de las úlceras gástricas y gastritis eran causadas por la colonización del estómago por esta bacteria, y no por estrés o comida picante, como se sostenía hasta entonces.[6]
Implicación en patogénesis
[editar]La comunidad médica reconoció muy recientemente el hecho de que esta bacteria fuese la causante tanto de úlceras gástricas como de gastritis, ya que se creía que las bacterias no podían sobrevivir por mucho tiempo en el medio ácido del estómago. La comunidad empezó a cambiar de idea basándose en estudios posteriores que reafirmaron esta hipótesis, incluyendo uno en el que Marshall bebió un cultivo de H. pylori, desarrollando gastritis y recobrando la bacteria de su propio revestimiento gástrico; con esto, satisfizo 3 de los 5 postulados de Koch. La gastritis de Marshall se curó gracias a un tratamiento que ellos mismos desarrollaron, a base de bismuto con antibióticos.
Posteriormente, Marshall y Warren descubrieron que los antibióticos eran efectivos para el tratamiento de la gastritis. En 1994, los Institutos Nacionales de Salud de los Estados Unidos informaron de que las úlceras gástricas más comunes eran causadas por H. pylori, y recomendaron el uso de antibióticos, siendo incluidos en el régimen de tratamiento.[7] En 2005, Warren y Marshall fueron galardonados con el Premio Nobel de Medicina por sus trabajos acerca de H. pylori.[8]
Antes de comprobarse la implicación de H. pylori en enfermedades estomacales, las úlceras gástricas eran tratadas con medicamentos que neutralizaban la acidez. Esto hacía muchas veces que las úlceras reaparecieran después de dejar el tratamiento. La medicación tradicional frente a la gastritis eran las sales de bismuto (subcitrato de bismuto coloidal o subsalicilato de bismuto).[9] Este tratamiento a menudo era efectivo, pero su efectividad disminuía con un uso prolongado, además de desconocerse el mecanismo de acción de este fármaco. Todavía no está claro si el bismuto puede actuar como antibiótico. Desde 2006, muchas úlceras son tratadas de forma efectiva utilizando antibióticos frente a H. pylori.
Mientras H. pylori sigue siendo la bacteria más importante conocida que habita en el estómago humano, algunas especies más del género Helicobacter han sido identificadas en otros mamíferos y en algunas aves. Se ha comprobado que algunas de estas pueden infectar a humanos. Existen especies de Helicobacter que son capaces de infectar el hígado de ciertos mamíferos, causando diversas enfermedades hepáticas.
Implicaciones en las migraciones humanas prehistóricas
[editar]Cada población humana posee una distribución característica de cepas de H. pylori que típicamente infectan a miembros de su población. Esta característica ha llevado a los investigadores a usar H. pylori para estudiar los patrones de migración en humanos. Así pues, las variedades encontradas estarían relacionadas con el origen de los humanos modernos y sus migraciones prehistóricas.
A medida que los grupos humanos originados en África se extendieron por el planeta, disgregándose y diversificando gradualmente sus características genéticas, las poblaciones de H. pylori que llevaban consigo hicieron lo mismo. Así pues la cepa que infecta a los habitantes de Europa, por ejemplo, es la hpEurope, mientras que las cepas hpAsia2 y hpEastasia están en la población asiática.[10] En Oceanía hay dos tipos principales: hpSahul que se originó hace entre 31 000 y 37 000 años en el continente Sahul y es típico de nativos australianos y papúes, y la cepa hspMaori relacionada con la cepa hpEastAsia y que al parecer salió de Taiwán hace unos 5000 años y se extendió con los pueblos malayo-polinesios.[11]
Distribución filogeográfica
[editar]Como se ha mencionado, H. pylori se encuentra presente en la mitad de la población mundial y ha sido posible relacionarla con las migraciones humanas y su distribución global, identificando las siguientes cepas:[12]
- hpAfrica1
- hspSAfrica: típico del África Austral.
- hspWAfrica: común en África y en afroamericanos. Típico del África Occidental.
- hpAfrica2: común en África Austral.
- hpNEAfrica: típico del Cuerno de África y de pueblos nilosaharianos. Poco en Europa y Asia.
- hpEurope: típico de Eurasia Occidental, lo que incluye Europa, Cercano Oriente, Asia Central y parte del Norte de África. La colonización europea lo dispersó en todo el mundo.
- hpEastAsia
- hspEAsia: típico del Extremo Oriente.
- hspAmerind: típico de pueblos indígenas americanos.
- hspMaori: típico de los pueblos malayo-polinesios.
- hpAsia2: en el subcontinente indio, parte del Sudeste de Asia y otras zonas de Eurasia.
- hpSahul: en nativos australianos y papúes.
Presencia en América prehispánica
[editar]Se puede establecer que las cepas de H. pylori en nativos amazónicos tienen su origen en el este de Asia, más que en Europa, lo que sugiere que estas poblaciones llegaron a América al menos hace 11 000 años.
Un estudio realizado por expertos del Departamento de Microbiología y Parasitología de la Facultad de Medicina de la UNAM (Universidad Nacional Autónoma de México) liderados por Gonzalo Castillo, y publicado en BMC Microbiology e impulsado por el INAH (Instituto Nacional de Antropología e Historia), sugiere la presencia de H. pylori en las sociedades prehispánicas. Durante la investigación se usaron muestras del tejido estomacal de 6 momias (5 de ellas procedentes de la cueva La Ventana en Chihuahua y otra de Durango, México) que datan de 1350.[13]
Estructura de la bacteria
[editar]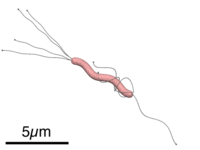
H. pylori es una bacteria gramnegativa de forma espiral, o espirilo,[14] de alrededor de 3 µm (micrómetros) de largo y con un diámetro aproximado de unos 0,5 µm. Tiene unos 4-6 flagelos. Es microaerófila, es decir, requiere oxígeno pero a más bajas concentraciones de las encontradas en la atmósfera. Usa hidrógeno y metanogénesis como fuente de energía. Además es oxidasa y catalasa positiva.

Con su flagelo y su forma espiral, la bacteria «taladra» literalmente la capa de mucus del estómago, y después puede quedarse suspendida en la mucosa gástrica o adherirse a células epiteliales ya que produce adhesinas, (que son proteínas fijantes). H. pylori produce una enzima llamada «ureasa» que transforma la urea en amoniaco y en dióxido de carbono mediante la reacción: CO(NH2)2 + H2O → 2NH3 + CO2, y es el amoniaco el que va a neutralizar parcialmente la acidez gástrica (que sirve para disolver los alimentos y matar la mayor parte de bacterias digeridas). Lamentablemente el amoniaco es tóxico y va a maltratar la superficie de las células epiteliales y provocar el proceso de formación de las úlceras.
Infección por H. pylori
[editar]
La infección por H. pylori puede ser sintomática o asintomática (sin efectos visibles en el enfermo); se estima que más del 70 % de las infecciones son asintomáticas.[15] En ausencia de un tratamiento basado en antibióticos, una infección por H. pylori persiste aparentemente durante toda la vida. El sistema inmunitario humano es incapaz de erradicarla.
Vía de infección
[editar]La bacteria ha sido aislada de las heces, de la saliva y de la placa dental de los pacientes infectados, lo cual sugiere una ruta oral-oral o fecal-oral como posible vía de transmisión.
Epidemiología
[editar]Se estima que más de dos tercios de la población mundial se encuentra infectada por esta bacteria.[16] La proporción de infección varía de nación a nación. En el mundo occidental (Europa, América y Australia), la proporción es de alrededor de un 25 % de la población, siendo mucho mayor en el tercer mundo. En este último caso, es común encontrar infecciones en niños, probablemente por las malas condiciones sanitarias. En los Estados Unidos, la infección se da principalmente en personas de edad avanzada (más del 50 % de estas ocurren en personas de más de 60 años de edad, frente a un 20 % que se presentan en personas de menos de 40) y en los sectores más pobres.
Estas discrepancias se atribuyen a una mayor higiene y al mayor uso de antibióticos en los países más ricos. De cualquier forma, en los últimos años están apareciendo cepas de H. pylori que presentan resistencia a antibióticos. En el Reino Unido hay incluso cepas resistentes a metronidazol.

1. H. pylori penetra la capa mucosa del estómago y se adhiere a la superficie de la capa mucosa epitelial gástrica.
2. Produce amoníaco a partir de la urea, para neutralizar el ácido gástrico.
3. Migración y proliferación de H. pylori al foco de infección.
4. Se desarrolla la ulceración gástrica con destrucción de la mucosa, inflamación y muerte de las células mucosas. El amoníaco es el responsable de la destrucción de la mucosa, permitiendo que el ácido penetre a la pared muscular gastrointestinal.
Diagnóstico
[editar]Existen diferentes métodos para diagnosticar una infección de H. pylori. Uno es detectando anticuerpos específicos en una muestra de sangre del paciente o de heces, utilizando antígenos. También se utiliza la prueba del aliento con urea, en la cual el paciente bebe urea marcada con 14C o 13C, produciéndose posteriormente (debido al metabolismo de la bacteria) dióxido de carbono marcado, el cual es detectado en la respiración. Otro método de diagnóstico es la biopsia, en la cual se mide la ureasa activa en la muestra extraída, el denominado «test rápido de la ureasa», el cual consiste en colocar una muestra de tejido en un medio con urea. Si la enzima ureasa producida por la bacteria está presente, descompone la urea del medio en amoníaco y CO2. El amoniaco generado provoca una elevación del pH que se evidencia a través de un cambio de coloración detectable a simple vista. Otra forma de diagnosticar una infección de H. pylori es por medio de una muestra histológica o de un cultivo celular. Uno de los métodos de detección más sensibles corresponde a la PCR (reacción en cadena de la polimerasa), la cual permite también identificar genes asociados a virulencia (CagA y VacA), genes asociados a adhesión (BabA) y genes de resistencia a antibióticos (Claritromicina).
Problemas en el diagnóstico
[editar]Ninguno de estos métodos es completamente infalible. La prueba de anticuerpos sanguíneos, por ejemplo, tiene tan sólo entre un 76 y un 84 % de sensibilidad. La medicación, por otro lado, puede afectar a la actividad de la ureasa y dar falsos positivos en los métodos basados en ella.
| Pruebas | Ventajas | Desventajas | |
|---|---|---|---|
| Endoscópicas | ∗1. Histología | Presenta una alta sensibilidad y especificidad. | Es costoso dado que requiere tinciones especiales, infraestructura y personal capacitado. |
| ∗2. Prueba de rápida de ureasa | Es asequible.
Proporciona resultados rápidos. Presenta una excelente y muy buena sensibilidad en pacientes debidamente seleccionados. |
Su precisión de sensibilidad se reduce significativamente en la configuración de postratamiento. | |
| ∗3. Cultivo | Alta especificidad. Permite la determinación de sensibilidad antibiótica. | Es costoso y difícil de realizar; ya que requiere tejido, que crece en ambiente microaerofílico y no es ampliamente disponible. Su sensibilidad tiene una precisión baja. | |
| ∗4. Reacción en cadena de polimerasa (PCR) | Presenta una alta sensibilidad y especificidad, además de ofrecer una determinación de sensibilidad antibiótica. | Su metodología no está estandarizada a través de laboratorios y no es ampliamente disponible. | |
| No endoscópicas | 1. Anticuerpos pruebas (cuantitativos y cualitativos) | Miden anticuerpos no antígeno, por lo que reporta contacto, no enfermedad actual, VNA barato, ampliamente disponible, muy bueno. | El valor de PPV depende de la prevalencia de H. pylori. No se recomienda después del tratamiento de H. Pylori. |
| ∗2. Pruebas de aliento de urea (13 y 14 C) | Identifica la infección activa por H. pylori, con resultados cuantitativos.
Alta precisión de PPV y VNA independientemente de la prevalencia de H. pylori. Útil antes y después del tratamiento de H. pylori, con ciertas condiciones del paciente para evitar falsos negativos. |
||
| ∗3. Prueba del antígeno fecal | Identifica la infección activa por H. pylori.
Alta precisión de valores positivos y negativos predictivos independientemente de la prevalencia de H. pylori. Útil antes y después del tratamiento de H. pylori |
La prueba monoclonal parece fiable antes y después del tratamiento antibiótico. |
∗La sensibilidad tanto de las pruebas endoscópicas como no endoscópicas para detectar la infección activa por H. pylori se ve disminuida por el uso reciente de inhibidores de la bomba de protones (PPI), bismuto o antibióticos. Es importante tener en cuenta que los PPI son inhibidores de la bomba de protones, y que los acrónimos PPV y NPV se refieren respectivamente al valor predictivo positivo y al valor predictivo negativo. Además, el UBT es el test de aliento de urea.
Prevención
[editar]Un estudio publicado en 2008 en el Diario Coreano de Microbiología y Biotecnología reveló que el kimchi (platos tradicionales coreanos a base de verduras fermentadas) contiene una cepa de un tipo de bacteria «que muestra una fuerte actividad antagonista contra la H. pylori». Se demostró que la variedad aislada de la bacteria del kimchi, designada Lb. plantarum NO1, reduce la actividad de la ureasa de la H. pylori en un 40-60 % y anula el desarrollo de células cancerígenas en más de un 33 %.[17] Un estudio de 2009, develó que el té verde puede prevenir la inflamación producida por la H. pylori.[18][19]
Tratamiento
[editar]
Inicialmente se utilizaba metronidazol, el cual presenta actualmente resistencia en más del 80 % de los casos.[cita requerida] Posteriormente se trataba solo cuando se presentaba infección sintomática, en cuyo caso se utilizaba claritromicina, amoxicilina y tetraciclina. Más adelante la terapia triple que consiste de un inhibidor de bomba de protones (IBP) (omeprazol, lansoprazol, pantoprazol, rabeprazol y otros), más dos antibióticos: amoxicilina y claritromicina es el tratamiento de elección, cuando las resistencias a claritromicina por Helicobacter no superan el 20 %. En caso de alergia a la penicilina, puede sustituirse la amoxicilina por el metronidazol. La erradicación se consigue en el 80-84 % de los casos.[20]Actualmente la terapia triple combinada con Saccharomyces boulardii ha demostrado mejorar la probabilidad de éxito en la erradicación de H. pylori, además de reducir los efectos secundarios de los antibióticos.[21][22]
Una vez que el H. pylori es detectado en pacientes con una úlcera péptica, el procedimiento normal es erradicarla y permitir que sane la úlcera. La terapia tradicional de primera línea es una semana de terapia triple consistente en los antibióticos amoxicilina y claritromicina, y un inhibidor de bomba de protones como el omeprazol.[23] El gastroenterólogo Thomas Borody de Sídney, Australia, inventó la primera terapia triple en 1987.[24] Al paso de los años, se han desarrollado variaciones de la triple terapia, tales como el uso de diferentes inhibidores de la bomba de protones, como el pantoprazol o el rabeprazol, o cambiando la amoxicilina por metronidazol para las personas que son alérgicas a la penicilina.[25] Tales terapias han revolucionado el tratamiento de las úlcera pépticas y han hecho posible la cura de la enfermedad.
Se ha encontrado que cada vez más individuos infectados tienen bacterias resistentes a los antibióticos, de modo que el tratamiento inicial no resulta efectivo y se requieren rondas adicionales de terapias con antibióticos o estrategias alternativas tales como una terapia cuádruple. Los compuestos de bismuto también son efectivos en combinación con el tratamiento tradicional.
Se ha creído que, en ausencia de tratamiento, una vez que una infección de H. pylori se ha establecido en su nicho gástrico, persistirá de por vida.[26][27] Sin embargo, en la gente anciana es posible que la infección pueda desaparecer conforme la mucosa estomacal se vuelva cada vez más atrófica e inhóspita para la colonización. La proporción de infecciones agudas que persisten no es conocida, pero varios estudios que siguieron la historia natural en diversas poblaciones han informado de la eliminación espontánea aparente.[28][29]

Científicos de la Universidad de Kioto, Japón, comprobaron que el aceite esencial de Cymbopogon citratus inhibía el crecimiento de la bacteria Helicobacter pylori en medios de cultivo, sin que dicha bacteria presentase resistencia al tratamiento con este aceite esencial.[30] No hay pruebas de que este ni otros aceites esenciales tengan eficacia en el tratamiento de la infección gástrica en humanos.
Otro estudio de la Universidad de Medicina de Dankook, en Cheonan, Corea del Sur, vincula el uso de la goma de mascar mástique con la reducción significativa de la presencia de H. pylori en el intestino y reducción de la inflamación en este.[31] En este sentido, masticar esta goma de mascar se considera uno de los tratamientos más novedosos y menos invasivos contra la H. pylori.[32]
Infección asintomática
[editar]En pacientes que presentan una infección asintomática, el tratamiento generalmente no está recomendado. Se deben atender las manifestaciones sintomáticas particulares de cada paciente.
Infección sintomática
[editar]En pacientes con úlceras gástricas en donde se detecta H. pylori, el procedimiento habitual es erradicarlo hasta que la úlcera sane. El tratamiento más extendido es la triple terapia. El gastroenterólogo de Sídney Thomas Borody inventó la primera triple terapia en 1987. Hoy en día, la triple terapia estándar es amoxicilina, claritromicina y omeprazol; en algunos casos se usa un inhibidor de la bomba de protones diferente. El metronidazol es utilizado en lugar de la amoxicilina en aquellos pacientes alérgicos a la penicilina. Esta terapia ha revolucionado el tratamiento de las úlceras gástricas y ha hecho posible la cura de esta enfermedad, siendo que previamente solo se controlaban los síntomas utilizando antiácidos, antagonistas de los receptores H2- o inhibidores de la bomba de protones.
Desafortunadamente, se ha incrementado el número de infecciones individuales que portan cepas resistentes a este primer tratamiento con antibióticos. Esto ha hecho que el tratamiento inicial falle y se requieran aplicaciones adicionales de terapia antibiótica. Se utiliza entonces una cuádruple terapia, incorporándose el bismuto, un metal que es también efectivo en combinación con otros fármacos.
En casos de resistencia a la claritromicina, se recomienda el uso de levofloxacino como parte de la terapia.
Cáncer y H. pylori
[editar]El cáncer gástrico y el linfoma MALT (linfoma del tejido linfoide asociado a mucosa) han sido relacionados con H. pylori, por lo que esta bacteria ha sido clasificada dentro del grupo I de carcinógenos por la Agencia Internacional de Investigación del Cáncer. Mientras que la asociación de estas enfermedades con H. pylori está apoyada por sospechas razonables, no está totalmente claro que haya una relación causal involucrada.
Mecanismos de acción
[editar]Se investigan dos mecanismos relacionados con esta supuesta capacidad de H. pylori de producir cáncer. El primero involucra la posibilidad de generar radicales libres asociada a una infección de H. pylori, la cual produciría un aumento en la tasa de mutación de la célula huésped. El segundo mecanismo ha sido llamado ruta perigenética[33] e involucra la trasformación del fenotipo de la célula huésped por medio de alteraciones en proteínas celulares tales como las proteínas de adhesión. Se ha propuesto la posibilidad de que H. pylori induzca inflamación y niveles localmente altos de TNF-alfa o interleucina 6. De acuerdo con el mecanismo perigenético propuesto, las moléculas señalizadoras de inflamación, tales como TNF-alfa, podrían alterar la capacidad de adhesión de las células epiteliales del estómago y conducir a la dispersión y migración de estas células epiteliales mutadas, sin necesidad de alteraciones adicionales en genes supresores de tumores (como, por ejemplo, los genes que codifican para proteínas de adhesión celular).
Reflujo ácido y cáncer de esófago
[editar]La tasa de infección por H. pylori ha ido decreciendo en países desarrollados, debido a las mejoras en la higiene y al incremento del uso de antibióticos. En consecuencia, la incidencia de cáncer de estómago en los Estados Unidos ha descendido en un 80 % durante el periodo entre 1900 y 2000. No obstante, se ha visto un drástico incremento —en este mismo periodo— de ciertas enfermedades relacionadas con el reflujo gastroesofágico y el cáncer de esófago.
Estudios genómicos de diferentes cepas
[editar]
Se conocen varias cepas de Helicobacter, y el genoma de dos de ellas se ha secuenciado completo.[34]
El genoma de la cepa «26695» consta de 1,7 millones de pares de bases nitrogenadas, con un total de aproximadamente 1550 genes. Las dos cepas secuenciadas muestran muchas diferencias genéticas, con más de un 6 % de nucleótidos diferentes.
El estudio del genoma de H. pylori se centra en aspectos relacionados con la patogenicidad, es decir, con la habilidad de este organismo en causar enfermedades. En la base de datos del genoma de H. pylori existen unos 62 genes en la categoría de patogénesis.
Isla Cag de patogenicidad
[editar]Ambas cepas secuenciadas tienen una isla de patogenicidad (una secuencia de genes que se cree que participa en la capacidad infecciosa de la bacteria) llamada Cag: mide 40 kilobases de tamaño y contiene unos 40 genes. Esta isla de patogenicidad está generalmente ausente en cepas de H. pylori aisladas de humanos con infecciones asintomáticas.
El gen cagA codifica para una de las proteínas de virulencia mayoritarias en H. pylori. Las cepas bacterianas que tienen el gen cagA, están asociadas con la habilidad de causar úlceras severas. Este gen codifica para la síntesis de una proteína relativamente larga (1186 aminoácidos). La proteína CagA ingresa a las células humanas, donde interrumpe el normal funcionamiento del citoesqueleto. La isla de patogenicidad Cag tiene unos 30 genes que codifican para un complejo de transporte (sistema de secreción tipo IV). Después de fijarse a las células epiteliales del estómago, la proteína CagA se inyecta dentro de la célula a través de este sistema de secreción. La proteína CagA es fosforilada en un residuo específico de tirosina por proteínas de membrana de la célula huésped. Se ha visto que cepas patogénicas de H. pylori activan el receptor del factor de crecimiento epidérmico (EGFR, en inglés), una proteína de membrana con tirosina quinasa. La activación del EGFR por H. pylori está asociada con alteraciones en las señales de transducción y de expresión génica en las células huéspedes, y este hecho puede contribuir a su patogenicidad. También se ha sugerido que la región C-terminal de la proteína CagA (aminoácidos 873-1002) podría regular la transcripción genética de la célula huésped, independientemente de la fosforilación. Se piensa, debido al bajo contenido GC del gen cagA en comparación con el resto del genoma, que este gen fue adquirido por transferencia horizontal desde otra bacteria cagA+.
Referencias
[editar]- ↑ Pajares J.M.; Gisbert J.P. (2006). «Helicobacter pylori: su descubrimiento e importancia en la medicina». Rev. esp. enferm. dig. (REVISIÓN) (Madrid: SciELO) 98 (10). Consultado el 19 de julio de 2023.
- ↑ Thaker, Yana; Moon, Andrew; Afzali, Anita (enero de 2016). «Helicobacter Pylori: A Review of Epidemiology, Treatment, and Management» [Helicobacter Pylori: una revisión de epidemiología, tratamiento y manejo]. J Clin Gastroenterol Treat (en inglés) (ClinMed International Library) 2 (1): 019. ISSN 2469-584X. Consultado el 6 de junio de 2017.
- ↑ Blaser MJ (2005). «An Endangered Species in the Stomach». Scientific American 292 (2): 38-45. PMID 15715390.
- ↑ Konturek JW (2003 Dec). «Discovery by Jaworski of Helicobacter pylori and its pathogenetic role in peptic ulcer, gastritis and gastric cancer». J Physiol Pharmacol. 54 Suppl 3: 23-41. PMID 15075463. Archivado desde el original el 28 de agosto de 2006.
- ↑ Marshall BJ (1983). «Unidentified curved bacillus on gastric epithelium in active chronic gastritis». The Lancet 1 (8336): 1273-1275. PMID 6134060.
- ↑ Marshall BJ, Warren JR (1984). «Unidentified curved bacilli in the stomach patients with gastritis and peptic ulceration». Lancet 1 (8390): 1311-1315. PMID 6145023.
- ↑ «Helicobacter pylori in peptic ulcer disease». NIH Consensus Statement Online Jan 7–9;12(1):1-23. Archivado desde el original el 19 de agosto de 2011. Consultado el 21 de diciembre de 2004.
- ↑ The Nobel Prize in Physiology or Medicine 2005 awarded to Barry J. Marshall and J. Robin Warren «for their discovery of the bacterium Helicobacter pylori and its role in gastritis and peptic ulcer disease».
- ↑ Hernández Tapias S. et al.. «Tratamiento de la úlcera péptica por Helicobacter pylori». Farm Hosp 1996;20(1):17-22. Disponible en línea (documento PDF).
- ↑ Blog Homo sapiens Una bacteria del estómago da luz sobre migraciones humanas.
- ↑ Yoshan Moodley et al 2009, The Peopling of the Pacific from a Bacterial Perspective
- ↑ Bodo Linz et al 2007, An African origin for the intimate association between humans and Helicobacter pylori
- ↑ «Tienen momias tarahumaras añeja bacteria». Archivado desde el original el 20 de febrero de 2014. Consultado el 20 de agosto de 2008.
- ↑ A. Lee & J. Fox. Helicobacter Pylori and Other Gastric Spirilla».
- ↑ Shetty, Varun; Prasad, H. Kishan; Konamme, Aashish; Shetty, K.; Kulamarva, Ganaraj (1 de enero de 2020). «Association between metabolic syndrome and Helicobacter pylori infection: A myth or a fact? A cross-sectional study.». Biomedical and Biotechnology Research Journal (en inglés) 4 (1): 41-41. Consultado el 10 de mayo de 2020.
- ↑ Encarnación Soriano Ayala, Rachida Dalouh, Rosa María Zapata Boluda, Verónica Caballero Cala, ed. (2017). III Jornadas Internacionales de investigación en educación y salud Experiencia de investigación con grupos vulnerables. España: Editorial Universidad de Almería. ISBN 9788416642892.
- ↑ Youl Lee and Hae Choon Chang (2008). «Isolation and Characterization of Kimchi Lactic Acid Bacteria Showing Anti-Helicobacter pylori Activity». Diario Coreano de Microbiología y Biotecnología 2: 106-114.
- ↑ Stoicov, C.; Saffari, R.; Houghton, J. (2009). «Green tea inhibits Helicobacter growth in vivo and in vitro». International journal of antimicrobial agents 33 (5): 473-478. PMC 2694061. PMID 19157800. doi:10.1016/j.ijantimicag.2008.10.032.
- ↑ Lee, S. .; Shin, Y. .; Hahm, K. . (2008). «Phytoceuticals: mighty but ignored weapons against Helicobacter pylori infection». Journal of digestive diseases 9 (3): 129-139. PMID 18956590. doi:10.1111/j.1751-2980.2008.00334.x.
- ↑ «Infección por Helicobacter Pylori». Consultado el 23 de abril de 2014.
- ↑ «Infección por Helicobacter pylori: síntomas y tratamiento - Nutribiótica». 31 de agosto de 2023. Consultado el 19 de julio de 2024.
- ↑ «Saccharomyces boulardii combined with triple therapy alter the microbiota in the eradication of Helicobacter pylori infection» (en inglés). 7 de junio de 2024. Consultado el 19 de julio de 2024.
- ↑ Mirbagheri, Seyed Amir; Mehrdad Hasibi, Mehdi Abouzari, and Armin Rashidi (14 de agosto de 2006). «Triple, standard quadruple and ampicillin-sulbactam-based quadruple therapies for H. pylori eradication: A comparative three-armed randomized clinical trial». World Journal of Gastroenterology 12 (30): 4888-4891. PMID 16937475. Archivado desde el original el 27 de septiembre de 2007.
- ↑ Borody, Thomas J.; P. Cole, S. Noonan, A. Morgan, J. Lenne, L. Hyland, S. Brandl, E. G. Borody, and L. L. George (16 de octubre de 1989). «Recurrence of duodenal ulcer and Campylobacter pylori infection after eradication». Medical Journal of Australia 151 (8): 431-435. PMID 2687668.
- ↑ European Helicobacter pylori Study Group. «Current Concepts in the Management of Helicobacter pylori Infection». The Maastricht 2-2000 Consensus Report. Archivado desde el original el 26 de agosto de 2011. Consultado el 30 de septiembre de 2006.
- ↑ Brown LM (2000). «Helicobacter pylori: epidemiology and routes of transmission» (pdf). Epidemiol Rev 22 (2): 283-297. PMID 11218379. Consultado el 3 de agosto de 2008.
- ↑ Fung C, Tan S, Nakajima M, Skoog EC, Camarillo-Guerrero LF, Klein JA, et al. (2019) High-resolution mapping reveals that microniches in the gastric glands control Helicobacter pylori colonization of the stomach. PLoS Biol 17(5): e3000231. https://doi.org/10.1371/journal.pbio.3000231
- ↑ Goodman KJ, O'rourke K, Day RS, et al (diciembre de 2005). «Dynamics of Helicobacter pylori infection in a US-Mexico cohort during the first two years of life». Int J Epidemiol 34 (6): 1348-1355. PMID 16076858. doi:10.1093/ije/dyi152.
- ↑ Goodman K, Cockburn M (2001). «The role of epidemiology in understanding the health effects of Helicobacter pylori.». Epidemiology 12 (2): 266-271. PMID 11246592. doi:10.1097/00001648-200103000-00023.
- ↑ Antimicrobial Activity of Essential Oils against Helicobacter pylori
- ↑ Roe, Imhawn; Nam, Seungwoo; Kim, Jungtaik; Shin, Jihyun; Bang, Wongi; Yang, Mierha (2002-07). «Association of The Myeloperoxidase −463G→A Polymorphism With Development of Atrophy in Helicobacter Pylori -Infected Gastritis». American Journal of Gastroenterology 97 (7): 1629-1634. ISSN 0002-9270. doi:10.1111/j.1572-0241.2002.05899.x. Consultado el 19 de noviembre de 2021.
- ↑ «Goma de mascar Mastixa o Masticha de Chios».
- ↑ Tsuji S, Kawai N, Tsujii M, Kawano S, Hori M (2003). «Review article: inflammation-related promotion of gastrointestinal carcinogenesis - a perigenetic pathway». Aliment Pharmacol Ther 18 (Suppl 1): 82-89. PMID 12925144.
- ↑ El sitio Pylori Gene da acceso a la información genómica de las cepas 26695 y J99 de H. pylori. Otra interfase genómica es la que ofrece el Centro Nacional para la Información Biotecnológica (National Center for Biotechnology Information; 26695, J99). Estas páginas están en inglés.
Bibliografía
[editar]- Baron, Samuel. Capítulo 23: "Campylobacter and Helicobacter". 4.ª edición, 1996.
- «Helicobacter pylori and peptic ulcer». Centers for Disease Control and Prevention. Archivado desde el original el 21 de junio de 2013. Consultado el 21 de diciembre de 2004.
- Logan, Robert P H; Walker, Marjorie M (20 de octubre de 2001). «Clinical review: ABC of the upper gastrointestinal tract. Epidemiology and diagnosis of Helicobacter pylori infection». BMJ 323: 920-922. PMID 11668141.
- Northfield, T.C.; Mendall, M.; y Goggin, P. C. (1994). H. pylori Infection Pathophysiology, Epidemiology and Management. Kluwer Academic Press Dortrecth.
- Sipponen, P.; Kekki, M.; Haapakoski, J.; Ihamäki, T.; y Siurala, M. Gastric cancer risk in chronic atrophic gastritis: Statistical calculations of cross-sectional data. Int J Cancer 1985; 35:173-177.
- Varis, K.; Samloff, I.M.; Ihamäki, T.; y Siurala, M. An appraisal of tests for severe atrophic gastritis in relatives of patients with pernicious anaemia. Dig Dis Sci, 1979; 24:187-191.
- Wadstrom, T. (1995). An update on Helicobacter pylori. Current Opinion in Gastroenterology, 11:69-75.
Enlaces externos
[editar]- The Helicobacter Foundation ofrece información sobre Helicobacter pylori y sus efectos - fundada por Dr. Barry J. Marshall, uno de los descubridores de H. pylori.
- Helicobacter pylori persistence: biology and disease por Martin J. Blaser y John C. Atherton en Journal of Clinical Investigations (2004), 113:321–333.
- Helicobacter pylori: Physiology and Genetics Texto en línea del libro de Mobley et al. (vía NCBI).
- European Helicobacter Study Group patrocina talleres, anuarios y protocolos clínicos a nivel internacional.
- The Year in Helicobacter pylori 2005 Helicobacter journal sept 2005 - Contenido gratuito
- The Year in Helicobacter pylori 2004 Helicobacter journal agosto de 2004 - Contenido gratuito en línea
- Atwood KC. Bacteria, Ulcers, and Ostracism?: H. pylori and the Making of a Myth. Skeptical Inquirer, noviembre de 2004. Texto completo
- Imagen microscópica de H. pylori
- Lista de especies en el género Helicobacter
- National Digestive Diseases Information Clearinghouse (NDDIC) Publicado bajo dominio público.
- Síntomas de Helicobacter pylori
- Nimish Vakil , MD, University of Wisconsin School of Medicine and Public Health
- Helicobacter pylori interacciones huésped patógeno
- Concepto y Causas - Helicobacter pylori
