Cáncer de esófago
| Cáncer de esófago | ||
|---|---|---|
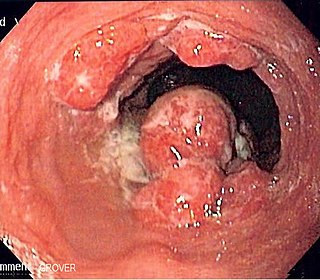 Endoscopia de un paciente con adenocarcinoma de esófago localizado en la unión gastroesofágica. | ||
| Especialidad |
oncología cirugía general gastroenterología | |
| Síntomas | Dificultad para tragar, pérdida de peso, voz ronca, agrandamiento de los ganglios linfáticos alrededor de la clavícula, vómitos de sangre, sangre en las heces | |
| Factores de riesgo | Tabaquismo, alcohol, bebidas muy calientes, obesidad, reflujo ácido | |
| Tratamiento | Cirugía, quimioterapia, radioterapia | |
El cáncer de esófago es un cáncer cuyo origen está en el esófago. Existen varios subtipos, aunque la mayoría se caracterizan por la presencia de síntomas como disfagia (dificultad para deglutir o tragar), dolor, pérdida de peso, entre otros, y son diagnosticados por medio de biopsia. Los tumores pequeños y localizados por lo general son tratados quirúrgicamente, mientras que los tumores avanzados requieren quimioterapia, radioterapia o una combinación de ambos. El pronóstico, que depende entre otras cosas de la extensión del tumor y de las complicaciones médicas asociadas, generalmente es malo.[1]
Clasificación
[editar]Los cánceres de esófago son típicamente carcinomas, que se presentan en el epitelio, o en la superficie que recubre el esófago.
Estos cánceres caen en dos clases:
- Carcinoma de células escamosas, la neoplasia maligna más común en el esófago que se presenta en hombres adultos de más de 50 años con mayor incidencia en la raza negra y generalmente asociado a la ingesta de alcohol y tabaco, y
- Adenocarcinomas, regularmente asociados a pacientes con antecedentes de reflujo gastroesofágico y esófago de Barrett.
Sintomatología
[editar]Si la clínica dice que tiene disfagia (dificultad para deglutir) no tenemos que descartar cáncer de esófago. La pérdida de peso es otra característica del padecimiento, que está relacionado con la pobre nutrición, por la odinofagia, y a la progresión del cáncer. El dolor, quemante la mayoría de las veces, puede ser severo o inclusive agravarse por la deglución. Un signo que se presenta prematuramente es el cambio de voz, que conforme progresa la enfermedad se va volviendo más ronca y rasposa.
La presencia de un tumor altera la peristalsis normal (el reflejo de deglución), dando lugar a náuseas, vómitos, regurgitación de la comida y tos, e inclusive de esta manera facilitar la aparición de otros padecimientos como la neumonía, una complicación frecuente. Algunas veces la superficie del tumor puede ser frágil y romperse fácilmente originando sangrados, causando hematemesis (vómitos de sangre). El crecimiento progresivo del tumor puede comprimir estructuras locales derivando en otras complicaciones como el síndrome de la vena cava superior. Con el tiempo se puede desarrollar un fístula entre el esófago y la tráquea, incrementando el riesgo de neumonía, que usualmente es anunciado por la presencia de tos, fiebre o aspiraciones de alimentos.[1]
En fases avanzadas, puede haberse extendido y originar otros signos y síntomas como ictericia, ascitis (ambos debido a la metástasis en hígado), falta de aire, derrame pleural (los dos causados por metástasis en pulmón), entre otros.
Causas y factores de riesgo
[editar]Factores que aumentan el riesgo
[editar]Aquí están una serie de factores de riesgo para el cáncer de esófago.[1] Algunos subtipos de cáncer están vinculadas a determinados factores de riesgo:
- Edad. La mayoría de los pacientes son mayores de 60 años, y la media en EU es de 67.[1]
- Género. Es más común en hombres.
- Herencia. Es más probable en personas que tienen parientes cercanos con cáncer.
- Tanto el tabaquismo como la ingesta de grandes cantidades de alcohol incrementan el riesgo de la aparición de este padecimiento, y juntos incrementan aún más esta probabilidad que cada uno por separado.
- Algunas sustancias dietéticas, como nitrosamina.
- Antecedentes de otros tumores en cráneo o cuello, incluyendo cáncer esofágico.
- Síndrome de Plummer-Vinson.
- Tilosis y Síndrome de Howel-Evans (engrosamiento hereditario de las plantas de los pies y las palmas de las mano).
- Radioterapia para otros padecimientos en el mediastino.[1]
- La enfermedad celíaca predispone al cáncer de esófago. El riesgo es mayor en los pacientes con enfermedad celíaca sin diagnosticar y disminuye tiempo después del diagnóstico, probablemente debido a la adopción de la dieta sin gluten estricta, que parece tener un papel protector contra el desarrollo de cánceres en los celíacos. Asimismo, el frecuente retraso en el diagnóstico de la enfermedad celíaca aumenta la probabilidad de desarrollar malignidad. En algunos casos, la enfermedad celíaca es detectada debido al desarrollo del cáncer, cuyos síntomas iniciales son similares a algunos síntomas que pueden aparecer en la enfermedad celíaca sin tratamiento.[2]
- La Enfermedad de reflujo gastroesofágico y el esófago de Barrett incrementan el riesgo de cáncer de esófago, debido a la irritación crónica de la mucosa (el adenocarcinoma es más común en esta condición, mientras que todos los demás factores de riesgo predisponen más para el carcinoma de células escamosas).[3]
- La obesidad incrementa al cuádruple el riesgo de desarrollar adenocarcinoma.[4] Se sospecha que el aumento del riesgo de reflujo pueden estar detrás de esta asociación.[3][5]
- De acuerdo con un estudio italiano sobre "una encuesta de la dieta completa de 5500 italianos", —un estudio que ha creado polémica por su relación con la aparición de cáncer— comer pizza más de una vez a la semana aparentemente es "un factor que favorece la aparición de neoplasias en esta población".[6]
- La acalasia predispone al desarrollo de cáncer.
Factores que disminuyen el riesgo
[editar]- El riesgo parece ser menor en personas que usan aspirina y otros fármacos relacionados (AINE).[7]
- El papel de la Helicobacter pylori en la progresión de adenocarcinoma esofágico es aún incierto, pero, sobre la base de datos de la población, puede tener un efecto protector.[8][9] Se postula que la H. pylori provoca la gastritis crónica, que es un factor de riesgo para el reflujo, que a su vez es un factor de riesgo de adenocarcinoma de esófago.[10] Sin embargo, si bien se conoce que H. pylori provoca gastritis crónica y úlcera doudenal, hay estudios que indican que la presencia de tal bacteria está pobremente relacionada con daños a la mucuosa esofágica[11] e incluso en situación de relación inversa entre su presencia y el diagnóstico de esofagitis.[12][13]
- De acuerdo con el National Cancer Institute, "dietas con alto contenido de crucíferas (repollo, brocoli, coliflor), de otros vegetales amarillos y verdes además de frutas, están asociadas con una disminución en el riesgo de cáncer esofágico".[14] El consumo moderado de café también se asocia a la disminución de este riesgo.[15]
Epidemiología
[editar]El cáncer esofágico ocupa el noveno lugar, por orden de frecuencia, entre las neoplasias malignas del mundo, si bien en los países en vías de desarrollo alcanza el quinto lugar. Su incidencia ha aumentado un 600 % en los últimos 30 años con un rango de supervivencia a los cinco años del 15 %.[16] Una característica epidemiológica de estos tumores es su gran variabilidad geográfica, su incidencia en Europa occidental es de 5 casos por cada 100 000 habitantes, mientras que en el sudeste de África y en otras áreas como Irán o China las tasas de incidencia superan los 100 casos por cada 100 000 habitantes. Predomina en varones, con una relación hombre/mujer de 4:1, aunque en algunas zonas esta relación se reduce.
En China, India y Japón, al igual que Reino Unido, y la región que rodea al mar Caspio, parecen ser los lugares que presentan la incidencia más alta de casos.[17] La American Cancer Society estima que durante el 2007, aproximadamente fueron diagnosticados 15 560 nuevos casos de este padecimiento en los Estados Unidos.[18] Generalmente la incidencia y mortalidad es mayor en afroamericanos que en caucásicos.[19]
Múltiples reportes indican que la incidencia del adenocarcinoma esofágica se ha incrementando en los últimos 20 años, en especial en blancos no hispanos.[20]
Diagnóstico
[editar]
Evaluación clínica
[editar]El examen radiológico con contraste demuestra la presencia de un tumor en aproximadamente el 80 % de los casos. Sin embargo, la mejor forma de hacer el diagnóstico es con la esofagogastroscopia, que implica el paso de un tubo flexible por el esófago y visualización de la pared, y mediante esta técnica son tomadas biopsias de las lesiones sospechosas que luego son examinadas histológicamente.
La realización de nuevos análisis se realizan para estimar el estado del tumor. La tomografía computarizada (TC) de tórax, abdomen y pelvis, puede evaluar si el cáncer se ha propagado a los tejidos adyacentes u otros órganos distantes (especialmente el hígado y los ganglios linfáticos). La sensibilidad de la TC se ve limitada por su capacidad para detectar masas (por ejemplo, ganglios linfáticos agrandados o de órganos involucrados) en general, de más de 1 cm. La exploración por FDG-PET (tomografía por emisión de positrones) se utiliza también para estimar si ampliada masas son metabólicamente activas, lo que indica que crecen más rápidamente que las células que se podría esperar en el cáncer. La ecoendoscopía esofágica puede proporcionar información en escena en relación con el nivel de invasión tumoral, y la posible extensión a los ganglios linfáticos locales.
La localización del tumor es generalmente medido por la distancia de los dientes. El esófago (25 cm o 10 pulgadas de largo) se divide en tres partes, para fines de determinar la localización. Los adenocarcinomas tienden a aparecer en la porción distal, mientras que los carcinomas de células escamosas proximalmente, pero no necesariamente.
Histopatología
[editar]La mayoría de los tumores del esófago son malignos. Una proporción muy pequeña (menos del 10 %) son leiomiomas (tumor de músculo liso) o tumores del estroma gastrointestinal. Los tumores malignos son en general los adenocarcinomas, carcinomas de células escamosas, y, en ocasiones, carcinomas de células pequeñas. Estos últimos comparten muchas propiedades del cáncer de pulmón de células pequeñas, y son relativamente sensibles a la quimioterapia en comparación con los otros tipos.
Tratamiento
[editar]Enfoque general
[editar]El tratamiento está determinado por el tipo celular de cáncer (adenocarcinoma o carcinoma de células escamosas vs otros tipos), la fase de la enfermedad, el estado general del paciente y otras enfermedades presentes en el paciente. En general, la nutrición tiene que ser adecuada, y la higiene dental es vital.
Si el paciente no puede tragar del todo, un stent puede ser insertado en el esófago de los pacientes; los stents también pueden ayudar a ocluir fístulas. Aunque una sonda nasogástrica puede ser necesaria para la alimentación mientras se está dando el tratamiento para el tumor, algunos pacientes requieren una gastrostomía (alimentación por medio de un agujero en la piel que le da acceso directo al estómago). Los dos últimos son especialmente importantes si el paciente tiende al aspirado de alimentos o saliva en las vías respiratorias, que predisponen a la aparición de neumonía.
En 2013[16] se publicó en Nature que el 48 % de las muestras analizadas por el equipo del Dr. Dulak se encontraron alteraciones genéticas potencialmente tratables con trastuzumab, un anticuerpo dirigido contra el receptor HER2 para los casos de sobreexpresión o amplificación del gen ERBB2.
Tratamiento del tumor
[editar]La cirugía es posible si la enfermedad es localizada, que es el caso en el 20-30 % de todos los pacientes. Si el tumor es más grande, pero localizado, la quimioterapia y/o radioterapia puede eventualmente reducir el tumor en la medida en que se convierta en "operable", pero esta combinación de tratamientos (se refiere a la quimiorradiación como tratamiento neoadyuvante) es todavía un tanto polémico en la mayoría de los círculos médicos. La esofagectomía es la eliminación de un segmento del esófago; ya que esto acorta la distancia entre la garganta y el estómago, algún otro segmento del tubo digestivo (en general, el estómago o parte del colon) se coloca en la cavidad torácica.[21] Si el tumor ya hizo metástasis, la resección quirúrgica no se considera que valga la pena, pero la cirugía paliativa puede ofrecer algún beneficio.
La terapia con láser es el uso de una luz de alta intensidad para la destrucción de células tumorales con la única afección del área tratada. Esta se hace cuando la extirpación por cirugía no es viable. El alivio de un bloqueo puede ayudar a reducir el dolor y la disfagia. También existe la terapia fotodinámica, un tipo de terapia láser que involucra el uso de drogas que son absorbidas por las células cancerígenas y que cuando son expuestas a una luz especial estas drogas se activan y destruyen a las células tumorales.
La quimioterapia depende del tipo del tumor, pero el tratamiento tiende a ser sobre la base de cisplatino (carboplatino u oxaliplatino) cada tres semanas con fluorouracilo (5-FU) de manera continua o cada tres semanas. En estudios más recientes, la adición de epirrubicina (ECF) fue mejor comparado con otros regímenes en cáncer avanzado no extirpable.[22] La quimioterapia puede darse después de la cirugía (como adyuvante, es decir, para reducir el riesgo de reincidencia), antes de la cirugía (neoadyuvante) o si la cirugía no es posible, en este caso, se usan cisplatino y 5-FU.
La radioterapia se da antes, durante o después de la quimioterapia o la cirugía, y, a veces, de forma independiente para controlar los síntomas. En los pacientes con enfermedad localizada, pero con contraindicaciones para cirugía, la "radioterapia radical" puede ser utilizada con finalidad curativa.
Pronóstico
[editar]En general, el pronóstico del cáncer de esófago es bastante malo, porque una gran parte de los pacientes se diagnostican en estados avanzados: la tasa global de supervivencia a los 5 años (TS5A) es menor del 5 %. El pronóstico individualizado depende mayoritariamente del estado del cáncer. Aquellos pacientes con un cáncer restringido a la mucosa tienen aproximadamente una TS5A del 80 %, pero se reduce a menos del 50 % cuando alcanza la submucosa. La extensión a la capa muscular propia del esófago representa una supervivencia a los 5 años del 20 %, y la extensión a las estructuras adyacentes al esófago representa un 7 % de TS5A. Los pacientes con metástasis a distancia (en los que no está indicada la resección quirúrgica) tienen una supervivencia a los 5 años por debajo del 3 %. De todos los pacientes a los que se les somete a cirugía con intención curativa, la TS5A es solamente de alrededor del 25 %. Pero estas estadísticas están mejorando, debido a que cada vez más pacientes tienen un diagnóstico más temprano como consecuencia de la mayor concienciación sobre el esófago de Barrett.
Genoma y exoma
[editar]

El interés en el estudio a nivel genético y epigenético es mayor principalmente debido al aumento de la incidencia de casos de cáncer de esófago a nivel mundial. Ha aumentado un 600 % durante los últimos 30 años con una tasa de supervivencia del 15 % tras los primeros 5 años.[16] Dulak y colaboradores en 2013 publicaron en Nature un estudio en el que se examina el exoma de 149 muestras procedentes de biopsias en diferente estado de progresión tumoral, de estas se seleccionaron 15 para secuenciación y análisis completo del genoma. Una de las hipótesis expuestas en dicho trabajo resume que una exposición significativa a mutágenos como el reflujo gástrico, inflamación, ácidos biliares, especies reactivas de oxígeno y nitrosaminas, podrían dar lugar a un ambiente dañino para las células y un potencial para la transformación.

Mutaciones y reorganizaciones cromosómicas
[editar]El análisis del genoma completo y de las regiones codificantes arroja información sobre la presencia de mutaciones puntuales y reorganizaciones cromosómicas más frecuentes. Dentro de la hipótesis de la mutación conductora, este tipo de mutaciones confieren una ventaja selectiva a las células tumorales para sobrevivir.[23] En este contexto, un gen que podría caer dentro de esta clasificación es RAC1, el cual se encuentra significativamente mutado en este tipo de cáncer.[16]
Secuenciación del genoma completo
[editar]Se emplearon librerías con 500ng DNA provenientes de tumores primarios y de la línea germinal, cada muestra constaba de 2 librerías de 380 a 400 bp.
Se encontró una media de 2952 reordenamientos cromosómicos, dentro de los cuales el 20 % consistían en translocaciones intercromosómicas y el 55 % eran fusiones aberrantes. Sin embargo, no se encontró correlación alguna entre la tasa de mutaciones y reordenamientos.
La característica más representativa en el adenocarcinoma de esófago a nivel genómico, es la alta incidencia de transversiones de adenina a citosina, sobre todo en sitios AA. La tasa de mutaciones sin considerar las transversiones AA, se reducen a 8,5 por cada millón de bases. El 34 % de las mutaciones en todo el genoma consistían en transversiones A>C, mientras que en la región exónica sólo se detectó una incidencia del 16 % e incluso menor en las regiones exónicas de mayor transcripción (7/Mb). Dichas transversiones al ocurrir menos en zonas más transcritas podrían indicar la presencia de un mecanismo de reconocimiento y reparación más activo para dicha zona.
Las transversiones en las zonas AA representan el 84 % de las transversiones totales dentro del genoma, con una incidencia media de 20,2 transversiones por Mb, el análisis estadístico demostró una incidencia diferencial según el contexto del triplete. Así, en el triplete GAA ocurría el cambio a GCA con una incidencia de 49,3/Mb, AAA>ACA de 8/Mb, CAA>CCA de 16,88/Mb, TAA>TCA de 6,7/Mb.
Secuenciación del exoma completo
[editar]El exoma es la fracción del genoma que codifica para los genes, los estudios exómicos van alcanzando importancia a medida que avanza la investigación en el cáncer.
Dulak y colaboradores analizaron el exoma de 149 muestras provenientes de biopsias de adenocarcinoma de esófago. En la tabla se resumen las principales mutaciones localizadas y su incidencia. De las 17 383 mutaciones encontradas, 16 516 eran mutaciones no silenciosas, mientras que 1954 eran mutaciones de inserción, deleción o nulas.
Alteraciones somáticas en rutas de señales de transducción
[editar]


Dulak y colaboradores proponen que una motilidad celular aumentada y la capacidad de invasión juegan un papel importante en la progresión de la enfermedad.
Las mutaciones en genes antes descritos muestran una asociación con otras rutas como la regulación del ciclo celular por CDKN2A, CCND1, CCNE1 y CDK6.
Una activación constitutiva de la ruta de la β-catenina se encontró en el 9 % de las muestras, con mutaciones en CDH1 o AXIN1. La ruta general más alterada encontrada fue la SMAD, con un 18 % de las ocurrencias. Entre las causas se proponen las mutaciones en SMAD4.
Las alteraciones somáticas en las rutas de la MAPK (Kinasa activada por mitógenos) y PI3K, dos rutas requeridas para la proliferación y supervivencia de las células cancerígenas. La ruta oncogénica más frecuentemente alterada por mutaciones (13 %) es la vía de la PI3K, seguida por la ruta mediada por PTEN.
Genes significativamente mutados
[editar]Empleando MutSig, se determinaron los genes mutados significativamente (FDR q<0,1).
Se encontraron 8331 genes mutados, de los 3639 se encontraron en dos o más muestras distintas. 199 de ellos se encontraron en más del 5 % de los tumores y 33 en más del 10% y 26 con una ocurrencia estadísticamente significativa.
El 7 % de los tumores presentaron inestabilidad en microsatélites (MSI) en dos genes de reparación de errores en el DNA: MSH6 y MSH3.
Se encontraron mutaciones en los genes supresores de tumores TP53 y CDKN2A; por otra parte, a excepción de ARID1A, PIK3CA y SMAD4 anteriormente no se han descrito genes significativamente mutados en cáncer de esófago.
Se encontraron mutaciones en los genes ELMO1 y DOCK2, mediadores intracelulares y ayudantes en la dimerización de GTPasas de la familia Rho (RAC1). En otros tipos de cáncer (además del esofágico), se detectó también una activación aberrante de la ruta RAC1 mediada por los genes TRIO, TIAMI, VAV2, ECT2 y PAK1.
Dentro de la familia SWI/SNF, se encuentran mutados en el 20 % de los casos varios genes encargados en la remodelación de la cromatina como ARID1A, SMARCA4 y ARID2. ARID1A y ARID2 se consideran genes supresores de tumores. Otros genes relacionados con la remodelación de la cromatina son PBRM1 y JARID2, que en conjunto se encuentran con una tasa de mutación del 24 %.
El gen SPG20 generado por transversiones AA, se encuentra mutado en el 7 % de las muestras analizadas por Dulak y colaboradores.
El gen que codifica para el receptor de tipo toll TLR4 se ve mutado en el 6 % de las muestras analizadas, activando la respuesta inmune innata ante la exposición de patógenos a través de la heterodimerización con MD-2. Se han reportado polimorfismos de este gen relacionados con un aumento en el riesgo de aparición de cáncer gástrico mediado por Helicobacter pylori. Mutaciones observadas TLR4 como p.D379, p.F487 y p.E439 sugieren una incapacidad para la correcta formación del complejo TLR4/MD-2 y por tanto, considerarse un conductor potencial en la progresión tumoral.
El gen que codifica para la proteína de anclaje de la proteína kinasa A (AKAP6) se encontró mutado en un 8 % de las muestras, la E3 ubiquitina ligasa, HECW1 (8 %) y AJAP1 (6 %) median la señalización en las uniones adherentes y por tanto, mutaciones en estos genes incrementan la capacidad invasiva en cáncer.
NUAK1 se encuentra mutado en el 3 % de las muestras, dicha mutación es importante, ya que la sobreexpresión del protooncogén Myc en modelos de carcinoma hepatocelular depende de NUAK1.
El gen MYST3 se encontró mutado en el 5 % de las muestras.
Genes candidatos para más estudios
[editar]Dulak y colaboradores sugieren estudios adicionales para 22 genes debido a su interés biológico y su significado en la recurrencia en otros tipos de cánceres. A pesar de que sólo 10 de estos genes se presentaron con un nivel de significación en el cáncer de esófago, en conjunto podrían albergar un mayor significado biológico a nivel del tumor individual. Entre estos genes se encuentran: KRAS, CRNNB1 y ErbB2.

Posibles dianas terapéuticas
[editar]Se proponen terapias que induzcan la activación o sobreexpresión de genes supresores de tumores que se encuentren con una mutación de pérdida de función. De modo análogo, se propone el uso de inhibidores o de RNAs de interferencia (siRNA) para los casos de sobreexpresión de protooncogenes.
Se considera una prioridad el tratamiento de tumores con dianas amplificadas, especialmente las relacionadas con las rutas RTK, PIK3CA. En la actualidad, el único agente terapéutico utilizado es el trastuzumab que actúa sobre la ruta HER2 debido a las mutaciones encontradas en el gen ErbB2.
La utilización de los genes más determinantes y con mayor tasa de mutación podrían emplearse como posibles biomarcadores para permitir un diagnóstico temprano.
Referencias
[editar]- ↑ a b c d e Enzinger PC, Mayer RJ. Esophageal cancer. N Engl J Med 2003;349:2241-52. PMID 14657432.
- ↑ Han Y, Chen W, Li P, Ye J (2015). «Association Between Coeliac Disease and Risk of Any Malignancy and Gastrointestinal Malignancy: A Meta-Analysis.». Medicine (Baltimore) (Meta-análisis) 94 (38): e1612. PMC 4635766. PMID 26402826. doi:10.1097/MD.0000000000001612.
- ↑ a b Lagergren J, Bergström R, Lindgren A, Nyrén O (1999). «Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma». N. Engl. J. Med. 340 (11): 825-31. PMID 10080844.
- ↑ Merry AH, Schouten LJ, Goldbohm RA, van den Brandt PA (2007). Body Mass Index, height and risk of adenocarcinoma of the oesophagus and gastric cardia: a prospective cohort study. PMID 17337464. doi:10.1136/gut.2006.116665.
- ↑ Layke JC, Lopez PP (2006). «Esophageal cancer: a review and update». American family physician 73 (12): 2187-94. PMID 16836035.
- ↑ Gallus S, Bosetti C, Negri E, Talamini R, Montella M, Conti E, Franceschi S, La Vecchia C. Does pizza protect against cancer? Int J Cancer 2003;107:283-4. PMID 12949808. Cited and qtd. by WebMD and BBC News.
- ↑ Corley DA, Kerlikowske K, Verma R, Buffler P. Protective association of aspirin/NSAIDs and esophageal cancer: a systematic review and meta-analysis. Gastroenterology 2003;124:47-56. PMID 12512029. See also NCI - "Esophfágico aún es incierto ageal Cancer (PDQ®): Prevention".
- ↑ Wong A, Fitzgerald RC. Epidemiologic risk factors for Barrett's esophagus and associated adenocarcinoma. Clin Gastroenterol Hepatol. 2005 Jan;3(1):1-10. PMID 15645398
- ↑ Ye W, Held M, Lagergren J, Engstrand L, Blot WJ, McLaughlin JK, Nyren O. Helicobacter pylori infection and gastric atrophy: risk of adenocarcinoma and squamous-cell carcinoma of the esophagus and adenocarcinoma of the gastric cardia. J Natl Cancer Inst. 2004 March 3;96(5):388-96. PMID 14996860
- ↑ Nakajima S, Hattori T. Oesophageal adenocarcinoma or gastric cancer with or without eradication of Helicobacter pylori infection in chronic atrophic gastritis patients: a hypothetical opinion from a systematic review. Aliment Pharmacol Ther. 2004 Jul;20 Suppl 1:54-61. PMID 15298606
- ↑ Deltenre M, DeKoster E, Ferhat M, Deprez C. Helicobacter pylori, gastric histology and gastro-oesophageal reflux disease (abstract). Gastroenterology 1995; 108: A81.
- ↑ Newton M, Bryan R, Burnham WR, Kamm MA. Evaluation of Helicobacter pylori in reflux oesophagitis and Barrettís oesophagus. Gut 1997; 40: 9-13.
- ↑ Labenz J, Tillenburg B, Peitz U, Bórsch G. Long-term consecuences of Helicobacter pylori eradicatin: clinical aspects. Scand J Gastroenterol 1996; 31 (Suppl 215): 111-115.
- ↑ NCI Prevention: Dietary Factors, based on Chainani-Wu N. Diet and oral, pharyngeal, and esophageal cancer. Nutr Cancer 2002;44:104-26. PMID 12734057.
- ↑ Tavani, A; Bertuzzi M, Talamini R, Gallus S, Parpinel M, Franceschi S, Levi F, La Vecchia C. (10 de 2003). «Coffee and tea intake and risk of oral, pharyngeal and esophageal cancer». Oral Oncol. 39 (7): 695-700. PMID 12907209.
- ↑ a b c d Dulak, A. M., Stojanov, P., Peng, S., Lawrence, M. S., = Fox, C., Stewart, C., Bandla, S., Imamura, Y., Schumacher, S. E., Shefler, E., McKenna, A., Cibulskis, K., Sivachenko, A., Carter, S. L., Saksena, G., Voet, D., Ramos, A. H., Auclair, D., Thompson, K., Sougnez, C., Onofrio, R. C., Guiducci, C., Beroukhim, R., Zhou, D., Lin, L., Lin, J., Reddy, R., Chang, A., Luketich, J. D., Pennathur, A., Ogino, S., Golub, T. R., Gabriel, S. B., Lander, E. S., Beer, D. G., Godfrey, T. E., Getz, G. & Bass, A. J. (2013). «Exome and whole genome sequencing of esophageal adenocarcinoma identifies recurrent driver events and mutational complexity.». Nature Genet. 45 (5).
- ↑ Stewart BW, Kleihues P (editors). World cancer report. Lyon: IARC, 2003. ISBN 92-832-0411-5.
- ↑ «What Are the Key Statistics About Cancer of the Esophagus?». Detailed Guide: Esophagus Cancer. American Cancer Society. Aug de 2006. Archivado desde el original el 29 de septiembre de 2007. Consultado el 21 de marzo de 2007.
- ↑ «Incidence and Mortality Rate Trends». A Snapshot of Esophageal Cancer. National Cancer Institute. Sep de 2006. Archivado desde el original el 16 de marzo de 2007. Consultado el 21 de marzo de 2007.
- ↑ Kenneth J. Vega, M.D., M. Mazen JamaM.D.l (Sep de 2000). «Changing pattern of esophageal cancer incidence in New Mexico». Changing pattern of esophageal cancer incidence in New Mexico. The American Journal of Gastroenterology. Consultado el 21 de marzo de 2007. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Deschamps C, Nichols FC, Cassivi SD, et al. (2005). «Long-term function and quality of life after esophageal resection for cancer and Barrett’s». Surgical Clinics of North America 85 (3): 649-656. PMID 15927658.
- ↑ Ross P, Nicolson M, Cunningham D, Valle J, Seymour M, Harper P, Price T, Anderson H, Iveson T, Hickish T, Lofts F, Norman A. Prospective randomized trial comparing mitomycin, cisplatin, and protracted venous-infusion fluorouracil (PVI 5-FU) with epirubicin, cisplatin, and PVI 5-FU in advanced esophagogastric cancer. J Clin Oncol 2002;20:1996-2004. PMID 11956258.
- ↑ Greenman, C. et al. (2007). «Patterns of somatic mutation in human cancer genomes.». Nature 446 (7132): 153-158.
Bibliografía
[editar]- Medicina Interna, Pedro Farreras Valentí, "15ª edición", vol. 1, Elsevier. Madrid, España, 2004. ISBN 84-8174-810-2.
Enlaces externos
[editar]
