Cromatóforo
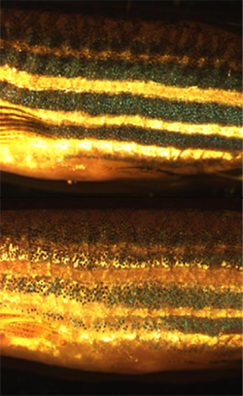
Los cromatóforos son células con pigmentos en su interior que reflejan la luz. Pueden encontrarse en diversos seres vivos como los anfibios, los peces, ciertos crustáceos y algunos cefalópodos. Son los principales responsables de la coloración de la piel, del color de los ojos en los animales ectotermos y de la formación de la cresta neural a lo largo del desarrollo embrionario. Los cromatóforos ya maduros pueden dividirse en diferentes clases según el color que reflejen bajo una luz blanca: cianóforos (azul), eritróforos (rojo), iridóforos (iridiscente), leucóforos (blanco), melanóforos (negro/marrón) y xantóforos (amarillo). El término también puede hacer referencia a las vesículas coloreadas asociadas a la membrana de ciertas bacterias fotosintéticas.
Algunas especies pueden cambiar de color rápidamente por medio de mecanismos que cambian un pigmento por otro y reorientan la superficie reflectora de los cromatóforos. Este proceso, a menudo utilizado como mecanismo de camuflaje, es llamado mimetismo o cambio fisiológico de color. Algunos cefalópodos como los pulpos, presentan unos órganos cromatóforos realmente complejos, controlados por músculos, mientras que ciertos vertebrados, como el camaleón, producen efectos similares mediados en este caso por vías de señalización celular. Estas señales pueden ser hormonas o neurotransmisores y pueden ser inducidas por cambios en el humor, la temperatura, el estrés o cambios notables del ambiente a nivel local.
A diferencia de los animales ectotermos, los mamíferos y los pájaros presentan únicamente una clase de células del tipo de los cromatóforos: los melanocitos. El equivalente en los animales ectotermos, los melanóforos, son estudiados actualmente en los laboratorios de investigación con el fin de ayudar en la comprensión de ciertas enfermedades humanas y utilizados como herramienta en el descubrimiento o diseño de nuevos fármacos.
Clasificación
[editar]Las primeras células pigmentadas descritas pertenecían a invertebrados y fueron denominadas cromóforos en una revista científica italiana en el año 1819.[1] El término cromatóforo se acuñó más tarde para denominar a las células que contenían pigmentos provenientes de la cresta neural de los vertebrados ectotermos y de los cefalópodos. La palabra cromatóforo proviene del griego y se puede dividir en dos términos:
- khrōma (χρωμα), cuyo significado es color.
- phoros (φορος), cuyo significado es que lleva.
Por el contrario, la palabra cromatocito (cito o κυτε del griego, cuyo significado es célula) fue acuñada para denominar a las células responsables del color encontradas en pájaros y mamíferos, aunque únicamente se ha encontrado uno de estos tipos celulares, el melanocito.
Sin embargo, la estructura y la coloración de los cromatóforos no fue desentrañada hasta la década de los 60, momento a partir del cual se pudo desarrollar un sistema de clasificación basado en la apariencia de dichos cromatóforos. Esta clasificación se ha mantenido hasta nuestros días aunque los últimos estudios al respecto han puesto de manifiesto algunos aspectos bioquímicos de los pigmentos que podrían ser más útiles a la hora de comprender su función en la célula.[2]
Según la producción de color, los cromatóforos pueden dividirse en dos clases:
- Biocromos: presentan pigmentos verdaderos, como pueden ser los carotenoides y las pteridinas. Estos pigmentos absorben selectivamente determinadas franjas del espectro de luz visible, que se compone de luz blanca, emitiendo así aquellas longitudes de onda que no absorben, y que son las que llegan al ojo del observador.
- Esquemocromos: también conocidos como colores estructurales, generan su coloración bien por reflexión de ciertas longitudes de onda (colores) de luz visible y emisión de otras, bien generando ondas de luz que interfieren dentro de la estructura o bien dispersando la luz que les llega.
Aunque todos los cromatóforos contienen pigmentos o estructuras reflectantes (excepto cuando han sido el resultado de una mutación genética como en el caso del albinismo), no todas las células que contienen pigmentos son cromatóforos. Por ejemplo, el grupo hemo es un biocromo responsable del color rojo de la sangre. Se encuentra principalmente en los eritrocitos, los cuales son generados en la médula ósea constantemente a lo largo de la vida de un organismo y no únicamente durante el desarrollo embrionario. Por ello, los eritrocitos aunque tengan pigmentos, al no provenir de las células de la cresta neural, no son clasificados como cromatóforos.

Xantóforos y eritróforos
[editar]Este tipo de cromatóforos contiene, o bien una gran cantidad de pigmentos amarillos del tipo de las pteridinas y son denominados xantóforos, o bien una gran cantidad de pigmentos rojos/naranjas del tipo de los carotenoides, denominándose entonces eritróforos.[3] En cualquier caso, se ha podido observar que las vesículas que contienen estos pigmentos, las pteridinas y los carotenoides, pueden llegar a encontrarse en la misma célula, lo que amplía en gran medida el abanico de colores que pueden observarse, dependiendo de la relación entre pigmentos rojos y amarillos.[4] Por ello, la distinción hecha entre estos cromatóforos realmente es arbitraria. La capacidad de generar pteridinas desde guanosín trifosfato es una característica común a la mayoría de los cromatóforos, pero los xantóforos parecen tener rutas bioquímicas alternativas que dan lugar a un exceso de pigmentos amarillos acumulados. Por el contrario, los carotenoides son metabolizados a partir de los alimentos ingeridos en la dieta y transportados a los eritróforos. Esto fue demostrado por primera vez con un sencillo experimento. Se criaron las típicas ranas verdes sometiéndolas a una dieta donde se eliminaron completamente los carotenos. La ausencia de carotenos dio lugar a una ausencia de pigmentos rojos/naranjas en los eritróforos, y esto se tradujo en que las ranas parecían ser de color azul en lugar de verdes.[5]
Iridóforos y leucóforos
[editar]Los iridóforos, también denominados guanóforos, son pigmentos celulares que reflejan la luz usando láminas de esquemocromos cristalinos sintetizados a partir de guanina.[6] Cuando estas láminas son iluminadas generan colores iridiscentes debido a la difracción que sufren los rayos de luz al atravesar la pila de láminas. La orientación de los esquemocromos determinará la naturaleza del color observado.[7] Cuando los iridóforos utilizan biocromos como filtros coloreados generan un efecto óptico conocido como efecto Tyndall o dispersión de Rayleigh, lo cual da lugar a la producción de colores azules brillantes y verdes.[8]
Existe otro cromatóforo relacionado, los leucóforos, que puede encontrarse en ciertas especies de peces. Al igual que los iridóforos, utilizan purinas cristalinas para reflejar la luz, generando así el típico brillo de color blanco que se puede apreciar en algunos peces. La distinción entre iridóforos y leucóforos en peces no es siempre evidente, al igual que pasa con los xantóforos y los eritróforos, pero generalmente, los iridóforos producen colores iridiscentes o metálicos mientras que los leucóforos generan reflejos de diversos tonos de blanco.[8]
Melanóforos
[editar]Los melanóforos contienen eumelanina, un tipo de melanina de color negro o marrón oscuro debido a su gran capacidad para absorber la mayoría de las longitudes de onda de la luz. Se encuentra en el interior de unas vesículas denominadas melanosomas, las cuales se distribuyen por todo el citoplasma celular. La eumelanina se sintetiza a partir de la tirosina a través de una serie de reacciones de catálisis química. Presenta una estructura compleja basada en unidades de dihidroxindol y dihidroxindol-2-carboxilato con algunos anillos pirrólicos.[9] La enzima clave en la síntesis de melanina es la tirosinasa. Si esta enzima se encuentra ausente, la melanina no puede sintetizarse y esto desemboca en diversos tipos de albinismo.
En algunas especies de anfibios se pueden apreciar unos pigmentos diferentes junto a la eumelanina, como por ejemplo, un nuevo pigmento de color rojizo que ha sido identificado en los melanóforos de filomedusina de ciertas ranas.[10] Posteriormente, este pigmento fue identificado como pterorodina, un dímero de pteridina que se acumula alrededor de la eumelanina. Aunque probablemente haya más subtipos de pigmentos en los melanóforos, hasta ahora, en la mayoría de los melanóforos estudiados contenían exclusivamente eumelanina.
Los seres humanos tienen tan solo una clase de célula pigmentada, el equivalente mamífero de los melanóforos, que se encarga de generar el color de la piel, el pelo y los ojos. Por ello, y por lo fácil que es estudiarlos debido al elevado número de colores diferentes que presentan, los melanóforos son, con mucha diferencia, los cromatóforos más ampliamente estudiados. Sin embargo, existen diferencias entre la biología de los melanóforos y la de los melanocitos. Además de la eumelanina, los melanocitos pueden sintetizar pigmentos amarillos/verdes denominados feomelaninas.

Cianóforos
[editar]En 1995 se demostró que los colores azul brillante de algunos tipos de pez mandarín (Siniperca chuatsi) no eran generados por esquemocromos, sino por un biocromo cian de estructura química desconocida.[8] Este pigmento, encontrado en el interior de vesículas en al menos dos especies de pez de la familia Callionymidae, es muy poco común en el reino animal, razón por la cual la mayoría de los pigmentos azules estudiados hasta el momento son esquemocromáticos. Por ello, estos nuevos pigmentos se propusieron como un nuevo tipo de cromatóforo, los cianóforos. Aunque parecen estar poco extendidos, es posible que haya cianóforos (así como otras clases de cromatóforos poco comunes o desconocidos) en otras especies de peces y anfibios. Por ejemplo, los cromatóforos de colores brillantes que se han observado en la rana venenosa de flecha (familia Dendrobatidae) y en la rana de cristal (familia Centrolenidae), cuyos pigmentos son desconocidos.[11]
Translocación de pigmentos
[editar]Muchas especies tienen la capacidad de translocar los pigmentos en el interior de los cromatóforos, lo que da lugar a un aparente cambio de color en el animal. Este proceso, conocido como cambio fisiológico de color, está ampliamente estudiado en los melanóforos, debido a que la melanina es el pigmento más oscuro y por ello el más visible. En la mayoría de las especies que poseen una dermis relativamente delgada, los melanóforos de la dermis tienden a ser planos y a cubrir una gran superficie. Sin embargo, en los animales cuya dermis es gruesa, como los reptiles adultos, los melanóforos de la dermis suelen formar unidades tridimensionales con otros melanóforos. Estas unidades dérmicas de cromatóforos (UDC) se componen de una primera capa superior de xantóforos o eritróforos, seguida de una capa de iridóforos y finalmente una especie de capa de melanóforos.[12]
Ambos tipos de melanóforos son importantes en el proceso del cambio fisiológico de color. Los melanóforos planos de la dermis se suelen superponer a otros cromatóforos, por lo que, cuando los pigmentos difunden a través de la célula, la piel aparece oscura. Por el contrario, cuando los pigmentos se concentran en el centro de la célula, quedan expuestos a la luz los pigmentos de los cromatóforos que se encuentran en las capas inferiores, lo que produce que la piel se torne en otras tonalidades. De forma similar, tras agregarse la melanina en UDCs, la piel se observa verde debido al filtro que ejercen los xantóforos (amarillos) de la luz dispersada que llega desde la capa de los iridóforos. Cuando se produce la difusión de la melanina, la luz no se dispersa tanto y la piel aparece oscura. Al igual que otros cromatóforos biocromáticos que son capaces de translocar pigmentos, los animales con múltiples tipos de cromatóforos pueden generar un espectacular abanico de colores en su piel, aprovechando el efecto divisional.[13],[14]

El control y los mecanismos implicados en la translocación rápida de pigmentos han sido ampliamente estudiados en un determinado número de especies, entre los que cabe destacar a los anfibios y a los peces teleósteos.[15],[8] Se ha demostrado que este proceso puede estar regulado por procesos hormonales, neuronales o por ambos. Se ha descrito que ciertos neurotransmisores como la noradrenalina, están relacionados con la translocación de pigmentos por medio de receptores en la superficie de los melanóforos.[16] Entre las principales hormonas involucradas en la regulación de este proceso se encuentran las melanocortinas, la melatonina y la hormona concentrante de melanina (MCH), las cuales son producidas principalmente en la glándula pituitaria, en la glándula pineal y en el hipotálamo, respectivamente. Estas hormonas también podrían ser generadas de modo paracrino por las células de la piel. También se ha observado que, en la superficie de los melanóforos, las hormonas activan específicamente al receptor acoplado a proteínas G, el cual transduce la señal al interior de la célula. Los efectos que producen estas hormonas son diversos. Las melanocortinas dan lugar a la dispersión de los pigmentos, mientras que la melatonina y la MHC dan lugar a la agregación de los mismos.[17]
Han sido identificados multitud de receptores de melanocortina, de MHC y de melatonina en ciertas especies de peces[18] y ranas,[19] incluyendo un homólogo de MC1R,[20] un receptor de melanocortina conocido por regular el proceso de coloración de la piel y del pelo en los humanos.[21] A su vez, se ha demostrado que, en el interior celular, el AMPc es un importante segundo mensajero de la translocación pigmentaria. A través de un mecanismo aún no comprendido completamente, el AMPc actúa sobre otras enzimas tales como la proteinasa K, con el fin de activar motores moleculares que transporten las vesículas con pigmentos a lo largo de los microtúbulos y los microfilamentos.[22],[23],[24]
Adaptación al fondo
[editar]La mayoría de los peces, reptiles y anfibios experimentan un cambio fisiológico de color limitado en respuesta a un cambio en el ambiente. Este tipo de camuflaje, conocido como adaptación al fondo, se manifiesta normalmente como un ligero oscurecimiento o aclaramiento de la tonalidad de la piel, cuyo fin es mimetizar el color y la tonalidad del medio ambiente en el que se encuentre. Se ha demostrado que el proceso de adaptación al fondo es dependiente de la visión (parece que es necesario que el animal vea el ambiente en el que se encuentra para ser capaz de adaptar el color de su piel a dicho entorno),[25] y que la translocación de melanina en los melanóforos es el factor principal en el cambio de color.[17] Algunos animales, como el camaleón o los anoles, han desarrollado una efectiva respuesta de adaptación al fondo, capaz de generar un gran número de colores en cortos espacios de tiempo. Han adaptado la capacidad para cambiar de color para que pueda responder a temperatura, cambios de humor, niveles de estrés, etc. y no simplemente a cambios ambientales.

Origen embrionario y desarrollo
[editar]Durante el desarrollo embrionario de los vertebrados, los cromatóforos pertenecen a uno de los tipos celulares generados en la cresta neural, un par de franjas de células incipientes en los márgenes del tubo neural. Estas células presentan la capacidad de migrar largas distancias, lo que permite que los cromatóforos lleguen y se establezcan en diferentes órganos del cuerpo, entre los que cabe destacar la piel, los ojos, las orejas y el cerebro. Tras abandonar la cresta neural en oleadas, los cromatóforos toman dos rutas posibles: o bien la ruta dorsolateral a través de la dermis, llegando al ectodermo a través de pequeños agujeros en la lámina basal, o bien la ruta ventromedial entre las somitas y el tubo neural. Una excepción a esto son los melanóforos del epitelio pigmentado de la retina del ojo, los cuales no derivan de la cresta neural, sino de una invaginación del tubo neural que genera la copa óptica y esta a su vez la retina.
Cuándo y cómo las células precursoras multipotentes de cromatóforos (denominadas cromatoblastos) dan lugar a los diversos subtipos de células hijas es objeto de investigación actualmente. Por ejemplo, se sabe que en los embriones de pez cebra, 3 días después de la fertilización, cada una de las clases celulares encontradas en el pez adulto — melanóforos, xantóforos e iridóforos — ya están presentes. Estudios realizados con mutantes de este pez han demostrado que ciertos factores de transcripción como kit, los genes SOX y mitf son claves en el control de la diferenciación de los cromatóforos.[26] Cuando estas proteínas se encuentran ausentes los cromatóforos pueden estar parcial o totalmente ausentes, lo que da lugar a desórdenes leucísticos.
Aplicaciones prácticas
[editar]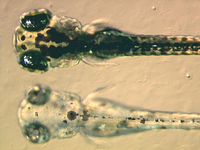
Además de la investigación básica llevada a cabo para lograr una mejor comprensión de los cromatóforos, se han buscado diversas utilidades a estas células. Por ejemplo, las larvas de los peces zebra son utilizadas en la actualidad para estudiar cómo los cromatóforos se organizan y comunican con el fin de generar de forma extremadamente precisa el típico patrón de rayas horizontales que se puede observar en los individuos adultos.[27] Esto ha sido tremendamente útil a la hora de buscar un sistema modelo en la creación de patrones con el que trabajar en el campo de la biología evolutiva del desarrollo. La biología de los cromatóforos también ha sido utilizada como modelo de ciertas enfermedades humanas, como el caso del melanoma, o de algunas condiciones genéticas, como el albinismo. Asimismo, se ha demostrado que las variaciones de pigmentación más claras, tanto en los seres humanos como en la variedad "dorada" de pez cebra, se debe a un menor número, tamaño y densidad de los melanosomas, los orgánulos pigmentados de los melanocitos. Tal característica está asociada a un gen que codifica para un intercambiador de cationes localizado en una membrana intracelular denominado Slc24a5.[28] El gen ortólogo en humanos presenta dos alelos principales, los cuales difieren en un solo nucleótido que determina un cambio de alanina a treonina en la posición 111 de la proteína. El alelo ancestral, que lleva la alanina, fue hallado en el 93 a 100% de las muestras de africanos, asiáticos del este y poblaciones originarias de América. En cambio, el alelo que lleva la treonina, originado hace 6.000 a 12.000 años atrás y asociado a pigmentación más clara, está presente en el 98,7 a 100% de las muestras tomadas de poblaciones europeas.[29] Por lo tanto, las variaciones en este gen, ubicado en el cromosoma 15 del genoma humano, estarían explicando las diferencias en la coloración de la piel en nuestra especie[30]
Los cromatóforos son también usados como biomarcadores de ceguera en especies ectotermas, ya que, cuando un animal con un determinado defecto visual es incapaz de adaptar el color de su piel al ambiente, se puede deducir que presenta un problema de visión.[25] Se cree que los receptores homólogos en humanos, que median la translocación pigmentaria en los melanóforos, están involucrados en procesos tales como la pérdida de apetito y el bronceado, lo que los convierte en posibles dianas a la hora de buscar fármacos relacionados.[31] Por ello, las compañías farmacéuticas han desarrollado ensayos biológicos para la rápida identificación de posibles compuestos bioactivos, usando para ello los melanóforos de la rana con garra africana (Xenopus laevis).[32] Otros científicos han desarrollado técnicas con el fin de utilizar melanóforos como biosensores,[33] y para la rápida detección de enfermedades (basado en el descubrimiento de que la toxina producida por la bacteria Bordetella pertussis bloquea la agregación de pigmentos en los melanóforos de los peces).[34] Por último, cabe destacar las posibles aplicaciones de los cromatóforos en el campo militar, donde podrían utilizarse con el fin de conseguir rápidos cambios de color, y principalmente, como una forma de camuflaje activo.[35]
Cromatóforos de cefalópodos
[editar]
Los cefalópodos de la subclase coleoidea presentan complejos órganos multicelulares que utilizan para cambiar de color rápidamente, como se puede observar en los calamares brillantes, las sepias y los pulpos. Cada unidad cromatófora está compuesta por una única célula cromatófora y numerosos músculos, nervios, células gliales y células de la vaina.[36] En el interior de la célula cromatófora, los gránulos de pigmentos se encuentran encerrados en un saco elástico, denominado cytoelastic sacculus. Para cambiar de color, el individuo deforma el tamaño o la forma del sacculus por medio de contracciones musculares, logrando así variar el estado de translucidez, reflexión u opacidad de los pigmentos. Este mecanismo difiere del utilizado por los peces, anfibios y reptiles, donde lo que ocurre es una translocación de pigmentos en el interior de la célula. Sin embargo, el efecto que se observa al final es muy similar.
Los pulpos presentan los cromatóforos en un complejo, capaz de emitir diferentes longitudes de onda cromáticas, lo que da lugar a esquemas de colores que cambian rápidamente. Se cree que los nervios que controlan a los cromatóforos se sitúan en el cerebro, en un orden similar a los cromatóforos que controlan. Esto quiere decir que el patrón de cambio de color está en consonancia con el patrón de activación neuronal. Esto podría explicar por qué, cuando las neuronas son activadas una tras otra, el cambio de color se produce en forma de ondas.[37] Al igual que los camaleones, los cefalópodos utilizan el cambio fisiológico de color como medio de interacción social. Además, se encuentran entre los que poseen una mayor habilidad en la adaptación al fondo, presentando la capacidad de asemejar su aspecto tanto al color como a la textura del ambiente en el que se encuentren de forma excepcionalmente precisa.
Cromatóforos en bacterias
[editar]Los cromatóforos también pueden encontrarse en las membranas de bacterias fototróficas, que los utilizan para llevar a cabo la fotosíntesis y se componen de pigmentos de bacterioclorofila y carotenoides.[38] En las bacterias púrpura como Rhodospirillum rubrum, las proteínas colectoras de luz se encuentran de forma intrínseca en las membranas de los cromatóforos. Sin embargo, las bacterias verdes del azufre han desarrollado un complejo-antena especializado, denominado clorosoma.[39]
Véase también
[editar]Notas
[editar]- ↑ Sangiovanni G. Descrizione di un particolare sistema di organi cromoforo espansivo-dermoideo e dei fenomeni che esso produce, scoperto nei molluschi cefaloso. G. Enciclopedico Napoli. 1819; 9:1–13.
- ↑ Bagnara JT. Cytology and cytophysiology of non-melanophore pigment cells. Int Rev Cytol. 1966; 20:173–205. PMID 5337298
- ↑ Bagnara JT. Cytology and cytophysiology of non-melanophore pigment cells. Int Rev Cytol. 1966; 20:173–205. PMID 5337298
- ↑ Matsumoto J. Studies on fine structure and cytochemical properties of erythrophores in swordtail, Xiphophorus helleri. J Cell Biol. 1965; 27:493–504. PMID 5885426
- ↑ Bagnara JT. Comparative Anatomy and Physiology of Pigment Cells in Nonmammalian Tissues in The Pigmentary System: Physiology and Pathophysiology, Oxford University Press, 1998. ISBN 0-19-509861-7
- ↑ Taylor JD. The effects of intermedin on the ultrastructure of amphibian iridophores. Gen Comp Endocrinol. 1969; 12:405-16. PMID 5769930
- ↑ Morrison RL. A transmission electron microscopic (TEM) method for determining structural colors reflected by lizard iridophores. Pigment Cell Res. 1995; 8:28–36. PMID 7792252
- ↑ a b c d Fujii R. The regulation of motile activity in fish chromatophores. Pigment Cell Res. 2000; 13:300-19. PMID 11041206
- ↑ Ito S & Wakamatsu K. Quantitative analysis of eumelanin and pheomelanin in humans, mice, and other animals: a comparative review. Pigment Cell Res. 2003; 16:523-31. PMID 12950732
- ↑ Bagnara JT et al. Color changes, unusual melanosomes, and a new pigment from leaf frogs. Science. 1973; 182:1034–5. PMID 4748673
- ↑ Schwalm PA et al. Infrared reflectance in leaf-sitting neotropical frogs. Science. 1977; 196:1225–7. PMID 860137
- ↑ Bagnara JT et al. The dermal chromatophore unit. J Cell Biol. 1968; 38:67–79. PMID 5691979 Full text — PDF.
- ↑ Palazzo RE et al. Rearrangements of pterinosomes and cytoskeleton accompanying pigment dispersion in goldfish xanthophores. Cell Motil Cytoskeleton. 1989; 13:9–20. PMID 2543509
- ↑ Porras MG et al. Corazonin promotes tegumentary pigment migration in the crayfish Procambarus clarkii. Peptides. 2003; 24:1581–9. PMID 14706537
- ↑ Deacon SW et al. Dynactin is required for bidirectional organelle transport. J Cell Biol. 2003; 160:297-301. PMID 12551954 Full text
- ↑ Aspengren S et al. Noradrenaline- and melatonin-mediated regulation of pigment aggregation in fish melanophores. Pigment Cell Res. 2003; 16:59–64. PMID 12519126
- ↑ a b Logan DW et al. Regulation of pigmentation in zebrafish melanophores. Pigment Cell Res. 2006; 19:206-13. PMID 16704454
- ↑ Logan DW et al. Sequence characterization of teleost fish melanocortin receptors. Ann N Y Acad Sci. 2003; 994:319-30. PMID 12851332
- ↑ Sugden D et al. Melatonin, melatonin receptors and melanophores: a moving story. Pigment Cell Res. 2004; 17:454-60. PMID 15357831
- ↑ Logan DW et al. The structure and evolution of the melanocortin and MCH receptors in fish and mammals. Genomics. 2003; 81:184-91. PMID 12620396
- ↑ Valverde P et al. Variants of the melanocyte-stimulating hormone receptor gene are associated with red hair and fair skin in humans. Nat Genet. 1995; 11:328-30. PMID 7581459
- ↑ Snider J et al. Intracellular actin-based transport: how far you go depends on how often you switch. Proc Natl Acad Sci USA. 2004; 101:13204-9. PMID 15331778 Full text
- ↑ Rodionov VI et al. Functional coordination of microtubule-based and actin-based motility in melanophores. Curr Biol. 1998; 8:165-8. PMID 9443917 Full text Archivado el 23 de octubre de 2008 en Wayback Machine.
- ↑ Rodionov VI et al. Protein kinase A, which regulates intracellular transport, forms complexes with molecular motors on organelles. Curr Biol. 2002; 14:1877–81. PMID 15498498 Full text Archivado el 23 de octubre de 2008 en Wayback Machine.
- ↑ a b Neuhauss SC. Behavioral genetic approaches to visual system development and function in zebrafish. J Neurobiol. 2003; 54:148-60. PMID 12486702. Full text — PDF.
- ↑ Kelsh RN et al. Genetic analysis of melanophore development in zebrafish embryos.] Dev Biol. 2000; 225:277-93. PMID 10985850
- ↑ Kelsh RN. Genetics and evolution of pigment patterns in fish. Pigment Cell Res. 2004; 17:326-36. PMID 15250934
- ↑ Lamason RL et al. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science. 2005; 310:1782–6. PMID 16357253
- ↑ Peen State University: fish gene sheds light on human skin color variation.[1] Archivado el 21 de julio de 2010 en Wayback Machine.
- ↑ Gibbons A (2007). «American Association of Physical Anthropologists meeting. European skin turned pale only recently, gene suggests». Science 316 (5823): 364. PMID 17446367. doi:10.1126/science.316.5823.364a. Archivado desde el original el 29 de junio de 2012. Consultado el 25 de noviembre de 2007.
- ↑ Logan DW et al. The structure and evolution of the melanocortin and MCH receptors in fish and mammals. Genomics. 2003; 81:184-91. PMID 12620396.
- ↑ Jayawickreme CK et al. Use of a cell-based, lawn format assay to rapidly screen a 442,368 bead-based peptide library. J Pharmacol Toxicol Methods. 1999; 42:189-97. PMID 11033434
- ↑ Andersson TP et al. Frog melanophores cultured on fluorescent microbeads: biomimic-based biosensing. Biosens Bioelectron. 2005; 21:111-20. PMID 15967358
- ↑ Karlsson JO et al. The melanophore aggregating response of isolated fish scales: a very rapid and sensitive diagnosis of whooping cough. FEMS Microbiol Lett. 1991; 66:169-75. PMID 1936946
- ↑ Lee I. Nanotubes for noisy signal processing: Adaptive Camouflage PhD Thesis. 2005; University of Southern California. Retrieved June 2006 — PDF (799 KiB).
- ↑ Cloney RA. & Florey E. Ultrastructure of cephalopod chromatophore organs. Z Zellforsch Mikrosk Anat. 1968; 89:250–280. PMID 5700268
- ↑ Demski LS. Chromatophore systems in teleosts and cephalopods: a levels oriented analysis of convergent systems. Brain Behav Evol. 1992; 40:141-56. PMID 1422807
- ↑ Salton MR. Bacterial membrane proteins. Microbiol Sci. 1987; 4:100-5. PMID 3153178
- ↑ Frigaard NU. & Bryant DA. Seeing green bacteria in a new light: genomics-enabled studies of the photosynthetic apparatus in green sulfur bacteria and filamentous anoxygenic phototrophic bacteria. Arch Microbiol. 2004; 182:265-75. PMID 15340781
Enlaces externos
[editar]- Vídeo de la adaptación al fondo de un pulpo
- Vídeo del patrón de cromatóforo de un calamar
- Proyecto Web Árbol de la Vida: cromatóforos de cefalópodos
