Usuario:Drex C137/Acetato de aluminio(III)
| Acetato de aluminio(III) | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Etanoato de aluminio | ||
| General | ||
| Otros nombres |
Solución de Burow Acetato alumínico Triacetato de aluminio | |
| Fórmula estructural | ||
| Fórmula molecular | ||
| Identificadores | ||
| Número CAS | 139-12-8[1] | |
| ChemSpider | 8427 | |
| DrugBank | DB14518 | |
| PubChem | 8757 | |
| UNII | 80EHD8I43D | |
|
CC(=O)[O-].CC(=O)[O-].CC(=O)[O-].[Al+3]
| ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 1002 kg/m³; 1,002 g/cm³ | |
| Masa molar | 204,11 g/mol | |
| Punto de descomposición | 200 °C (473 K) | |
| Propiedades químicas | ||
| Solubilidad en agua | 235,5 g/L (25°C) | |
| Solubilidad | Ligeramente soluble en acetona | |
| Peligrosidad | ||
| SGA |
 | |
| Riesgos | ||
| Ojos | Irritación (en solución) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El Acetato de aluminio(III), triacetato de aluminio o formalmente llamado como acetato de aluminio,[2] es un compuesto químico formado por 3 aniones acetato y un catión de aluminio de carga 3+. En condiciones estandar es un sólido blanco[3] que se descompone alrededor de los 200°C[4].
El acetato de aluminio se hidroliza en una mezcla de de hidróxidos básicos, sales de acetato,[5] y multiples especies que coexisten en equilibrio químico. Particularmente en solución acuosa el nombre acetato de aluminio se usa comúnmente para denominar a la mezcla de todas estas sustancias.
Aplicaciones
[editar]Medicina
[editar]Posee usos terapéuticos como medicamento tópico por sus propiedades antipruriginosas, astringentes y antisépticas [6]. Las preparaciones de solución de Burow se diluyen y modifican con aminoácidos para hacerlas más apetecibles para su uso como gárgaras en afecciones como las aftas de la boca o para tratar la otitis externa.[7][8] Se comercializa como un medicamento de venta sin receta bajo el nombre de Agua Burow o Domeboro.[9]
En medicina veterinaria se utiliza para tratar la enfermedad de Mortellaro en animales ungulados como el ganado vacuno.[10]
El triacetato de aluminio se utiliza como agente mordiente con colorantes como la alizarina [11]. En combinación con el diacetato de aluminio [12] o con el sulfacetato de aluminio [13] se utiliza sobre algodón, seda y otras fibras de celulosa [14][13].
También se ha combinado con acetato ferroso para producir diferentes colores. [15]
Nomenclatura
[editar]De acuerdo con las reglas formales para nombrar compuestos inorgánicos, el nombre de es acetato de aluminio, [2] aunque se aceptan nombres más formales como acetato de aluminio(III) y etanoato de aluminio. [5] El uso del prefijo multiplicador "tri" en el nombre triacetato de aluminio, aunque no es técnicamente necesario, se utiliza regularmente para evitar posibles confusiones con compuestos relacionados con ligandos hidroxo . Diacetato de aluminio básico, formalmente diacetato de hidroxialuminio ( CAS RN 142-03-0), [16] con la fórmula , con un ligando hidróxido sustituyendo uno de acetato, y monoacetato de aluminio dibásico, formalmente acetato de dihidroxialuminio (CAS RN 7360-44-3), con la fórmula , sustituye 2 de los 3 ligando acetato por ligandos hidróxido.
Estos tres compuestos son distintos en la fase sólida, pero generalmente se tratan como un grupo y se describen colectivamente como acetato de aluminio en solución, debido a que el triacetato se hidroliza a una mezcla que incluye las otras dos formas. [5] La abreviatura como , junto con variantes como , a veces se utilizan en la disciplina de la geoquímica, [17] aunque son inconsistentes con la práctica estándar en la química convencional.[18]
Estructura
[editar]La fórmula indica la presencia de un núcleo de aluminio en el estado de oxidación +3 y grupos acetato en una proporción de 1:3. Las imágenes utilizadas para representar esta sustancia, como las que se muestran a la izquierda, representan dos aproximaciones muy simplificadas de la estructura del estado sólido: la primera es como una sal puramente iónica con un solo catión de aluminio(III) () rodeado por y asociado electrostáticamente con tres aniones acetato (), pero esto no debe interpretarse como una representación de la estructura cristalina . Por ejemplo, el cloruro de sodio (NaCl) tiene una estequiometría catión-anión de 1:1, pero tiene una estructura cúbica con cada ion rodeado octaédricamente por seis iones de carga opuesta. [19]
La otra imagen es la forma molecular con los tres grupos acetato unidos covalentemente al núcleo metálico en una geometría plana trigonal e interacciones intermoleculares que mantienen las moléculas unidas entre sí en la estructura cristalina. Es muy probable que la estructura del estado sólido sea más complicada e incluya características tanto covalentes como iónicas y pueden estar presentes múltiples núcleos de aluminio y/o grupos de acetato como puente ; ambos se han informado en soluciones de acetato de aluminio [20] y se sabe que el cloruro de aluminio existe como dímeros . [21]
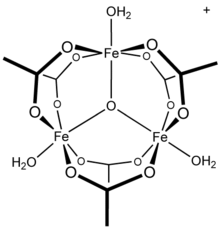
Las investigaciones de RMN del sistema del acetato de aluminio(III) acuoso muestran la presencia de aluminio como un complejo hexahidratado, , [22] así como especies mononucleares con diferentes sustituciones. Además, las investigaciones demuestran que una especie importante en fase de solución es un tridecámero, [23] un resto informado en mecanismos conflictivos de hidrólisis y polimerización de soluciones de aluminio. [24] Se sabe que otros cationes metálicos trivalentes forman especies polinucleares: el acetato de hierro (III), por ejemplo, forma una estructura trinuclear [25] con un centro oxo de triple puente [26] con el catión [Fe3(μ3–O)(OAc)6(H2O)3]+.[27] El compuesto hidróxido de acetato de cromo, , también se ha descrito como isoestructural. [28] Se conocen compuestos análogos de rutenio (III), vanadio (III), rodio (III) e iridio (III) con estructuras trinucleares. [29] El acetato de cobre (II) y el acetato de cromo (II) tienen estructuras dihidrato dinucleares, M 2 (OAc) 4 (H 2 O) 2, [30] al igual que el acetato de rodio (II) ; [31] cada uno muestra importantes interacciones de enlace metal-metal. [30] [31]
Química
[editar]Preparación
[editar]Según el Manual de compuestos inorgánicos del CRC, el triacetato de aluminio se presenta como un sólido blanco hidrosoluble y generalmente se prepara a partir de cloruro de aluminio o directamente a partir de aluminio calentándolo en una solución de ácido acético con anhídrido acético . [16]
Teóricamente, todas las sales de aluminio/acetato/hidróxido se pueden preparar a partir de hidróxido de aluminio o aluminato de sodio y ácido acético, pero la formación del triacetato sólo se produce en ausencia de agua. [5] En soluciones acuosas, el diacetato es el principal producto formado y también se produce cuando se trata cloruro de aluminio con una solución de acetato de sodio en condiciones alcalinas. [32] Las ecuaciones para estos procesos son:
Se patentó un proceso mejorado combina cloruro de aluminio y aluminato de sodio con acetato de sodio preparado in situ : [33]
Los mordientes triacetato de aluminio y sulfacetato de aluminio se preparan a partir de sulfato de aluminio, determinándose el producto formado por la cantidad añadida de acetato de plomo (II): [13]
Descomposición
[editar]Al calentarlo, el triacetato de aluminio se descompone por encima de 200°C en un proceso similar al del formiato de aluminio . [4] El proceso comienza con la pérdida de anhídrido acético entre 120 y 140°C [16] para formar una mezcla de acetatos de óxidos básicos como y , [32] que finalmente se transforman en ( alúmina ), primero como un sólido anhidro amorfo y luego a través de otras fases sólidas ( formas cristalinas γ-, δ- y θ-) para finalmente convertirse en α- polimórfico: [4]
Hidrólisis
[editar]El triacetato de aluminio se hidroliza para producir acetatos de monohidróxido y dibásicos en solución o por higroscopia : [5]
Usos
[editar]Según el Instituto Nacional del Cáncer, los acetatos de aluminio se utilizan tópicamente en humanos como agentes antisépticos. [34] Su propiedad astringente también se utiliza para tratar enfermedad de Mortellaro en animales ungulados como el ganado vacuno. El acetato de aluminio promueve la curación de la piel infectada gracias a sus propiedades antibióticas y también posee propiedades antipruriginosas y antiinflamatorias. [34] La Administración de Alimentos y Medicamentos ha aprobado su uso para el "alivio temporal de irritaciones menores de la piel debido a :' hiedra venenosa ', 'roble venenoso', ' zumaque venenoso ', 'picaduras de insectos', ' pie de atleta ' o ' erupciones causadas por jabones, detergentes, cosméticos o joyas'". [35] Para estas aplicaciones, generalmente se usan preparaciones de venta libre como la solución de Burow, [9] mientras que las formas diluidas se usan como gárgaras para afecciones como úlceras aftosas. de la boca, incluso con aditivos de aminoácidos para mejorar la palatabilidad y el gusto . El uso más común de la solución de Burow es el tratamiento de infecciones de oído [36] [8] incluida la otomicosis, aunque generalmente no es tan eficaz como el clotrimazol en las infecciones micóticas. [37] El polvo astringente tópico Domeboro contiene tetradecahidrato de sulfato de aluminio, y acetato de calcio monohidrato, , y forma una solución de acetato de aluminio similar a la solución de Burow cuando se disuelve. [38] Las soluciones de Domeboro en agua tibia se pueden usar en casos de uñas encarnadas, [39] para reducir la irritación y contener cualquier infección que pueda estar presente.
Mordiente
[editar]
Un mordiente es una sustancia utilizada para fijar tintes en telas o secciones de tejido formando un complejo de coordinación con el tinte, que posteriormente se adhiere a la tela o tejido. [41] Un mordiente suele contener un ion metálico polivalente, comúnmente aluminio o hierro, [42] como es el caso de las mezclas de triacetato de aluminio con sulfacetato de aluminio [13] o con diacetato de aluminio básico. [12] Se han utilizado mordientes de triacetato de aluminio con algodón[14], seda y , otras fibras a base de celulosa. [13] También se han combinado con acetato ferroso para producir diferentes colores. [15]

2Al(μ-OH)
2AlAz
2Ca[11]
En el caso del colorante alizarina (1,2-dihidroxi antraquinona, , se planteó la hipótesis de que el mordiente implicaba la formación de un dianión de alizarina. Esto formaría un complejo de aluminio de cinco coordenadas, , [43] que puede absorber agua para formar un hidrato con un dianión centrado en aluminio de seis coordenadas, . [44] La propuesta se basó en datos de espectroscopía infrarroja y posteriormente fue cuestionada por un trabajo que sugería una estructura con dos ligandos de hidroxilo puente que conectaban un núcleo dinuclear, Az
2Al(μ-OH)
2AlAz4−
2, con dos restos de alizarina, cada uno de los cuales quela a cada centro de aluminio. [40] La estructura fue propuesta por Soubayrol et al. basado en evidencia de espectroscopia de 27Al RMN y espectrometría de masas de ionización por electropulverización . [45] Informaron que el grado de hidratación dependía de la identidad del contraión, siendo la sal de sodio un tetrahidrato estable y un monohidrato formado a partir de hidróxido de potasio . Estos se distinguían en función de sus cambios químicos, lo que sugiere que las aguas se asocian con los centros de aluminio o los restos de alizarina, y no se comportan como es típico de las aguas de cristalización . [45]
En 1994 se informó sobre una estructura relacionada con los iones de calcio, y en ella las alizarinas se quelan con los iones de calcio para formar puentes AzCaAz entre los centros de aluminio (que también están unidos por grupos hidroxo) y los centros de aluminio se unen posteriormente a los residuos de fenol deprotonados del tinte; [11] en el modelo de Soubayrol, cada alizarina está asociada a un único catión de aluminio. [45] Al igual que ocurre con la estructura del propio acetato de aluminio, no se han resuelto las formas que adopta en las aplicaciones.
Notas
[editar]El símbolo "Ac" utilizado en estas ecuaciones no se refiere al elemento actinio. Usado de esta manera, la convención en química orgánica es que Ac se refiere al grupo acetilo, cuya forma radical es y OAc o AcO se usarían para el radical acetato, a veces también llamado "acetoxi". El ion acetato sería entonces AcO⁻, y el ácido acético sería AcOH o HOAc. Según esta convención, el triacetato de aluminio sería Al(OAc)3. Sin embargo, las publicaciones en geoquímica utilizan Ac para referirse a acetato en lugar de acetilo y, por lo tanto, AlAc+2 en geoquímica se escribiría según las convenciones químicas más habituales como [Al(OAc)2]⁺ o [Al(CH3CO2)2]⁺.
Referencias
[editar][[Categoría:Fármacos dermatológicos]] [[Categoría:Acetatos]] [[Categoría:Compuestos de aluminio]] [[Categoría:Wikipedia:Páginas con traducciones sin revisar]]
- ↑ Número CAS
- ↑ a b International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005. RSC Publishing. ISBN 0854044388.
- ↑ Perry, Dale L.; Phillips, Sidney L., eds. (1995). Handbook of Inorganic Compounds [Manual de compuestos inorgánicos] (en inglés). CRC Press. p. 3. ISBN 9780849386718.
- ↑ a b c Sato, Taichi; Ikoma, Shuji; Ozawa, Fusaji (1984). «Thermal decomposition of organic basic aluminium salts—formate and acetate». Thermochim. Acta 75 (1–2): 129-137. doi:10.1016/0040-6031(84)85013-3.
- ↑ a b c d e Daintith, John, ed. (2008). «Aluminium ethanoate (aluminium acetate)». A Dictionary of Chemistry (6th edición). Oxford University Press. ISBN 9780191726569.
- ↑ «NCI Thesaurus». ncit.nci.nih.gov. Consultado el 22 de julio de 2024.
- ↑ Thorp, M. A.; Kruger, J.; Oliver, S.; Nilssen, E. L. K.; Prescott, C. a. J. (1998-10). «The antibacterial activity of acetic acid and Burow's solution as topical otological preparations». The Journal of Laryngology & Otology (en inglés) 112 (10): 925-928. ISSN 1748-5460. doi:10.1017/S0022215100142100. Consultado el 22 de julio de 2024.
- ↑ a b Kashiwamura, Masaaki; Chida, Eiji; Matsumura, Michiya; Nakamaru, Yuuji; Suda, Noriyuki; Terayama, Yoshihiko; Fukuda, Satoshi (2004). «The Efficacy of Burow's Solution as an Ear Preparation for the Treatment of Chronic Ear Infections». Otol. Neurotol. 25 (1): 9-13. PMID 14724484. doi:10.1097/00129492-200401000-00002.
- ↑ a b «Acetic acid / aluminum acetate solution». Drugs.com. 3 November 2016. Consultado el 23 November 2016.
- ↑ Morelli, Joseph P.; Fernandes, Jeffrey R.; Verkaar, Edward L. C.; Vogt, Petra (22 de abril de 2014). «Use of metal astringents for the treatment of hairy heel warts» [Uso de astringentes metálicos para el tratamiento de las verrugas pilosas del talón]. US8703104B2 (en inglés) (Estados Unidos). US8703104B2.
- ↑ a b c Wunderlich, Christian-Heinrich; Bergerhoff, Günter (1994). «Konstitution und Farbe von Alizarin- und Purpurin-Farblacken» [Constitución y color de las lacas de Alizarina y Purpurina]. Chem. Ber. (en alemán) 127 (7): 1185-1190. doi:10.1002/cber.19941270703.
- ↑ a b Haar, Sherry; Schrader, Erica; Gatewood, Barbara M. (2013). «Comparison of aluminum mordants on the colorfastness of natural dyes on cotton». Cloth. & Textiles Res. J. 31 (2): 97-108. doi:10.1177/0887302X13480846.
- ↑ a b c d e Georgievics, Von (2013). The Chemical Technology of Textile Fibres – Their Origin, Structure, Preparation, Washing, Bleaching, Dyeing, Printing and Dressing. Read Books. ISBN 9781447486121.
- ↑ a b Brown, Donna; de Souza, Diane; Ellis, Catharine (2010). «How to Mordant Cotton—let me count the ways». Turkey Red Journal 15 (2). Archivado desde el original el 27 de febrero de 2021. Consultado el 23 de noviembre de 2016.
- ↑ a b Ellis, Catharine (2016). «Transformative Processes». The Weaver's Studio Woven Shibori. F+W Media, Inc. pp. 83-84. ISBN 9781632503541.
- ↑ a b c Perry, Dale L.; Phillips, Sidney L., eds. (1995). Handbook of Inorganic Compounds. CRC Press. p. 3. ISBN 9780849386718.
- ↑ Wesolowski, D. J.; Blencoe, J. G.; Cole, D. R.; Bell, J. L. S.; Palmer, D. A. (1992). «Geochemistry of Crustal Processes to High Temperatures and Pressures». Summaries of FY 92 Geosciences Research. United States Department of Energy. pp. 38-44.
- ↑ AlAc
- ↑ Myerson, Allan S.; Ginde, Rajiv (2002). «Crystals, Crystal Growth, and Nucleation». En Myerson, Allan S., ed. Handbook of Industrial Crystallization (2nd edición). Butterworth-Heinemann. p. 37. ISBN 9780080533513.
- ↑ Alcock, Nathaniel W.; Tracy, Valerie M.; Waddington, Thomas C. (1976). «Acetates and acetato-complexes. Part 2. Spectroscopic studies». J. Chem. Soc., Dalton Trans. 1976 (21): 2243-2246. doi:10.1039/DT9760002243.
- ↑ Daintith, John, ed. (2008). «ALuminium chloride». A Dictionary of Chemistry (6th edición). Oxford University Press. ISBN 9780191726569.
- ↑ Kubicki, J. D.; Sykes, D.; Apitz, S. E. (1999). «Ab Initio Calculation of Aqueous Aluminum and Aluminum−Carboxylate Complex Energetics and 27Al NMR Chemical Shifts». J. Phys. Chem. A 103 (7): 903-915. Bibcode:1999JPCA..103..903K. doi:10.1021/jp983462w.
- ↑ Thomas, Fabien; Masion, Armand; Bottero, Jean Yves; Rouiller, James; Genevrier, Francine; Boudot, Denis (1991). «Aluminum(III) Speciation with Acetate and Oxalate. A Potentiometric and 27Al NMR Study». Environ. Sci. Technol. 25 (9): 1553-1559. doi:10.1021/es00021a004.
- ↑ Bi, Shuping; Wang, Chenyi; Cao, Qing; Zhang, Caihua (2004). «Studies on the mechanism of hydrolysis and polymerization of aluminum salts in aqueous solution: correlations between the "Core-links" model and "Cage-like" Keggin-Al13 model». Coord. Chem. Rev. 248 (5–6): 441-455. doi:10.1016/j.ccr.2003.11.001.
- ↑ Weinland, R.; Dinkelacker, P. (1909). «Über Salze einer Hexaacetato(formiato)-trichrombase. II». Ber. Dtsch. Chem. Ges. (en alemán) 42 (3): 2997-3018. doi:10.1002/cber.19090420318.
- ↑ Figgis, B. N.; Robertson, G. B. (1965). «Crystal-Molecular Structure and Magnetic Properties of Cr3(CH3.COO)6OCl.5H2O». Nature 205 (4972): 694-695. Bibcode:1965Natur.205..694F. doi:10.1038/205694a0.
- ↑ Burgess, J.; Twigg, M. V. (2005). King, R. Bruce, ed. Encyclopedia of Inorganic Chemistry (10th edición). Wiley. ISBN 9780470860786.
- ↑ «Chromium(III) Acetate Hydroxide». chemicalbook.com. The chemical book. 2016. Consultado el 18 November 2016.
- ↑ Catterick, Janet; Thornton, Peter (1977). «Structures and Physical Properties of Polynuclear Carboxylates». En Emeléus, H. J.; Sharpe, A. G., eds. Advances in Inorganic Chemistry and Radiochemistry 20. Academic Press. pp. 291-362. ISBN 9780080578699.
- ↑ a b Van Niekerk, J. N.; Schoening, F. R. L. (1953). «X-Ray Evidence for Metal-to-Metal Bonds in Cupric and Chromous Acetate». Nature 171 (4340): 36-37. Bibcode:1953Natur.171...36V. doi:10.1038/171036a0.
- ↑ a b Cotton, F. A.; Deboer, B. G.; Laprade, M. D.; Pipal, J. R.; Ucko, D. A. (1971). «The crystal and molecular structures of dichromium tetraacetate dihydrate and dirhodium tetraacetate dihydrate». Acta Crystallogr. B 27 (8): 1664. Bibcode:1971AcCrB..27.1664C. doi:10.1107/S0567740871004527.
- ↑ a b Wade, K.; Banister, A. J. (1973). «The Chemistry of Aluminium, Gallium, Indium and Thallium». En Bailar, J. C.; Emeléus, H. J., eds. Comprehensive Inorganic Chemistry. Elsevier. p. 1047. ISBN 9781483153223.
- ↑ Jerome, James E.; Glenda L. Fleming & Joel H. Swinson, "Process for producing aluminum diacetate monobasic", {{{country-code}}} {{{patent-number}}}.
- ↑ a b «Aluminum Acetate (Code C47387)». National Cancer Institute thesaurus (NCIt). October 31, 2016. Archivado desde el original el December 16, 2016. Consultado el November 15, 2016.
- ↑ Food and Drug Administration (April 1, 2016). «Part 347 – Skin Protectant Drug Products for Over-The-Counter Human Use». CFR – Code of Federal Regulations Title 21. United States Department of Health and Human Services. Consultado el November 15, 2016.
- ↑ Thorp, M. A.; Kruger, J.; Oliver, S.; Nilssen, E. L. K.; Prescott, C. A. J. (1998). «The antibacterial activity of acetic acid and Burow's solution as topical otological preparations». J. Laryng. Otol. 112 (10): 925-928. PMID 10211213. doi:10.1017/S0022215100142100.
- ↑ Munguia, Raymundo; Daniel, Sam J. (2008). «Ototopical antifungals and otomycosis: A review». Int. J. Ped. Otorhinolaryng. 72 (4): 453-459. PMID 18279975. doi:10.1016/j.ijporl.2007.12.005.
- ↑ «Domeboro – aluminum sulfate tetradecahydrate, calcium acetate monohydrate powder, for solution». DailyMed. U.S. National Library of Medicine. 12 de mayo de 2016. Consultado el 23 November 2016.
- ↑ Simon, Harvey (31 January 2013). «Ingrown Toenails». The New York Times. Consultado el 23 November 2016.
- ↑ a b Atta-ur-Rahman (2002). «Rubia tinctorum L». Bioactive Natural Products (Part G). Studies in Natural Products Chemistry 26. Elsevier. pp. 629-684. ISBN 9780080542065.
- ↑ Unión Internacional de Química Pura y Aplicada. «mordant». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Llewellyn, Bryan D. (May 2005). «Stain Theory – How mordants work». Archivado desde el original el 14 August 2007.
- ↑ Kiel, E. G.; Heertjes, P. M. (1965). «Metal Complexes of Alizarin V—Investigations of Alizarin–dyed Cotton Fabrics». Coloration Technology 81 (3): 98-102. doi:10.1111/j.1478-4408.1965.tb02647.x.
- ↑ Kiel, E. G.; Heertjes, P. M. (1963). «Metal Complexes of Alizarin I—The Structure of the Calcium–Aluminium Lake of Alizarin». Coloration Technology 79: 21-27. doi:10.1111/j.1478-4408.1963.tb02507.x.
- ↑ a b c Soubayrol, Patrick; Dana, Gilbert; Man, Pascal P. (1996). «Aluminium-27 Solid-State NMR Study of Aluminium Coordination Complexes of Alizarin» [Estudio de RMN de estado sólido de aluminio-27 de complejos de coordinación de aluminio y alizarina]. Magnetic Resonance in Chemistry (en inglés) 34 (8): 638-645. doi:10.1002/(SICI)1097-458X(199608)34:8<638::AID-OMR926>3.0.CO;2-5.












![{\displaystyle {\ce {[Al(H2O)6]^{3+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4fdfe36416f07ff880304b5568c372af9f42087)

















![{\displaystyle {\ce {[Al(H2O)6]2(SO4)3 * 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59adbd7ab5d68220ab89dfc34df1c776d2dd777c)

![{\displaystyle {\ce {Ca[Al(H2O)(OH)Az2]*2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a006f2061e00199514c1ac548aaad92605e61cc1)



