Tetraciclina
| Tetraciclina | ||
|---|---|---|
 | ||
| Nombre (IUPAC) sistemático | ||
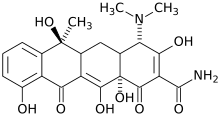
| (2Z,4S,4aS,5aS,12aS)-2-(amino-hydroxymethylidene)-4-dimethylamino-6,10,11,12a-tetrahydroxy-6-methyl-4,4a,5,5a-tetrahydrotetracene-1,3,12-trione | ||
| Identificadores | ||
| Número CAS | 60-54-8 | |
| Código ATC | J01AA07 | |
| PubChem | 5497101 | |
| DrugBank | DB00759 | |
| ChEBI | 27902 | |
| Datos químicos | ||
| Fórmula | C22H24N2O 8 | |
| Peso mol. | 444.4 g/mol | |
| Farmacocinética | ||
| Vida media | 6 - 11 horas | |
| Excreción | Fecal y renal | |
Las tetraciclinas constituyen un grupo de antibióticos, unos naturales y otros obtenidos por semisíntesis, que abarcan un amplio espectro en su actividad antimicrobiana. Químicamente son derivados de la naftacenocarboxamida policíclica, con un núcleo tetracíclico del que deriva el nombre del grupo.
Las tetraciclinas naturales se extraen de las bacterias del género Actinomyces. De Streptomyces aurofaciens se extraen la clortetraciclina y la demetilclortetraciclina, de Streptomyces rimosus se extrae la oxitetraciclina, y la tetraciclina, representante genérico del grupo, se puede extraer del Streptomyces viridifaciens, aunque también se puede obtener de forma semisintética. Una característica común al grupo es su carácter anfotérico, que le permite formar sales tanto con ácidos como con bases, utilizándose usualmente los clorhidratos solubles.
Presentan fluorescencia a la luz ultravioleta y tienen la capacidad de quelar metales di o trivalentes, como el calcio, manganeso, o magnesio.[1]
Es uno de los antibacterianos más experimentados. Ya en 1953, se recoge la aprobación de su nomenclatura en la farmacopea británica.[2] Su uso se extendió rápidamente, de manera que ya en 1955 se hablaba de cepas resistentes a la tetraciclina y la clortetraciclina.[3] A finales del año 2008, PubMed recoge más de 14 000 artículos sobre estos antibióticos.
Farmacocinética
[editar]Las tetraciclinas se absorben de forma rápida y completa a nivel de tubo digestivo, fundamentalmente en el intestino delgado, y alcanzan su máxima concentración en la sangre en un plazo de entre tres y seis horas. De manera parenteral se absorben de forma óptima, destacando la rolitetraciclina.
Su unión a proteínas plasmáticas es muy variable: desde el 20 % de la oxitetraciclina al 90 % de la doxiciclina.
Se distribuyen por todos los tejidos, especialmente en el tejido óseo, y penetran en el interior de las células. Atraviesan la barrera placentaria, y también la hematoencefálica, pero sin llegar a alcanzar concentraciones terapéuticas en el líquido cefalorraquídeo. Consecuencia de estas dos propiedades es su contraindicación en el embarazo.
Se metabolizan en todo el organismo de forma parcial, eliminándose la mayor parte en forma inalterada por orina. Debido a su alta concentración en la bilis presentan un fenómeno de recirculación entero-hepática, pudiendo ser encontradas parcialmente excretadas en las heces.
A nivel renal presentan fenómenos de reabsorción tubular más o menos intensos en función del tipo de tetraciclina, lo que explica las diferencias respecto a la vida media dentro del grupo. La clortetraciclina es la de vida media más corta (unas 5 horas), mientras que la doxiciclina tiene más de 15.
Mecanismo de acción
[editar]Actúan fundamentalmente como bacteriostáticos a las dosis habituales, aunque resultan bactericidas a altas dosis, generalmente tóxicas. Actúan por varios mecanismos:
- Desacoplan la fosforilación oxidativa de las bacterias.
- Provocan una inhibición de la síntesis proteica en el ribosoma de la bacteria. Actúan inhibiendo la síntesis proteica al unirse a la subunidad 30 S del ribosoma y no permitir la unión del ácido ribonucleico de Transferencia (tRNA) a este, ni el transporte de aminoácidos hasta la subunidad 50 S.[1]
- Existe también evidencia preliminar que sugiere que las tetraciclinas alteran la membrana citoplasmática de organismos susceptibles, permitiendo la salida de componentes intracelulares.[4]
Las resistencias bacterianas a las tetraciclinas son de aparición lenta, aunque mucho más rápida si se utiliza por vía tópica. Entre los mecanismos bacterianos implicados se encuentran el bombeo activo del antibiótico al exterior, o la síntesis de una proteína protectora que separa al antibiótico del ribosoma permitiéndole continuar con la síntesis proteica. Cualquiera de estos genes puede estar presente en un plásmido, lo que explica la reticencia a usar las tetraciclinas en el ámbito hospitalario para evitar la aparición de resistencias simultáneas a varios antibióticos. Existen resistencias cruzadas entre los miembros del grupo.[5]
Indicaciones
[editar]- Bacterias grampositivas: Streptococcus, Diplococcus, Clostridium.
- Bacterias gramnegativas: Neisseria, Brucellas, Haemophilus, Shigella, Escherichia coli, Bordetella, Klebsiella, Vibrio y Pasteurella.
- Espiroquetas.
- Algunos protozoos: Entamoeba.
- Actinomyces.
- Rickettsia.
Este espectro explica su utilización en las siguientes patologías, entre otras:
- Infecciones de la piel: acné, rosácea.
- Infecciones urogenitales: gonococia, sífilis.
- Infecciones gastrointestinales: disentería, cólera, amebiasis, úlcera gástrica, infecciones periodontales.
- Infecciones respiratorias: faringoamigdalitis, bronquitis y algunas formas de neumonía atípica.
- Otras infecciones: Fiebre recurrente, fiebre Q, tifus exantemático, tifus endémico, actinomicosis, brucelosis.
Hay que tener en cuenta que aunque in vitro su actividad es más amplia, in vivo nos encontramos con otros muchos antibióticos que pueden resultar más efectivos o con menos efectos adversos que las tetraciclinas, por lo que éstas quedan relegadas a antibiótico de segunda elección, cuando fallan los de primera elección.
Contraindicaciones
[editar]- El uso de tetraciclinas durante el desarrollo dental (segunda mitad del embarazo, lactancia y niños menores de 8 años), puede causar decoloración permanente de los dientes (de gris parduzco a amarillento). Aunque esta reacción adversa es más frecuente con el uso durante períodos prolongados, también se ha observado tras la administración de tratamientos cortos repetidos.[6]
- En caso de alergia a tetraciclinas (doxiciclina, minociclina, oxitetraciclina, tetraciclina).
- Las tetraciclinas deben evitarse en pacientes con lupus eritematoso sistémico.
- No se deben ingerir con leche ya que se inactivan.
- NO se deben tomar conjunto a retinoides orales (Roaccutane® o similares) ya que existe el riesgo de formación de tumores intracraneales benignos.
Reacciones adversas
[editar]En el siguiente listado se recogen tan sólo las reacciones adversas descritas con una frecuencia superior al 0.1 % (>1/1000). Están descritas otras numerosas reacciones que se presentan con una frecuencia inferior (<1/1000; menor del 0.1 %).[6]
| Órgano afectado. | Criterio CIOMS. | Tipo de reacción adversa. |
| Pruebas de Laboratorio. | Infrecuentes. | aumentos en los niveles de urea en sangre |
| Trastornos de la sangre. | Infrecuentes. | anemia hemolítica, trombocitopenia, neutropenia y eosinofilia. |
| Trastornos del sistema nervioso. | Infrecuentes. | Dolor de cabeza |
| Trastornos gastrointestinales. | Infrecuentes. | Glosodinia , náuseas y vómitos , faringitis aguda ; gastroenteritis y colitis no infecciosa, estomatitis. |
| Trastornos de la piel. | Infrecuentes. | Rash maculopapular y eritematoso. Fotosensibilidad. |
| Otros. | Muy frecuentes. | hipersensibilidad dental (al calor). |
Clasificación
[editar]Siguiendo las directrices de la Clasificación ATC, los antibióticos que componen el grupo de las tetraciclinas serían:
| J01A Tetraciclinas[7] | ||
| J01AA Tetraciclinas. | J01AA01 Demeclociclina.
J01AA02 Doxiciclina. J01AA03 Clortetraciclina. J01AA04. J01AA05 Metaciclina. J01AA06 Oxitetraciclina. J01AA07 Tetraciclina. J01AA08 Minociclina. J01AA09 Rolitetraciclina. J01AA10 Penimepiciclina. J01AA11 Clomociclina. J01AA12 J01AA20 Combinaciones de tetraciclinas. J01AA56 Oxitetraciclina, combinaciones. | |
Degradación
[editar]Algunos de los tratamientos realizados son los siguientes:
- Absorción y disipación: se han realizado estudios sobre la absorción y disipación de las tetraciclinas en el suelo, en el compost de estiércol porcino y en mezclas suelo/compost con distintas cantidades de carbono orgánico. Se llevaron a cabo distintos tratamientos, y en todos ellos las tetraciclinas se absorbían fuertemente al estiércol debido a su alto contenido en carbono orgánico. En una mezcla suelo/estiércol tratada a 25 °C (grados Celsius) y a oscuras, se observó que las tetraciclinas se degradan un 50 % después de 20 o 41 días; y un 90 % entre 68 y 137 días. Si no hay compost en el suelo, la disipación es muy lenta.
- Ozonización: Con este método se obtienen muy buenos resultados si se trabaja a pH altos. En un estudio realizado, la tetraciclina (20 mg/L) fue degradada completamente después de 5 minutos de ozonización, aunque para disminuir el carbono orgánico total se necesitaron 40 minutos. Esto sugiere que la ozonización no mineraliza a la tetraciclina.
- Fotodegradación en solución acuosa utilizando radiación UV y procesos de oxidación UV/H2O2: los resultados obtenidos en este estudio muestran que las tasas de degradación dependen de la concentración inicial de antibiótico y del pH. Si en esta técnica solamente se utilizara la radiación UV sería un proceso muy lento, pero, al combinar UV/H2O2, se obtiene una degradación más rápida, se disminuye la concentración de carbono orgánico total y disminuye la toxicidad de los productos de oxidación de la tetraciclina.
- Fotodegradación en agua en presencia de un complejo hierro/oxalato: utilizando luz UV-vis y un complejo de Fe(III)/oxalato, se puede conseguir la degradación total de la tetraciclina, después de 15 minutos de tratamiento. Para que esto ocurra hay que controlar la fuente de luz, la relación Fe/oxalato y el pH.
- Irradiación con un haz de electrones: este experimento se llevó a cabo en una muestra de estiércol de cerdo. Los resultados obtenidos de la eficiencia de degradación de la tetraciclina fueron: 42.77 % a 1 kGy, 64.20 % a 3 kGy, 77.83 % a 5 kGy, y 90.50 % a 10 kGy.
Metabolismo
[editar]Las tetraciclinas se pueden utilizar para inhibir las metaloproteasas de matriz (MMPs). Las MMPs están presentes en tumores y metástasis, así como en procesos inflamatorios. Numerosos estudios han demostrados que los derivados de las tetraciclinas inhiben la actividad de ciertas MMPs, no de todas. Así que se pueden usar para la inhibición de metástasis y en particular para la angiogénesis. Aunque todavía no se conocen muy bien los mecanismos por los cuales las tetraciclinas actúan sobre la angiogénesis, sus efectos están demostrados, por lo que se podrían utilizar estas sustancias en el tratamiento del cáncer.
Otra característica de las tetraciclinas es que reducen la inflamación en procesos neurológicos, afecciones óseas, cardíacas y de las vías aéreas, etc.
Incidencia ambiental
[editar]El impacto de los antibióticos en el medio ambiente es un tema poco conocido y por tanto está en estudio. Tanto los residuos de antibióticos, como las bacterias resistentes a ellos, son un problema en el medio ambiente y suponen un riesgo para la salud humana.
Se están realizando diversos estudios centrándose en el uso de antibióticos en la alimentación animal, ya que una gran parte de esos antibióticos se excreta en la orina o estiércol, y una vez que ocurre esto, los antibióticos van a parar al suelo o a las aguas (subterráneas o superficiales).[8]
Presencia en restos de poblaciones antiguas
[editar]Un equipo dirigido por George Armelagos descubrió la presencia de elevadas cantidades de tetraciclina en huesos humanos de Nubia datados en los años 350-550, lo que indicaba un consumo crónico de este antibiótico. Al analizar recetas contemporáneas para la elaboración de la cerveza, comprobó que su proceso de fermentación podría ser la fuente más plausible.[9]
Véase también
[editar]Referencias
[editar]- ↑ a b Lorenzo Velázquez et al.: Farmacología y su proyección a la clínica. 13.ª ed. Ed. Oteo. 1976, pp. 966s {ISBN 84-85152-05-0}.
- ↑ Approved Names. Br Med J. 1954 February 20; 1(4859): 451.
- ↑ Jackson, R. The Systemic Use of Antibiotics in Dermatology Can Med Assoc J. 1956 February 15; 74(4): 301.
- ↑ Pontificia Universidad Javeriana, Bogotá. Macrolidos, Cloramfenicol, Clindamicina y Tetraciclinas (en español). Último acceso: 14 de octubre de 2008.
- ↑ Drobnic, L., Salvá, J.A.,Curso sobre antibioticoterapia. Ruan, S.A. 1980, pp. 225s.
- ↑ a b Agencia española de medicamentos y productos sanitarios. Información de prospectos autorizados. Enlace consultado el 15 de septiembre de 2008.
- ↑ Véase Índice ATC-2008 para las Tetraciclinas, de la página web del WHO Collaborating Centre for Drug Statistics Methodology del Instituto Noruego de Salud Pública (enlace consultado el 15 de septiembre de 2008).
- ↑ Mathers, Jeremy J; Sondra C Flick, L Anthony, Jr Cox (2011-07). «Longer-duration uses of tetracyclines and penicillins in U.S. food-producing animals: Indications and microbiologic effects». Environment International 37 (5): 991-1004. ISSN 1873-6750. doi:10.1016/j.envint.2011.01.014. Consultado el 22 de septiembre de 2011.
- ↑ Nelson, Mark L.; Andrew Dinardo, Jeffery Hochberg, George J. Armelagos (2010-09). «Brief communication: Mass spectroscopic characterization of tetracycline in the skeletal remains of an ancient population from Sudanese Nubia 350-550 CE». American Journal of Physical Anthropology 143: 151-154. ISSN 0002-9483. doi:10.1002/ajpa.21340. Consultado el 22 de septiembre de 2011.
