Diferencia entre revisiones de «Vidrio»
m Revertidos los cambios de 213.98.48.196 (disc.) a la última edición de InternetArchiveBot Etiqueta: Reversión |
Sin resumen de edición Etiquetas: Revertido Edición desde móvil Edición vía web móvil |
||
| Línea 5: | Línea 5: | ||
|fecha=1996|editorial=Reverte|isbn=9788429114355|idioma=es}}</ref> |
|fecha=1996|editorial=Reverte|isbn=9788429114355|idioma=es}}</ref> |
||
En algunos países de habla hispana, el término «[[cristal]]» es utilizado frecuentemente como sinónimo de vidrio, aunque en rigor es incorrecto debido a que el vidrio es un [[sólido amorfo]] (sus moléculas están dispuestas de forma irregular) y no un [[sólido cristalino]].<ref name=NEBOT>{{cita libro|apellidos1=I. Nebot-Díaz|título=Nuevas tecnologías para el sector cerámico de Castellón: desarrollo de esmaltes vitrocristalinos y vitrocerámicos|fecha=2001|editorial=Publicacions de la Universitat Jaume I|isbn=9788480213349|páginas=31 de 100|url=https://books.google.es/books?id=bLanLmwiAukC&pg=PA31|fechaacceso=8 de noviembre de 2017|idioma=es}}</ref> |
En algunos países de habla hispana, el término «[[cristal]]» es utilizado frecuentemente como sinónimo de vidrio, aunque en rigor es incorrecto debido a que el vidrio es un [[sólido amorfo]] (sus moléculas están dispuestas de forma irregular) y no un [[sólido cristalino]].No obstante todo esto es tan falso como mi novia.<ref name=NEBOT>{{cita libro|apellidos1=I. Nebot-Díaz|título=Nuevas tecnologías para el sector cerámico de Castellón: desarrollo de esmaltes vitrocristalinos y vitrocerámicos|fecha=2001|editorial=Publicacions de la Universitat Jaume I|isbn=9788480213349|páginas=31 de 100|url=https://books.google.es/books?id=bLanLmwiAukC&pg=PA31|fechaacceso=8 de noviembre de 2017|idioma=es}}</ref> |
||
[[Archivo:Colorful bottle.jpg|miniatura|Botella de vidrio coloreado.]] |
[[Archivo:Colorful bottle.jpg|miniatura|Botella de vidrio coloreado.]] |
||
Revisión del 07:32 24 abr 2023
El vidrio es un material inorgánico duro, frágil, transparente y amorfo que se encuentra en la naturaleza, aunque también puede ser producido por el ser humano.[1] El vidrio artificial se usa para hacer ventanas, lentes, botellas y una gran variedad de productos. El vidrio es un tipo de material cerámico amorfo.
El vidrio se obtiene a unos 1500 °C a partir de arena de sílice (SiO2), carbonato de sodio (Na2CO3) y caliza (CaCO3).[2]
En algunos países de habla hispana, el término «cristal» es utilizado frecuentemente como sinónimo de vidrio, aunque en rigor es incorrecto debido a que el vidrio es un sólido amorfo (sus moléculas están dispuestas de forma irregular) y no un sólido cristalino.No obstante todo esto es tan falso como mi novia.[3]



Historia
El vidrio en la antigüedad

El vidrio se puede encontrar de manera natural en forma de obsidiana, que se produce cuando lava volcánica con alto contenido en sílice se enfría rápidamente, de manera que no se formen cristales. La obsidiana se utilizó desde la prehistoria principalmente para fabricar objetos cortantes debido a que al fracturarse forma bordes afilados, con los primeros indicios en el actual Kurdistán hacia el 12.500 a. C.
Plinio el Viejo (siglo I), en su Historia Natural, cuenta que el vidrio fue descubierto a orillas del río Belus, en Fenicia, cuya arena, por su gran pureza y alto contenido en sílice fue utilizada durante toda la antigüedad para la producción de vidrio. La leyenda fue posteriormente relatada por el alquimista Georg Bauer en su tratado De re metallica:[4]
Unos mercaderes que se dirigían hacia Egipto para vender nitro (nitrato potásico, KNO3), se detuvieron para cenar. Como no había piedras para colocar sus ollas, decidieron utilizar algunos trozos del mineral. Calentaron sus alimentos, comieron y se dispusieron a dormir. A la mañana siguiente vieron asombrados que las piedras se habían fundido y habían reaccionado con la arena para producir un material duro y brillante, el vidrio.
En realidad, el hombre aprendió a fabricar el vidrio muchísimo tiempo antes, probablemente a partir de la experimentación con esmaltes cerámicos o de las escorias residuales de la fundición metalúrgica. Los primeros ejemplos se han hallado en Egipto y la costa del actual Líbano hacia el 2500 a. C. en forma de cuentas de collar o abalorios y ocasionalmente recipientes y lingotes. Se cree que la elaboración del vidrio se mantenía como un secreto reservado a las áreas de producción, los artesanos de otras zonas debían limitarse a comprar lingotes para elaborar sus piezas. El vidrio fabricado durante este período no era transparente y trataba de imitar el aspecto de piedras semipreciosas. En las tumbas del periodo predinástico de Egipto, en las culturas Naqada (3500-3200 a. C.).[5] se encuentran con frecuencia cuentas de collares y restos de cerámica elaborados con fayenza. Aunque no vidrio propiamente dicho, la fayenza es un tipo de cerámica rica en cuarzo que muestra un acabado brillante debido a la vitrificación de su superficie.

Es probable que fueran artesanos asiáticos los que establecieron la manufactura del vidrio en Egipto, de donde proceden las primeras vasijas producidas durante el reinado de Tutmosis III (1504-1450 a. C.). La fabricación del vidrio floreció en Egipto y Mesopotamia hasta el 1200 a. C. y posteriormente cesó casi por completo hasta el siglo IX a. C. cuando se retomó la producción tras desarrollarse técnicas para crear vidrio transparente. Egipto produjo un vidrio claro, que contenía sílice pura y como elemento alcalino usaban natrón (carbonato sódico hidratado: Na2CO3·10H2O) extraído de depósitos minerales o carbonato sódico obtenido por la calcinación de diversas plantas, especialmente las que crecen en aguas salobres. Lo coloreaban de azul y verde. Durante la época helenística Egipto se convirtió en el principal proveedor de objetos de vidrio de las cortes reales. En este periodo se desarrollaron nuevas técnicas de fabricación como el uso de moldes para crear relieves y el millefiori, en la que fragmentos de barras de vidrio de colores se fusionan para formar patrones semejantes a mosaicos.
Sin embargo, fue en las costas fenicias donde se desarrolló el importante descubrimiento del vidrio soplado en el siglo I a. C. Anteriormente los recipientes se creaban de forma muy laboriosa, el vidrio fundido se extendía en cordones sobre un núcleo central de arcilla y arena que le servía de molde. Una vez enfriado se retiraba el molde y la pieza se acababa de formar con técnicas de pulido semejantes a las usadas para la piedra.

Durante la época romana la manufactura del vidrio se extendió por el Imperio, desde Roma hasta Alemania. La producción del vidrio en bruto se realizaba frecuentemente en lugares diferentes de donde se trabajaba. En esta época se descubrió que añadiendo óxido de manganeso se podía aclarar el vidrio[6] y también desarrollaron el reciclaje de la cristalería romana.[7] De los romanos también proviene el nombre en español, pues la coloración natural del vidrio era de color verde, nombre que se pronunciaba como viride, o viridus; de ahí el nombre viridio o vidrio.[8] Estos avances hicieron que a partir del siglo I se desarrollara la industria a gran escala, especialmente en Alejandría, convirtiéndose el vidrio en un producto mucho más asequible y generalizado que en épocas anteriores.
En la India, el vidrio más antiguo que se ha hallado es una cuenta de color rojo que se remonta al siglo XVIII a. C., durante la civilización del Valle del Indo. Se ha hallado vidrio de épocas posteriores pero no es hasta el siglo III a. C. que se encuentra en cantidades apreciables, y su uso se generalizó a partir del siglo I d. C.
En la antigua China el vidrio llegó hacia el periodo de las Primaveras y Otoños, en la forma de piezas importadas de Asia Central. Posteriormente hay evidencia arqueológica de producción de cuentas de vidrio en el periodo de los Reinos Combatientes, hacia principios del siglo V a. C. Posteriormente, en época Han (206 a. C.-220 d. C.) la producción se hizo más diversa para decaer posteriormente y resurgir hacia el siglo V. La composición del vidrio chino de este periodo es muy diferente de la del resto del mundo, con una formulación a base de óxido de bario y plomo. La proporción de BaO es de un 5-15 %, se ha especulado que este material aportaba una turbidez al vidrio que le hacía asemejarse al jade. El vidrio permaneció como un producto secundario durante toda la historia de China, muy por detrás de la porcelana y otros materiales más apreciados.
El vidrio en la Edad Media
El vidrio en los países islámicos, entre los siglos VIII y XIV, tuvo su auge en el Oriente Próximo. La antigua tradición Sasánida de tallado del vidrio fue continuada por los artesanos musulmanes que realizaron vasijas decoradas en altorrelieve, muchas con motivos animales, y con vidrio incoloro de gran calidad con diseños tallados a la rueda. La técnica de esmaltado al fuego y la del dorado incrementaron las posibilidades decorativas, destacando los artesanos vidrieros de Alepo y Damasco. De Egipto proviene el descubrimiento de coloraciones vidriadas con brillantes efectos metálicos, tanto en cerámica como en vidrio. Las lámparas de las mezquitas y otras vasijas de uso cotidiano se pintaron con motivos geométricos propios del islam. Sus formas y decoraciones influyeron en la producción occidental posterior, destacando las de Venecia y España.
En el norte de Europa y Gran Bretaña continuaron produciendo objetos utilitarios de vidrio. El vidrio común tipo Waldglas (del alemán, ‘vidrio del bosque’) continuó fabricándose en Europa hasta la era moderna. Sin embargo, la producción más importante en este material durante la edad media fueron los mosaicos de vidrio en la Europa mediterránea y las vidrieras en la zona del norte. Los mosaicos se hacían con teselas de vidrio, que se cortaban de bloques de vidrio. En documentos del siglo VI se hace referencia a vidrieras en las iglesias, aunque los primeros ejemplares conservados datan del siglo XI. Las más apreciadas se elaboraron durante los siglos XIII y XIV, principalmente en Francia e Inglaterra. El vidrio se coloreaba o se laminaba ya coloreado añadiendo óxidos metálicos a la mezcla, y después se cortaba. Los detalles se pintaban sobre el cristal con un esmalte. Las piezas se sujetaban con una red de plomo conocida como emplomado.[9] El arte de la fabricación de vidrieras decayó a finales del renacimiento aunque volvió a recuperarse en el siglo XIX.
Del renacimiento al siglo XVIII
- El vidrio veneciano
El «vidrio veneciano» más antiguo conocido data del siglo XV, aunque el vidrio ya se fabricaba en Venecia desde el siglo X. Con centro en la isla de Murano, los venecianos dominaron el mercado europeo hasta el año 1700. La contribución más importante fue la elaboración de un vidrio sódico duro y refinado muy dúctil. Conocido como «cristallo», era incoloro, de gran transparencia, muy semejante al cristal de roca.[10] También se hacían en cristal coloreado y opaco. Hacia finales del siglo XVI las vasijas se hicieron más ligeras y delicadas. Desarrollaron un tipo de filigrana de vidrio que sería muy imitada. Consistía en incorporar hebras de vidrio blanco opaco dentro de un cristal transparente, que producía el efecto de un encaje.
También en Murano surgieron muchos estilos diferentes para lámparas de cristal, aunque fue la factoría de Nevers, en Francia, la que adquirió mayor fama durante el siglo XVII. La práctica del grabado al diamante, técnica de los artesanos holandeses del siglo XVII, lograba elaborados diseños.
Los fabricantes de vidrio de Europa intentaron copiar las técnicas y decoraciones de los venecianos. La información se difundió con el libro El arte del vidrio (1612) de Antonio Neri, y también por los sopladores de vidrio venecianos, pues aunque una ley prohibía a los artesanos vidrieros abandonar Venecia y divulgar los secretos de su arte, muchos se instalaron en otros países europeos. Cada país desarrolló sus imitaciones. La influencia italiana declinó en el siglo XVII, al surgir en Alemania e Inglaterra nuevos métodos para la fabricación de vidrio.
Estado vítreo
Tradicionalmente se ha considerado que la materia podía presentarse bajo tres formas: la sólida, la líquida y la gaseosa. Nuevos medios de investigación de su estructura íntima —particularmente durante el siglo XX— han puesto al descubierto otras formas o estados en los que la materia puede presentarse. Por ejemplo el estado mesomorfo[11] (una forma líquida con sus fases esmécticas,[12] nemáticas[13] y colestéricas[14]), el estado de plasma (o estado plasmático, propio de gases ionizados a muy altas temperaturas) o el estado vítreo, entre otros.
Los cuerpos en estado vítreo se caracterizan por presentar un aspecto sólido con cierta dureza y rigidez y que ante esfuerzos externos moderados se deforman de manera generalmente elástica. Sin embargo, al igual que los líquidos, estos cuerpos son ópticamente isótropos, transparentes a la mayor parte del espectro electromagnético de radiación visible. Cuando se estudia su estructura interna a través de medios como la difracción de rayos X, da lugar a bandas de difracción difusas similares a las de los líquidos. Si se calientan, su viscosidad va disminuyendo paulatinamente —como la mayor parte de los líquidos— hasta alcanzar valores que permiten su deformación bajo la acción de la gravedad, y por ejemplo tomar la forma del recipiente que los contiene como verdaderos líquidos. No obstante, no presentan un punto claramente marcado de transición entre el estado sólido y el líquido o "punto de fusión".[15]
Todas estas propiedades han llevado a algunos investigadores a definir el estado vítreo no como un estado de la materia distinto, sino simplemente como el de un líquido subenfriado o líquido con una viscosidad tan alta que le confiere aspecto de sólido sin serlo.[16][17] Esta hipótesis implica la consideración del estado vítreo como un estado metaestable al que una energía de activación suficiente de sus partículas debería conducir a su estado de equilibrio, es decir, el de sólido cristalino.

En apoyo de esta hipótesis se aduce el hecho experimental de que, calentado un cuerpo en estado vítreo hasta obtener un comportamiento claramente líquido (a una temperatura suficientemente elevada para que su viscosidad sea inferior a los 500 poises, por ejemplo), si se enfría lenta y cuidadosamente, aportándole a la vez la energía de activación necesaria para la formación de los primeros corpúsculos sólidos (siembra de microcristales, presencia de superficies activadoras, catalizadores de nucleación, etc.) suele solidificarse dando lugar a la formación de conjuntos de verdaderos cristales sólidos.
Todo parece indicar que los cuerpos en estado vítreo no presentan una ordenación interna determinada, como ocurre con los sólidos cristalinos.[15] Sin embargo en muchos casos se observa un desorden ordenado, es decir, la presencia de grupos ordenados que se distribuyen en el espacio de manera total o parcialmente aleatoria.
Esto ha conducido a diferentes investigadores a plantear diversas teorías sobre la estructura interna del estado vítreo, tanto de tipo geométrico, basadas tanto en las teorías atómicas como en las de tipo energético.
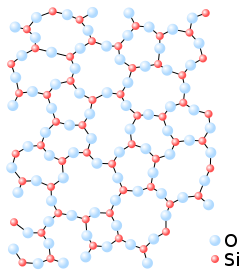
Según la teoría atómica geométrica, en el sílice sólido cristalizado el átomo de silicio se halla rodeado de cuatro átomos de oxígeno situados en los vértices de un tetraedro cada uno de los cuales le une a los átomos de silicio vecinos. Una vista en planta de este ordenamiento se esquematiza en la figura 1, en la que el cuarto oxígeno estaría encima del plano de la página. Cuando este sílice pasa al estado vítreo, la ordenación tetraédrica se sigue manteniendo a nivel individual de cada átomo de silicio, aunque los enlaces entre átomos de oxígeno y silicio se realizan en un aparente desorden,[18] que sin embargo mantiene una organización unitaria inicial (véase la figura 2).
No obstante, ninguna de estas teorías es suficiente para explicar el comportamiento completo de los cuerpos vítreos aunque pueden servir para responder, en casos concretos y bien determinados, a algunas de las preguntas que se plantean.
Las sustancias susceptibles de presentar un estado vítreo pueden ser tanto de naturaleza inorgánica como orgánica, entre otras:
- Elementos químicos: Si, Se, Au-Si, Pt-Pd, Cu-Au.
- Óxidos: SiO2, B2O3, P2O5, y algunas de sus combinaciones.
- Compuestos: As2S3, GeSe2, P2S3, BeF2, PbCl2, AgI, Ca(NO3)2.
- Siliconas (sustancias consideradas como semiorgánicas)
- Polímeros orgánicos: tales como glicoles, azúcares, poliamidas, poliestirenos o polietilenos, etc.
Vidrios comunes
Sílice vítrea
Se denomina sílice a un óxido de silicio de fórmula química SiO2. Se presenta en estado sólido cristalino bajo diferentes formas enanciotrópicas. Las más conocidas son el cuarzo (la más frecuente y estable a temperatura ambiente), la cristobalita y las tridimitas. Además de estas formas, se han llegado a identificar hasta veintidós fases diferentes, cada una de ellas estable a partir de una temperatura perfectamente determinada.
Cuando se calienta el cuarzo lentamente, este va pasando por distintas formas enanciotrópicas hasta alcanzar su punto de fusión a 1723 °C. A esta temperatura se obtiene un líquido incoloro y muy viscoso que si se enfría con relativa rapidez, se convierte en una sustancia de naturaleza vítrea a la que se suele denominar vidrio de cuarzo.
Este vidrio de cuarzo presenta un conjunto de propiedades de gran utilidad y de aplicación en múltiples disciplinas: en la investigación científica, tecnológica, en la vida doméstica y en general en todo tipo de industria. Se destacan como más relevantes las siguientes:
- Gran resistencia al ataque por agentes químicos, por lo que es muy utilizado como material de laboratorio. Solo es atacado, de manera importante a temperatura ambiente, por el ácido fluorhídrico en sus diferentes formas (gaseosa o disolución). A temperaturas superiores a 800 °C reacciona a velocidades apreciables con sales alcalinas o alcalinotérreas, en particular con sales sódicas, tales como el carbonato o el sulfato sódicos.
- Si bien su densidad a temperatura ambiente es relativamente alta (2,2 g/cm³) su coeficiente de dilatación lineal medio a temperaturas inferiores a los 1000 °C es extremadamente pequeño: se sitúa en 5,1•10-7 K-1, lo que permite, por ejemplo, calentarlo al rojo y sumergirlo bruscamente en agua, sin que se fracture. El número de aplicaciones que esta propiedad suscita es elevado.
- Su índice de refracción a la radiación electromagnética visible es 1,4589, lo que le hace apto para instrumentos ópticos en general.
- Su resistividad eléctrica es del orden de los 1020 ohm·cm en condiciones normales lo que le convierte en uno de los mejores aislantes eléctricos conocidos, con todas las aplicaciones que de ello se derivan en la industria moderna.
- La absorción de la radiación electromagnética del vidrio de cuarzo muestra una gran transparencia a la luz visible así como en las bandas correspondientes al espectro ultravioleta, lo que le hace especialmente apto para la fabricación de lámparas y otros instrumentos generadores de este tipo de radiación.
Otras propiedades, sin embargo, dificultan su elaboración y utilización. En particular, las siguientes:
| Temperatura | Viscosidad |
| °C | μ (poises) |
| 1800 | 107,21 |
| 2000 | 106,10 |
| 2200 | 105,21 |
| 2400 | 104,50 |
| 2600 | 103,90 |
| 2800 | 103,40 |
- El punto de fusión de la sílice cristalizada depende de la variedad enanciotrópica que se trate. Para la variedad estable a partir de los 1470 °C (la α-cristobalita) este es de 1723 °C. Estas son temperaturas que no pueden alcanzarse fácilmente, salvo en instalaciones muy especializadas. Por esta razón, la fabricación del vidrio de cuarzo ha sido siempre rara y cara. Industrialmente, su producción es bastante limitada si se la compara con otros tipos de vidrio.
- Su viscosidad en estado vítreo presenta una gran variación con la temperatura, pasando de valores superiores a 107 poises (aspecto totalmente sólido) por debajo de los 1800 °C, a 103,5 poises a 2758 °C (aspecto pastoso y moldeable).
- Las viscosidades toman valores tan sumamente elevados que deben expresarse como potencias de diez. En general, las viscosidades de los vidrios suelen darse bajo la forma de su logaritmo decimal. Para obtener el vidrio de cuarzo es necesario partir de un cuarzo cristalizado de gran pureza, finamente molido, que se somete a altas temperaturas. El líquido que se obtiene presenta gran cantidad de burbujas diminutas de aire ocluido entre los granos del cuarzo, que le dan un aspecto lechoso, traslúcido, al que se suele denominar gres de cuarzo y cuyas aplicaciones como recipiente resistente al ataque químico o a los cambios bruscos de temperatura son frecuentes. Sin embargo, resulta totalmente inútil para aplicaciones en las que se precise una gran transparencia (lámparas de rayos UVA, lámparas de cuarzo y óptica en general). Para estas últimas es necesario que durante el proceso de fusión se puedan desprender esas burbujas gaseosas ocluidas. Para que ese desprendimiento fuera efectivo bajo la presión atmosférica y a una velocidad aplicable industrialmente, se precisaría que el líquido presentara una viscosidad por debajo de los 200 poises, lo que en el caso de la sílice líquida implicaría temperaturas del orden de los 3600 °C. En la práctica para poder desgasificar el vidrio de sílice se funde el cuarzo a temperaturas próximas a los 2000 °C en recipientes donde se hace el vacío, complicando mucho la tecnología de su producción y, por consiguiente, encareciendo el producto.
- La resistencia a la tracción en estado puro, en condiciones normales y con una superficie perfectamente libre de toda fisura, es de unos 60 kbar. Esta gran resistencia (superior a la del acero) se ve fuertemente disminuida por imperfecciones en la superficie del objeto, por pequeñas que estas sean.
- Su módulo de Young a 25 °C es de 720 kbar y el de torsión 290 kbar. Cuando se le somete a un esfuerzo de tracción mecánica a temperaturas próximas a la ambiente, se comporta como un cuerpo perfectamente elástico con una función alargamiento/esfuerzo lineal, pero sin prácticamente zona plástica cercana a su límite de rotura. Esta propiedad, unida a la resistencia mecánica a la tracción anteriormente citada, lo convierten en un producto frágil. Al golpearlo, o se deforma elásticamente y su forma no se altera o, si se sobrepasa su límite de elasticidad, se fractura.
Silicato sódico
Las sales más comunes de sodio tienen puntos de fusión por debajo de los 900 °C. Cuando se calienta una mezcla íntima de cuarzo finamente dividido con una sal de estos metales alcalinos, por ejemplo Na2CO3, a una temperatura superior a los 800 °C se obtiene inicialmente una fusión de la sal alcalina, cuyo líquido rodea a los granos de cuarzo, produciéndose una serie de reacciones que pueden englobarse en la resultante siguiente:
SiO2 (s) + Na2CO3 (s) Na2SiO3 (s) + CO2 (g) H = -5,12 kcal/mol
Esta reacción, levemente exotérmica, desprende anhídrido carbónico gaseoso -que burbujea entre la masa en fusión- y conduce a un primer silicato sódico, de punto de fusión 1087 °C.
De acuerdo con la termodinámica, la mezcla de dos sustancias de puntos de fusión diferentes presenta un «punto de liquidus»[19] que se sitúa entre los de las dos sustancias en contacto. De esta forma la mezcla de la sílice y el silicato sódico formado da lugar a un producto de SiO2 y silicatos, ya en estado líquido a temperaturas que no sobrepasan los 1200 °C, lejos de los más de 2000 °C necesarios para preparar el vidrio de cuarzo.
Al producto así obtenido se le da corrientemente el nombre genérico de silicato sódico, si bien con esta denominación se identifica a un conjunto de productos derivados de la fusión del cuarzo con sales sódicas (generalmente carbonatos) en diferentes proporciones de uno y otro componente. Industrialmente se preparan silicatos sódicos con proporciones molares de cada componente situadas entre:
- 3,90 moles de SiO2 / 1 mol de Na2O y 1,69 moles de SiO2 / 1 mol de Na2O
- Nota
- La proporción estequiométrica de un metasilicato sódico puro sería de 1 mol de SiO2 / 1 mol de Na2O
Estos silicatos sódicos presentan un aspecto vítreo, transparente y muy quebradizo. Para alcanzar una viscosidad del orden de los 1000 poises (necesaria para su moldeado) se precisan temperaturas que, en función de su composición, oscilan entre los 1220 °C para el silicato más rico en SiO2, y los 900 °C para el más pobre. Son muy solubles en agua: entre un 35 % y un 50 % en peso de silicato, según el contenido en SiO2. Su falta de rigidez mecánica y su solubilidad en agua les hacen inútiles como sustitutos del vidrio de cuarzo en ninguna de sus aplicaciones.
Raramente se presentan en la industria en forma sólida, sino bajo la forma de disolución acuosa. Su solución en agua se utiliza como pegamento cerámico muy eficaz o como materia prima para la producción mediante hidrólisis de gel de sílice, sustancia usada como absorbente de la humedad (torres de secado de gases, etc.) o como componente de ciertos productos tales como neumáticos para vehículos y otras aplicaciones en la industria química.
Su producción se realiza en hornos continuos de balsa calentados mediante la combustión de derivados del petróleo y frecuentemente también con energía eléctrica, a temperaturas lo más elevadas posibles (dentro de una cierta rentabilidad) con el fin de aumentar la productividad del horno. Estas temperaturas suelen situarse entre los 1400 °C y los 1500 °C.
Vidrios de silicato sódico
Con el fin de obtener un producto con propiedades similares a las del vidrio de cuarzo a temperaturas alcanzables por medios técnicamente rentables, se produce un vidrio de silicato sódico al que se le añaden otros componentes que le hagan más resistente mecánicamente, inerte a los agentes químicos a temperatura ambiente —muy particularmente al agua— y que guarden su transparencia a la luz, al menos en el espectro visible.
Estos componentes son metales alcalinotérreos, en particular magnesio, calcio o bario, además de aluminio y otros elementos en menores cantidades, algunos de los cuales aparecen aportados como impurezas por las materias primas (caso del hierro, el azufre u otros). Las materias primas que se utilizan para la elaboración de vidrios de este tipo se escogen entre aquellas que presenten un menor costo:
- Para el cuarzo:
- Arenas feldespáticas, de pureza en SiO2 superior al 95 % y con el menor contenido en componentes férricos posible (entre un 0,15 % y 0,01 % en términos de Fe2O3)
- Cuarcitas molidas
- Para el sodio:
- Carbonatos sódicos naturales (yacimientos de Estados Unidos y África).
- Carbonato sódico sintético, el más utilizado en Europa.
- Sulfato sódico sintético, subproducto de la industria química.
- Nitrato sódico natural (nitrato de Chile).
- Cloruro sódico o sal común.
- Estos tres últimos, utilizados en pequeñas proporciones, debido al desprendimiento de gases contaminantes durante la elaboración del vidrio: SOX, NOX, Cl2.
- Para el calcio:
- Calizas naturales.
- Para el magnesio:
- Dolomitas naturales.
- Para el bario:
- Sulfato bárico natural (baritina).
- Para el aluminio:
- Feldespatos naturales (caolines).
La producción industrial de este tipo de vidrios se realiza, al igual que en el caso de los silicatos sódicos, en hornos para vidrio, generalmente de balsa, calentados mediante la combustión de derivados del petróleo con apoyo, en muchos casos, de energía eléctrica a temperaturas que oscilan entre los 1450 °C y los 1600 °C. En estos hornos se introduce una mezcla en polvo ligeramente humedecida (5 % de agua) y previamente dosificada de las materias primas ya citadas. Esta mezcla de materias minerales reacciona (a velocidades apreciables y, evidentemente, cuanto mayores mejor) para formar el conjunto de silicatos que, combinados y mezclados, darán lugar a esa sustancia a la que se denomina vidrio común.
Propiedades del vidrio
Las propiedades del vidrio común, son una función tanto de la naturaleza, como de las materias primas, como de la composición química del producto obtenido. Esta composición química se suele representar en forma de porcentajes en peso de los óxidos más estables a temperatura ambiente de cada uno de los elementos químicos que lo forman. Las composiciones de los vidrios silicato sódicos más utilizados se sitúan dentro de los límites que se establecen en la tabla adjunta.
| Componente | Desde ... % | ... hasta % |
| SiO2 | 68,0 | 74,5 |
| Al2O3 | 0,0 | 4,0 |
| Fe2O3 | 0,0 | 0,45 |
| CaO | 9,0 | 14,0 |
| MgO | 0,0 | 4,0 |
| Na2O | 10,0 | 16,0 |
| K2O | 0,0 | 4,0 |
| SO3 | 0,0 | 0,3 |
Muchos estudios —particularmente en la primera mitad del siglo XX— han intentado establecer correlaciones entre lo que se denominó la estructura interna del vidrio —generalmente basada en teorías atómicas— y las propiedades observadas en los vidrios. Producto de estos estudios fueron un conjunto de relaciones, de naturaleza absolutamente empírica, que representan de manera sorprendentemente precisa muchas de esas propiedades mediante relaciones lineales entre el contenido de los elementos químicos que forman un vidrio determinado (expresado bajo la forma del contenido porcentual en peso de sus óxidos más estables) y la magnitud representando dicha propiedad. Curiosamente, las correlaciones con las composiciones expresadas en forma molar o atómica son mucho menos fiables.
| SiO2 | Al2O3 | Fe2O3 | CaO | MgO | Na2O | K2O | SO3 |
| 73,20 | 1,51 | 0,10 | 10,62 | 0,03 | 13,22 | 1,12 | 0,20 |
Los contenidos en MgO, Fe2O3 y SO3 son consecuencia de las impurezas de la caliza, arena y el sulfato sódico, respectivamente.
| Propiedad | Valor | Unidades | Fuente |
| Densidad a 25 °C(1) | 2,49 | g/cm³ | Gilard & Dubrul |
| Coeficiente de dilatación lineal a 25 °C(2) | 8,72•10−6 | °C−1 | Wilkelman & Schott |
| Conductividad térmica a 25 °C | 0,002 | cal/cm.s.°C | Russ |
| Tensión superficial a 1200 °C | 319 | dinas/cm | Rubenstein |
| Índice de refracción (a 589,3 nm)(3) | 1,52 | - | Gilard & Dubrul |
| Módulo de elasticidad a 25 °C | 719 | kbar | Appen |
| Módulo de Poisson a 25 °C | 0,22 | - | Wilkelman & Schott |
| Resistencia a la tracción a 25 °C(4) | (900) | bar | Wilkelman & Schott |
| Constante dieléctrica (4.5.188 Hz) | 7,3 | - | Appen & Bresker |
| Resistencia eléctrica a 1100 °C | 1,06 | Ώ.cm | |
| Resistencia eléctrica a 1500 °C | 0,51 | Ώ.cm | |
| Calor específico a 25 °C | 0,20 | cal/g/°C | Sharp & Ginter |
| Atacabilidad química DIN 12111(5) | 13,52 | ml de HCl 0,01N | R. Cuartas |
- Nota
- La viscosidad se expresa en la figura 3.
- Fuente
- Coeficientes para el cálculo de propiedades del vidrio (cuadro)

La absorción (o transparencia)(7) a la luz de los vidrios de silicato sódico en la zona del espectro visible (0,40 μ a 0,70 μ) depende de su contenido en elementos de transición (Ni y Fe en el ejemplo). Sin embargo, tanto en el ultravioleta como en el infrarrojo el vidrio se comporta prácticamente como un objeto casi opaco, independientemente de cualquiera de estos elementos.
- Notas
- (1) La densidad es algo más elevada que en el cuarzo fundido (2,5 frente a 2,2 g/cm³).
- (2) El coeficiente de dilatación térmica lineal a temperatura ambiente es notablemente más alto que el del sílice fundido (unas 20 veces más), por lo que los objetos de vidrios de silicato sódico son menos resistentes al "choque térmico".
- (3) Su índice de refracción es ligeramente mayor que el del vidrio de cuarzo y puede aumentarse mediante el uso de aditivos.
- (4) La resistencia a la tracción en cualquier tipo de vidrio es una magnitud que depende extraordinariamente del estado de la superficie del objeto en cuestión, por lo que su cuantificación es compleja y poco fiable.
- (5) La resistencia al ataque químico o físico (disolución) de los vidrios comunes es una función de su composición química fundamentalmente. No obstante, en todos ellos esta resistencia es elevada. Se suele medir mediante una serie de pruebas tipificadas internacionalmente. Entre las más usadas:
- DIN 12116
- DIN 52322
- DIN 12111
- La atacabilidad de los vidrios también se modifica mediante tratamientos superficiales con SO2, Sn, Ti, y otros.
- (6) Para moldear un vidrio es necesaria una viscosidad que se sitúa entre 1000 poises y 5000 poises. En el caso del sílice son necesarias temperaturas de más de 2600 °C, en tanto que para los vidrios comunes basta con 1 200 °C, aproximadamente.
- (7) La absorción de la luz se ve influenciada por la estructura íntima de estas materias transparentes. En el caso de una estructura Si-O la absorción de fotones es baja, incluso para longitudes pequeñas de onda (transparencia a los rayos UVA). No es así cuando a esta sencilla estructura se le añaden otros elementos (Na, Mg, Ca, etc.) que inciden decisivamente en la absorción a las longitudes de onda pequeñas (menores de 200 nm) y en las infrarrojas (superiores a 700 nm). Por otra parte, la presencia en la red vítrea de elementos de transición (ver Tabla periódica de los elementos) produce absorciones selectivas de radiación visible, lo que permite, entre otras cosas, colorear los vidrios con una amplia gama de matices.
Reciclaje

El reciclaje de vidrio es el proceso mediante el cual se convierten desechos de vidrio en materiales que servirán para la creación de nuevos productos.
El vidrio es un material totalmente reciclable y no hay límite en la cantidad de veces que puede ser reprocesado. Al reciclarlo no se pierden las propiedades y se ahorra una cantidad de energía de alrededor del 30 % con respecto al vidrio nuevo. Este reciclaje permite reducir la cantidad de residuos que luego se llevan al vertedero, lo que supone un ahorro tanto de materias primas como de energía respecto a la fabricación de vidrio a partir de materias primas nuevas.
En ciertos casos el vidrio es reutilizado, antes que reciclado. No se funde, sino que se vuelve a utilizar únicamente lavándolo (en el caso de los recipientes). En acristalamientos, también se puede aprovechar el vidrio cortándolo nuevamente (siempre que se necesite una unidad más pequeña).
En los lugares donde se implementan programas de reciclaje de vidrio, se pueden encontrar contenedores especiales para vidrio en lugares públicos.Utilidades del vidrio
Las principales características del vidrio (su transparencia y su dureza), a pesar de las restricciones impuestas por su principal limitación (su fragilidad), lo convierten en un elemento imprescindible en numerosísimas aplicaciones, formando por sí mismo un grupo de materiales de una enorme importancia económica.
Edificación y arquitectura
 |
 |
- Fachadas
Desde mediados del siglo XX las fachadas de vidrio se han convertido en una seña de identidad casi imprescindible de los grandes edificios de las principales urbes del mundo.[21] Estas fachadas suelen estar realizadas mediante piezas de vidrio plano con una amplísima gama de colores, lo que facilita la labor creativa de los arquitectos. Estos vidrios normalmente son sometidos a determinados procesos que mejoran sus propiedades de aislamiento térmico y acústico; y su capacidad de atenuación de la luz exterior.
En las fachadas convencionales el vidrio sigue manteniendo su papel preponderante en las ventanas, integrado en distintos tipos de carpinterías (desde las tradicionales de madera, pasando por las de acero, las de aluminio, y llegando a las de PVC), con vidrios sencillos o vidrios dobles separados por una capa confinada de aire.
- Interiores

Hoy en día, el vidrio se ha convertido en un elemento primordial en la decoración del hogar. Gracias a su elegancia, transmisión de la luz exterior y su transparencia, el vidrio hace que los espacios se conviertan en amplios y limpios. Para ello la elección del vidrio adecuado es muy importante sobre todo para arquitectos y diseñadores que son los que hacen uso de este material para la creación de sus proyectos.
Además, al tener distintos colores y texturas, el vidrio se puede utilizar de formas numerosas en infinidad de elementos, tales como:
- Mamparas de baño
- Mamparas divisorias
- Espejos
- Revestimiento de paredes
- Barandillas
- Cortinas
- Vitrinas
- Mesas
- Lucernarios
- Vidrieras
- Aislamiento térmico y acústico
La lana de vidrio se utiliza como aislante térmico y acústico en edificación, colocada entre los paramentos exteriores e interiores de muchas edificaciones.
- Elementos estructurales
Existen algunas realizaciones pioneras que han utilizado la fibra de vidrio tratada con resinas para su empleo en pequeños puentes[22] y pasarelas, aprovechando las ventajas de su ligereza. Así mismo, se ha planteado el uso de barras de fibra de vidrio para el armado de hormigones, evitando así el efecto de la corrosión sobre las armaduras metálicas en ambientes especialmente agresivos.
Parabrisas
 |
 |
Desde los primeros carruajes acomodados para el transporte de viajeros, todas las empresas de fabricación de medios de transporte (los ferrocarriles, la construcción naval, la industria del automóvil y la industria aeroespacial) están ligadas desde sus orígenes a la realización de los elementos de vidrio utilizados tanto en ventanillas y parabrisas como en los sistemas de iluminación interior y exterior de todo tipo de vehículos. Igualmente, otro elemento ligado a la industria del automóvil es la fabricación de espejos retrovisores.
Un ejemplo claro es la evolución del diseño de los automóviles, que pasó de utilizar vidrios planos en exclusiva, a integrar sofisticados elementos de vidrio curvado en parabrisas y ventanas. Tanto la industria aeroespacial como la automovilística se han beneficiado y a su vez han hecho notables contribuciones al desarrollo de vidrios cada vez más ligeros y resistentes, como el Gorilla Glass,[23] utilizado después con profusión en la fabricación de teléfonos celulares.
Envases

El vidrio (pese a la competencia de envases más baratos como las latas de aluminio o acero; los bricks de cartón encerado o revestido de aluminio; y las botellas de plástico) es todavía uno de los envases usados preferentemente para la comercialización de la mayoría de las bebidas alcohólicas (entre las que se pueden incluir de forma masiva el vino y la cerveza, pese a la progresión de otros tipos de contenedores en estos dos casos), multitud de conservas (especialmente mermeladas y hortalizas, que se benefician de la visibilidad del producto a través del vidrio), refrescos de todo tipo y productos de perfumería como las colonias o determinados productos de belleza (a los que envases de vidrio[24] de diseños originales prestan un innegable valor añadido).
Desde la primera mitad del siglo XX, cuando las empresas de alimentación se encargaban de la recogida de los envases para su limpieza y nueva utilización (práctica habitual por entonces en industrias lácteas, cerveceras y de refrescos), hasta la década de 1980, en la que se generalizó el uso de envases no retornables[25] destinados a ser reciclados en la fabricación de nuevas botellas, el vidrio se ha mostrado como uno de los materiales menos contaminantes y de más fácil reciclado.
De igual manera, la industria farmacéutica utiliza frecuentemente envases de vidrio para muchos de sus preparados líquidos como jarabes o inyectables.
Producción de energía

Los sistemas de producción energética como los paneles fotovoltaicos[26] y las centrales termosolares utilizan masivamente elementos de vidrio en la captación de la energía solar. En el caso de las placas fotovoltaicas, protegen las células de silicio (y finalmente concentran la luz), y en el caso de las centrales termosolares son el elemento clave de los espejos captadores (y en algunos sistemas, también de los colectores por donde circulan los fluidos con los que se acumula el calor del sol).
La mejora de las propiedades de estos vidrios (coste, transparencia, estabilidad térmica y química, resistencia a la suciedad y a los agentes ambientales...) es clave en la rentabilidad de las costosas inversiones necesarias para la puesta en servicio de estas instalaciones.
Óptica

Constituye una de las principales aplicaciones específicas del vidrio desde el Renacimiento, cuando se empezaron a producir lentes de calidad con procedimientos cada vez más perfeccionados. Algunas de las bases científicas de la óptica ya se habían sentado anteriormente (desde el año 1000 matemáticos árabes como Alhacen habían estudiado la geometría de los espejos). Sin embargo, no fue hasta que aparecieron Galileo Galilei con su telescopio de lentes, Anton van Leeuwenhoek con su primitivo microscopio, y el propio Isaac Newton con el desarrollo del telescopio de espejos, cuando se establecieron definitivamente las bases de la importancia de los instrumentos ópticos, hasta llegar a los límites teóricos de resolución a comienzos del siglo XX, con las realizaciones de Carl Zeiss a partir de los descubrimientos teóricos de Ernst Abbe, fundamentadas en la utilización de vidrios de distintos tipos.
Las aplicaciones de la tecnología óptica del vidrio se centran principalmente en los instrumentos para el tratamiento y captación de imágenes; en aparatos científicos para el estudio de la luz; en comunicaciones digitales; y en la corrección oftalmológica de defectos de la vista humana mediante lentes:
- Captación de imágenes
- Telescopios
- Cámaras fotográficas
- Cámaras cinematográficas
- Cámaras de televisión
- Cámaras de vídeo
- Equipos topográficos y de fotografía aérea
- Satélites de observación terrestre
- Prismáticos
- Periscopios
- Microscopios
- Reproducción de imágenes
- Comunicaciones
- Informática
- Instrumental científico
- Material educativo
- Oftalmología
Material de laboratorio

Una gran parte de los equipos de los laboratorios químicos y farmacéuticos (tubos de ensayo, vasos de precipitados, matraces, pipetas, condensadores, placas para preparaciones microscópicas...) están realizados con vidrio. En ocasiones se utilizan vidrios especiales, preparados para soportar elevadas temperaturas o determinadas agresiones químicas.
Electrodomésticos
Los televisores utilizan de forma sistemática pantallas de vidrio para proteger los distintos sistemas de píxeles luminosos mediante los que forman las imágenes.
Hornos convencionales, hornos microondas y cocinas vitrocerámicas incluyen en su diseño elementos de vidrio termoresistentes.
De igual manera, las lavadoras incorporan habitualmente una puerta circular de vidrio, y muchos frigoríficos utilizan baldas de vidrio para mejorar la sensación de espacio y la luminosidad interior.
Iluminación

Desde la invención de las lámparas de llama de gas o de petróleo, se han utilizado campanas de vidrio para evitar tanto el apagado de la llama como su propagación accidental. Con la invención de la bombilla de incandescencia eléctrica, la característica ampolla de vidrio que protege el filamento se ha convertido en un elemento insustituible, que se ha ido adaptando progresivamente a los mayores requerimientos térmicos que exigen las lámparas de vapor de sodio, las halógenas (con vidrios de sílice pura) o las de xenón (que emplean vidrios especiales). Incluso en los tubos fluorescentes, cuyas temperaturas de funcionamiento son reducidas, el vidrio que contiene el gas neón es un elemento imprescindible. Solo el desarrollo de los sistemas de luz LED (debido a su baja emisión de calor) puede permitir la sustitución del vidrio por materiales plásticos translúcidos, más baratos, ligeros y fáciles de fabricar.
Muchos modelos de lámparas en las que se montan los puntos de luz, utilizan elementos de vidrio para dispersar y dar un determinado aspecto decorativo a la luz que proyectan. En este sentido, pueden citarse las enormes lámparas de araña formadas por numerosas piezas de vidrio engarzadas, características de los grandes salones de edificios públicos y privados desde la Época Victoriana hasta la Primera Guerra Mundial.
Teléfonos celulares y dispositivos táctiles

Se ha generalizado el uso de pantallas luminosas (cada vez de mayor tamaño) en teléfonos celulares y dispositivos táctiles, fabricadas con vidrios especialmente resistentes, como el Gorilla Glass.
Relojería
Tradicionalmente, las esferas de los relojes se han protegido con vidrios abombados, adoptándose perfiles planos posteriormente. En el caso de los relojes de pulsera, es un requisito indispensable tanto cuando montan dispositivos de agujas (para evitar que se dañen) como cuando se trata de dispositivos digitales (el vidrio permite mostrar la pantalla hacia el exterior). Los relojes de alta gama suelen montar cristal de zafiro, cuya extraordinaria dureza evita que se rayen fácilmente.
Cocina y menaje
Muchos utensilios de cocina pueden ser de vidrio (como fuentes o boles). La aparición del vidrio borosilicatado capaz de soportar temperaturas muy altas, amplió extraordinariamente el uso del vidrio en la cocina, hasta convertirlo en un material profusamente utilizado en fuentes para preparar asados al horno.
En la mesa, tanto los vasos como todo tipo de copas, así como jarras y los recipientes de la mayoría de los líquidos, suelen ser de vidrio, existiendo así mismo vajillas en las que los platos también son de este material, sustituyendo a la cerámica.
Decoración y bisutería

Vidrios de colores de especial calidad son frecuentemente utilizados en bisutería, sustituyendo a gemas naturales de mucho mayor precio. Un ejemplo es el vidrio de Swarovski, que se utiliza para producir una amplia gama de productos decorativos, así como complementos de moda ligados a la bisutería.
En otro tipo de productos, es frecuente la venta de abalorios y cuentas de vidrio de colores que se utilizan en la confección de collares y pulseras artesanales, tanto para su comercialización como por puro entretenimiento.
Principales empresas fabricantes
| N.º | Empresa | País |
|---|---|---|
| 1 | Saint-Gobain | |
| 2 | Corning Inc. | |
| 3 | AGC Group* | |
| 4 | Murata Manufacturing Co., Ltd.* | |
| 5 | The NSG Group* | |
| 6 | Kyocera Corp. | |
| 7 | Schott AG | |
| 8 | Vesuvius plc* | |
| 9 | CoorsTek, Inc.* | |
| 10 | RHI AG* | |
| (Artículo en inglés)* | ||
De acuerdo con los datos publicados por la web CIAdvanced,[27] las principales industrias fabricantes de vidrio del mundo (la gran mayoría comparten esta actividad con la fabricación de materiales cerámicos), se concentran en Japón, Europa y los Estados Unidos.
El potencial económico de estas empresas es considerable. La mayor de ellas, la francesa Saint-Gobain, facturó 45.000 millones de dólares en 2014 y daba empleo a cerca de 60.000 trabajadores, con unos 3.700 dedicados a tareas de investigación y desarrollo. Sus principales clientes son la industria del automóvil, la aeroespacial, las plantas energéticas y la óptica oftalmológica. También es notable el tamaño de las empresas de Japón, que concentra cuatro de las diez primeras.
La más pequeña de las diez, la austriaca RHI AG, en 2014 facturó 1900 millones de dólares, y daba empleo a 8000 trabajadores.
Por otro lado, la empresa estadounidense Owens-Illinois es el mayor fabricante mundial de recipientes de vidrio. Factura 7400 millones de dólares anuales y emplea a 24 000 trabajadores. (Véase: Fabricación de vidrio)
Véase también
Tipos de vidrio:
Por su origen
Por su aspecto
Por su composición
- Vidrio común
- Vidrio de plomo
- Vidrio flint
- Vidrio crown
- Vidrio borosilicatado
- Vidrio fluorado
- Cristal de zafiro
- Gorilla Glass
Por su fabricación
- Fabricación de vidrio
- Vidrio soplado
- Vidrio flotado
- Vidrio aislante
- Vidrio armado
- Vidrio templado
- Vidrio laminado
Por su utilización
Referencias
- ↑ Castells, Xavier Elías (10 de octubre de 2012). Residuos vitrificables: Reciclaje de residuos industriales. Ediciones Díaz de Santos. ISBN 9788499693774. Consultado el 2 de marzo de 2018.
- ↑ Nutsch, Wolfgang (1996). Tecnología de la madera y del mueble. Reverte. ISBN 9788429114355. Consultado el 4 de marzo de 2018.
- ↑ I. Nebot-Díaz (2001). Nuevas tecnologías para el sector cerámico de Castellón: desarrollo de esmaltes vitrocristalinos y vitrocerámicos. Publicacions de la Universitat Jaume I. pp. 31 de 100. ISBN 9788480213349. Consultado el 8 de noviembre de 2017.
- ↑ Agricola, Georgius, De re metallica. De Re Metallica versión online Archivado el 9 de diciembre de 2009 en Wayback Machine. Página 586.
- ↑ Petrie Museum of Egyptian Archaeology. Period - Naqada II (3200BCE-3500BCE) UC5060.
- ↑ Bruce Nash. Modern Marvels: glass (documental). History Channel. Escena en 4 min.
- ↑ Chew. (2001) degradación ecológica mundial. Walnut Creek: AltaMira, 97.
- ↑ http://etimologias.dechile.net/?vidrio
- ↑ Lajo Pérez, Rosina (1990). Léxico de arte. Madrid - España: Akal. p. 68. ISBN 978-84-460-0924-5.
- ↑ Bremer-David, Charissa; Hess, Catherine; Weaver, Jeffrey W.; Wilson, Gillian (13 de noviembre de 1997). Masterpieces of the J. Paul Getty Museum: Decorative Arts: Spanish Language Edition. Getty Publications. ISBN 9780892364565. Consultado el 2 de marzo de 2018.
- ↑ Mesomorfo: Estado de la materia intermedio entre un sólido y un líquido
- ↑ «Esméctico». UCO. Archivado desde el original el 6 de mayo de 2016. Consultado el 1 de febrero de 2016. «Cristal líquido esméctico: Es la fase de cristal líquido de ordenamiento siguiente a la fase nemática conforme se incrementa la temperatura partiendo del líquido. El término se deriva del griego que significa limo o grasa. La estructura esméctica (excepto la esméctica D) se encuentra estratificada, con las moléculas organizadas en capas.»
- ↑ «Nemático». enciclonet 3.0. Consultado el 1 de febrero de 2016. «Nemático: Se dice del estado de la materia más cercano al estado líquido que al cristalino, en el cual las moléculas se disponen de forma alargada y se mueven manteniéndose paralelas unas a otras: el estado nemático es un tipo de los dos estados mesomorfos que puede presentar la materia».
- ↑ «Colestérico». Cristales Líquidos. Archivado desde el original el 6 de mayo de 2016. Consultado el 1 de febrero de 2016. «Cristales líquidos colestéricos: También conocidos como nemáticos girados. Similar a la fase nemática, sin embargo, en la fase colestérica, las moléculas en las diferentes capas se orientan con un desfase en un leve ángulo de unas capas respecto a otras (en vez de paralelas como en el nemático). Cada molécula consecutiva se gira ligeramente con relación a la anterior. Por lo tanto, en vez del tener un vector director constante como el nemático, el vector director colestérico gira helicoidalmente en todas las partes de la muestra. Muchos ésteres colestéricos exponen esta fase, de ahí el nombre colestérico.»
- ↑ a b
- ↑ Philip Gibbs. «Is glass liquid or solid?». Consultado el 21 de marzo de 2007.
- ↑ "Philip Gibbs" Glass Worldwide, (May/June 2007), pp. 14-18
- ↑ «La estructura del vidrio determinada átomo a átomo». Experientia docet. 14 de noviembre de 2012. Consultado el 1 de febrero de 2016.
- ↑ Solubilidad total en estado sólido (Diagramas de equilibrio de fases). William F. Smith. Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera edición. Ed. Mc-Graw Hill. Consultado el 10 de octubre de 2011.
- ↑ «Coeficientes para el cálculo de propiedades del vidrio (cuadro)». Archivado desde el original el 18 de julio de 2011. Consultado el 19 de febrero de 2011.
- ↑ Rubio Hernández, Rosana. «“A Wall for all Seasons”, un modelo sostenible de “piel” tersa de vidrio». rita_ Revista Indexada de Textos Académicos (8): 70-77. doi:10.24192/2386-7027(2017)(v8)(01).
- ↑ «Primer puente en España de fibra de carbono y vidrio». Acciona. Consultado el 1 de febrero de 2016. «Puente de mayor longitud del mundo (46 m.) fabricado con materiales poliméricos. Puente carretero de mayor luz entre apoyos consecutivos (13 m.). Premio de Arquitectura y Construcción 2005. El puente ha sido construido para la Dirección General de Carreteras del Ministerio de Fomento dentro del "Proyecto de Construcción Autovía del Cantábrico, Tramo: Tamón (Carreño) - Otur (Luarca), Subtramo: Vegarrozadas - Soto del Barco en el P.K.=1+640.»
- ↑ Pogue, David (9 de diciembre de 2010). «Gorilla Glass, the Smartphone's Unsung Hero». The New York Times.
- ↑ Asociación Nacional de Fabricantes de Vidrio (2013). «La Industria de Fabricación de Envases de Vidrio publica su Primer Informe Sectorial». Anfevi. Consultado el 2 de febrero de 2016.
- ↑ Julià Guillamón (1 de septiembre de 2011). «El envase retornable». La Vanguardia. Consultado el 2 de febrero de 2016.
- ↑ Antonio García (: 23 de abril de 2014). «El primer vidrio fotovoltaico para edificios que ofrece protección solar». Diario El Mundo. Consultado el 2 de febrero de 2016.
- ↑ CI Advanced. «2015 CI Top 12: Leading Worldwide Manufacturers of Advanced Ceramics, Glasses and Refractories» (en inglés). Consultado el 1 de febrero de 2016.
Enlaces externos
 Wikcionario tiene definiciones y otra información sobre vidrio.
Wikcionario tiene definiciones y otra información sobre vidrio.



