Buckminsterfullereno
| Buckminsterfullereno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| (C60-Ih)[5,6]fullereno | ||
| General | ||
| Otros nombres |
Buckybola; fullereno-C60; [60]fullereno; futboleno. | |
| Fórmula estructural | Estructura en Jmol | |
| Fórmula molecular | C60 | |
| Identificadores | ||
| Número CAS | 99685-96-8[1] | |
| ChEBI | 33128 | |
| ChemSpider | 110185 | |
| PubChem | 123591 | |
|
InChI=InChI=1S/C60/c1-2-5-6-3(1)8-12-10-4(1)9-11-7(2)17-21-13(5)23-24-14(6)22-18(8)28-20(12)30-26-16(10)15(9)25-29-19(11)27(17)37-41-31(21)33(23)43-44-34(24)32(22)42-38(28)48-40(30)46-36(26)35(25)45-39(29)47(37)55-49(41)51(43)57-52(44)50(42)56(48)59-54(46)53(45)58(55)60(57)59
Key: XMWRBQBLMFGWIX-UHFFFAOYSA-N | ||
| Propiedades físicas | ||
| Apariencia | Cristales oscuros con forma de aguja | |
| Densidad | 1650 kg/m³; 1,65 g/cm³ | |
| Masa molar | 72 064 g/mol | |
| Estructura cristalina | Cúbica centrada en las caras cF1924 | |
| Propiedades químicas | ||
| Solubilidad en agua | Insoluble | |
| Termoquímica | ||
| ΔfH0gas | 2560 kJ/mol | |
| ΔfH0sólido | 2320 kJ/mol | |
| Peligrosidad | ||
| NFPA 704 |
1
1
0
| |
| Frases R | R36/37 | |
| Frases S | S26 S36 | |
| Riesgos | ||
| Ingestión | Irritación; dar leche o agua, asistencia médica. | |
| Inhalación | Irritación; dar aire fresco, si es necesario dar respiración artificial u oxígeno, asistencia médica. | |
| Piel | Irritación; lavar con abundante agua y jabón, quitar ropa contaminada y zapatos, asistencia médica. | |
| Ojos | Irritación; lavar con abundante agua, asistencia médica. | |
| Más información | El compuesto sublima a 873 K[2] | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El buckminsterfullereno, buckybola o futboleno es una molécula de fullereno esférico con la fórmula empírica C60. Presenta una estructura tridimensional en forma de jaula integrada por anillos de carbono unidos en una configuración de icosaedro truncado que se asemeja a un balón de fútbol. Se encuentra formado por veinte anillos de carbono hexagonales y doce anillos pentagonales, con un átomo de carbono en los vértices de cada polígono, y un enlace en cada una de las aristas.
Fue preparado intencionalmente por primera vez en 1985 por Harold Kroto, James R. Heath, Sean O'Brien, Robert Curl y Richard Smalley en la Universidad Rice.[3] Curl y Smalley fueron galardonados con el Premio Nobel de Química por sus papeles en el descubrimiento de los buckminsterfullerenos, y su familia de moléculas relacionadas, los fullerenos. El nombre es un homenaje a Buckminster Fuller, el ingeniero inventor de la cúpula geodésica, que tiene una enorme semejanza con esta molécula. El buckminsterfullereno fue la primera molécula de fullereno en ser descubierta, y también es la que se encuentra con mayor frecuencia en la naturaleza, tanto es así que puede ser encontrada en el hollín en pequeñas cantidades.[4][5]
El buckminsterfullereno es la mayor partícula de materia que ha exhibido dualidad onda-partícula.[6] Su descubrimiento inició la exploración de todo un campo nuevo de la química, el que comprende el estudio de los fullerenos.
Etimología
[editar]El nombre buckminsterfullerene deriva del notorio inventor y futurista Buckminster Fuller. Uno de sus diseños de la estructura de domo geodésico mantuvo un gran parecido al C60; como resultado, los descubridores del alótropo dieron ese nombre a la molécula recién encontrada. Hoy, mucha gente se refiere al buckminsterfullereno y a la estructura de domo de Fuller como buckybolas.[7]
Historia
[editar]El descubrimiento casual de una tercera forma alotrópica del carbono en 1985, dio a conocer una estructura fundamentalmente diferente de jaulas cerradas de carbono, que se volvieron conocidas como fullerenos. Esta nueva familia de "compuestos" no planos de carbono ha generado un inmenso interés dentro de la comunidad científica en un corto periodo de tiempo, con miles de artículos publicados sobre fullerenos y materiales basados en fullerenos en los años 1990s.
Descubrimiento
[editar] |

Las primeras predicciones teóricas de la existencia de moléculas de fullerenos aparecieron a finales de los años 1960 y comienzos de los 1970[8] pero permanecieron por mucho tiempo sin ser conocidas. A principios de los años 1970, la química de las configuraciones de los compuestos de carbono insaturados era estudiada por un grupo de la Universidad de Sussex, liderado por Harry Kroto y David Walton. En los años 1980, Richard Smalley y Bob Curl de la Universidad Rice desarrollaron una técnica para aislar estas sustancias. Para ello utilizaron un láser para vaporizar un compuesto adecuado para obtener agrupaciones de átomos. Kroto utilizó la misma técnica, empleando un blanco de grafito como objetivo para el láser.[9]
El C60 fue descubierto por Robert Curl, Harold Kroto y Richard Smalley en 1985, utilizando la técnica de evaporación por láser de una muestra de grafito. Mediante espectrometría de masas encontraron evidencias de agrupaciones de átomos de tipo Cn (donde n>20), y que además las presencias más abundantes eran las de C60 y C70. Por este descubrimiento fueron galardonados con el Premio Nobel de Química de 1996. El descubrimiento de las buckybolas fue fortuito, mientras los científicos se empeñaban en producir plasmas con átomos de carbono para replicar y caracterizar los compuestos desconocidos de la materia interestelar, el análisis de espectrometría de masas del producto obtenido sugirió la formación de moléculas de carbono esferoidales.[8]
La evidencia experimental encontrada, un pico intenso a 720 unidades de masa atómica, indicaba que se había formado una molécula con 60 átomos de carbono, pero proveía muy poca información estructural. Luego de diversos experimentos de reactividad química el grupo de investigación concluyó que la estructura más probable era la de una molécula esferoidal. La idea fue rápidamente racionalizada como la base para una estructura molecular en forma de jaula con una particular simetría molecular icosaédrica. Kroto mencionó su similitud con las cúpulas geodésicas del notable ingeniero, arquitecto, inventor y futurólogo Buckminster Fuller, eso condujo finalmente al nombre de buckminsterfullereno.[8]
Investigaciones posteriores
[editar]La versatilidad de las moléculas de fullerenos ha conducido a un gran acuerdo de parte de los grupos investigadores para explorar sus propiedades. Una propiedad potencialmente útil es la gran capacidad de los espacios internos de estas moléculas de carbono con forma de jaula, donde pueden ser introducidos átomos de diferentes elementos para producir versiones empaquetadas de los mismos.[10]
Experimentos seriados desarrollados entre 1985 y 1990 presentaron mayor evidencia de la estabilidad de esta molécula de C60, y proveyeron un marco de soporte más sólido para la teoría de estructura en forma de jaula, llegando incluso a predecir algunas de las propiedades intensivas que un material formado por tales moléculas debería poseer. Alrededor de estas fechas una intensa investigación en teoría de grupos predijo que una molécula C60 esferoidal sólo debería poseer cuatro bandas vibracionales activas en el espectro infrarrojo como consecuencia de su simetría icosaédrica.[11]
En 1989, los miembros del grupo Heidelberg/Tuscon, liderado por los físicos Wolfgang Krätschmer y Donald Huffman, observaron una absorción óptica inusual en láminas delgadas de carbono generadas por arco eléctrico entre barras de grafito. Además de otras características, los espectros de infrarrojo observados, mostraron cuatro bandas discretas de absorción en estrecha concordancia con aquellas propuestas para el C60. A raíz de estos resultados el grupo publicó un trabajo de investigación en el año 1990 donde detallaban la extracción en benceno de un material soluble a partir del grafito procesado por medio de arco eléctrico. El extracto fue cristalizado, y un análisis de cristalografía de rayos x demostró la consistencia de una estructura molecular de C60 con la forma de pequeñas esferas de aproximadamente 0,7 nanómetros de diámetro.[11]
Síntesis
[editar]
En 1990, W. Krätchmer y D. R. Huffman desarrollaron un método simple y eficiente para producir fullerenos en cantidades de gramos e incluso kilogramos el cual impulsó la investigación de los fullerenos. En esta técnica, hollín de carbón es producido a partir de dos electrodos de grafito de alta pureza mediante la ignición de una descarga de arco entre ellos en una atmósfera inerte (gas helio). De manera alternativa, el hollín es producido por la ablación láser del grafito o la pirólisis de hidrocarburos aromáticos. Los fullerenos son extraídos del hollín usando un procedimiento de múltiples etapas. Primero, el hollín es disuelto en los disolventes orgánicos apropiados. Este paso lleva a una disolución que contiene más del 75% de C60, así como otros fullerenos. Estas fracciones son separadas usando cromatografía.[12]
Propiedades
[editar]Molécula
[editar]La estructura del buckminsterfullereno es un Icosaedro truncado con 60 vértices y 32 caras (20 hexágonos y 12 pentágonos donde ningún pentágono comparte un vértice) con un átomo de carbono en los vértices de cada polígono y un enlace a lo largo de cada borde del polígono. El diámetro de Van der Waals de una molécula de C60 es alrededor de 1.01 nanómetros (nm). El diámetro de núcleo a núcleo de una molécula de C60 es alrededor de 0.71 nm. La molécula de C60 tiene dos longitudes de enlace. Los enlaces de anillo 6:6 (entre dos hexágonos) pueden ser considerados "dobles enlaces" y son más cortos que los enlaces 6:5 (entre un hexágono y un pentágono). Su longitud de enlace promedio es 0.14 nm. Cada átomo de carbono en la estructura está enlazado covalentemente con otros 3.[13]
La molécula C60 es extremadamente estable, siendo capaz de resistir altas temperaturas y presiones. La superficie expuesta de la estructura es capaz de reaccionar con otras especies mientras mantiene la geometría esférica.[14] La estructura hueca es también capaz de atrapar átomos y pequeñas moléculas, las cuales no reaccionan con la molécula de fullereno.
El C60 puede sufrir seis reducciones monoelectrónicas reversibles hasta C606-, mientras que la oxidación es irreversible. La primera reducción requiere ~1.0 V (Fc/Fc+), indicando que el C60 es un aceptor de electrones. El C60 tiene la tendencia de evitar tener dobles enlaces dentro de los anillos pentagonales lo que produce una pobre deslocalización electrónica, y en la práctica resulta que el C60 no es "superaromático". El C60 se comporta mucho como un alqueno deficiente de electrones y fácilmente reacciona con especies ricas en electrones.[11]
Un átomo de carbono en la molécula C60 puede ser sustituido por un átomo de nitrógeno o boro obteniéndose C59N o C59B respectivamente.[15]
| Centrado por | Vértice | Borde 5-6 |
Borde 6-6 |
Cara Hexágono |
Cara Pentágono |
|---|---|---|---|---|---|
| Imagen | 
|
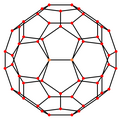
|
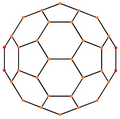
|
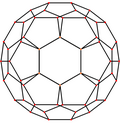
|

|
| Simetría proyectiva |
[2] | [2] | [2] | [6] | [10] |
Disoluciones
[editar]
| Solvente | S |
|---|---|
| 1-cloronaftaleno | 51 |
| 1-metilnaftaleno | 33 |
| 1,2-diclorobenceno | 24 |
| 1,2,4-trimetilbenceno | 18 |
| tetrahidronaftaleno | 16 |
| Disulfuro de carbono | 8 |
| 1,2,3-tribromopropano | 8 |
| xileno | 5 |
| bromoformo | 5 |
| cumeno | 4 |
| tolueno | 3 |
| benceno | 1.5 |
| tetracloruro de carbono | 0.447 |
| cloroformo | 0.25 |
| n-hexano | 0.046 |
| ciclohexano | 0.035 |
| tetrahidrofurano | 0.006 |
| acetonitrilo | 0.004 |
| metanol | 0.00004 |
| agua | 1.3×10−11 |
| pentano | 0.004 |
| octano | 0.025 |
| isooctano | 0.026 |
| decano | 0.070 |
| dodecano | 0.091 |
| tetradecano | 0.126 |
| dioxano | 0.0041 |
| mesitileno | 0.997 |
| diclorometano | 0.254 |
Los fulerenos son un poco solubles en muchos disolventes aromáticos como el tolueno y también en otros apolares, como el disulfuro de carbono, pero no en agua. Las disoluciones de C60 puras tienen un color púrpura oscuro que vira al marrón al evaporar parte del disolvente. La razón de este cambio de color es la relativa estrechez energética de la banda de niveles moleculares responsables de la absorción en la región verde del espectro de las moléculas individuales de C60. Esto permite que una disolución donde las moléculas no se encuentran formando agregados pueda transmitir un poco de luz azul y roja lo que resulta en un color púrpura de la misma. Al evaporar el disolvente, las interacciones moleculares provocan la superposición y ensanchamiento de las bandas energéticas, eliminando así la transmisión de la luz azul y haciendo que el color púrpura vire hacia el marrón.[19]

La solubilidad del C60 en algunos solventes muestra un comportamiento inusual debido a la existencia de fases solvatadas (análogas a cristalohidratos). Por ejemplo, la solubilidad del C60 en benceno presenta un máximo en torno a los 313 K. La cristalización a partir de la solución en benceno a temperaturas menores a este máximo provoca la formación de un sólido triclínico solvatado con cuatro moléculas de benceno C60·4C6H6 el cual es bastante inestable al aire. Una vez retirada de la solución esta estructura se descompone formando la típica estructura cristalina cúbica centrada en las caras (cF) del C60 en un par de minutos. A temperaturas por encima de la máxima solubilidad, el solvato no es estable, ni siquiera sumergido en la solución saturada, y funde para formar C60 cF. La cristalización a temperaturas por encima de la solubilidad máxima siempre provoca la formación de cristales puros de C60 cF. Por este mecanismo se pueden hacer crecer cristales a partir de soluciones tanto de los solvatos como de los fullerenos puros.[20][21]
Sólido
[editar]

En su forma sólida, las moléculas de buckminsterfullereno normalmente se adhieren entre sí por medio de fuerzas de Van der Waals; sin embargo la exposición a la luz o al oxígeno puede provocar su dimerización o polimerización. A baja temperatura se ordenan en un arreglo cúbico simple donde se encuentran impedidas para rotar. Al elevar la temperatura, comienzan a rotar en torno a los −20 °C, lo que provoca una transición de fase hacia una estructura cúbica centrada en las caras, y en un pequeño, pero aun así abrupto aumento en la constante de red de 0,1411 a 0,14154 nm.[22]
El C60 es un sólido tan blando como el grafito, pero cuando es comprimido a menos del 70% de su volumen, se transforma en una forma superdura de diamante (ver agregados de nanobarras de diamante). Las películas y soluciones de C60 poseen fuertes propiedades ópticas no lineales, en particular, su absorbancia óptica aumenta con la intensidad de la luz (absorbancia saturable).
El C60 forma un sólido amarronado con una barrera de absorción óptica a aproximadamente 1,6 eV.[23] Es un semiconductor de tipo n, con una baja energía de activación en el orden de 0,1-0,3 eV; esta conductividad es atribuible a defectos intrínsecos del cristal o a defectos causados por su exposición al oxígeno.[24] La celda unitaria del C60 posee huecos en 4 posiciones octaédricas y en 12 posiciones tetraédricas. Estos huecos son lo suficientemente grandes como para acomodar átomos de diferentes tipos. Cuando estos espacios son ocupados por átomos donadores de electrones, tales como los de los metales alcalinos o de algún otro tipo de metal, puede convertirse de semiconductor a conductor, o incluso a superconductor.[22][25]
Estructura de bandas y superconductividad
[editar]
En 1991, Haddon et al.[26] encontraron que la intercalación de átomos de metales alcalinos en C60 sólido lleva a un comportamiento metálico.[27] En 1991, fue publicado que el C60 dopado con potasio se vuelve superconductor a 18 K.[28] Esta fue la mayor temperatura de transición para un superconductor molecular. Desde entonces, la superconductividad ha sido reportada en fullerenos dopados con varios otros metales alcalinos.[29][30] Se ha mostrado que la temperatura de transición superconductora en fullerenos dopados con metales alcalinos se incrementa con el volumen de la celda unitaria.[31][32] Como el cesio forma el ion alcalino más grande, el fullereno dopado con cesio es un material importante en esta familia. Recientemente, la superconductividad a 38 K ha sido reportada en Cs3C60 en gran cantidad,[33] pero solo bajo la aplicación de presión. La más alta temperatura de transición superconductora de 33 K a presión ambiente está reportada para el Cs2RbC60.[34]
El incremento de la temperatura de transición con el volumen de la celda unitaria ha sido creído como evidencia para del mecanismo BCS de la superconductividad del C60 sólido, porque la separación interna del C60 puede ser relacionada con un incremento en la densidad de estados en el nivel de Fermi, N(εF). Por lo tanto, ha habido muchos esfuerzos en incrementar la separación dentro del fullereno, en particular, intercalando moléculas neutras dentro de la red A3C60 para incrementar el espaciado interfullereno mientras que la valencia del C60 se mantiene inalterada. Sin embargo, esta técnica de amoniación ha revelado un nuevo aspecto de los compuestos de intercalación de fullerenos: la transición de Mott y la correlación entre la orientación/orden orbital de las moléculas de C60 y la estructura magnética.[35]

Las moléculas de C60 forman un sólido de moléculas débilmente enlazadas. Los "fulleritos" son por tanto sólidos moleculares, en los cuales las propiedades moleculares se mantienen. Los niveles discretos de una molécula C60 libre están solo débilmente ensanchados en el sólido, lo que lleva a un conjunto de bandas esencialmente no traslapantes con una estrecha anchura de alrededor de 0.5 eV.[27] Para un C60 sólido sin dopar, la banda hu de 5-pliegues es el nivel HOMO, y la banda t1u de 3-pliegues es el nivel LUMO vacío, y este sistema es un aislante de bandas. Pero cuando el C60 sólido es dopado con átomos metálicos, los átomos de metal dan electrones a la banda t1u o a la banda superior de 3-pliegues t1g.[36] Esta parcial ocupación de electrones de la banda puede llevar a un comportamiento metálico. Sin embargo, A4C60 es un aislante, aunque la banda t1u está únicamente llena de manera parcial y debería ser un metal de acuerdo a la teoría de bandas.[37] Este comportamiento no predicho puede ser explicado por el efecto Jahn-Teller, donde las deformaciones espontáneas de las moléculas de alta simetría inducen el desdoblamiento de niveles degenerados para ganar la energía electrónica. La interacción electrón-fonón tipo Jahn-Teller es suficientemente fuerte en los sólidos de C60 para destruir la imagen de bandas para estados de valencia particulares.[35]
Una banda estrecha o un sistema electrónico fuertemente correlacionado y estados basales degenerados son puntos importantes para entender la superconductividad en fullerenos sólidos. Cuando la repulsión Inter electrónica es mayor que el ancho de la banda, se produce un estado basal aislante de electrones localizados en el modelo simple de Mott-Hubbard. Esto explica la ausencia de la superconductividad a presión ambiente en los sólidos de C60 dopados con cesio.[33] La localización mediante correlación electrónica de los electrones t1u excede el valor crítico, llevando hacia el aislante de Mott. La aplicación de alta presión disminuye el espacio interfullereno, por tanto, los sólidos de C60 dopados con cesio se vuelven metálicos y superconductores.
Una teoría completamente desarrollada sobre la superconductividad de los sólidos de C60 es aún necesaria, pero ha sido ampliamente aceptado que las fuertes correlaciones electrónicas y el acoplamiento electrón-fonón de Jahn-Teller[38] producen apareamientos locales de electrones que muestran una alta temperatura de transición cercana a la transición aislante-metal.[39]
Funcionalización
[editar]Fullereno hidratado (HyFn)
[editar]
El fullereno hidratado C60HyFn es un complejo molecular estable y altamente hidrofílico formado por una molécula de fullereno С60 encerrada en un shell o caparazón de moléculas de agua. Esta caparazón corresponde a la primera capa de hidratación y se encuentra constituida por 24 moléculas de agua: C60@(H2O)24. Esta capa de hidratación es el resultado de interacciones de tipo donor-aceptor entre los pares solitarios del oxígeno de las moléculas de agua, y los centros aceptores de electrones de la superficie de la molécula de fullereno. Además las moléculas de agua que forman esta primera capa se encuentran interconectadas por una red tridimensional de puentes de hidrógeno. El tamaño del C60HyFn es de aproximadamente 1,6–1,8 nm. La máxima concentración lograda en el año 2010 para una solución acuosa de С60 en la forma de C60HyFn es de 4 mg/mL.[40] [41][42][43]
Aplicaciones tecnológicas
[editar]La molécula de C60 puede ligar un gran número de átomos de hidrógeno (más de uno por cada átomo de carbono) sin alterar su estructura. Esta propiedad sugiere que el C60 podría ser un mejor medio de almacenamiento para el hidrógeno que los hidruros metálicos (actualmente reconocidos como los mejores materiales para tal propósito), pudiéndose convertir en un factor clave para el desarrollo de nuevas baterías e incluso de automóviles no contaminantes propulsados por celdas de combustible más livianas y más eficientes que las clásicas baterías ácidas de plomo.[10]
Las propiedades de absorción ópticas del C60 coinciden con el espectro solar, lo cual favorece el desarrollo de películas basadas en el C60 para aplicaciones fotovoltaicas. Se han reportado eficiencias de conversión superiores al 5,7% en algunas celdas de polímeros de fullereno.[44]
Algunos experimentos sugieren que el C60 al cual se le han añadido metales alcalinos posee propiedades catalíticas similares a las del platino.[10]
Aplicaciones médicas
[editar]Las moléculas de C60 pueden enjaular y transportar átomos hasta otras moléculas dentro del cuerpo humano (como a los marcadores radioactivos). Por ejemplo, el carburo de lantano (LaC2) que reacciona violentamente con el vapor de agua y el oxígeno, degradándose rápidamente expuesto al aire ambiental, ha sido exitosamente protegido al ser encerrado dentro de la molécula de C60, manteniéndose estable durante más de seis meses.[10] Algunos elementos tales como el helio (que puede ser detectado en cantidades minúsculas) puede ser utilizado como marcador químico en buckibolas impregnadas.
El buckminsterfullereno podría además inhibir al virus del sida. La molécula de C60 aparentemente sería capaz de bloquear el sitio activo de una enzima clave para la replicación del virus conocida como proteasa VIH-1; esto impediría la replicación del virus dentro de las células del sistema inmune.[cita requerida]
Aceites con C60 y riesgos
[editar]Un experimento en 2011-2012 suministró a roedores una disolución de C60 en aceite de oliva, logrando así que sus vidas se prolongasen mucho más.[45] Desde entonces, diversos aceites con C60 son comercializados como antioxidantes para consumo humano, pero un experimento posterior mostró que la exposición a la luz degradaba a esos aceites, volviéndolos tóxicos y haciendo que incrementasen 'masivamente' el riesgo de contraer cáncer (tumores).[46][47]
Para evitar ese riesgo, los aceites con C60 deberían ser producidos en ambientes muy oscuros, embotellados en recipientes de la mayor opacidad posible, y guardados en la oscuridad, siendo además conveniente el consumirlos en lugares poco luminosos y el advertir mediante etiquetas de los peligros que tiene la luz para esos productos.[46][48]
Algunas empresas han conseguido disolver C60 en agua para evitar posibles problemas con el aceite, pero en principio eso no protege al C60 de la luz, por lo que habría que tomar las mismas precauciones.[48]
Por otra parte, el C60 tarda en ser completamente desalojado del cuerpo, especialmente del hígado, donde tiende a acumularse más, lo cual potencialmente podría tener algún efecto problemático para la salud.[49]
Véase también
[editar]Referencias
[editar]- ↑ Número CAS
- ↑ Eiji Ōsawa (2002). Perspectives of fullerene nanotechnology. Springer. pp. 275-. ISBN 978-0-7923-7174-8. Consultado el 26 de diciembre de 2011.
- ↑ Kroto, H. W.; Heath, J. R.; O'Brien, S. C.; Curl, R. F.; Smalley, R. E. (1985). «C60: Buckminsterfullerene». Nature 318 (6042): 162-163. Bibcode:1985Natur.318..162K. doi:10.1038/318162a0.
- ↑ Howard, Jack B.; McKinnon, J. Thomas; Makarovsky, Yakov; Lafleur, Arthur L.; Johnson, M. Elaine (1991). «Fullerenes C60 and C70 in flames». Nature 352 (6331): 139-41. PMID 2067575. doi:10.1038/352139a0.
- ↑ Howard, J; Lafleur, A; Makarovsky, Y; Mitra, S; Pope, C; Yadav, T (1992). «Fullerenes synthesis in combustion». Carbon 30 (8): 1183. doi:10.1016/0008-6223(92)90061-Z.
- ↑ Arndt, Markus; Nairz, Olaf; Vos-Andreae, Julian; Keller, Claudia; Van Der Zouw, Gerbrand; Zeilinger, Anton (1999). «Wave-particle duality of C60». Nature 401 (6754): 680-2. Bibcode:1999Natur.401..680A. PMID 18494170. doi:10.1038/44348.
- ↑ The AZo Journal of Materials Online. AZoM™.com. "Buckminsterfullerene." 2006. Consultado el 4 de enero de 2011.
- ↑ a b c Katz, 363
- ↑ Katz, 368
- ↑ a b c d Properties of Buckminsterfullerene. Ming Kai College, Hong Kong
- ↑ a b c Buckminsterfullerene, C60. University of Bristol. Chm.bris.ac.uk (1996-10-13). Consultado el 25-12-2011.
- ↑ Katz, 369–370
- ↑ Katz, 364
- ↑ Buckminsterfullerene and Buckyballs – Definition, Discovery, Structure, Production, Properties and A. AZoM.com. 15 de julio de 2006
- ↑ Katz, 374
- ↑ Beck, Mihály T.; Mándi, Géza (1997). «Solubility of C60». Fullerenes, Nanotubes and Carbon Nanostructures 5 (2): 291. doi:10.1080/15363839708011993.
- ↑ Bezmel'nitsyn, V.N.; Eletskii, A.V.; Okun', M.V. (1998). «Fullerenes in solutions». Physics-Uspekhi 41 (11): 1091. Bibcode:1998PhyU...41.1091B. doi:10.1070/PU1998v041n11ABEH000502.
- ↑ Ruoff, R. S.; Tse, Doris S.; Malhotra, Ripudaman; Lorents, Donald C. (1993). «Solubility of fullerene (C60) in a variety of solvents». Journal of Physical Chemistry 97 (13): 3379. doi:10.1021/j100115a049.
- ↑ Science of fullerenes and carbon nanotubes. Academic Press. 20 de febrero de 1996. p. 437–. ISBN 978-0-12-221820-0. Consultado el 26 de diciembre de 2011.
- ↑ Talyzin, A.V. (1997). «Phase Transition C60−C60*4C6H6in Liquid Benzene». Journal of Physical Chemistry B 101 (47): 9679. doi:10.1021/jp9720303.
- ↑ Talyzin, A.V.; Engström, I. (1998). «C70 in Benzene, Hexane, and Toluene Solutions». Journal of Physical Chemistry B 102 (34): 6477. doi:10.1021/jp9815255.
- ↑ a b Katz, 372
- ↑ Katz, 361
- ↑ Katz, 379
- ↑ Kaz, 381
- ↑ Haddon, R. C.; Hebard, A. F.; Rosseinsky, M. J.; Murphy, D. W.; Duclos, S. J.; Lyons, K. B.; Miller, B.; Rosamilia, J. M. et al. (1991). «Conducting films of C60 and C70 by alkali-metal doping». Nature 350 (6316): 320. Bibcode:1991Natur.350..320H. doi:10.1038/350320a0.
- ↑ a b Gunnarsson, O. (1997). «Superconductivity in fullerides». Reviews of Modern Physics 69 (2): 575. Bibcode:1997RvMP...69..575G. arXiv:cond-mat/9611150. doi:10.1103/RevModPhys.69.575.
- ↑ Hebard, A. F.; Rosseinsky, M. J.; Haddon, R. C.; Murphy, D. W.; Glarum, S. H.; Palstra, T. T. M.; Ramirez, A. P.; Kortan, A. R. (1991). «Superconductivity at 18 K in potassium-doped C60». Nature 350 (6319): 600. Bibcode:1991Natur.350..600H. doi:10.1038/350600a0.
- ↑ «Superconductivity at 28 K in Rb_{x}C_{60}». Physical Review Letters 66: 2830. 1991. Bibcode:1991PhRvL..66.2830R. doi:10.1103/PhysRevLett.66.2830.
- ↑ Chen, C.-C.; Kelty, S. P.; Lieber, C. M. (1991). «(RbxK1-x)3C60 Superconductors: Formation of a Continuous Series of Solid Solutions». Science 253 (5022): 886-8. Bibcode:1991Sci...253..886C. PMID 17751824. doi:10.1126/science.253.5022.886.
- ↑ Zhou, O.; Zhu, Q.; Fischer, J. E.; Coustel, N.; Vaughan, G. B. M.; Heiney, P. A.; McCauley, J. P.; Smith, A. B. (1992). «Compressibility of M3C60 Fullerene Superconductors: Relation Between Tc and Lattice Parameter». Science 255 (5046): 833-5. Bibcode:1992Sci...255..833Z. PMID 17756430. doi:10.1126/science.255.5046.833.
- ↑ «Pressure dependence of superconductivity in the Na_{2}Rb_{0.5}Cs_{0.5}C_{60} fulleride». Physical Review B 59: 4439. 1999. Bibcode:1999PhRvB..59.4439B. doi:10.1103/PhysRevB.59.4439.
- ↑ a b
Ganin, Alexey Y.; Takabayashi, Yasuhiro; Khimyak, Yaroslav Z.; Margadonna, Serena; Tamai, Anna; Rosseinsky, Matthew J.; Prassides, Kosmas (2008). «Bulk superconductivity at 38 K in a molecular system». Nature 7 (5): 367
|página=y|páginas=redundantes (ayuda). Bibcode:2008NatMa...7..367G. PMID 18425134. doi:10.1038/nmat2179. Texto «2» ignorado (ayuda) - ↑ Tanigaki, K.; Ebbesen, T. W.; Saito, S.; Mizuki, J.; Tsai, J. S.; Kubo, Y.; Kuroshima, S. (1991). «Superconductivity at 33 K in CsxRbyC60». Nature 352 (6332): 222-223. Bibcode:1991Natur.352..222T. doi:10.1038/352222a0.
- ↑ a b Iwasa, Y; Takenobu, T (2003). «Superconductivity, Mott Hubbard states, and molecular orbital order in intercalated fullerides». Journal of Physics: Condensed Matter 15 (13): R495. Bibcode:2003JPCM...15R.495I. doi:10.1088/0953-8984/15/13/202.
- ↑ «Electronic structure of crystalline K_{6}C_{60}». Physical Review Letters 67: 1610. 1991. Bibcode:1991PhRvL..67.1610E. doi:10.1103/PhysRevLett.67.1610.
- ↑ «Electronic structure of superconducting Ba_{6}C_{60}». Physical Review B 47: 14657. 1993. Bibcode:1993PhRvB..4714657E. arXiv:cond-mat/9301006. doi:10.1103/PhysRevB.47.14657.
- ↑ «Strong Superconductivity with Local Jahn-Teller Phonons in C_{60} Solids». Physical Review Letters 90: 167006. 2003. Bibcode:2003PhRvL..90p7006H. PMID 12731998. doi:10.1103/PhysRevLett.90.167006.
- ↑
Capone, M.; Fabrizio, M; Castellani, C; Tosatti, E (2002). «Strongly Correlated Superconductivity». Science 296 (5577): 2634
|página=y|páginas=redundantes (ayuda). Bibcode:2002Sci...296.2364C. PMID 12089436. arXiv:cond-mat/0207058. doi:10.1126/science.1071122. - ↑ Fullerene Hydration
- ↑ Andrievsky, G; Klochkov, V.K.; Bordyuh, A.B.; Dovbeshko, G.I. (2002). «Comparative analysis of two aqueous-colloidal solutions of C60 fullerene with help of FTIR reflectance and UV–Vis spectroscopy». Chemical Physics Letters 364: 8. Bibcode:2002CPL...364....8A. doi:10.1016/S0009-2614(02)01305-2.
- ↑ Andrievsky, G.; Klochkov, V.; Derevyanchenko, L. (2005). «Is the C 60 Fullerene Molecule Toxic?!». Fullerenes, Nanotubes, and Carbon Nanostructures 13 (4): 363. doi:10.1080/15363830500237267.
- ↑ Andrievsky, GV; Bruskov, VI; Tykhomyrov, AA; Gudkov, SV (2009). «Peculiarities of the antioxidant and radioprotective effects of hydrated C60 fullerene nanostuctures in vitro and in vivo». Free radical biology & medicine 47 (6): 786-93. PMID 19539750. doi:10.1016/j.freeradbiomed.2009.06.016.
- ↑ Katz, 385 ff.
- ↑ Baati, Tarek; Bourasset, Fanchon; Gharbi, Najla; Njim, Leila; Abderrabba, Manef; Kerkeni, Abdelhamid; Szwarc, Henri; Moussa, Fathi (2012-06). «The prolongation of the lifespan of rats by repeated oral administration of [60]fullerene». Biomaterials 33 (19): 4936-4946. ISSN 1878-5905. PMID 22498298. doi:10.1016/j.biomaterials.2012.03.036. Consultado el 15 de abril de 2021.
- ↑ a b Grohn, Kristopher J.; Moyer, Brandon S.; Wortel, Danique C.; Fisher, Cheyanne M.; Lumen, Ellie; Bianchi, Anthony H.; Kelly, Kathleen; Campbell, Paul S. et al. (29 de octubre de 2020). «C60 in olive oil causes light-dependent toxicity / Toxicidad por luz en C60 con aceite de oliva». GeroScience (en inglés). ISSN 2509-2723. doi:10.1007/s11357-020-00292-z. Consultado el 15 de abril de 2021.
- ↑ Grohn, Kristopher J. «Comp grad leads research». Weyburn Review.
- ↑ a b Nature. «Degradation of C60 by light».
- ↑ Xenobiotica. «Disposition of fullerene C60 in rats following intratracheal or intravenous administration».
Bibliografía
[editar]- Katz, E. A. (2006). «Fullerene Thin Films as Photovoltaic Material». En Sōga, Tetsuo, ed. Nanostructured materials for solar energy conversion. Elsevier. pp. 361-443. ISBN 9780444528445.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Fullerenos.
Wikimedia Commons alberga una categoría multimedia sobre Fullerenos.- Buckminsterfullereno en el Libro del Web de Química del NIST
- Ficha de seguridad del Departamento de Química de la Universidad de Akron (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Esta obra contiene una traducción derivada de «Buckminsterfullerene» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.

