Diferencia entre revisiones de «Hidrocarburo»
m Revertidos los cambios de 200.123.249.24 (disc.) a la última edición de SeroBOT Etiqueta: Reversión |
Sin resumen de edición |
||
| Línea 1: | Línea 1: | ||
{{En desarrollo|1=Enmanuel1002|t=20190618145004}} |
|||
{{referencias|t=20171129173838}} |
{{referencias|t=20171129173838}} |
||
| Línea 62: | Línea 63: | ||
* '''10-21,9''' - pesado |
* '''10-21,9''' - pesado |
||
* '''< 9,9''' - extrapesado |
* '''< 9,9''' - extrapesado |
||
== Propiedades generales == |
|||
Debido a las diferencias en la estructura molecular, la fórmula empírica sigue siendo diferente entre los hidrocarburos; en los alcanos lineales o de "cadena recta", los alcanos y los alquenos, la cantidad de hidrógeno enlazado disminuye en los alcanos y los alquinos debido a la "autovinculación" o catenación del carbono que impide la saturación completa del hidrocarburo mediante la formación de enlaces dobles o triples. |
|||
Esta capacidad inherente de los hidrocarburos para unirse a sí mismos se conoce como [[catenación]], y permite que los hidrocarburos formen moléculas más complejas, como el [[ciclohexano]], y en casos más raros, [[arenes]] como el [[benceno]]]. Esta capacidad proviene del hecho de que el carácter de enlace entre los átomos de carbono es enteramente [[no polar]], en el sentido de que la distribución de electrones entre los dos elementos se debe de alguna manera a los mismos valores [[electronegatividad]] de los elementos (~0.30), y no resulta en la formación de un [[electrofilo]]. |
|||
Generalmente, con la catenación viene la pérdida de la cantidad total de hidrocarburos enlazados y un aumento en la cantidad de energía requerida para la división de la unión debido a la tensión ejercida sobre la molécula; en moléculas como el ciclohexano, esto se conoce como [[tensión del anillo]], y ocurre debido a la configuración electrónica espacial "desestabilizada" del átomo. |
|||
En química simple, según la [[teoría de la unión de valencia]], el átomo de carbono debe seguir la regla del 4-hidrógeno, que establece que el número máximo de átomos disponibles para unirse con el carbono es igual al número de electrones que son atraídos hacia la capa externa del carbono. En términos de capas, el carbono consiste en una capa externa incompleta, que comprende 4 electrones, y por lo tanto tiene 4 electrones disponibles para [[enlace covalente|enlaces covalentes]] o [[enlace dativo|enlaces dativos]]. |
|||
Los hidrocarburos son [[hidrofóbicos]] como los [[lípidos]]. |
|||
Algunos hidrocarburos también son abundantes en el [[sistema solar]]. Se han encontrado lagos de metano y etano líquido en la luna más grande de [[Titan (luna)|Titan]], [[Saturno]], confirmada por la [[Mision Cassini-Huygens]]. <ref>[http://www.jpl.nasa.gov/news/news.php?release=2013-364 NASA's Cassini Spacecraft Reveals Clues About Saturn Moon] {{webarchive|url=https://web.archive.org/web/20140902080814/http://www.jpl.nasa.gov/news/news.php?release=2013-364 |date=2 September 2014 }}. NASA (December 12, 2013)</ref> Los hidrocarburos también son abundantes en las nebulosas que forman [[hidrocarburo aromático policíclico]] (PAH).<ref>{{cite journal|doi=10.1093/mnras/stu454|arxiv=1403.1856|title=PAH formation in O-rich planetary nebulae|journal=Monthly Notices of the Royal Astronomical Society|volume=441|pages=364|year=2014|last1=Guzman-Ramirez|first1=L.|last2=Lagadec|first2=E.|last3=Jones|first3=D.|last4=Zijlstra|first4=A. A.|last5=Gesicki|first5=K.|bibcode=2014MNRAS.441..364G}}</ref> |
|||
== Uso == |
|||
[[Archivo:ShellMartinez-refi.jpg|thumb|right|upright=1.54|[[refinería de petróleo|Refinerías de petróleo]]] son una de las formas en que se procesan los hidrocarburos para su uso. El [[petróleo crudo]] se procesa en varias etapas para formar hidrocarburos deseados, usados como combustible y en otros productos.]] |
|||
[[Archivo:2018-05-04 (303) Tank wagon 33 80 7920 362-0 with hydrocarbon gas at Bahnhof Enns.jpg|thumb|Vagón cisterna 33 80 7920 362-0 con gas hidrocarburo en Bahnhof Enns (2018).]] |
|||
Los hidrocarburos son una fuente de energía primaria para las civilizaciones actuales. El uso predominante de los hidrocarburos es como fuente de combustible [[combustible]]. En su forma sólida, los hidrocarburos toman la forma de asfalto ([[betún]]). |
|||
Las mezclas de hidrocarburos [[Volatilidad (química)|volátiles]] se utilizan ahora con preferencia a los [[clorofluorocarbonos]] como [[propulsor]] para [[aerosoles]], debido al impacto de los clorofluorocarbonos en la [[capa de ozono]]. |
|||
El [[metano]] (CH<sub>4</sub>) y el [[etano]] (C<sub>2</sub>H<sub>6</sub>) son gaseosos a [[temperatura ambiente]] y no pueden ser fácilmente [[Liquefacción|liquidados]] por presión sola. El [[Propano]] (C<sub>3</sub>H<sub>8</sub>) es, sin embargo, fácil de licuar, y existe en 'botellas de propano' principalmente como líquido. El [[butano]] (C<sub>4</sub>H<sub>10</sub>) es tan fácil de licuar que proporciona un combustible seguro y volátil para pequeñas bolsas [[Lighter|lighters]]. El [[pentano]] (C<sub>5</sub>H<sub>12</sub>) es un líquido incoloro a temperatura ambiente, comúnmente utilizado en química e industria como un poderoso [[solvente]] casi inodoro de ceras y compuestos orgánicos de alto peso molecular, incluyendo [[Grasa (lubricante)|grasas]]. El [[Hexano]] (C<sub>6</sub>H<sub>14</sub>) es también un solvente no polar y no aromático ampliamente utilizado, así como una fracción significativa de [[gasolina]] común. |
|||
Los C<sup>6</sup> hasta C<sup>10</sup> alcanos, los alcanos y cicloalcanos isoméricos son los componentes principales de las mezclas de [[gasolina]], [[nafta de petróleo|nafta]], [[combustible para aviones]] y solventes industriales especializados. Con la adición progresiva de unidades de carbono, los hidrocarburos simples estructurados sin anillo tienen [[viscosidad|viscosidades]] más altas, índices de lubricación, puntos de ebullición, temperaturas de [[solidificación]] y un color más profundo. En el extremo opuesto del metano se encuentran los alquitranes pesados que permanecen como la ''fracción más baja'' en una réplica de refinación de petróleo crudo. Se recogen y se utilizan ampliamente como compuestos para techos, composición de pavimentos, conservantes de la madera (la serie [[creosota]]) y como líquidos extremadamente resistentes al cizallamiento de alta viscosidad. |
|||
El uso de hidrocarburos también es frecuente en la naturaleza. Algunos artrópodos eusociales, como la abeja brasileña sin aguijón, ''[[Schwarziana quadripunctata]]'', utilizan "olores" únicos de hidrocarburos para determinar el parentesco entre no parientes. La composición química de los hidrocarburos varía entre edad, sexo, ubicación del nido y posición jerárquica. <ref name=nunes09>{{cite journal|last=Nunes|first=T.M.|last2=Turatti|first2=I.C.C.|last3=Mateus|first3=S.|last4=Nascimento|first4=F.S.|last5=Lopes|first5=N.P.|last6=Zucchi|first6=R.|year=2009|title=Cuticular Hydrocarbons in the Stingless Bee Schwarziana quadripunctata (Hymenoptera, Apidae, Meliponini): Differences between Colonies, Castes and Age|journal=Genetics and Molecular Research|volume=8|issue=2|pages=589–595|url=http://www.funpecrp.com.br/gmr/year2009/vol8-2/pdf/kerr012.pdf|doi=10.4238/vol8-2kerr012|pmid=19551647|deadurl=no|archiveurl=https://web.archive.org/web/20150926031231/http://www.funpecrp.com.br/gmr/year2009/vol8-2/pdf/kerr012.pdf|archivedate=26 September 2015|df=dmy-all}}</ref> |
|||
== Toxicidad == |
|||
El [[envenenamiento]] por hidrocarburos como el de [[benceno]] y el [[petróleo]] suelen producirse accidentalmente por inhalación o ingestión de estos compuestos químicos [[citotóxicos]]. [[Inyección intravenosa]] o [[inyección subcutánea|subcutánea]] de compuestos de petróleo con la intención del [[suicidio]] o [[abuso]] es un evento extraordinario que puede resultar en daño local o toxicidad sistémica como [[necrosis tisular]], formación de [[absceso]], fallo del [[sistema respiratorio]] y daño parcial [[daño renal|en los riñones]], el cerebro y el sistema nervioso. Moaddab y Eskandarlou informan de un caso de necrosis de la pared torácica y [[empyema]] resultante de un intento de suicidio por inyección de petróleo en la [[cavidad pleural]].<ref>{{cite journal | last1 = Eskandarlou | first1 = M | last2 = Moaddab | first2 = AH | date = Aug 2010 | title = Chest wall necrosis and empyema resulting from attempting suicide by injection of petroleum into the pleural cavity | url = | journal = Emerg Med J | volume = 27 | issue = 8| pages = 616–8 | doi = 10.1136/emj.2009.073486 | pmid=20558490}}</ref> |
|||
== Reacciones == |
|||
Hay tres tipos principales de reacciones de hidrocarburos: |
|||
*[[Reacción de sustitución]] |
|||
*[[Reacción de adición]] |
|||
*[[Combustión]] |
|||
=== Reacciones de sustitución === |
|||
Las reacciones de sustitución sólo se producen en hidrocarburos saturados (enlaces carbono-carbono simples). En esta reacción, un alcano reacciona con una molécula de cloro. Uno de los átomos de cloro desplaza a un átomo de hidrógeno. Esto forma ácido clorhídrico así como el hidrocarburo con un átomo de cloro. |
|||
:CH<sub>4</sub> + Cl<sub>2</sub> → CH<sub>3</sub>Cl + HCl |
|||
:CH<sub>3</sub>Cl + Cl<sub>2</sub> → CH<sub>2</sub>Cl<sub>2</sub> + HCl |
|||
hasta CCl<sub>4</sub> ([[tetracloruro de carbono]]) |
|||
:C<sub>2</sub>H<sub>6</sub> + Cl<sub>2</sub> → C<sub>2</sub>H<sub>5</sub>Cl + HCl |
|||
:C<sub>2</sub>H<sub>4</sub>Cl<sub>2</sub> + Cl<sub>2</sub> → C<sub>2</sub>H<sub>3</sub>Cl<sub>3</sub> + HCl |
|||
hasta C<sub>2</sub>Cl<sub>6</sub> ([[hexacloroetano]]) |
|||
===Reacciones de adición === |
|||
Las reacciones de adición involucran a los alquenos y a los alquinos. En esta reacción una molécula [[halógena]] rompe el enlace doble o triple en el hidrocarburo y forma un enlace. |
|||
=== Combustión === |
|||
{{Principal|Combustión}} |
|||
Los hidrocarburos son actualmente la principal fuente de [[energía eléctrica]] y de calor (como la calefacción de los hogares) debido a la energía que se produce cuando se quema.<ref name="World Coal">[http://www.worldcoal.org/coal/uses-of-coal/coal-electricity/ World Coal, Coal and Electricity] {{webarchive|url=https://web.archive.org/web/20151022093430/http://www.worldcoal.org/coal/uses-of-coal/coal-electricity/ |date=22 October 2015 }}. World Coal Association</ref> A menudo esta energía se utiliza directamente como calor, como en los calentadores domésticos, que utilizan ya sea [[petróleo]] o [[gas natural]]. El hidrocarburo se quema y el calor se utiliza para calentar el agua, que luego circula. Un principio similar se utiliza para crear [[energía eléctrica]] en [[centrales eléctricas]]. |
|||
Las propiedades comunes de los hidrocarburos son el hecho de que producen vapor, [[dióxido de carbono]] y calor durante la [[combustión]] y el [[oxígeno]] es necesario para que se produzca la combustión. El hidrocarburo más simple, [[metano]], se quema de la siguiente manera: |
|||
:CH<sub>4</sub> + 2 O<sub>2</sub> → 2 H<sub>2</sub>O + CO<sub>2</sub> + energía |
|||
En un suministro inadecuado de aire, se forman el gas [[monóxido de carbono]] y el [[vapor de agua]]: |
|||
:2 CH<sub>4</sub> + 3 O<sub>2</sub> → 2 CO + 4 H<sub>2</sub>O |
|||
Otro ejemplo es la combustión de [[propano]]: |
|||
:C<sub>3</sub>H<sub>8</sub> + 5 O<sub>2</sub> → 4 H<sub>2</sub>O + 3 CO<sub>2</sub> + energía |
|||
Y finalmente, para cualquier [[Alcano#Alcanos lineales|alcano liner]] de n átomos de carbono, |
|||
:C<sub>''n''</sub>H<sub>2''n''+2</sub> + {{sfrac|3''n'' + 1|2}} O<sub>2</sub> → (''n'' + 1) H<sub>2</sub>O + ''n'' CO<sub>2</sub> + energía |
|||
La quema de hidrocarburos es un ejemplo de una reacción química [[reacción exotérmica|exotérmica]]. |
|||
Los hidrocarburos también pueden ser quemados con [[flúor]] elemental, resultando en productos [[tetrafluoruro de carbono]] y [[fluoruro de hidrógeno]]. |
|||
==== Petroleo ==== |
|||
{{Principal|Petroleo}} |
|||
[[File:Korna natural oil seep 1.JPG|thumb|upright=1.36|Fuente de petróleo natural en [[Korňa]], [[Eslovaquia]]]] |
|||
Los hidrocarburos extraídos en forma líquida se denominan [[petróleo]] (literalmente "aceite de roca") o [[aceite mineral]], mientras que los hidrocarburos en forma gaseosa se denominan [[gas natural]]. El petróleo y el gas natural se encuentran en el subsuelo de la Tierra con las herramientas de [[geología del petróleo]] y son una fuente importante de combustible y materias primas para la producción de [[química orgánica|productos químicos orgánicos]]. |
|||
La extracción de combustible líquido de hidrocarburos de [[cuenca sedimentaria|cuencas sedimentarias]] es parte integral del [[desarrollo energético]] moderno. Los hidrocarburos son [[minar|minados]] de [[arenas bituminosas]] y [[esquisto bituminoso]], y potencialmente extraídos de [[hidrato de metano]] sedimentario. Estas reservas requieren [[destilación]] y mejoras para producir [[crudo sintético]] y petróleo. |
|||
Las [[reservas de petróleo]] en [[Roca sedimentaria|rocas sedimentarias]]] son la fuente de hidrocarburos para las industrias de [[Industria energética|energía]], [[transporte]] y [[petroquímica]]. |
|||
Los hidrocarburos de importancia económica incluyen los [[combustibles fósiles]] tales como [[carbón]], petróleo y [[gas natural]], y sus derivados tales como [[plástico]]s,[[parafina]]s, [[cera]]s, [[solvente]]s y aceites. Los hidrocarburos – junto con [[NOx|NO<sub>''x''</sub>]] y la [[luz solar]]. – contribuye a la formación de [[ozono troposférico]] y los [[gases de efecto invernadero]]. |
|||
==== Biorremediación ==== |
|||
Las bacterias en la [[gabro|capa gabróica]] de la corteza del océano pueden degradar los hidrocarburos; pero el medio ambiente extremo dificulta la investigación<ref>{{cite journal|vauthors=Mason OU, Nakagawa T, Rosner M, Van Nostrand JD, Zhou J, Maruyama A, Fisk MR, Giovannoni SJ |title=First investigation of the microbiology of the deepest layer of ocean crust.|date=2010|pmid=21079766|doi=10.1371/journal.pone.0015399|volume=5|issue=11|pmc=2974637|journal=PLoS ONE|pages=e15399|bibcode=2010PLoSO...515399M}}</ref> Otras bacterias como ''[[Lutibacterium anuloederans]]'' también pueden degradar hidrocarburos.<ref>{{cite journal |
|||
| year=2007 |
|||
| title=Obligate oil-degrading marine bacteria |
|||
| journal=Curr. Opin. Biotechnol. |
|||
| volume=18 |
|||
| pages=257–266 |
|||
| doi=10.1016/j.copbio.2007.04.006 |
|||
| pmid=17493798 |
|||
| issue=3|citeseerx=10.1.1.475.3300| author1=Yakimov |
|||
| first1=M. M. |
|||
| last2=Timmis |
|||
| first2=K. N. |
|||
| last3=Golyshin |
|||
| first3=P. N. |
|||
}} |
|||
</ref> |
|||
Es posible la [[micorremediación]] o descomposición de hidrocarburos por [[micelio]] y [[setas]].<ref>Stamets, Paul (2005) "[http://www.ted.com/talks/paul_stamets_on_6_ways_mushrooms_can_save_the_world?language=en Mycoremediation] {{webarchive|url=https://web.archive.org/web/20141031151149/http://www.ted.com/talks/paul_stamets_on_6_ways_mushrooms_can_save_the_world?language=en |date=31 October 2014 }}", Ch. 7, p. 86, in ''Mycelium Running: How Mushrooms Can Help Save the World''. {{ISBN|9781580085793}}</ref> |
|||
===Seguridad=== |
|||
Muchos hidrocarburos son altamente [[inflamables]]; por lo tanto, se debe tener cuidado para evitar lesiones. El [[benceno]] y muchos [[hidrocarburos aromáticos]]] son posibles [[carcinógeno]]s, y se debe usar el equipo de seguridad adecuado para evitar que estos compuestos dañinos entren en el cuerpo. Si los hidrocarburos se queman en áreas estrechas, se puede formar [[monóxido de carbono]] tóxico. Los hidrocarburos deben mantenerse alejados de los compuestos [[flúor]] debido a la alta probabilidad de formación de compuestos tóxicos [[ácido fluorhídrico]]. |
|||
== Impacto ambiental == |
|||
Los hidrocarburos se introducen en el medio ambiente a través de su uso extensivo como combustibles y productos químicos, así como a través de fugas o derrames accidentales durante la exploración, producción, refinación o transporte. La contaminación antropogénica del suelo por hidrocarburos es un grave problema mundial debido a la persistencia de los contaminantes y al impacto negativo en la salud humana<ref>{{Cite web|url=https://www.researchgate.net/publication/226738847_Microbial_Degradation_of_Alkanes|title=Microbial Degradation of Alkanes (PDF Download Available)|website=ResearchGate|language=en|access-date=2017-02-23|deadurl=no|archiveurl=https://web.archive.org/web/20170224053341/https://www.researchgate.net/publication/226738847_Microbial_Degradation_of_Alkanes|archivedate=24 February 2017|df=dmy-all}}</ref> |
|||
== Hidrocarburos sustituidos == |
== Hidrocarburos sustituidos == |
||
| Línea 74: | Línea 185: | ||
{{VT|Compuesto organohalogenado}} |
{{VT|Compuesto organohalogenado}} |
||
== Toxicología == |
|||
Las [[intoxicación|intoxicaciones]] por hidrocarburos tienden a causar cuadros respiratorios relativamente severos. La [[gasolina]], el [[queroseno]] y los aceites y/o barnices para el tratamiento de muebles, que contienen hidrocarburos, son los agentes más comúnmente implicados en las intoxicaciones. El tratamiento a menudo requiere [[intubación]] y [[ventilación mecánica]]. Inducir el [[vómito]] en estos sujetos está contraindicado porque puede causar más daño [[esófago|esofágico]]. |
|||
==Microorganismos que degradan los hidrocarburos== |
==Microorganismos que degradan los hidrocarburos== |
||
| Línea 99: | Línea 206: | ||
* [[Malteno]] |
* [[Malteno]] |
||
* [[Cicloalcano]] |
* [[Cicloalcano]] |
||
* [[Hidrocarburo |
* [[Hidrocarburo aromatico]] |
||
* [[Petróleo]] |
* [[Petróleo]] |
||
* [[Petroquímica]] |
* [[Petroquímica]] |
||
* [[Derivados del petróleo]] |
* [[Derivados del petróleo]] |
||
== Refeferencias == |
|||
{{listaref}} |
|||
== Enlaces externos == |
== Enlaces externos == |
||
| Línea 110: | Línea 219: | ||
[[Categoría:Hidrocarburos |
[[Categoría:Hidrocarburos]] |
||
Revisión del 14:50 18 jun 2019
Los hidrocarburos son compuestos orgánicos formados únicamente por átomos de carbono e hidrógeno. Son los compuestos básicos que estudia la química orgánica.
Las cadenas de átomos de carbono pueden ser lineales o ramificadas, y abiertas o cerradas. Los que tienen en su molécula otros elementos químicos (heteroátomos) se llaman hidrocarburos sustituidos.
La mayoría de los hidrocarburos que se encuentran en nuestro planeta ocurren naturalmente en el petróleo crudo, donde la materia orgánica descompuesta proporcionó una abundancia de carbono e hidrógeno, los que pudieron catenarse para formar cadenas aparentemente ilimitadas. Los hidrocarburos pueden encontrarse también en algunos planetas sin necesidad de que haya habido vida para generar petróleo, como en Júpiter, Saturno, Titán y Neptuno, compuestos parcialmente por hidrocarburos como el metano o el etano.
Clasificación

Los hidrocarburos se pueden clasificar en dos tipos: alifáticos y aromáticos. Los alifáticos se pueden clasificar a su vez en alcanos, alquenos y alquinos según los tipos de enlace que unen entre sí los átomos de carbono. Las fórmulas generales de los alcanos, alquenos y alquinos son CnH2n+2, CnH2n y CnH2n-2, respectivamente.
Hidrocarburos saturados o alcanos: son compuestos formados por carbono e hidrógeno, presentan enlaces sencillos (SP3). Presenta una fórmula general (CnH2n+2), donde n es el número de carbonos del compuesto y el sufijo o y su terminación es ano.
CH4→ Metano, C2H6→Etano, C3H8→Propano, C4H10→Butano, C5H12→Pentano, C6H14→ Hexano, C7H16→Heptano
C8H18→Octano, C9H20→Nonano, C10H22→Decano.
De acuerdo al tipo de estructuras que pueden formar, los hidrocarburos se pueden clasificar en:
- Hidrocarburos acíclicos, los cuales presentan sus cadenas abiertas. A su vez se clasifican en:
- Hidrocarburos lineales a los que carecen de cadenas laterales
- Hidrocarburos ramificados, los cuales presentan cadenas laterales.
- Hidrocarburos cíclicos o cicloalcanos, que se definen como hidrocarburos de cadena cerrada. Estos a su vez se clasifican como:
- Monocíclicos, que tienen una sola operación de ciclización.
- Policíclicos, que contienen varias operaciones de ciclización.
Los sistemas policíclicos se pueden clasificar por su complejidad en:
- Fusionados, cuando al menos dos ciclos comparten un enlace covalente.

- Espiroalcanos, cuando al menos dos ciclos tienen un solo carbono en común.
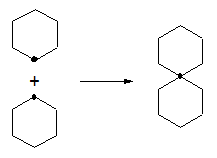
- Puentes Estructuras de von Baeyer, cuando una cadena lateral de un ciclo se conecta en un carbono cualquiera. Si se conectara en el carbono de unión del ciclo con la cadena, se tendría un compuesto espiro. Si la conexión fuera sobre el carbono vecinal de unión del ciclo con la cadena, se tendría un compuesto fusionado. Una conexión en otro carbono distinto a los anteriores genera un puente.

- Agrupaciones, cuando dos ciclos independientes se conectan por medio de un enlace covalente.

- Ciclofanos, cuando a partir de un ciclo dos cadenas se conectan con otro ciclo.

Según los enlaces entre los átomos de carbono, los hidrocarburos se clasifican en:
- Hidrocarburos alifáticos, los cuales carecen de un anillo aromático, que a su vez se clasifican en:
- Hidrocarburos saturados, (alcanos o parafinas), en la que todos sus carbonos tienen cuatro enlaces simples (o más técnicamente, con hibridación sp3).
- Hidrocarburos no saturados o insaturados, que presentan al menos un enlace doble (alquenos u olefinas) o triple (alquino o acetilénico) en sus enlaces de carbono.
- Hidrocarburos aromáticos, los cuales presentan al menos una estructura que cumple la regla de Hückel (Estructura cíclica, que todos sus carbonos sean de hibridación sp2 y que el número de electrones en resonancia sea par no divisible entre 4).
Los hidrocarburos extraídos directamente de formaciones geológicas en estado líquido se conocen comúnmente con el nombre de petróleo, mientras que los que se encuentran en estado gaseoso se les conoce como gas natural.
La explotación comercial de los hidrocarburos constituye una actividad económica de primera importancia, pues forman parte de los principales combustibles fósiles (petróleo y gas natural), así como de todo tipo de plásticos, ceras y lubricantes.
Según los grados API, se clasifican en:
Si es:
- > 40 - condensado
- 30-39,9 - liviano
- 22-29,9 - mediano
- 10-21,9 - pesado
- < 9,9 - extrapesado
Propiedades generales
Debido a las diferencias en la estructura molecular, la fórmula empírica sigue siendo diferente entre los hidrocarburos; en los alcanos lineales o de "cadena recta", los alcanos y los alquenos, la cantidad de hidrógeno enlazado disminuye en los alcanos y los alquinos debido a la "autovinculación" o catenación del carbono que impide la saturación completa del hidrocarburo mediante la formación de enlaces dobles o triples.
Esta capacidad inherente de los hidrocarburos para unirse a sí mismos se conoce como catenación, y permite que los hidrocarburos formen moléculas más complejas, como el ciclohexano, y en casos más raros, arenes como el benceno]. Esta capacidad proviene del hecho de que el carácter de enlace entre los átomos de carbono es enteramente no polar, en el sentido de que la distribución de electrones entre los dos elementos se debe de alguna manera a los mismos valores electronegatividad de los elementos (~0.30), y no resulta en la formación de un electrofilo.
Generalmente, con la catenación viene la pérdida de la cantidad total de hidrocarburos enlazados y un aumento en la cantidad de energía requerida para la división de la unión debido a la tensión ejercida sobre la molécula; en moléculas como el ciclohexano, esto se conoce como tensión del anillo, y ocurre debido a la configuración electrónica espacial "desestabilizada" del átomo.
En química simple, según la teoría de la unión de valencia, el átomo de carbono debe seguir la regla del 4-hidrógeno, que establece que el número máximo de átomos disponibles para unirse con el carbono es igual al número de electrones que son atraídos hacia la capa externa del carbono. En términos de capas, el carbono consiste en una capa externa incompleta, que comprende 4 electrones, y por lo tanto tiene 4 electrones disponibles para enlaces covalentes o enlaces dativos.
Los hidrocarburos son hidrofóbicos como los lípidos.
Algunos hidrocarburos también son abundantes en el sistema solar. Se han encontrado lagos de metano y etano líquido en la luna más grande de Titan, Saturno, confirmada por la Mision Cassini-Huygens. [1] Los hidrocarburos también son abundantes en las nebulosas que forman hidrocarburo aromático policíclico (PAH).[2]
Uso


Los hidrocarburos son una fuente de energía primaria para las civilizaciones actuales. El uso predominante de los hidrocarburos es como fuente de combustible combustible. En su forma sólida, los hidrocarburos toman la forma de asfalto (betún).
Las mezclas de hidrocarburos volátiles se utilizan ahora con preferencia a los clorofluorocarbonos como propulsor para aerosoles, debido al impacto de los clorofluorocarbonos en la capa de ozono.
El metano (CH4) y el etano (C2H6) son gaseosos a temperatura ambiente y no pueden ser fácilmente liquidados por presión sola. El Propano (C3H8) es, sin embargo, fácil de licuar, y existe en 'botellas de propano' principalmente como líquido. El butano (C4H10) es tan fácil de licuar que proporciona un combustible seguro y volátil para pequeñas bolsas lighters. El pentano (C5H12) es un líquido incoloro a temperatura ambiente, comúnmente utilizado en química e industria como un poderoso solvente casi inodoro de ceras y compuestos orgánicos de alto peso molecular, incluyendo grasas. El Hexano (C6H14) es también un solvente no polar y no aromático ampliamente utilizado, así como una fracción significativa de gasolina común. Los C6 hasta C10 alcanos, los alcanos y cicloalcanos isoméricos son los componentes principales de las mezclas de gasolina, nafta, combustible para aviones y solventes industriales especializados. Con la adición progresiva de unidades de carbono, los hidrocarburos simples estructurados sin anillo tienen viscosidades más altas, índices de lubricación, puntos de ebullición, temperaturas de solidificación y un color más profundo. En el extremo opuesto del metano se encuentran los alquitranes pesados que permanecen como la fracción más baja en una réplica de refinación de petróleo crudo. Se recogen y se utilizan ampliamente como compuestos para techos, composición de pavimentos, conservantes de la madera (la serie creosota) y como líquidos extremadamente resistentes al cizallamiento de alta viscosidad.
El uso de hidrocarburos también es frecuente en la naturaleza. Algunos artrópodos eusociales, como la abeja brasileña sin aguijón, Schwarziana quadripunctata, utilizan "olores" únicos de hidrocarburos para determinar el parentesco entre no parientes. La composición química de los hidrocarburos varía entre edad, sexo, ubicación del nido y posición jerárquica. [3]
Toxicidad
El envenenamiento por hidrocarburos como el de benceno y el petróleo suelen producirse accidentalmente por inhalación o ingestión de estos compuestos químicos citotóxicos. Inyección intravenosa o subcutánea de compuestos de petróleo con la intención del suicidio o abuso es un evento extraordinario que puede resultar en daño local o toxicidad sistémica como necrosis tisular, formación de absceso, fallo del sistema respiratorio y daño parcial en los riñones, el cerebro y el sistema nervioso. Moaddab y Eskandarlou informan de un caso de necrosis de la pared torácica y empyema resultante de un intento de suicidio por inyección de petróleo en la cavidad pleural.[4]
Reacciones
Hay tres tipos principales de reacciones de hidrocarburos:
Reacciones de sustitución
Las reacciones de sustitución sólo se producen en hidrocarburos saturados (enlaces carbono-carbono simples). En esta reacción, un alcano reacciona con una molécula de cloro. Uno de los átomos de cloro desplaza a un átomo de hidrógeno. Esto forma ácido clorhídrico así como el hidrocarburo con un átomo de cloro.
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
hasta CCl4 (tetracloruro de carbono)
- C2H6 + Cl2 → C2H5Cl + HCl
- C2H4Cl2 + Cl2 → C2H3Cl3 + HCl
hasta C2Cl6 (hexacloroetano)
Reacciones de adición
Las reacciones de adición involucran a los alquenos y a los alquinos. En esta reacción una molécula halógena rompe el enlace doble o triple en el hidrocarburo y forma un enlace.
Combustión
Los hidrocarburos son actualmente la principal fuente de energía eléctrica y de calor (como la calefacción de los hogares) debido a la energía que se produce cuando se quema.[5] A menudo esta energía se utiliza directamente como calor, como en los calentadores domésticos, que utilizan ya sea petróleo o gas natural. El hidrocarburo se quema y el calor se utiliza para calentar el agua, que luego circula. Un principio similar se utiliza para crear energía eléctrica en centrales eléctricas.
Las propiedades comunes de los hidrocarburos son el hecho de que producen vapor, dióxido de carbono y calor durante la combustión y el oxígeno es necesario para que se produzca la combustión. El hidrocarburo más simple, metano, se quema de la siguiente manera:
- CH4 + 2 O2 → 2 H2O + CO2 + energía
En un suministro inadecuado de aire, se forman el gas monóxido de carbono y el vapor de agua:
- 2 CH4 + 3 O2 → 2 CO + 4 H2O
Otro ejemplo es la combustión de propano:
- C3H8 + 5 O2 → 4 H2O + 3 CO2 + energía
Y finalmente, para cualquier alcano liner de n átomos de carbono,
- CnH2n+2 + 3n + 12 O2 → (n + 1) H2O + n CO2 + energía
La quema de hidrocarburos es un ejemplo de una reacción química exotérmica.
Los hidrocarburos también pueden ser quemados con flúor elemental, resultando en productos tetrafluoruro de carbono y fluoruro de hidrógeno.
Petroleo

Los hidrocarburos extraídos en forma líquida se denominan petróleo (literalmente "aceite de roca") o aceite mineral, mientras que los hidrocarburos en forma gaseosa se denominan gas natural. El petróleo y el gas natural se encuentran en el subsuelo de la Tierra con las herramientas de geología del petróleo y son una fuente importante de combustible y materias primas para la producción de productos químicos orgánicos.
La extracción de combustible líquido de hidrocarburos de cuencas sedimentarias es parte integral del desarrollo energético moderno. Los hidrocarburos son minados de arenas bituminosas y esquisto bituminoso, y potencialmente extraídos de hidrato de metano sedimentario. Estas reservas requieren destilación y mejoras para producir crudo sintético y petróleo.
Las reservas de petróleo en rocas sedimentarias] son la fuente de hidrocarburos para las industrias de energía, transporte y petroquímica.
Los hidrocarburos de importancia económica incluyen los combustibles fósiles tales como carbón, petróleo y gas natural, y sus derivados tales como plásticos,parafinas, ceras, solventes y aceites. Los hidrocarburos – junto con NOx y la luz solar. – contribuye a la formación de ozono troposférico y los gases de efecto invernadero.
Biorremediación
Las bacterias en la capa gabróica de la corteza del océano pueden degradar los hidrocarburos; pero el medio ambiente extremo dificulta la investigación[6] Otras bacterias como Lutibacterium anuloederans también pueden degradar hidrocarburos.[7] Es posible la micorremediación o descomposición de hidrocarburos por micelio y setas.[8]
Seguridad
Muchos hidrocarburos son altamente inflamables; por lo tanto, se debe tener cuidado para evitar lesiones. El benceno y muchos hidrocarburos aromáticos] son posibles carcinógenos, y se debe usar el equipo de seguridad adecuado para evitar que estos compuestos dañinos entren en el cuerpo. Si los hidrocarburos se queman en áreas estrechas, se puede formar monóxido de carbono tóxico. Los hidrocarburos deben mantenerse alejados de los compuestos flúor debido a la alta probabilidad de formación de compuestos tóxicos ácido fluorhídrico.
Impacto ambiental
Los hidrocarburos se introducen en el medio ambiente a través de su uso extensivo como combustibles y productos químicos, así como a través de fugas o derrames accidentales durante la exploración, producción, refinación o transporte. La contaminación antropogénica del suelo por hidrocarburos es un grave problema mundial debido a la persistencia de los contaminantes y al impacto negativo en la salud humana[9]
Hidrocarburos sustituidos
Los hidrocarburos sustituidos son compuestos que tienen la misma estructura que un hidrocarburo, pero que contienen átomos de otros elementos distintos al hidrógeno y el carbono en lugar de una parte del hidrocarburo. La parte de la molécula que tiene un ordenamiento específico de átomos, que es el responsable del comportamiento químico de la molécula base, recibe el nombre de grupo funcional.
Por ejemplo:
Los compuestos halogenados tienen como grupo funcional los átomos de halógenos. Tienen una alta densidad. Se utilizan en refrigerantes, disolventes, pesticidas, repelentes de polillas, en algunos plásticos y en funciones biológicas: hormonas tiroideas. Por ejemplo: cloroformo, diclorometano, tiroxina, Freón, DDT, PCBs, PVC. La estructura de los compuestos halogenados es: R-X, en donde X es flúor (F), cloro (Cl), bromo (Br) y yodo (I), y R es un radical de hidrocarburo.
Microorganismos que degradan los hidrocarburos
Los microorganismos se consideran como seres capaces de adaptarse y adaptar su metabolismo en función de las condiciones ambientales en las que se desarrollen y los parámetros físico-químicos que presenten, lo que les permite también desarrollarse en lugares donde están presentes los hidrocarburos.
Existen alrededor de 160 géneros de microorganismos que degradan los hidrocarburos, entre los principales se encuentran:
- Acinetobacter
- Flavobacterium
- Corynebacterium
- Bacillus
- Achromobacter
- Rhodococcus
Véase también
- Alcano
- Alqueno
- Alquino
- Asfalteno
- Malteno
- Cicloalcano
- Hidrocarburo aromatico
- Petróleo
- Petroquímica
- Derivados del petróleo
Refeferencias
- ↑ NASA's Cassini Spacecraft Reveals Clues About Saturn Moon (enlace roto disponible en este archivo).. NASA (December 12, 2013)
- ↑ Guzman-Ramirez, L.; Lagadec, E.; Jones, D.; Zijlstra, A. A.; Gesicki, K. (2014). «PAH formation in O-rich planetary nebulae». Monthly Notices of the Royal Astronomical Society 441: 364. Bibcode:2014MNRAS.441..364G. arXiv:1403.1856. doi:10.1093/mnras/stu454.
- ↑ Nunes, T.M.; Turatti, I.C.C.; Mateus, S.; Nascimento, F.S.; Lopes, N.P.; Zucchi, R. (2009). «Cuticular Hydrocarbons in the Stingless Bee Schwarziana quadripunctata (Hymenoptera, Apidae, Meliponini): Differences between Colonies, Castes and Age». Genetics and Molecular Research 8 (2): 589-595. PMID 19551647. doi:10.4238/vol8-2kerr012. Archivado desde el original el 26 September 2015. Parámetro desconocido
|df=ignorado (ayuda) - ↑ Eskandarlou, M; Moaddab, AH (Aug 2010). «Chest wall necrosis and empyema resulting from attempting suicide by injection of petroleum into the pleural cavity». Emerg Med J 27 (8): 616-8. PMID 20558490. doi:10.1136/emj.2009.073486.
- ↑ World Coal, Coal and Electricity (enlace roto disponible en este archivo).. World Coal Association
- ↑ «First investigation of the microbiology of the deepest layer of ocean crust.». PLoS ONE 5 (11): e15399. 2010. Bibcode:2010PLoSO...515399M. PMC 2974637. PMID 21079766. doi:10.1371/journal.pone.0015399. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Yakimov, M. M.; Timmis, K. N.; Golyshin, P. N. (2007). «Obligate oil-degrading marine bacteria». Curr. Opin. Biotechnol. 18 (3): 257-266. PMID 17493798. doi:10.1016/j.copbio.2007.04.006. Parámetro desconocido
|citeseerx=ignorado (ayuda) - ↑ Stamets, Paul (2005) "Mycoremediation (enlace roto disponible en este archivo).", Ch. 7, p. 86, in Mycelium Running: How Mushrooms Can Help Save the World. ISBN 9781580085793
- ↑ «Microbial Degradation of Alkanes (PDF Download Available)». ResearchGate (en inglés). Archivado desde el original el 24 February 2017. Consultado el 23 de febrero de 2017. Parámetro desconocido
|df=ignorado (ayuda)
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Hidrocarburos.
Wikimedia Commons alberga una galería multimedia sobre Hidrocarburos. Wikcionario tiene definiciones y otra información sobre hidrocarburo.
Wikcionario tiene definiciones y otra información sobre hidrocarburo.

