Cumarina
| Cumarina | ||
|---|---|---|
 | ||
 | ||
 | ||
| Nombre IUPAC | ||
| 2H-chromen-2-one | ||
| General | ||
| Otros nombres | 1-benzopyran-2-one | |
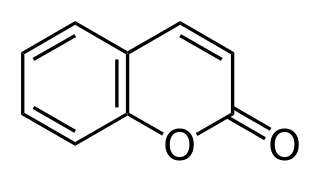
| Fórmula estructural |
 | |
| Fórmula molecular | C9H6O2 | |
| Identificadores | ||
| Número CAS | 91-64-5[1] | |
| Número RTECS | GN4200000 | |
| ChEBI | 28794 | |
| ChEMBL | 6466 | |
| ChemSpider | 13848793 | |
| DrugBank | DB04665 | |
| PubChem | 323 | |
| UNII | A4VZ22K1WT | |
| KEGG | D07751 | |
|
c1ccc2c(c1)ccc(=O)o2
| ||
| Propiedades físicas | ||
| Masa molar | 146,036779 g/mol | |
| Punto de fusión | 71 °C (344 K) | |
| Punto de ebullición | 301,71 °C (575 K) | |
| Riesgos | ||
| LD50 | 293 mg/kg (rat, oral) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La cumarina es un compuesto químico orgánico perteneciente a la familia de las benzopironas, cuyo nombre según la IUPAC es 2H-cromen-2-ona. En su estado normal (estándar) se caracteriza por una estructura cristalina e incolora. A este esqueleto se le pueden adicionar diferentes residuos formando la familia de las cumarinas. Las cumarinas se consideran un grupo de metabolitos secundarios de las plantas. Etimológicamente, «cumarina» deriva de la palabra francesa coumarou, utilizada para referirse al haba de Tonka. Se encuentra de forma natural en gran variedad de plantas, y en alta concentración en el Haba de Tonka (Dipteryx odorata), grama de olor (Anthoxanthum odoratum), asperula olorosa (Galium odoratum), gordolobo (Verbascum spp.), hierba de búfalo (Hierochloe odorata), canela de Cassia (Cinnamomum aromaticum), trébol de olor (Melilotus ssp.) y Panicum clandestinum.


Aunque la cumarina en sí no tiene propiedades anticoagulantes, esta se transforma por acción de gran variedad de hongos en el anticoagulante natural dicumarol. Esto ocurre como resultado de la producción de la 4-hidroxicumarina, además (en presencia de formaldehído de origen natural) da lugar al dicumarol, un producto de fermentación y micotoxinas. Esta sustancia fue responsable de la enfermedad hemorrágica conocida históricamente como "enfermedad del trébol dulce" del ganado que se alimenta de este forraje.[2] A raíz del estudio de esta enfermedad se han podido sintetizar gran variedad de agentes anticoagulantes, similares al dicumarol, como por ejemplo la warfarina.
La cumarina tiene valor clínico en sí misma, como modificador de edemas. Se sabe que las benzopironas cumarínicas, como la 5,6 benzopirona, benzopirona 1,2, diosmina, estimulan los macrófagos para degradar el albumen extracelular, lo que permite una reabsorción más rápida de los líquidos edematosos.[3][4]
Síntesis y metabolismo
[editar]La cumarina se puede preparar en el laboratorio mediante la Reacción de Perkin entre aldehído salicílico y anhídrido acético. La Condensación de Pechmann[5] es otra de las formas de sintetizar la cumarina y sus derivados.
La biosíntesis de la cumarina en plantas se hace a través de la hidroxilación, la glucólisis y la ciclación del ácido cinámico.
- Metabolismo en humanos: La enzima codificada por el gen UGT1A8 cuenta con actividad glucuronidasa y posee muchos substratos incluyendo a las cumarinas.[6]
Funciones biológicas
[editar]En plantas se encuentran en los tegumentos de las semillas, frutos, flores, raíces, hojas y tallos, aunque la mayor concentración se halla en general en frutos y flores. La cumarina funciona como defensor para la planta, ya que posee propiedades supresoras del apetito, lo que explicaría su extensión generalizada, especialmente en pastos y tréboles. Esto provoca la disminución del impacto del pastoreo sobre el forraje. Además, tiene propiedades antimicrobianas, captadoras de radiación UV e inhibidoras de la germinación. A pesar del agradable olor dulce de este compuesto y de ser responsable de nombres de plantas como el trébol dulce o la grama dulce, a las plantas no se las ha denominado así por su sabor. La cumarina tiene un sabor amargo y los animales la evitan siempre que pueden, pues produce hemorragias internas.[7]
Derivados
[editar]
La cumarina y sus derivados son considerados fenilpropanoides. Algunos de estos derivados naturales incluyen a la umbeliferona (7-hidroxicumarina), la esculetina (6,7dihidroxicumarina), el herniarin (7-methoxicumarina), los psoralenos y la imperatorina.
Usos médicos
[editar]Las cumarinas han mostrado que ejercen muchas actividades biológicas, aunque están aprobadas solo para algunos usos médicos como productos farmacéuticos. La actividad registrada de la cumarina y de sus derivados es, entre otras, antitumoral, antiarrítmicos, antiinflamatorios, antisépticos, analgésicos (alivio del dolor) y contra la hipertensión, la osteoporosis y el VIH. También se usan en tratamientos contra el asma,[8] y se han empleado contra el linfedema.[9]
Toxicidad y uso en alimentos, bebidas, cosméticos y tabaco
[editar]La cumarina es moderadamente tóxica para el hígado y los riñones, con una Dosis Letal Media LD50 de 275 mg/kg, que es baja comparada con la de otros compuestos similares. Aunque solo es peligrosa en algunos casos para los humanos, la cumarina es hepatotóxica para ratas (menormente en ratones). Los roedores la metabolizan a 3,4-cumarina epóxido, un compuesto tóxico inestable que, debido a un metabolismo posterior, podría explicar la posibilidad de causar cáncer de hígado en ratas y tumores de pulmón en ratones[10] .[11] Los humanos la metabolizan a 7-hidroxicumarina, un compuesto menos tóxico. El Instituto de Evaluación de Riesgos de Alemania ha establecido una “ingesta diaria tolerable” (TDI) de 0.1 mg de cumarina por kg de peso del individuo. Además, se advierte que si este valor se sobrepasa puntualmente, no presenta un peligro para la salud.[12] Por ejemplo, una persona de 60 kg de peso podría tomar alrededor de 6.0 mg de cumarina. La Administración de Seguridad y Salud Ocupacional de EE. UU. considera que la cumarina no se deba clasificar como cancerígena para humanos.[13]
Las agencias europeas de la salud advierten del peligro de tomar grandes cantidades de corteza de canela de Cassia, ya que esta variedad contiene altas concentraciones de la sustancia.[14] Según el Instituto de Evaluación de Riesgos de Alemania 1 kg de Cassia contiene de 2.1 a 4.4 g de cumarina.[15] Si la densidad de la canela de Cassia en polvo es 0.56 g/cm3,[16] un kilo contendrá 362.39 cucharaditas (que resulta de la operación: 1000 gramos divididos por 0.56 g/cm3 multiplicado por 0,20288 cucharadas que caben en un centímetro cúbico), las cucharaditas contendrán de 5.8 a 12.1 mg de cumarina, lo que sobrepasa la TDI para individuos de pequeño tamaño.[17] Sin embargo, el Instituto de Evaluación de Riesgos de Alemania solo advierte del peligro de esta sustancia en grandes ingestas diarias de canela.[15] La canela común (Cinnamomun verum) contiene muy poca cantidad de cumarina. Por otro lado, la planta de manzanilla, usada normalmente en infusiones, también la contiene.
La cumarina se encuentra a menudo en sustitutos artificiales de la vainilla a pesar de haber sido prohibida como aditivo alimenticio en numerosos países a partir de la mitad del sigo XX. En los Estados Unidos fue prohibida en 1954 en gran parte debido a su hepatoxicidad en roedores.[18] La Administración de Seguridad y Salud Ocupacional considera a este compuesto un cancerígeno específico del pulmón, y no en general.[19] La Administración de Alimentos y Medicamentos de Estados Unidos clasifica a la cumarina como "sustancia generalmente prohibida en el uso directo en alimentación humana", de acuerdo con 21 CFR 189.130, CFR 189.130,[20] pero algunos aditivos naturales que contiene la cumarin, como la apérula (Galium odoratum), solo se permite su uso en bebidas alcohólicas(21 CFR 172.510).[21] En Europa estas bebidas son muy populares, por ejemplo, Maiwein (vino blanco con aspérula) y Żubrówka (vodka aromatizado con hierbas). Sin embargo, se dice que el contenido de cumarina en estas bebidas solo produce dolor de cabeza.
El uso de la cumarina en perfumería se ha restringido debido a que algunas personas han demostrado ser sensibles a ella.[22] No obstante, la evidencia de que la cumarina puede causar reacciones alérgicas está en duda.[23]
La cumarina se sigue usando legalmente como aditivo en la industria del tabaco, sobre todo para la producción del tabaco de pipa dulce. Esta aplicación llevó al exejecutivo de Brown & Williamson,[24] Jeffrey Wigand a contactar con el programa de investigación “60 Minutes” de la CBS’ en 1995, alegando que existía una variedad de veneno para ratas en el tabaco. Sostuvo que desde el punto de vista químico, la cumarina es un "precursor inmediato" del raticida “Coumadin”. El Dr. Wigand indicó más adelante que la cumarina en sí es peligrosa, y señaló que la FDA prohibió su adición a los alimentos destinados a humanos en 1954.[25] Mateniendo sus declaraciones, volvió a clasificar la cumarina como un carcinógeno pulmonar. En Alemania, la cumarina está prohibida como aditivo para el tabaco.
Uso como rodenticida
[editar]
Muchos de los componentes ya citados (particularmente las 4-hidroxicumarinas o comúnmente llamadas cumarinas) son usados como anticoagulantes y/o como rodenticidas, que actúan mediante un mecanismo anticoagulante que bloquea la regeneración y reciclado de la vitamina K. La razón de que estos compuestos se usen como rodenticidas se basa en que están diseñados para tener altas potencias y tiempos largos de residencias en el cuerpo.
A veces se denominan incorrectamente a estos químicos como “Coumadin” que es uno de los nombres comerciales de la warfarina.
La Vitamina K es un potente antídoto para el envenenamiento por los rodenticidas 4-hidroxicumarinas como la bromadiolona. El tratamiento normalmente consta del suministro inmediato de grandes dosis de vitamina K intravenosa. Se continuará con administración de pastillas durante al menos dos semanas, que se pueden prolongar hasta cuatro. El tratamiento se puede extender incluso a meses. Con un diagnóstico precoz las posibilidades de recuperación del individuo son altas incluso cuando la intoxicación ha sido grave. A corto plazo la transfusión con plasma fresco congelado (PFC) proporciona factores anticoagulantes, los cuales le dan a la vitamina K el tiempo necesario para invertir la acción de la enzima tóxica en el hígado. A su vez se permite la sintetización de nuevos anticoagulantes.
Importancia económica
[editar]El descubrimiento de su efecto en los mamíferos llevó al desarrollo de la warfarina, un medicamento anticoagulante oral utilizado también como rodenticida, y de otros compuestos relacionados para tratar y prevenir la apoplejía. Una forma de dermatitis inducida por cumarina puede ocurrir durante la manipulación del apio. El psoraleno se usa exitosamente en varios desórdenes de la piel (eccemas, psoriasis) a través de una combinación de su ingesta oral con exposición a radiación UV-A.
La Occupational Safety and Health Administration considera a la cumarina como un compuesto carcinogénico específico del pulmón. La cumarina es una sustancia que incrementa la adicción del consumidor a los cigarrillos.[19]
Su olor dulce recuerda al heno recién cortado y por ello se ha usado desde 1882 como esencia de algunos perfumes. Sin embargo, se prohibió el uso del compuesto como potenciador de aroma en cigarrillos en 1997. La FDA (EE. UU.) lo clasifica como sustancia prohibida para aditivos alimentarios aromatizantes.[21]
La cumarina también se usa como medio activo en algunos Láser de colorante, así como sintetizador en tecnologías fotovoltaicas más antiguas.
Referencias
[editar]- ↑ Número CAS
- ↑ Bye, A., King, H. K., 1970. The biosynthesis of 4-hydroxycoumarin and dicoumarol by Aspergillus fumigatus Fresenius. Biochemical Journal 117, 237-245.
- ↑ Casley-Smith,J.R., Morgan R.G., and Piller, N.B., 1993. Treatment of Lymphedema of the Arms and Legs with 5,6-Benzo-[alpha]-pyrone. The New England Journal of Medicine. Volume 329:1158–1163. Number 16.
- ↑ Australasyan Lymphology Association. Review of benzypyrone drugs and edema
- ↑ H. v. Pechmann (1884). «Neue Bildungsweise der Cumarine. Synthese des Daphnetins». Berichte der deutschen chemischen Gesellschaft 17 (1): pp. 929–936.
- ↑ Ritter, J.K., Chen, F., Sheen, Y.Y., Tran, H.M., Kimura, S., Yeatman, M.T., Owens, I.S. 1992. A novel complex locus UGT1 encodes human bilirubin, phenol, and other UDP-glucuronosyltransferase isozymes with identical carboxyl termini. J Biol Chem. Volumen 267. 5. páginas 3257–61
- ↑ Link, K.P. 1959. The discovery of dicumarol and its sequels. Circulation. Volumen 19. 1. páginas 97–107 [1]
- ↑ Liu, H., 2011. Extraction and Isolation of compounds from Herbal medicines. Traditional Herbal Medicine Research Methods. Editado por Willow JH Liu, John Wiley and Sons, Inc
- ↑ Farinola, N., Piller, N. 2005. Pharmacogenomics: Its Role in Re-establishing Coumarin as Treatment for Lymphedema. Lymphatic Research and Biology. Volumen 3. 2. páginas 81–86
- ↑ Vassallo J.D., Hicks, S.M., Daston, G.P., Lehman-McKeeman, L.D. 2004. Metabolic detoxification determines species differences in coumarin-induced hepatotoxicity. Toxicol Sci. Volumen 80. 2. páginas 249-257
- ↑ Born, S.L., Api, A.M., Ford, R.A., Lefever, F.R., Hawkins, D.R. 2003. Comparative metabolism and kinetics of coumarin in mice and rats. Food Chem Toxicol. Volumen 41. 2. páginas 247-258
- ↑ Federal Institute for Risk Assessment. 2006. Frequently Asked Questions about coumarin in cinnamon and other foods.
- ↑ Occupational Safety & Health Administration. 1998. NIOSH Registry of Toxic Effects of Chemical Substances.
- ↑ Harris, E. 2006. German Christmas Cookies Pose Health Danger. NPR.
- ↑ a b BfR Health Assessment. 2006. High daily intakes of cinnamon: Health risk cannot be ruled out. Número 044/06.
- ↑ «Engineering Resources - Bulk Density Chart». Archivado desde el original el 8 de septiembre de 2008. Consultado el 18 de agosto de 2008.
- ↑ BfR Health Assessment. 2006. High daily intakes of cinnamon: Health risk cannot be ruled out. Número 044/06
- ↑ Marles, R.J., Compadre, C.M., Farnsworth, N.R. 1986. Coumarin in vanilla extracts: Its detection and significance. Volumem 41, Número 1. páginas 41-47
- ↑ a b Occupational Safety & Health Administration. 1998. NIOSH Registry of Toxic Effects of Chemical Substances.
- ↑ Office of the Federal Register National Archives and Records Administration. 2006. Food and Drugs.
- ↑ a b Office of the Federal Register National Archives and Records Administration. 2006. Food and Drugs.
- ↑ International Fragance Association. 2009. Coumarin.
- ↑ Cropwatch. 2008. Cropwatch Claims Victory Regarding “26 Allergens” Legislation.
- ↑ Wallace, M. 1996. Jeffrey Wigand on 60 Minutes. Jeffrey Wigand.
- ↑ Borio, G. 2005. Dr. Wigand and The Solicitous Solicitor. Blogging U.S. vs. Philip Morris, Inc.
