Colesterol
| Colesterol | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| (3β)-cholest-5-en-3-ol | ||
| General | ||
| Otros nombres | (10R,13R)-10,13-dimethyl-17-(6-methylheptan-2-yl)-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-ol | |
| Fórmula estructural |
 | |
| Fórmula molecular | C27H46O | |
| Identificadores | ||
| Número CAS | 57-88-5[1] | |
| Número RTECS | FZ8400000 | |
| ChEBI | 16113 | |
| ChEMBL | 112570 | |
| ChemSpider | 5775 | |
| DrugBank | 04540 | |
| PubChem | 5997 | |
| UNII | 97C5T2UQ7J | |
| KEGG | D00040 | |
|
C[C@H](CCCC(C)C)[C@H]1CC[C@@H]2[C@@]1(CC[C@H]3[C@H]2CC=C4[C@@]3(CC[C@@H](C4)O)C)C
| ||
| Propiedades físicas | ||
| Apariencia | polvo cristalino blanco[2] | |
| Densidad | 1052 kg/m³; 1,052 g/cm³ | |
| Masa molar | 38 665 g/mol | |
| Punto de fusión | 421,15 K (148 °C) | |
| Punto de ebullición | 633,15 K (360 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 0,095 mg/L (30 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El colesterol es un esterol (lípido) que se encuentra en los tejidos corporales y en el plasma sanguíneo de los vertebrados. Pese a que las cifras elevadas de colesterol en la sangre tienen consecuencias perjudiciales para la salud, es una sustancia esencial para crear la membrana plasmática que regula la entrada y salida de sustancias en la célula. Abundan en las grasas de origen animal.
François Poulletier de la Salle identificó por primera vez el colesterol en forma sólida en los cálculos de la vesícula biliar en 1769. Sin embargo, fue en 1815 cuando el químico Michel Eugène Chevreul nombró el compuesto «colesterina»,[3][4] del griego χολή, kolé, ‘bilis’ y στερεος, stereos, ‘sólido’.
Estructura química
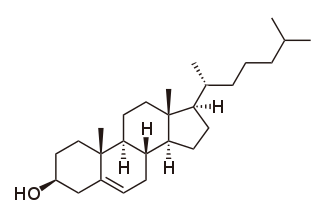
La fórmula química del colesterol se representa de dos formas: C27H46O / C27H45OH.
Es un lípido esteroide, derivado del ciclopentanoperhidrofenantreno (o esterano), constituido por cuatro carboxilos condensados o fusionados, denominados A, B, C y D, que presentan varias sustituciones:
- Dos radicales metilo en las posiciones C-10 y C-13.
- Una cadena alifática ramificada de 8 carbonos en la posición C-17.
- Un grupo hidroxilo en la posición C-3.
- Una insaturación entre los carbonos C-5 y C-6.
En la molécula de colesterol se puede distinguir una cabeza polar constituida por el grupo hidroxilo y una cola o porción apolar formada por el carbociclo de núcleos condensados y los sustituyentes alifáticos. Así, el colesterol es una molécula tan hidrófoba que la solubilidad de colesterol libre en agua es de 10−8 M y, al igual que los otros lípidos, es bastante soluble en disolventes apolares como el cloroformo (CHCl3).
Metabolismo del colesterol
Biosíntesis del colesterol
La biosíntesis del colesterol tiene lugar en el retículo endoplasmático liso de prácticamente todas las células de los animales vertebrados. Mediante estudios de marcaje isotópico, Rittenberg y Bloch demostraron que todos los átomos de carbono del colesterol proceden, en última instancia, del acetato, en forma de acetil coenzima A. Se requirieron aproximadamente otros 30 años de investigación para describir las líneas generales de la biosíntesis del colesterol, desconociéndose, sin embargo, muchos detalles enzimáticos y mecanísticos a la fecha. Los pasos principales de la síntesis de colesterol son:
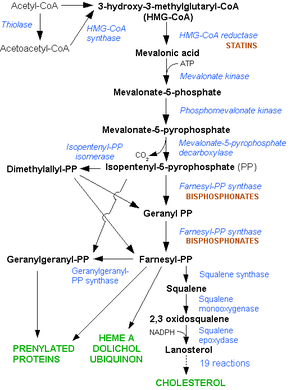
Resumidamente, estas reacciones pueden agruparse de la siguiente manera:[5][6]
- Tres moléculas de acetil-CoA se combinan entre sí formando mevalonato, el cual es fosforilado a 3-fosfomevalonato 5-pirofosfato.
- El 3-fosfomevalonato 5-pirofosfato es descarboxilado y desfosforilado a pirofosfato de isopentenilo.
- El ensamblaje sucesivo de seis moléculas de pirofosfato de isopentenilo origina el escualeno, vía pirofosfato de geranilo y pirofosfato de farnesilo.
- La ciclación del escualeno da lanosterol.
- El lanosterol se convierte en colesterol después de numerosas reacciones sucesivas, enzimáticamente catalizadas, que implican la eliminación de tres grupos metilo (–CH3), el desplazamiento de un doble enlace y la reducción del doble enlace de la cadena lateral.
Degradación del colesterol
El ser humano no puede metabolizar la estructura del colesterol hasta CO2 y H2O. El núcleo intacto de esterol se elimina del cuerpo convirtiéndose en ácidos y sales biliares las cuales son secretadas en la bilis hacia el intestino para desecharse por heces fecales. Parte de colesterol intacto es secretado en la bilis hacia el intestino el cual es convertido por las bacterias en esteroides neutros como coprostanol y colestanol.[cita requerida]
En ciertas bacterias sí se produce la degradación total del colesterol y sus derivados; sin embargo, la ruta metabólica es aún desconocida.
Regulación del colesterol
La producción en el humano del colesterol es regulada directamente por la concentración del colesterol presente en el retículo endoplásmico de las células, habiendo una relación indirecta con los niveles plasmáticos de colesterol presente en las lipoproteínas de baja densidad (LDL por su acrónimo inglés). Una alta ingesta de colesterol en los alimentos conduce a una disminución neta de la producción endógena y viceversa. El principal mecanismo regulador de la homeostasis de colesterol celular aparentemente reside en un complejo sistema molecular centrado en las proteínas SREBPs (Sterol Regulatory Element Binding Proteins 1 y 2: proteínas que se unen a elementos reguladores de esteroles). En presencia de una concentración crítica de colesterol en la membrana del retículo endoplásmico, las SREBPs establecen complejos con otras dos importantes proteínas reguladoras: SCAP (SREBP-cleavage activating protein: proteína activadora a través del clivaje de SREBP) e Insig (insulin induced gene) 1 y 2. Cuando disminuye la concentración del colesterol en el retículo endoplásmico, las Insigs se disocian del complejo SREBP-SCAP, permitiendo que el complejo migre al aparato de Golgi, donde SREBP es escindido secuencialmente por S1P y S2P (site 1 and 2 proteases: proteasas del sitio 1 y 2 respectivamente). El SREBP escindido migra al núcleo celular donde actúa como factor de transcripción uniéndose al SRE (Sterol Regulatory Element: elemento regulador de esteroles) de una serie de genes relevantes en la homeostasis celular y corporal de esteroles, regulando su transcripción. Entre los genes regulados por el sistema Insig-SCAP-SREBP destacan los del receptor de lipoproteínas de baja densidad (LDLR) y la hidroxi-metil-glutaril CoA-reductasa (HMG-CoA-reductasa), la enzima limitante en la vía biosintética del colesterol. El siguiente diagrama muestra de forma gráfica los conceptos anteriores:
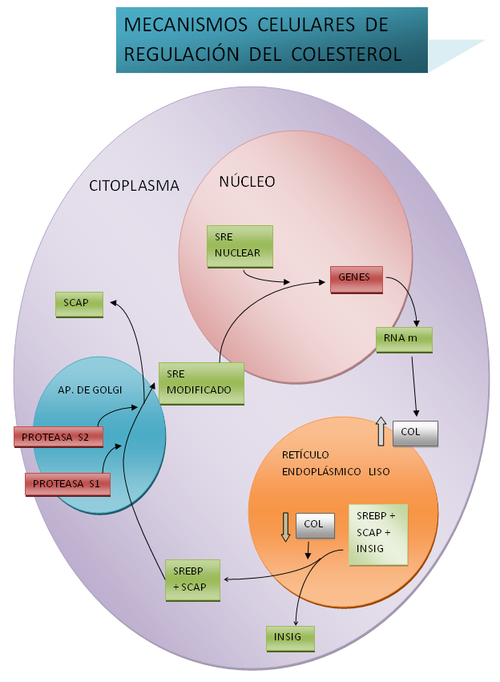
Tras dilucidar los mecanismos celulares de captación endocítica de colesterol lipoproteico, trabajo por el cual fueron galardonados con el Premio Nobel en Fisiología o Medicina en el año 1985, Michael S. Brown y Joseph L. Goldstein han participado directamente en el descubrimiento y caracterización de la vía de los SREBPs de regulación del colesterol corporal. Estos avances han sido la base del mejor entendimiento de la fisiopatología de diversas enfermedades humanas, fundamentalmente la enfermedad vascular aterosclerótica, principal causa de muerte en el mundo occidental a través del infarto agudo al miocardio y los accidentes cerebrovasculares y el fundamento de la farmacología de las drogas hipocolesteromiantes más potentes: las estatinas. Debemos tener presente que el colesterol es esencial para la vida y reducir la síntesis de colesterol farmacológicamente o mediante dietas puede ocasionar fisiopatologías más graves que la que deseamos prevenir o curar.[7][8] No hay ningún estudio tipo causa-efecto realizado por científicos sin relación o sin haber sido financiados por las grandes farmacéuticas que demuestre que el colesterol es una causa relacionada con enfermedades cardiovasculares o aterosclerosis.;[9][10]
Es importante tener en cuenta que la inhibición de HMG-CoA reductasa por cualquier tipo de estatina tiene efectos secundarios no deseados. HMG-CoA reductasa es una enzima que forma parte de la ruta metabólica del ácido mevalónico, la cual es común para la síntesis de la Q10 en humanos, una conezima imprescindible para la producción de energía en las mitocondrias.[11][12] Así, todas las estatinas consiguen inhibir la síntesis de colesterol, que ya de por sí no es recomendable, además se inhibe la síntesis de coenzima Q10, provocando una disminución de la energía necesaria para vivir, cuyos síntomas se manifiestan fundamentalmente en los tejidos con mayores requerimientos energéticos como son el músculo esquelético, el cerebro o los riñones, de ahí las dolencias, miopatías (dolores musculares de las extremidades) manifestadas por un porcentaje elevado de pacientes consumidores de estatinas.
Funciones del colesterol
El colesterol es imprescindible para la vida animal por sus numerosas funciones:
- Estructural: el colesterol es un componente muy importante de las membranas plasmáticas de las células animales (en vegetales esa función es análoga a la del Fitoesterol). Aunque el colesterol se encuentra en pequeña cantidad en las membranas celulares, en la membrana citoplasmática lo hallamos en una proporción molar 1:1 con relación a los fosfolípidos, regulando sus propiedades físico-químicas, en particular la fluidez. Sin embargo, el colesterol se encuentra en muy baja proporción o está prácticamente ausente en las membranas subcelulares.
- Precursor de la vitamina D: esencial en el metabolismo del calcio.
- Precursor de las hormonas sexuales: progesterona, estrógenos y testosterona.
- Precursor de las hormonas corticoesteroidales: cortisol y aldosterona.
- Precursor de las sales biliares: esenciales en la absorción de algunos nutrientes lipídicos y vía principal para la excreción de colesterol corporal.
- Precursor de las balsas de lípidos.
Transporte del colesterol e hipercolesterolemia
La concentración actualmente aceptada como normal de colesterol en el plasma sanguíneo (colesterolemia) de individuos sanos es de 120 a 200 mg/dL. Sin embargo, debe tenerse presente que la concentración total de colesterol plasmático tiene un valor predictivo muy limitado respecto del riesgo cardiovascular global (ver más abajo). Cuando esta concentración aumenta se habla de hipercolesterolemia.
Dado que el colesterol es insoluble en agua, el colesterol plasmático solo existe en la forma de complejos macromoleculares llamados lipoproteínas, principalmente LDL y VLDL, que tienen la capacidad de fijar y transportar grandes cantidades de colesterol. La mayor parte de dicho colesterol se encuentra en forma de ésteres de colesterol, en los que algún ácido graso, especialmente el ácido linoleico (un ácido graso de la serie omega-6), esterifica al grupo hidroxilo del colesterol.
Aunque habitualmente se afirma que la existencia sostenida de niveles elevados de colesterol LDL (popularmente conocido como "colesterol malo") por encima de los valores recomendados, incrementa el riesgo de sufrir eventos cardiovasculares (principalmente infarto de miocardio agudo) hasta diez años después de su determinación, según indicaba el estudio de Framingham[cita requerida] iniciado en 1948, lo cierto es que ningún ensayo clínico rigurosamente controlado ha demostrado jamás de forma concluyente que la reducción del colesterol LDL pueda prevenir enfermedades cardiovasculares.[13][14] Por tanto, el colesterol tiene un impacto dual y complejo sobre la fisiopatología de la arteriosclerosis, por lo que la estimación del riesgo cardiovascular basado solo en los niveles totales de colesterol plasmático es claramente insuficiente.
Sin embargo, y considerando lo anterior, se ha definido clínicamente que los niveles de colesterol plasmático total (la suma del colesterol presente en todas las clases de lipoproteínas) recomendados por la Sociedad Norteamericana de Cardiología (AHA)[cita requerida] son:
- Colesterolemia por debajo de 200 mg/dL (miligramos por decilitros): es la concentración deseable para la población general, pues por lo general correlaciona con un bajo riesgo de enfermedad cardiovascular.
- Colesterolemia entre 200 y 239 mg/dL: existe un riesgo intermedio en la población general, pero es elevado en personas con otros factores de riesgo como la diabetes mellitus.
- Colesterolemia mayor de 240 mg/dL: puede determinar un alto riesgo cardiovascular y se recomienda iniciar un cambio en el estilo de vida, sobre todo en lo concerniente a la dieta y al ejercicio físico.
En sentido estricto, el nivel deseable de colesterol LDL debe definirse clínicamente para cada sujeto en función de su riesgo cardiovascular individual, el cual está determinado por la presencia de diversos factores de riesgo, entre los que destacan:
- Edad y sexo.
- Antecedentes familiares.
- Tabaquismo.
- Presencia de hipertensión arterial.
- Nivel de colesterol HDL.
Es preferible que el LDL sea bajo. En general, el nivel de LDL se considera demasiado elevado si es de 190 mg/dL o mayor.[15]
Los niveles entre 79 y 189 mg/dL suelen considerarse excesivamente altos en pacientes diabéticos con edades comprendidas entre 40 y 75 años, pacientes diabéticos con riesgo alto de desarrollar enfermedades cardíacas y personas con riesgo de medio a alto de padecer enfermedades cardíacas.[15]
En relación al colesterol total, pueden darse las siguientes cifras orientativas, aunque el riesgo es muy variable, dependiendo de otros factores asociados, como tabaquismo, diabetes e hipertensión arterial.
- Colesterol por debajo de 200 mg/dL: bajo riesgo.
- Colesterol entre 200 y 300 mg/dL: riesgo intermedio.
- Colesterol mayor de 300 mg/dL: alto riesgo.
Referencias
- ↑ Número CAS
- ↑ «Safety (MSDS) data for cholesterol». Consultado el 20 de octubre de 2007.
- ↑ Chevreul (1816) "Recherches chimiques sur les corps gras, et particulièrement sur leurs combinaisons avec les alcalis. Sixième mémoire. Examen des graisses d'homme, de mouton, de boeuf, de jaguar et d'oie" (Chemical researches on fatty substances, and particularly on their combinations o filippos ine kapios with alkalis. Sixth memoir. Study of human, sheep, beef, jaguar and goose fat), Annales de Chimie et de Physique, 2 : 339-372. From page 346 : "Je nommerai cholesterine, de χολη, bile, et στερεος, solide, la substance cristallisée des calculs biliares humains, ... " (I will name cholesterine — from χολη (bile) and στερεος (solid) — the crystalized substance from human gallstones ... )
- ↑ Olson RE (febrero de 1998). «Discovery of the lipoproteins, their role in fat transport and their significance as risk factors». J. Nutr. 128 (2 Suppl): 439S-443S. PMID 9478044.
|coautores=requiere|autor=(ayuda) - ↑ Lehninger, 2009. Principios de bioquímica. Omega, Barcelona. ISBN 978-84-282-1486-5.
- ↑ Devlin, T. M. 2004. Bioquímica, 4.ª edición. Reverté, Barcelona. ISBN 84-291-7208-4.
- ↑ Stephen T. Sinatra, et al. 2014. The Saturated Fat, Cholesterol, and Statin Controversy. Journal of the American College of Nutrition, Vol. 33, No. 1, 79–88.
- ↑ Michel de Lorgeril and Patricia Salen 2006. Cholesterol lowering and mortality: Time for a new paradigm?. Nutrition, Metabolism & Cardiovascular Diseases. 16, 387e 390.
- ↑ Ravnskov U 2002. A hypothesis out-of-date: The diet–heart idea. Magle Stora Kyrkogata 9
- ↑ Ravnskov U 2002. Is atherosclerosis caused by high cholesterol? Q J Med;95:397e403.
- ↑ Mikael Turunen 2004. Metabolism and function of coenzyme Q. Biochimica et Biophysica Acta 1660 171–199.
- ↑ Catarina M. Quinzii and Michio Hirano 2010. Coenzyme Q and Mitochondrial Disease. Dev Disabil Res Rev. 16(2):183–188.
- ↑ Colpo, Anthony (2005). «LDL Cholesterol: Bad Cholesterol, or "Bad Science"?». Journal of American Physicians and Surgeons (en inglés) 10 (3): 83-90.
- ↑ Ravnskov, Uffe (2005). «Los mitos del colesterol» (Web). Los mitos del colesterol. Consultado el 30 de marzo de 2014.
|autor=y|apellido=redundantes (ayuda) - ↑ a b MedlinePlus (ed.). «Exámenes de colesterol y sus resultados». Consultado el 23 de mayo de 2015.
Enlaces externos
 Wikcionario tiene definiciones y otra información sobre colesterol.
Wikcionario tiene definiciones y otra información sobre colesterol.- En MedlinePlus hay más información sobre Colesterol.
- Sociedad Internacional de Arteriosclerosis.
- Animación divulgativa de El Mundo Salud, 8 de agosto de 2009.









