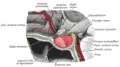
Adenohipófisis
| Adenohipófisis | ||
|---|---|---|
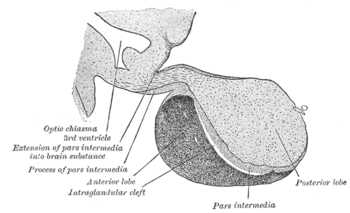 Adenohipófisis (en gris oscuro abajo) "Anterior lobe". Hipófisis de mono. | ||
| Nombre y clasificación | ||
| Sinónimos |
hipófisis anterior | |
| Latín |
[TA]: adenohypophysis; [TA]: lobus anterior hypophysis; pars distalis | |
| TA | A11.1.00.002 | |
| Gray | pág.1276 | |
| Información anatómica | ||
| Sistema | endocrino | |
| Arteria |
arteria hipofisaria superior; arteria hipofisaria inferior (en parte) | |
| Vena | venas portales hipofisarias | |
|
| ||
La adenohipófisis[1]
o lóbulo anterior de la hipófisis es una estructura glandular perteneciente al sistema endócrino. Se encuentra formada por cordones epiteliales anastomosados, rodeados de una red de sinusoides.[2] Secreta siete hormonas principales, que controlan la actividad de las glándulas endocrinas periféricas: adrenales, tiroides y gónadas. La adenohipófisis contribuye además al control de otras actividades fisiológicas como el crecimiento y la lactancia.
Los trastornos en la función de la adenohipófisis, pueden provocar hipofunción o hiperfunción de las células secretoras, con hiposecreción o hipersecreción de sus hormonas que determinan consecuencias globales.
Desarrollo embriológico


La adenohipófisis deriva de la boca embrionaria primitiva (llamada estomodeo), está formada por ectodermo del techo de la boca y deriva de la bolsa de Rathke. En el embrión humano durante el segundo mes, la conexión con la cavidad oral se pierde y la bolsa se ubica en asociación estrecha con el infundíbulo del hipotálamo.
Posteriormente, las células del remanente de la bolsa de Rathke aumentan en cantidad y conforman el lóbulo anterior (AL) de la hipófisis o adenohipófisis.[3]
Estructura

Durante mucho tiempo se consideró a la adenohipófisis como similar a un mosaico aleatorio de células productoras de hormonas. El uso de imágenes 3D de toda la adenohipófisis, ha descubierto redes de células neuroendócrinas altamente organizadas e interdigitadas, con interacciones entre células del mismo tipo y de tipo diferente.
Otros componentes conforman el tejido de soporte (estroma) como las células gliales, las células foliculoestelatas y un lecho capilar abundante.[4]
Los diferentes tipos de células endocrinas están más agrupados en los peces teleósteos.[5]
Células
La adenohipófisis secreta muchas hormonas, de las cuales seis son relevantes para el funcionamiento adecuado del organismo; estas seis son secretadas por cinco tipos de células, de origen epitelial.
Como ocurre en muchas glándulas endocrinas, estas células aparecen organizadas en lagunas rodeadas de capilares sinusoides fenestrados, hacia los cuales se vierte su secreción hormonal.[cita requerida]


Durante décadas los tipos de células se clasificaron según su afinidad por las tinciones en: acidófilas, basófilas y cromófobas, estas últimas no se tiñen. Esta clasificación morfológica no aportaba información significativa sobre su actividad secretora. En la actualidad, se cuenta con técnicas de inmunohistoquímica, y se han podido identificar cinco tipos celulares principales que son secretores: células somatotropas, células lactotropas, células corticotropas, células gonadotropas y células tirotropas.[2]
Somatotropas
Las células Somatotrofas[6] tienen unos grandes gránulos acidófilos, y se tiñen de color naranja intenso con eosina. Se encuentra gran cantidad de ellas en la parte distal de la adenohipófisis. Secretan somatotropina u hormona del crecimiento. Tienen un núcleo central, mitocondrias en bastón y un abundante retículo endoplásmico rugoso.
Mamotropas o Lactotropas
Las células lactotrofas[7] aparecen separadas, individualmente. Son pequeñas, poligonales, con gránulos de prolactina pequeños que se tornan grandes durante la lactancia. Después del nacimiento, aumenta su número, el cual se normaliza al terminar la lactancia. La liberación de sus gránulos está determinada por su estimulante, el péptido intestinal vasoactivo (VIP) y la hormona liberadora de tirotropina, y es inhibida por la dopamina.
Corticotropas
Las células corticotropas[8] son basófilas, redondas u ovoides, con un núcleo excéntrico y pocos orgánulos. Secretan hormona adrenocorticotrópica (ACTH) y hormona lipotrópica o lipotropina (LPH) ). Sus gránulos se excretan con el estímulo de la hormona liberadora de corticotropina (CRH).
Gonadotropas
Las células Gonadotrofas[9] son basófilas, redondas, con abundante retículo endoplásmico rugoso y abundantes mitocondrias. Secretan las gonadotropinas LH y FSH. Aún no ha podido confirmarse si existen dos poblaciones de células gonadótropas: unas que producen la hormona luteinizante[10] y otras, la hormona foliculoestimulante, o si una misma célula produce ambas hormonas en diferentes fases de un mismo ciclo secretor.[cita requerida]
Tirotropas
Las células Tirotrofas[11] son basófilas. Se encuentran cerca de los cordones, a cierta distancia de los sinusoides. Se distinguen por sus gránulos pequeños de tirotropina (TSH). También estimulan la liberación de prolactina.
Cromófobas
No se tiñen, tienen poco citoplasma. Estas células se encuentran en medio de los cordones que formarán las células cromófilas. Presentan poco retículo endoplásmico rugoso, poco retículo endoplásmico liso y poco aparato de Golgi pero, por el contrario, tendrán grandes cantidades de poliribosomas, hecho singular que ha llevado a creer que posiblemente sean células de sostén, aunque también se plantea la probabilidad de que sean de renovación de las células glandulares anteriormente citadas. Hay, en cambio, otro porcentaje de células cromófobas, llamadas células foliculoestrelladas.
Foliculoestrelladas, estrelladas o foliculares
Las células foliculoestrelladas (FS) constituyen una población grande en la parte distal de la hipófisis, tienen prolongaciones largas con las que forman uniones herméticas entre ellas, pero que se encontraron en medio de las células secretoras de hormonas. Se caracterizan por no presentar gránulos.[12][13]
Hormonas
| "Hormona" | Otros nombres | Abrev. | Estructura | Células secretoras | Tinción | Blanco | Efecto |
|---|---|---|---|---|---|---|---|
| Hormona adrenocorticotropa | Corticotropina | ACTH | Polipéptido | Corticotropas | Basófila | Glándula suprarrenal | Secreción de glucocorticoides |
| Betaendorfina | Polipéptido | Corticotropas | Basófila | Receptores de opioides | Inhibe los receptores del dolor | ||
| Hormona estimulante de tiroides | Tirotropina | TSH | Glicoproteína | Tirotropas | Basófila | glándula tiroides | Secreción de hormonas tiroideas |
| Hormona foliculoestimulante | Folitropina | FSH | Glicoproteína | Gonadotropas | Basófilo | Gónadas | Crecimiento del sistema reproductivo |
| Hormona luteinizante | Lutropina | LH, ICSH | Glicoproteína | Gonadotropas | Basófilo | Gónadas | Producción de hormonas sexuales |
| Hormona de crecimiento | Somatotropina | GH, STH | Polipéptido | Somatotropas | Acidófilo | Hígado, tejido adiposo | Promueve el crecimiento; metabolismo de lípidos y carbohidratos |
| Prolactina | Lactogenic hormone | PRL | Polipéptido | Lactotropas o mamotropas | Acidofilo | Ovarios, glándulas mamarias | Secreción de estrógenos/progesterona; producción de leche |
- Hormona del crecimiento o somatotropina (GH). Estimula la síntesis proteica, e induce la captación de glucosa por parte del músculo y los adipocitos, además induce la gluconeogénesis por lo que aumenta la glucemia; su efecto más importante es quizás que promueve el crecimiento de todos los tejidos y los huesos en conjunto con las somatomedinas. Por lo que un déficit de esta hormona causa enanismo y un aumento (ocasionado por un tumor acidófilo) ocasiona gigantismo en niños, y acromegalia en adultos, (consecuencia del previo cierre de los discos epifisiarios).
- Prolactina (PRL) u hormona luteotrópica. Estimula el desarrollo de los acinos mamarios y estimula la traducción de los genes para las proteínas de la leche.
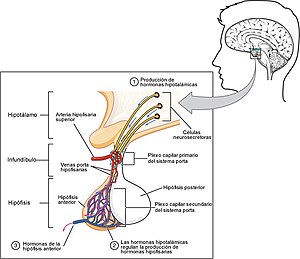
Las demás hormonas son hormonas tróficas que tienen su efecto en algunas glándulas endocrinas periféricas:
- Hormona estimulante del tiroides (TSH) o tirotropina. Estimula la producción de hormonas por parte del tiroides
- Hormona estimulante de la corteza suprarrenal (ACTH) o corticotropina. Estimula la producción de hormonas por parte de las glándulas suprarrenales
- Hormona luteinizante (LH). Estimulan la producción de hormonas por parte de las gónadas y la ovulación.
- Hormona estimulante del folículo (FSH). Misma función que la anterior.
La LH y la FSH se denominan gonadotropinas, ya que regulan la función de las gónadas.
Pérdida de la adenohipófisis
La pérdida de la adenohipófisis debido a un proceso patológico o iatrogénico, provocará un cuadro clínico[14] que se denomina pan-hipopituitarismo con efectos múltiples en el organismo:
- Detención del crecimiento.
- Atrofia de las glándulas suprarrenales.
- Atrofia de los testículos y ovarios.
- Atrofia de la tiroides.
- Trastorno en el metabolismo de lípidos, glúcidos y proteínas.
Patología
Las enfermedades de la adenohipófisis son propias de su origen epitelial secretor, los adenomas y los carcinomas. Los adenomas son neoplasias benignas, originadas en las células secretoras de la adenohipófisis. Se pueden clasificar como adenomas benignos o invasivos. Los carcinomas son neoplasias malignas raras.
Adenomas
Los adenomas adenohipofisarios son expansiones clonales de alguno de sus cinco tipos de células. Estos tipos celulares tienen la capacidad de secretar hormonas y son: las somatotropas, las lactotropas, las corticotropas, las tirotropas y las gonadotropas.[15]
Pueden originar una variedad de síndromes clínicos, como consecuencia de la producción de hormonas, o bien como consecuencia del crecimiento (efecto masa) local.[16]
Las hormonas secretadas en forma excesiva por los adenomas son, con mayor frecuencia, la hormona de crecimiento, la prolactina y la ACTH.[17]
Los adenomas constituyen un 10-15% del total de las neoplasias intracraneales.
Afectan a ambos sexos, predominantemente entre la tercera y sexta décadas de vida, pero pueden parecer en cualquier grupo etario.[18]
Los adenomas invasivos que constituyen el 35 % de todos los neoplasmas hipofisarios, pueden invadir la duramadre, el hueso del cráneo o el seno esfenoide.
Los carcinomas constituyen 0,1 a 0,2 % de todos los tumores hipofisarios.[19]
Imágenes adicionales
-
La silla turca corte Antero-posterior.
-
Huesos de la cara.
Referencias
- ↑ OMS,OPS. (ed.). «Adenohipófisis». Descriptores en Ciencias de la Salud, Biblioteca virtual de salud. Consultado el 5 de agosto de 2020.
- ↑ a b Kühnel, Wolfgang (2005). Atlas color de citología e histología. Ed. Médica Panamericana. ISBN 978-84-7903-835-9. Consultado el 3 de diciembre de 2021.
- ↑ Langman. «cap18:Sistema nervioso central». Embriología médica. p. 20. Consultado el 3 de agosto de 2020.
- ↑ Budry L.; Lafont C.; El Yandouzi T.; Chauvet N.; Conéjero G.; Drouin J.; Mollard P. (2011). «Related pituitary cell lineages develop into interdigitated 3D cell networks». PNAS (en inglés) 108 (30): 12515-12520. Consultado el 18 de noviembre de 2021.

- ↑ Grønlien HK.; Fontaine R.; Hodne K.; Tysseng I.; Ager-Wick E.; Weltzien FA. et al. (2021). «Long extensions with varicosity-like structures in gonadotrope Lh cells facilitate clustering in medaka pituitary culture». PLoS ONE (en inglés) 16 (1): e0245462. doi:10.1371/journal.pone.0245462.

- ↑ OMS,OPS (ed.). «Somatotrofos». Descriptores en Ciencias de la Salud, Biblioteca virtual de salud. Consultado el 21 de noviembre de 2020.
- ↑ OMS,OPS (ed.). «Lactotrofos». Descriptores en Ciencias de la Salud, Biblioteca virtual de salud. Consultado el 21 de noviembre de 2020.
- ↑ OMS,OPS (ed.). «Corticotrofos». Descriptores en Ciencias de la Salud, Biblioteca virtual de salud. Consultado el 21 de noviembre de 2020.
- ↑ OMS,OPS (ed.). «Gonadotrofos». Descriptores en Ciencias de la Salud, Biblioteca virtual de salud. Consultado el 21 de noviembre de 2020.
- ↑ BIREME/OPS/OMS (ed.). «Hormona Luteinizante». Consultado el 3 de diciembre de 2021.
- ↑ OMS,OPS (ed.). «Tirotrofos». Descriptores en Ciencias de la Salud, Biblioteca virtual de salud. Consultado el 21 de noviembre de 2020.
- ↑ «Adenohipófisis Pars distalis». coggle.
- ↑ Morris J.; Christian H. (2011). «Folliculo-stellate Cells: Paracrine Communicators in the Anterior Pituitary». The Open Neuroendocrinology Journal (PDF) (en inglés) (bentham) 4: 77-89.

- ↑ «Insuficiencia hipofisaria». Mayo Clinic. 2019.
- ↑ Gonzales-Portillo M. «Tumores de la Hipófisis». Neurocirugía (Universidad Nacional Mayor de San Marcos) 1. Consultado el 14 de febrero de 2022.
- ↑ Niveiro de Jaime M.; Aranda López F.I.; Peiró Cabrera G. (2003). «Patología de los adenomas hipofisarios». Revista Española de Patología 36 (4). Consultado el 14 de febrero de 2022.
- ↑ «Lesiones hipofisarias». Manual MSD, Versión para Profesionales. Consultado el 14 de febrero de 2022.
- ↑ Tortosa F.; Webb S.M. (2017). Novel aspects in histopathology of the pituitary gland 64 (3). pp. 152-161. Consultado el 14 de febrero de 2022.
- ↑ «Tratamiento de los tumores de Hipófisis. Versión para profesionales de salud.». NIH. 2020. Consultado el 14 de febrero de 2022.