Rotavirus
| Rotavirus | ||
|---|---|---|
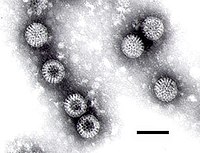 Una micrografía electrónica de un rotavirus: obsérvese el aspecto de «rueda» del virión. | ||
| Taxonomía | ||
| Dominio: | Riboviria | |
| Reino: | Orthornavirae | |
| Filo: | Duplornaviricota | |
| Familia: | Sedoreoviridae | |
| Género: | Rotavirus | |
| Clasificación de Baltimore | ||
| Grupo: | III (Virus ARN bicatenario) | |
| Grupos | ||
| ||
Rotavirus es un género de virus ARN bicatenario de la familia Reoviridae que es la causa más común de diarrea grave en niños de hasta 5 años[2] y neonatos de distintas especies de mamíferos.[3] Es uno de los varios virus que a menudo causan las infecciones denominadas gastroenteritis. En humanos, la gran mayoría de los infantes menores de 5 años de edad han sido infectados por el rotavirus al menos una vez.[4] En bovinos, por ejemplo, la diarrea por rotavirus afecta a terneros en las primeras semanas de vida,[5] lo que genera grandes pérdidas económicas.[6]
Hay 8 grupos, denominadas: A, B, C, D, E, F, G y H.[1] El rotavirus A, el más común, causa más del 90 % de las infecciones en humanos y animales. El virus se transmite por vía fecal-oral. Infecta y daña las células que recubren el intestino delgado y causa gastroenteritis.
El rotavirus es un virus de fácil resolución en pacientes sanos (aquellos que no están inmunocomprometidos), pero en todo el mundo aún mueren cada año cerca de 450.000 niños,[7] la mayoría de ellos en países en vías de desarrollo,[8] y casi dos millones más caen gravemente enfermos.[9] En los bovinos, este virus forma parte del complejo Diarrea Neonatal del Ternero que puede afectar hasta el 70 % de esos animales.[6]
La forma más eficaz de prevenir la infección por rotavirus es mediante la vacunación. En niños, esta se realiza de manera obligatoria principalmente en países desarrollados, y también en algunos en vías de desarrollo como la Argentina. En bovinos, la estrategia de vacunación es inmunizar a la madre antes del parto para, luego, transmitir sus defensas al ternero al momento del nacimiento.[10]
Historia[editar]
En 1943, Jacob Light y Horace Hodes demostraron que un agente filtrable en las heces de los niños con diarrea infecciosa también causaba diarrea en el ganado.[11] Tres décadas más tarde, las muestras conservadas del agente demostraron que era un rotavirus.[12] En los años siguientes, el virus inoculado en ratones[13] demostró la relación entre el virus y las diarreas.[14] En 1973, Ruth Bishop y sus compañeros describieron el virus relacionado con la gastroenteritis infantil.[15]
En 1974, Thomas Henry Flewett sugirió el nombre de rotavirus tras observarlo por el microscopio electrónico, dónde vio que parecía una rueda (rotaen latín);[16][17] el nombre fue oficialmente reconocido por el Comité Internacional de Taxonomía de Virus cuatro años más tarde.[18] En 1976, se describió el virus relacionado con otras especies.[14] El virus fue reconocido como un agente infeccioso para los humanos y animales por todo el mundo.[16] Los serotipos del rotavirus fueron descritos por primera vez en 1980,[19] y al año siguiente, se lograba su obtención en cultivos celulares derivados de riñones de simios mediante la adición de tripsina (una enzima que se encuentra en el duodeno de los mamíferos y que se sabe que es esencial contra la replicación del rotavirus) en el medio de cultivo.[20] La capacidad de hacer crecer el rotavirus en cultivos aceleró el ritmo de la investigación, y a mediados de la década de 1980 se empezaron a evaluar las primeras vacunas.[21]
En 1998, el uso de la vacuna contra el rotavirus fue aprobada por los Estados Unidos. Se realizaron ensayos clínicos en Estados Unidos, Finlandia y Venezuela que tuvieron una efectividad del 80-100% en la prevención de la diarrea grave causada por el rotavirus A. No obstante, los investigadores detectaron efectos adversos serios estadísticamente significativos.[22][23] El fabricante la retiró del mercado en 1999 cuando se descubrió que la vacuna podía haber contribuido a un aumento del riesgo de invaginación intestinal, un tipo de obstrucción intestinal, en uno de cada 12 000 niños vacunados.[24] La experiencia provocó un intenso debate sobre los riesgos y beneficios relativos de la vacuna contra el rotavirus.[25] En 2006, aparecieron dos nuevas vacunas contra el rotavirus A que demostraron ser seguras y efectivas en los niños,[26] y en junio de 2009 la Organización Mundial de la Salud recomendó que la vacunación contra el rotavirus se incluyera en todos los programas nacionales de inmunización para brindar protección contra este virus.[27]
Sintomatología[editar]
La gastroenteritis por rotavirus es una enfermedad que puede ser tanto leve como grave y está caracterizada por: vómitos, diarrea acuosa y fiebre leve. Cuando un niño está infectado por el virus, hay un periodo de incubación de aproximadamente dos días antes de que aparezcan los síntomas.[28] Estos suelen comenzar con vómitos seguidos de cuatro a ocho días de diarrea profusa. La deshidratación es más común en la infección por rotavirus que en la mayoría de las infecciones causadas por bacterias patógenas y es la causa más común de muerte relacionada con la infección por rotavirus.[29]
Puede producirse un brote infeccioso por rotavirus A en cualquier momento de la vida: la primera, en general, produce síntomas, pero las infecciones posteriores suelen ser leves o asintomáticas,[30][31] ya que el sistema inmunitario proporciona una cierta protección.[32][33] Consecuentemente, las infecciones sintomáticas son más frecuentes en niños menores de dos años y disminuyen progresivamente con la edad.[34] Las infecciones en bebés, aun siendo comunes, están a menudo asociadas con la enfermedad leve o asintomática; los síntomas más graves tienden a producirse en niños de seis meses a dos años de edad, ancianos y personas inmunodeprimidas.[35] Debido a la inmunidad adquirida en la infancia, la mayoría de los adultos no son vulnerables al rotavirus; la gastroenteritis en adultos en general tiene una causa diferente del rotavirus, pero las infecciones asintomáticas pueden mantener la transmisión de la infección en la comunidad.[36]
Transmisión[editar]

El rotavirus se transmite principalmente por vía fecal-oral, pero también se puede transmitir a través de las manos, superficies y objetos sucios,[37] también se puede transmitir a través del sistema respiratorio.[38] Los excrementos de una persona infectada pueden contener más de 10 billones de partículas infecciosas por gramo;[31] resultando suficientes menos de 100 de estas partículas para infectar a otra persona.[39]
El rotavirus es estable en el medio ambiente y se han encontrado muestras en estuarios a niveles tan altos como 1-5 partículas infecciosas por galón americano (3.78 litros).[40] Las medidas sanitarias adecuadas para la eliminación de bacterias y parásitos parecen ser ineficaces en el control del rotavirus, puesto que la incidencia de la infección por rotavirus en los países con niveles sanitarios altos y bajos es similar.[38]
Mecanismos de la infección[editar]

La diarrea está causada por las múltiples actividades del virus. La malabsorción se debe a la destrucción de las células intestinales denominadas enterocitos. La proteína tóxica NSP4 del rotavirus interrumpe al transportador SGLT1 que interviene en la reabsorción del agua, al parecer, reduce la actividad de las disacaridasas y, posiblemente, activa los iones de calcio dependientes de los reflejos de la secreción del sistema nervioso entérico.[41] Los enterocitos sanos segregan lactasa en el intestino delgado; la intolerancia a la leche causada por una deficiencia de lactasa es un síntoma de la infección por rotavirus,[42] la cual puede persistir durante semanas.[43] A una diarrea recurrente leve a menudo le sigue la reintroducción de la leche en la dieta del niño, debido a la fermentación bacteriana del disacárido lactosa en el intestino.[44]
Diagnóstico y detección[editar]
El diagnóstico del rotavirus normalmente es un diagnóstico de gastroenteritis como causa de diarrea grave. A la mayoría de los niños ingresados en hospitales por gastroenteritis se les hace el test del rotavirus A.[45][46] El diagnóstico específico para la infección por rotavirus A se realiza buscando el virus en las heces de los niños a través de un ensayo por inmunoabsorción ligado a enzimas, ELISA por sus siglas en inglés. Hay varios equipos de prueba con licencia en el mercado que son sensibles, específicos y detectan todos los serotipos de rotavirus A.[47] Otros métodos, como la visualización en el microscopio electrónico y la reacción en cadena de la polimerasa, se utilizan en los laboratorios de investigación.[32] La transcripción inversa de la reacción en cadena de la polimerasa (RT-PCR) puede detectar e identificar todas las especies y serotipos de rotavirus humanos.[48]
Tratamiento y pronóstico[editar]
El tratamiento de la infección aguda por rotavirus no es específico y consiste en la gestión de los síntomas y, lo más importante, mantener la hidratación.[49] Si no se trata, los niños pueden morir por una grave deshidratación.[50] Dependiendo de la gravedad de la diarrea, el tratamiento consiste en rehidratar oralmente, dando al niño un exceso de agua para beber que contiene pequeñas cantidades de sales y azúcares[51] o se administran líquidos por vía intravenosa por goteo o sonda nasogástrica, mientras se controlan los electrolitos del niño y el azúcar en sangre.[45] Las infecciones por rotavirus raramente causan otras complicaciones y para un niño muy controlado, el pronóstico es excelente.[52]
Virología[editar]
Tipos de rotavirus[editar]
Hay ocho grupos de rotavirus, designadas como A, B, C, D, E, F y G. Los humanos solo pueden verse infectados por los tipos A, B y C, principalmente por el A. Todas las especies atacan a algún animal.[53] Dentro del tipo A hay variaciones, llamadas serotipos.[54] Al igual que con el virus de la gripe, se usa un sistema doble de clasificación, basado en dos tipos de proteínas de la cápside. La glucoproteína VP-7 define el tipo G y la proteína sensible a proteasas VP-4 define al tipo P.[55] El tipo P se define como un número para el serotipo P y como un número entre corchetes para el genotipo P. Los serotipos G tienen una nomenclatura similar, siendo el número del serotipo G el mismo del genotipo G. Por ejemplo, la cadena Wa se denota como P1A[8]G1. Debido a que los dos genes que determinan el tipo G y el tipo P pueden transmitirse por separado, en la progenie del virus se encuentran diferentes combinaciones.[56]
Estructura[editar]
Los rotavirus (del lat. rota: rueda) tienen una apariencia característica similar a una rueda, cuando es visualizado mediante microscopio electrónico. Los rotavirus son virus no envueltos (desnudos), en su capside se observan 3 capas (capa Externa, Media e Interna). El genoma está compuesto de 11 segmentos de ARN de doble-hebra, que codifican por seis proteínas estructurales y seis no estructurales (uno de sus segmentos codifica para 2 proteínas). El virus es estable en el medio ambiente. Pueden llegar a medir 76,5 nm de diámetro.
Proteínas[editar]
El virión está formado por siete proteínas (VP). Estas proteínas estructurales se llaman VP1, VP2, VP3, VP4, VP5, VP6 y VP7. Aparte de las proteínas estructurales, hay seis más no estructurales (NSP), producidas únicamente en las células infectadas. Se denominan NSP1, NSP2, NSP3, NSP4, NSP5 y NSP6. Por lo menos seis de las doce proteínas codificadas por el genoma vírico llevan ARN asociado, y la función de estas proteínas en el rotavirus no están bien explicadas; se cree que están implicadas en la síntesis y empaquetamiento del ARN, transporte del ARNm hacia la zona de replicación del genoma y en la traslación de ARNm y regulación de la expresión génica.
Proteínas estructurales[editar]
La VP1 está situada en el núcleo del virus y es una ARN polimerasa. En una célula infectada produce los transcritos de ARNm para sintetizar las proteínas víricas y duplica el genoma para producir nuevas partículas víricas.
La VP2 forma parte de la capa más interna del virión y va unida al genoma de ARN.
La VP3 también forma parte de la capa interna del virión y es un enzima llamado guanilil transferasa. Es un enzima que produce la caperuza en 5' del ARN (capping enzyme), durante la modificación postranscripcional del ARN mensajero. Esta caperuza estabiliza el extremo 5' del mensajero e impide que sea atacado por nucleasas, enzimas que degradan ácidos nucleicos.
La VP4 está situada en la parte externa del virión y forma una protuberancia, que es capaz de unirse a los receptores celulares de la célula para entrar en su interior. La VP4 debe ser modificada por una proteasa intestinal, para dar lugar a VP5* y VP8*, antes de que la partícula vírica sea infecciosa. La estructura de VP4 determina la virulencia del virus y que sea de tipo P.
La VP6 es la proteína principal de la cápside. Es altamente antigénica y puede usarse para determinar la especie del rotavirus. Se usa en los ensayos clínicos para determinar la existencia de infección por rotavirus A.
La VP7 es una glucoproteína que forma parte de la capa externa del virión. Aparte de sus funciones estructurales, determina el tipo G de la cadena, y junto con VP4, está implicada en la respuesta inmunitaria al virus.
Proteínas no estructurales[editar]
NSP1 es transcrita por el gen 5 y es una proteína no estructural de unión a ARN.
NSP2 es una proteína de unión a ARN, que se acumula en inclusiones citoplasmáticas (viroplasma) y es necesaria en la replicación del genoma.
NSP3 está unida a ARNm en las células infectadas y es la responsable de la finalización de la síntesis proteica celular.
NSP4 es una enterotoxina viral que induce diarrea y fue la primera enterotoxina viral que se descubrió.
NSP5 está codificada por el segmento 11 del genoma vírico del rotavirus A, y en las células infectadas se acumula en el viroplasma.
NSP6 es una proteína de unión a ácido nucleico es codificada por el gen 11, en un marco abierto de lectura desfasado.
| Segmento del ARN (gen) | Tamaño (pares de bases) | Proteína | Peso molecular kDa | Localización | Función |
|---|---|---|---|---|---|
| 1 | 3302 | VP1 | 125 | Vértices del núcleo | ARN polimerasa ARN-dependiente |
| 2 | 2690 | VP2 | 102 | Forma la capa interna del núcleo | Estimula la RNA replicasa viral |
| 3 | 2591 | VP3 | 88 | Vértices del núcleo | Enzima guanilil transferasa de ARNm |
| 4 | 2362 | VP4 | 87 | Protuberancias superficiales | Ataque celular, virulencia |
| 5 | 1611 | NSP1 | 59 | No estructural | No es esencial en el crecimiento del virus |
| 6 | 1356 | VP6 | 45 | Cápside interna | Estructural y antígeno específico de cada especie |
| 7 | 1104 | NSP3 | 37 | No estructural | Aumenta la actividad del ARNm viral y finaliza la síntesis de proteínas celulares. |
| 8 | 1059 | NSP2 | 35 | No estructural | NTPasa involucrada en el empaquetamiento de ARN |
| 9 | 1062 | VP71 VP72 | 38 y 34 | Superficie | Estructural y neutralizadora de antígenos. |
| 10 | 751 | NSP4 | 20 | No estructural | Enterotoxina |
| 11 | 667 | NSP5 NSP6 | 22 | No estructural | Moduladora de la unión del ARNsc y ARNdc |
Multiplicación[editar]
Se replican principalmente en el intestino e infectan enterocitos de las vellosidades intestinales, lo que causa cambios funcionales y estructurales en el epitelio. Su triple capa proteica (no confundir con cápside) lo hace resistente al pH del estómago y a las enzimas digestivas del intestino.
El virus entra a las células mediante endocitosis mediada por receptores y forma una vesícula llamada endosoma. Proteínas en la tercera capa (VP7 y VP4) quebrantan la membrana del endosoma, creando una diferencia en la concentración de Calcio. Esto produce la ruptura de los trímeros de VP7 en una sola subunidad proteica, dejando la cobertura de VP2 y VP6 alrededor del ARN viral.
Los 11 segmentos de ARN bicatenario permanecen bajo la protección de dos cubiertas proteicas y la polimerasa de ARN crea transcritos de ARNm del genoma de ARN. Al permanecer en la cápside, el ARN viral evade la respuesta inmune de ARN interferente, una molécula de ARN que suprime la expresión de genes específicos, que es disparado por la presencia del ARN bicatenario.
Durante la infección, el rotavirus produce ARNm para la biosíntesis proteica y la replicación de genes. La mayor parte de las proteínas se acumulan en el viroplasma, donde el ARN es replicado y se ensamblan los viriones. El viroplasma se forma alrededor del núcleo celular pasadas 2 horas a partir de la infección, y consiste de fábricas virales que se cree están formadas por dos proteínas no estructurales: NSP5 y NSP2. La inhibición de NSP5 por el ARN interferente resulta en un marcado decrecimiento en la replicación del rotavirus. Los viriones migran al retículo endoplasmático donde obtienen su tercera capa formada por VP7 y VP4. La progenie es liberada de la célula por lisis.
Respuesta inmune[editar]
Respuesta especifica[editar]
Los rotavirus provocan respuestas inmunitarias de células B y células T . Los anticuerpos contra las proteínas VP4 y VP7 del rotavirus neutralizan la infectividad viral in vitro e in vivo[33]. Se producen anticuerpos específicos de las clases IgM, IgA e IgG, que se ha demostrado que protegen contra la infección por rotavirus mediante la transferencia pasiva de los anticuerpos en otros animales.[57] Los anticuerpos IgG transplacentaria materna podría desempeñar un papel en la protección de los recién nacidos contra las infecciones por rotavirus, pero por otro lado podría reducir la eficacia de la vacuna.[58]
Respuesta innata[editar]
Después de la infección por rotavirus, se produce una respuesta inmunitaria innata rápida que implica interferones de tipo I y III y otras citocinas (en particular, Th1 y Th2)[59] que inhiben la replicación del virus y reclutan macrófagos y células asesinas naturales para las células infectadas por rotavirus. El dsRNA del rotavirus activa los receptores de reconocimiento de patrones, como los receptores tipo toll, que estimulan la producción de interferones.[60] La proteína de rotavirus NSP1 contrarresta los efectos de los interferones tipo 1 al suprimir la actividad de las proteínas reguladoras de interferón IRF3, IRF5 e IRF7.[61]
Marcadores de protección[editar]
Los niveles de IgG e IgA en la sangre y de IgA en el intestino se correlacionan con la protección contra infecciones. Se ha afirmado que las IgG e IgA séricas específicas de rotavirus en títulos altos (p. ej., >1:200)[62] protegen y existe una correlación significativa entre los títulos de IgA y la eficacia de la vacuna contra el rotavirus.[63]
Infecciones por Rotavirus[editar]
La naturaleza de la enfermedad[editar]
Los rotavirus propician gastroenteritis aguda y fuerte dolor abdominal. "Diarrea infantil", "diarrea invernal", "infección no bacterial aguda" y "gastroenteritis viral aguda" son los otros nombres con los que se denomina a este padecimiento. La dosis infectante se presume que es de 10-100 partículas virales infecciosas, ya que una persona con rotavirus frecuentemente excreta una gran cantidad de partículas virales: en el orden de (108-1010 partículas infecciosas /ml de heces). La vía de contagio se da a través del contacto con manos, objetos o utensilios contaminados. El período de incubación de la enfermedad por rotavirus es de aproximadamente 2 días pero no se sabe con certeza. La enfermedad está caracterizada por vómito y diarrea acuosa de 3 a 8 días, y fiebre con dolor abdominal ocurre con frecuencia. La inmunidad se produce después de la infección. Infecciones posteriores tienden a ser menos graves que la infección original.
Pronóstico y prevención de la enfermedad[editar]
Usualmente el desarrollo de la infección se resuelve espontáneamente. La deshidratación aguda debida a la diarrea es una de las mayores complicaciones. Es aconsejable el uso de electrólitos, si bien es conveniente consultar previamente al médico.
La mejor manera de prevenirla es utilizar utensilios limpios, y lavarse las manos después de usar el baño. También hay que tener cuidado al manejar pañales para no propiciar un contagio posterior.
Vacunas Importantes[editar]
En el 2006, dos vacunas contra el rotavirus mostraron ser seguras y efectivas en los niños: la vacuna monovalente Rotarix desarrollada por los laboratorios GlaxoSmithKline y es creada a base de virus vivos atenuados y la vacuna pentavalente RotaTeq desarrollada por los laboratorios Merck y es creada con virus recombinantes humanos y bovinos. Ambas se administran vía oral y contienen virus vivos atenuados. La vacunación con Rotarix tiene una efectividad de 90% para prevención de diarrea grave por rotavirus durante los primeros 2 años de vida en países con baja mortalidad infantil y de 35% en países con alta mortalidad infantil, mientras que las cifras para RotaTeq son 96% y 44% respectivamente.[64] Otras dos vacunas han sido desarrolladas (la monovalente Rotavac y la pentavalente Rotasil) que han sido aprobadas para su uso en India y han demostrado tener niveles de efectividad similares a Rotarix y RotaTeq.[64]
En 2006, la FDA aprobó RotaTeq para su uso en los Estados Unidos y anunció un precio de 187.50 para el régimen estándar de tres dosis. Por tanto, es una de las inmunizaciones infantiles más costosas, a pesar de los descuentos viene a ser una opción inalcanzable para los infantes del tercer mundo. Sin embargo la OMS recomienda fuertemente la inclusión de la vacuna contra rotavirus a los programas de inmunización en todas las regiones del mundo. Hasta abril del 2020, 107 países han introducido la vacuna para rotavirus en sus sistemas nacionales de vacunación.[65]
Una primera vacuna aprobada para rotavirus, Rotashield, desarrollada por Wyeth-Ayerst, fue retirada del mercado a finales de los 90s cuando se descubrió en casos muy raros estar vinculada a invaginación intestinal; sin embargo, evaluaciones posteriores demostraron que el riesgo de intususcepción aumentaba conforme aumentaba la edad a la administración de la primera dosis y que el riesgo era muy bajo si se iniciaba con la vacunación a una edad temprana. Así mismo, ninguna de las cuatro vacunas aprobadas actualmente se ha asociado con un riesgo aumentado de efectos adversos graves o invaginación intestinal cuando se administra de la forma recomendada.[64]
Complicaciones[editar]
Repetidas infecciones de rotavirus pueden incrementar el riesgo de desarrollar Celiaquía en niños generalmente susceptibles. Siempre se ha creído que las infecciones intestinales contribuyen a su desarrollo, un desorden digestivo común disparado por comer productos a base de trigo y otros alimentos que contienen la proteína gluten. Algunos estudios, sin embargo, han revisado el rol de los agentes infecciosos específicos en el desarrollo de la enfermedad. Como participantes de un estudio de los agentes ambientales desatadores de la enfermedad, 1931 niños del área metropolitana de Denver -quienes eran genéticamente susceptibles a la celiaquía- fueron monitorizados desde la infancia verificando si habían padecido rotavirus y el desarrollo de celiaquía posteriormente.
Conclusiones[editar]
El rotavirus es una enfermedad infecciosa prevenible y altamente contagiosa, que puede llegar a ser mortal en los menores, si no es tratada a tiempo. Datos obtenidos por la OMS dicen "Las enfermedades diarreicas son la segunda mayor causa de muerte de niños menores de 5 años". Es importante resaltar que este tipo de infecciones son prevenibles y tratables; educando a padres y población en general en hábitos higiénico-diétetico, enfatizando en la vacunación, recordando que esta es gratuita y está al alcance de todos.
Referencias[editar]
- ↑ a b Matthijnssens, Jelle; Otto, Peter H.; Ciarlet, Max; Desselberger, Ulrich; Ranst, Marc Van; Johne, Reimar (1 de junio de 2012). «VP6-sequence-based cutoff values as a criterion for rotavirus species demarcation». Archives of Virology (en inglés) 157 (6): 1177-1182. ISSN 0304-8608. doi:10.1007/s00705-012-1273-3. Consultado el 12 de julio de 2017.
- ↑ DENNEHY, PENELOPE H. «Transmission of rotavirus and other enteric pathogens in the home». The Pediatric Infectious Disease Journal 19 (Supplement): S103-S105. doi:10.1097/00006454-200010001-00003. Consultado el 12 de julio de 2017.
- ↑ Badaracco, A.; Garaicoechea, L.; Matthijnssens, J.; Louge Uriarte, E.; Odeón, A.; Bilbao, G.; Fernandez, F.; Parra, G. I. et al. (1 de agosto de 2013). «Phylogenetic analyses of typical bovine rotavirus genotypes G6, G10, P[5] and P[11] circulating in Argentinean beef and dairy herds». Infection, Genetics and Evolution 18: 18-30. doi:10.1016/j.meegid.2013.04.023. Consultado el 12 de julio de 2017.
- ↑ Bernstein, David I. «Rotavirus Overview». The Pediatric Infectious Disease Journal 28 (Supplement): S50-S53. doi:10.1097/inf.0b013e3181967bee. Consultado el 12 de julio de 2017.
- ↑ Kohara, Junko; Tsunemitsu, Hiroshi (2000). «Correlation between Maternal Serum Antibodies and Protection against Bovine Rotavirus Diarrhea in Calves». Journal of Veterinary Medical Science 62 (2): 219-221. doi:10.1292/jvms.62.219. Consultado el 12 de julio de 2017.
- ↑ a b Bendali, F.; Sanaa, M.; Bichet, H.; Schelcher, F. (septiembre de 1999). «Risk factors associated with diarrhoea in newborn calves». Veterinary Research 30 (5): 509-522. ISSN 0928-4249. PMID 10543385. Consultado el 12 de julio de 2017.
- ↑ Tate, Jacqueline E.; Burton, Anthony H.; Boschi-Pinto, Cynthia; Steele, A. Duncan; Duque, Jazmin; Parashar, Umesh D. (1 de febrero de 2012). «2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis». The Lancet Infectious Diseases (en inglés) 12 (2): 136-141. ISSN 1473-3099. PMID 22030330. doi:10.1016/s1473-3099(11)70253-5. Consultado el 12 de julio de 2017.
- ↑ «WHO | 21 November 2008, vol. 83, 47 (pp 421–428)». www.who.int. Consultado el 12 de julio de 2017.
- ↑ Simpson, Evan; Wittet, Scott; Bonilla, Josefina; Gamazina, Kateryna; Cooley, Laura; Winkler, Jennifer L. (5 de octubre de 2007). «Use of formative research in developing a knowledge translation approach to rotavirus vaccine introduction in developing countries». BMC Public Health 7: 281. ISSN 1471-2458. PMC 2173895. PMID 17919334. doi:10.1186/1471-2458-7-281. Consultado el 12 de julio de 2017.
- ↑ Parreño, V.; Marcoppido, G.; Vega, C.; Garaicoechea, L.; Rodriguez, D.; Saif, L.; Fernández, F. (1 de julio de 2010). «Milk supplemented with immune colostrum: Protection against rotavirus diarrhea and modulatory effect on the systemic and mucosal antibody responses in calves experimentally challenged with bovine rotavirus». Veterinary Immunology and Immunopathology 136 (1): 12-27. doi:10.1016/j.vetimm.2010.01.003. Consultado el 12 de julio de 2017.
- ↑ Light JS, Hodes HL (1943). «Studies on epidemic diarrhea of the new-born: Isolation of a Filtrable Agent Causing Diarrhea in Calves». Am. J. Public Health Nations Health 33 (12): 1451-4. PMC 1527675. PMID 18015921. doi:10.2105/AJPH.33.12.1451.
- ↑ Mebus CA, Wyatt RG, Sharpee RL, et al. (1 de agosto de 1976). «Diarrhea in gnotobiotic calves caused by the reovirus-like agent of human infantile gastroenteritis» (PDF). Infect. Immun. 14 (2): 471-4. PMC 420908. PMID 184047.
- ↑ Rubenstein D, Milne RG, Buckland R, Tyrrell DA (1971). «The growth of the virus of epidemic diarrhoea of infant mice (EDIM) in organ cultures of intestinal epithelium». British journal of experimental pathology 52 (4): 442-45. PMID 4998842.
- ↑ a b Woode GN, Bridger JC, Jones JM, Flewett TH, Davies HA, Davis HA, White GB (1 de septiembre de 1976). «Morphological and antigenic relationships between viruses (rotaviruses) from acute gastroenteritis in children, calves, piglets, mice, and foals» (PDF). Infect. Immun. 14 (3): 804-10. PMC 420956. PMID 965097.
- ↑ Bishop R (octubre de 2009). «Discovery of rotavirus: Implications for child health». Journal of Gastroenterology and Hepatology. 24 Suppl 3: S81-5. PMID 19799704. doi:10.1111/j.1440-1746.2009.06076.x.
- ↑ a b Flewett TH, Woode GN (1978). «The rotaviruses». Arch. Virol. 57 (1): 1-23. PMID 77663. doi:10.1007/BF01315633.
- ↑ Flewett TH, Bryden AS, Davies H, Woode GN, Bridger JC, Derrick JM (1974). «Relation between viruses from acute gastroenteritis of children and newborn calves». Lancet 2 (7872): 61-3. PMID 4137164. doi:10.1016/S0140-6736(74)91631-6.
- ↑ Matthews RE (1979). «Third report of the International Committee on Taxonomy of Viruses. Classification and nomenclature of viruses». Intervirology 12 (3–5): 129-296. PMID 43850. doi:10.1159/000149081.
- ↑ Beards GM, Brown DW (marzo de 1988). «The antigenic diversity of rotaviruses: significance to epidemiology and vaccine strategies». European Journal of Epidemiology 4 (1): 1-11. PMID 2833405.
- ↑ Urasawa T, Urasawa S, Taniguchi K (1981). «Sequential passages of human rotavirus in MA-104 cells». Microbiol. Immunol. 25 (10): 1025-35. PMID 6273696.
- ↑ Ward RL, Bernstein DI (enero de 2009). «Rotarix: a rotavirus vaccine for the world». Clinical Infectious Diseases : an Official Publication of the Infectious Diseases Society of America 48 (2): 222-8. PMID 19072246. doi:10.1086/595702.
- ↑ «Rotavirus vaccine for the prevention of rotavirus gastroenteritis among children. Recommendations of the Advisory Committee on Immunization Practices (ACIP)». MMWR Recomm Rep 48 (RR–2): 1-20. 1999. PMID 10219046.
- ↑ Kapikian AZ (2001). «A rotavirus vaccine for prevention of severe diarrhoea of infants and young children: development, utilization and withdrawal». Novartis Found. Symp. 238: 153-71; discussion 171-9. PMID 11444025. doi:10.1002/0470846534.ch10.
- ↑ Bines JE (2005). «Rotavirus vaccines and intussusception risk». Curr. Opin. Gastroenterol. 21 (1): 20-5. PMID 15687880. Archivado desde el original el 11 de mayo de 2013. Consultado el 27 de julio de 2012.
- ↑ Bines J (2006). «Intussusception and rotavirus vaccines». Vaccine 24 (18): 3772-6. PMID 16099078. doi:10.1016/j.vaccine.2005.07.031.
- ↑ Dennehy PH (2008). «Rotavirus vaccines: an overview». American Society for microbiologu 21 (1): 198-208. PMC 2223838. PMID 18202442. doi:10.1128/CMR.00029-07.
- ↑ «Meeting of the immunization Strategic Advisory Group of Experts, April 2009—conclusions and recommendations». Organització Mundial de la Salut 84 (23): 220-36. Junio de 2009. PMID 19499606.[1]
- ↑ Hochwald C, Kivela L (1999). «Rotavirus vaccine, live, oral, tetravalent (RotaShield)». Pediatr. Nurs. 25 (2): 203-4, 207. PMID 10532018.
- ↑ Maldonado YA, Yolken RH (1990). «Rotavirus». Baillieres Clin. Gastroenterol. 4 (3): 609-25. PMID 1962726. doi:10.1016/0950-3528(90)90052-I.
- ↑ Glass RI, Parashar UD, Bresee JS, Turcios R, Fischer TK, Widdowson MA, Jiang B, Gentsch JR (Julio de 2006). «Rotavirus vaccines: current prospects and future challenges». Lancet 368 (9532): 323-32. PMID 16860702. doi:10.1016/S0140-6736(06)68815-6.
- ↑ a b Bishop RF (1996). «Natural history of human rotavirus infection». Arch. Virol. Suppl. 12: 119-28. PMID 9015109.
- ↑ a b Paul Offit (2001). «Gastroenteritis viruses». Wiley (Nueva York). pp. 106–124. ISBN 0-471-49663-4.
- ↑ a b Ward R (marzo de 2009). «Mechanisms of protection against rotavirus infection and disease». The Pediatric Infectious Disease Journal 28 (3 Suppl): S57-9. PMID 19252425. doi:10.1097/INF.0b013e3181967c16.
- ↑ Ramsay M and Brown D (2000). Desselberger, U.; Gray, James, ed. Rotaviruses: methods and protocols. Totowa, NJ: Humana Press. pp. 217. ISBN 0-89603-736-3.
- ↑ J.), Gray, James (James; U., Desselberger, (2000). Rotaviruses : methods and protocols. Humana Press. ISBN 0896037363. OCLC 55684328.
- ↑ Hrdy DB (1987). «Epidemiology of rotaviral infection in adults». Rev. Infect. Dis. 9 (3): 461-9. PMID 3037675. doi:10.1093/clinids/9.3.461.
- ↑ Butz AM, Fosarelli P, Dick J, Cusack T, Yolken R (1993). «Prevalence of rotavirus on high-risk fomites in day-care facilities». Pediatrics 92 (2): 202-5. PMID 8393172.
- ↑ a b Dennehy PH (2000). «Transmission of rotavirus and other enteric pathogens in the home». Pediatr. Infect. Dis. J. 19 (10 Suppl): S103-5. PMID 11052397. doi:10.1097/00006454-200010001-00003.
- ↑ Grimwood K, Lambert SB (febrero de 2009). «Rotavirus vaccines: opportunities and challenges». Human Vaccines 5 (2): 57-69. PMID 18838873.
- ↑ Rao VC, Seidel KM, Goyal SM, Metcalf TG, Melnick JL (1 de agosto de 1984). «Isolation of enteroviruses from water, suspended solids, and sediments from Galveston Bay: survival of poliovirus and rotavirus adsorbed to sediments» (PDF). Appl. Environ. Microbiol. 48 (2): 404-9. PMC 241526. PMID 6091548.
- ↑ Hyser JM, Estes MK (enero de 2009). «Rotavirus vaccines and pathogenesis: 2008». Current Opinion in Gastroenterology 25 (1): 36-43. PMC 2673536. PMID 19114772. doi:10.1097/MOG.0b013e328317c897. Archivado desde el original el 11 de mayo de 2013. Consultado el 30 de enero de 2015.
- ↑ Farnworth ER (junio de 2008). «The evidence to support health claims for probiotics». The Journal of Nutrition 138 (6): 1250S-4S. PMID 18492865.
- ↑ Ouwehand A, Vesterlund S (2003). «Health aspects of probiotics». IDrugs 6 (6): 573-80. PMID 12811680.
- ↑ Arya SC (1984). «Rotaviral infection and intestinal lactase level». J. Infect. Dis. 150 (5): 791. PMID 6436397.
- ↑ a b Patel MM, Tate JE, Selvarangan R, et al. (2007). «Routine laboratory testing data for surveillance of rotavirus hospitalizations to evaluate the impact of vaccination». Pediatr. Infect. Dis. J. 26 (10): 914-9. PMID 17901797. doi:10.1097/INF.0b013e31812e52fd.
- ↑ The Pediatric ROTavirus European CommitTee (PROTECT) (2006). «The paediatric burden of rotavirus disease in Europe». Epidemiol. Infect. 134 (5): 908-16. PMC 2870494. PMID 16650331. doi:10.1017/S0950268806006091.
- ↑ Angel J, Franco MA, Greenberg HB (2009). Mahy WJ and Van Regenmortel MHV, ed. Desk Encyclopedia of Human and Medical Virology. Boston: Academic Press. p. 278. ISBN 0-12-375147-0.
- ↑ Fischer TK, Gentsch JR (2004). «Rotavirus typing methods and algorithms». Reviews in Medical Virology 14 (2): 71-82. PMID 15027000. doi:10.1002/rmv.411.
- ↑ Diggle L (2007). «Rotavirus diarrhoea and future prospects for prevention». Br. J. Nurs. 16 (16): 970-4. PMID 18026034.
- ↑ Alam NH, Ashraf H (2003). «Treatment of infectious diarrhea in children». Paediatr. Drugs 5 (3): 151-65. PMID 12608880.
- ↑ Sachdev HP (1996). «Oral rehydration therapy». Journal of the Indian Medical Association 94 (8): 298-305. PMID 8855579.
- ↑ Ramig RF (agosto de 2007). «Systemic rotavirus infection». Expert Review of Anti-infective Therapy 5 (4): 591-612. PMID 17678424. doi:10.1586/14787210.5.4.591.
- ↑ Kirkwood CD (septiembre de 2010). «Genetic and antigenic diversity of human rotaviruses: potential impact on vaccination programs». The Journal of Infectious Diseases. 202 Suppl: S43-8. PMID 20684716. doi:10.1086/653548.
- ↑ O'Ryan M (marzo de 2009). «The ever-changing landscape of rotavirus serotypes». The Pediatric Infectious Disease Journal 28 (3 Suppl): S60-2. PMID 19252426. doi:10.1097/INF.0b013e3181967c29.
- ↑ Patton JT (enero de 2012). «Rotavirus diversity and evolution in the post-vaccine world». Discovery Medicine 13 (68): 85-97. PMID 22284787.
- ↑ Desselberger U, Wolleswinkel-van den Bosch J, Mrukowicz J, Rodrigo C, Giaquinto C, Vesikari T (2006). «Rotavirus types in Europe and their significance for vaccination». Pediatr. Infect. Dis. J. 25 (1 Suppl.): S30-41. PMID 16397427. doi:10.1097/01.inf.0000197707.70835.f3. Archivado desde el original el 11 de mayo de 2013. Consultado el 29 de julio de 2012.
- ↑ Vega CG, Bok M, Vlasova AN, Chattha KS, Fernández FM, Wigdorovitz A, Parreño VG, Saif LJ (2012). «IgY antibodies protect against human Rotavirus induced diarrhea in the neonatal gnotobiotic piglet disease model». PLOS ONE 7 (8): e42788. Bibcode:2012PLoSO...742788V. PMC 3411843. PMID 22880110. doi:10.1371/journal.pone.0042788.
- ↑ Mwila K, Chilengi R, Simuyandi M, Permar SR, Becker-Dreps S (2017). «Contribution of Maternal Immunity to Decreased Rotavirus Vaccine Performance in Low- and Middle-Income Countries». Clinical and Vaccine Immunology 24 (1). PMC 5216432. PMID 27847365. doi:10.1128/CVI.00405-16.
- ↑ Gandhi GR, Santos VS, Denadai M, da Silva Calisto VK, de Souza Siqueira Quintans J, de Oliveira e Silva AM, de Souza Araújo AA, Narain N, Cuevas LE, Júnior LJ, Gurgel RQ (2017). «Cytokines in the management of rotavirus infection: A systematic review of in vivo studies». Cytokine 96: 152-160. PMID 28414969. S2CID 3568330. doi:10.1016/j.cyto.2017.04.013.
- ↑ Holloway G, Coulson BS (2013). «Innate cellular responses to rotavirus infection». The Journal of General Virology 94 (6): 1151-1160. PMID 23486667. doi:10.1099/vir.0.051276-0.
- ↑ Villena J, Vizoso-Pinto MG, Kitazawa H (2016). «Intestinal Innate Antiviral Immunity and Immunobiotics: Beneficial Effects against Rotavirus Infection». Frontiers in Immunology 7: 563. PMC 5136547. PMID 27994593. doi:10.3389/fimmu.2016.00563.
- ↑ Offit PA (1994). Rotaviruses: immunological determinants of protection against infection and disease. «Advances in Virus Research Volume 44». Advances in Virus Research 44. pp. 161-202. ISBN 978-0-12-039844-7. PMC 7130874. PMID 7817873. doi:10.1016/S0065-3527(08)60329-2.
- ↑ Patel M, Glass RI, Jiang B, Santosham M, Lopman B, Parashar U (2013). «A systematic review of anti-rotavirus serum IgA antibody titer as a potential correlate of rotavirus vaccine efficacy». The Journal of Infectious Diseases 208 (2): 284-294. PMID 23596320. doi:10.1093/infdis/jit166.
- ↑ a b c Bergman, Hanna; Henschke, Nicholas; Hungerford, Daniel; Pitan, Femi; Ndwandwe, Duduzile; Cunliffe, Nigel; Soares-Weiser, Karla (17 de noviembre de 2021). «Vaccines for preventing rotavirus diarrhoea: vaccines in use». En Cochrane Infectious Diseases Group, ed. Cochrane Database of Systematic Reviews (en inglés) 2021 (11). PMC 8597890. PMID 34788488. doi:10.1002/14651858.CD008521.pub6. Consultado el 1 de diciembre de 2021.
- ↑ «Global Introduction Status». Rota Council (en inglés estadounidense). Consultado el 1 de diciembre de 2021.
