Compuesto de organoestaño

Los compuestos orgánicos de estaño, compuestos de organoestaño, compuestos organoestánnicos o estannanos son compuestos químicos a base de estaño con sustituyentes hidrocarbonados, por tanto, con enlaces químicos entre átomos de carbono y estaño. La química de los organoestánnicos forma parte del amplio campo de la química organometálica.[1][2] El primer compuesto de organoestaño descubierto fue el diyoduro de dietilestaño, estudiado por Edward Frankland en 1849. Un compuesto de estaño se aplica comercialmente como limpiador (scavenger) de residuos de ácido clorhídrico (o estabilizador térmico) en cloruro de polivinilo y también como biocida. El óxido de tributilestaño ha sido ampliamente utilizado como conservante de la madera. Los compuestos de tributilestaño se utilizan como agentes contra las bioincrustaciones (biofouling) marinas. Las preocupaciones sobre la toxicidad [2] de estos compuestos (algunos informes describen efectos biológicos sobre la vida marina en una concentración de 1 nanogramo por litro), han llevado a su prohibición en todo el mundo por la Organización Marítima Internacional. El tricloruro de n-butilestaño se utiliza en la producción de capas de dióxido de estaño sobre botellas de vidrio por deposición de vapor químico.
Preparación de compuestos orgánicos de estaño
[editar]Los compuestos orgánicos de estaño pueden ser sintetizados por reacción de un reactivo de Grignard con haluros de estaño, por ejemplo, tetracloruro de estaño. Un ejemplo es la síntesis orgánica de tributil-[(Z)-5-fenil-2-penten-2-il]estannano[3][4]
La reacción de acoplamiento, similar a la de Wurtz, de compuestos alquílicos de sodio con haluros de estaño permite obtener compuestos de tetraorganoestaño. Otro método es un reacción de intercambio de haluros de estaño con un compuesto de organoaluminio (AlR3). Los haluros de triorganoestaño se pueden preparar en la reacción de redistribución Kocheshkov.
Reacciones de los compuestos orgánicos de estaño
[editar]Reacciones importantes en las que intervienen compuestos orgánicos de estaño son la reacción de Stille (reacción de acoplamiento con haluros orgánicos que poseen hibridación sp2, catalizada por paladio):
y la adición de organostannanos (adición nucleofílica de un alil-, alenil-, o propargil-estannano a un aldehído o imina).
Uso y toxicidad
[editar]- Los compuestos de tetraorganoestaño son moléculas muy estables, con baja toxicidad y baja actividad biológica. No se pueden utilizar como biocidas, pero puede ser metabolizados a compuestos tóxicos de triorganoestaño. Se utilizan como materiales de partida para obtener catalizadores.
- Los compuestos de triorganoestaño son muy tóxicos. Los compuestos de tri-n-alquilestaño son fitotóxicos y por lo tanto no pueden ser utilizados en la agricultura. Dependiendo de los grupos orgánicos, pueden ser bactericidas y fungicidas de gran alcance. Los compuestos de tributilestaño son utilizados como biocidas industriales, por ejemplo, como agentes antifúngicos en el sector textil y del papel, fábricas de pulpa de madera y de papel, fábricas de cerveza, y sistemas de refrigeración industrial. También se utilizan en pinturas antiincrustaciones marinas. Los compuestos de trifenilestaño se utilizan como componentes activos de las pinturas antihongos y fungicidas agrícolas. Otros compuestos de triorganoestaño se utilizan como acaricidas.
- Los compuestos de diorganoestaño no tienen actividad antifúngica, poseen baja toxicidad, y la actividad antibacteriana es baja, a excepción de los derivados de difenilestaño. Se utilizan en la fabricación de polímeros, como estabilizadores térmicos de PVC, catalizadores, en la fabricación de poliuretano y endurecedor de silicona. El DBT es, sin embargo, inmunotóxico, y un estudio reciente sugiere un vínculo con las enfermedades autoinmunes relacionadas[5]
- Los compuestos de monoorganoestaño no tienen actividad biocida y su toxicidad para los mamíferos es muy baja. Los compuestos de metilestaño, butilestaño, octilestaño y monoésterestaño son utilizados como estabilizadores térmicos del PVC.
- Muchos de los compuestos orgánicos de estaño están siendo estudiados en la terapia contra el cáncer, observando que su citotoxicidad y selectividad hacia la célula cancerosa es mayor que la del cisplatino.[6]
Compuestos
[editar]Los compuestos orgánicos de estaño se usan comercialmente en una amplia gama de aplicaciones como biocidas, insecticidas, productos químicos intermedios y catalizadores.
- Compuestos de organoestaño
-
Compuestos de tetrabutilestaño, material de partida para los compuestos de di- y tributilo
-
Óxido de tributilestaño, un líquido incoloro a amarillo pálido usado en conservación de la madera
-
Cloruro de trifenilestaño, un sólido blanco cristalino, que se utiliza como biocida y compuesto intermedio en síntesis química
-
Cloruro de trimetilestaño también es un biocida
-
hidróxido de trifenilestaño, un polvo blanco, utilizado como fungicida y para esterilizar los insectos
-
Azocicloestaño, un sólido cristalino incoloro, acaricida de larga duración para el control de la araña roja en las plantas
-
Cihexaestaño, un sólido blanco cristalino, que se utiliza como acaricida
-
Hexametildiestaño usado como producto intermedio en síntesis química
Otras clasificaciones
[editar]Los poliestannanos son estannanos poliméricos del tipo (SnR2)n
Los estannoles son analógos estructurales del pirrol. También existen organoestannanos insaturados: los estannenos son compuestos del tipo RRC=SnRR con un doble enlace formal (ver también estannobenceno), y los diestannenos tiene un doble enlace estaño-estaño como en RRSn=SnRR. Un estannino contiene un triple enlace entre un átomo de carbono y otro de estaño; un diestannino posee un triple enlace entre dos átomos de estaño (RSnSnR). Los radicales estaño se llaman radicales estannilo, y los carbenos de estaño son los estannilenos (RSn:)[8]
Estannanos hipercoordinados
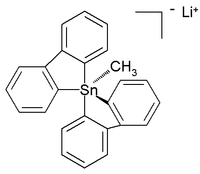
[editar]A diferencia de sus análogos de carbono, los compuestos orgánicos de estaño también pueden estar coordinados con cinco y hasta seis átomos en lugar de los cuatro habituales. Estos compuestos hipercoordinados suelen tener sustituyentes electronegativos para su estabilización. Los pentaorganoestannatos de litio fueron detectados por primera vez y se caracterizaron en disolución en 1986,[9] mientras que en años posteriores se informó sobre un compuesto de tetraorganoestaño de coordinación seis.[10] En 2007, se informó sobre una estructura cristalina de pentaorganoestannano estable a temperatura ambiente (en argón) en forma de sal de litio con esta estructura:[11]
En esta estructura bipiramidal trigonal distorsionada las longitudes de enlace carbono - estaño (2,26 Å apical, 2,17 Å ecuatorial) son más grandes que los enlaces C-Sn normales (2,14 Å) lo cual refleja su naturaleza hipervalente.
Véase también
[editar]Enlaces químicos del carbono con el resto de átomos
[editar]| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Química orgánica básica. | Muchos usos en Química. |
| Investigación académica, pero no un amplio uso. |
Enlace desconocido / no evaluado. |
Referencias
[editar]- ↑ Sander H.L. Thoonen, Berth-Jan Deelman, Gerard van Koten (2004). «Synthetic aspects of tetraorganotins and organotin(IV) halides». Journal of Organometallic Chemistry (689): 2145-2157.
- ↑ Química de organoestaño. Técnica y síntesis en química inorgánica. Robert J. Angelici. Editorial Reverté, 1979. ISBN 8429170189. Pág. 204
- ↑ Martin J. Stoermer, John T. Pinhey (1998). «Tributyl-[(Z)-5-phenyl-2-penten-2-yl]stannane». Molecules 3: M67.
- ↑ Un Grignard reagent reactivo de Grignard se prepara a partir de virutas de magnesio y (Z)-2-bromo-5-fenil-2-penteno en tetrahidrofurano seco y se titula con cloruro de tributilestaño hasta que la disolución se decolora. La disolución resultante se agita a temperatura ambiente durante 1 hora y se elimina el disolvente en un rotavapor. Se añade éter dietílico y el extracto etéreo se lava con salmuera y se filtra y se evapora el éter en un rotavapor. El producto bruto se destila en un Kugelrohr hasta obtener tributil-[(Z)-5-fenil-2-penten-2-il]estannano como un aceite incoloro.
- ↑ C Gumy et al. (2008). «Dibutyltin Disrupts Glucocorticoid Receptor Function and Impairs Glucocorticoid-Induced Suppression of Cytokine Production». PLoS ONE 3: e3545. doi:10.1371/journal.pone.0003545.
- ↑ S. Gómez-Ruiz et al. (2008). «Study of the cytotoxic activity of di and triphenyltin(IV) carboxylate complexes». Journal of Inorganic Biochemistry 102 (12): 2087. PMID 18760840. doi:10.1016/j.jinorgbio.2008.07.009.
- ↑ Organic Syntheses, Coll. Vol. 4, p.881 (1963); Vol. 36, p.86 (1956). Enlace
- ↑ Organotin chemistry 2004 Alwyn George Davies ISBN 3-527-31023-1
- ↑ Reich, Hans J.; Phillips, Nancy H. (1986). «Lithium-Metalloid Exchange Reactions. Observation of Lithium Pentaalkyl/aryl Tin Ate Complexes». J. Am. Chem. Soc. 108: 2102. doi:10.1021/ja00268a067.
- ↑ V. G. Kumar Das, Lo Kong Mun, Chen Wei, and Thomas C. W. Mak (1987). «Synthesis, Spectroscopic Study, and X-ray Crystal Structure of Bis[3-(2-pyridyl)-2-thienyl-C,N]diphenyltin(IV): The First Example of a Six-Coordinate Tetraorganotin Compound». Organometallics 6: 10. doi:10.1021/om00144a003.
- ↑ Masaichi Saito, Sanae Imaizumi, Tomoyuki Tajima, Kazuya Ishimura, and Shigeru Nagase (2007). «Synthesis and Structure of Pentaorganostannate Having Five Carbon Substituents». J. Am. Chem. Soc. 129: 10974-10975. doi:10.1021/ja072478.

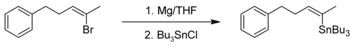
![{\displaystyle {\ce {{} \atop {R-X}+R'-SnR3->[{\ce {Pd\ catalyst}}]{R-R'}+XSnR3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc32d8bb27dcd1527df666b4e488674b353582cf)







![Tetraetilestaño, punto de ebullición 63–65° /12 mm Hg es un catalizador[7]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1e/Tetraethyltin.svg/120px-Tetraethyltin.svg.png)