Diferencia entre revisiones de «Esclerosis múltiple»
m Corrección de -Aparte- Wikiproyecto:Corrección de errores menores |
|||
| Línea 652: | Línea 652: | ||
Entre las mujeres, los principales problemas son: anorgasmia, falta de lubricación vaginal y disminución de la libido. La falta de lubricación vaginal se resuelve con lubricantes. La anorgasmia en ocasiones puede mejorar con dosis bajas de estrógenos en crema de aplicación vaginal. El sildenafilo se ha probado en mujeres con EM y disfunción sexual sin éxito.<ref>{{Cita publicación|url=http://dx.doi.org/10.1097/01.ju.0000113145.43174.24|título=Efficacy of Sildenafil in the Treatment of Female Sexual Dysfunction Due to Multiple Sclerosis|apellidos=DasGUPTA|nombre=RANAN|apellidos2=WISEMAN|nombre2=OLIVER J.|fecha=2004-03|publicación=The Journal of Urology|volumen=171|número=3|páginas=1189–1193|fechaacceso=4 de agosto de 2018|issn=0022-5347|doi=10.1097/01.ju.0000113145.43174.24|pmid=|apellidos3=KANABAR|nombre3=GORANDE|apellidos4=FOWLER|nombre4=CLARE J.}}</ref> |
Entre las mujeres, los principales problemas son: anorgasmia, falta de lubricación vaginal y disminución de la libido. La falta de lubricación vaginal se resuelve con lubricantes. La anorgasmia en ocasiones puede mejorar con dosis bajas de estrógenos en crema de aplicación vaginal. El sildenafilo se ha probado en mujeres con EM y disfunción sexual sin éxito.<ref>{{Cita publicación|url=http://dx.doi.org/10.1097/01.ju.0000113145.43174.24|título=Efficacy of Sildenafil in the Treatment of Female Sexual Dysfunction Due to Multiple Sclerosis|apellidos=DasGUPTA|nombre=RANAN|apellidos2=WISEMAN|nombre2=OLIVER J.|fecha=2004-03|publicación=The Journal of Urology|volumen=171|número=3|páginas=1189–1193|fechaacceso=4 de agosto de 2018|issn=0022-5347|doi=10.1097/01.ju.0000113145.43174.24|pmid=|apellidos3=KANABAR|nombre3=GORANDE|apellidos4=FOWLER|nombre4=CLARE J.}}</ref> |
||
=== Terapias alternativas y complementarias === |
|||
En EM entre 30 y 80% de los pacientes utilizan terapias alternativas y complementarias <ref name=":0">{{cita publicación|título=Summary of evidence-based guideline: Complementary and alternative medicine in multiple sclerosis: Report of the Guideline Development Subcommittee of the American Academy of Neurology|nombre1=V.|apellidos2=Bever|nombre2=C.|fecha=24 de marzo de 2014|publicación=Neurology|volumen=82|número=12|páginas=1083–1092|doi=10.1212/WNL.0000000000000250|apellidos3=Bowen|nombre3=J.|apellidos4=Bowling|nombre4=A.|apellidos5=Weinstock-Guttman|nombre5=B.|apellidos6=Cameron|nombre6=M.|apellidos7=Bourdette|nombre7=D.|apellidos8=Gronseth|nombre8=G. S.|apellidos9=Narayanaswami|nombre9=P.|apellidos1=Yadav}}</ref> <ref name=":1">{{cita publicación|título=Complementary and alternative medicine for the treatment of multiple sclerosis|nombre1=Vijayshree|apellidos2=Shinto|nombre2=Lynne|fecha=10 de enero de 2014|publicación=Expert Review of Clinical Immunology|volumen=6|número=3|páginas=381–395|doi=10.1586/eci.10.12|apellidos3=Bourdette|nombre3=Dennis|apellidos1=Yadav}}</ref>, que son terapias no convencionales pueden utilizarse como ayuda o en lugar de tratamientos establecidos de la enfermedad, principalmente como parte del manejo de síntomas específicos relacionados con la enfermedad <ref name=":2">{{cita publicación|título=Complementary and alternative medicine in multiple sclerosis|nombre1=Heidi|apellidos2=Shepard|nombre2=Katie M.|fecha=de febrero de 2015|publicación=Neurology: Clinical Practice|volumen=5|número=1|páginas=74–79|doi=10.1212/CPJ.0000000000000020|apellidos3=Satya-Murti|nombre3=Saty|apellidos1=Moawad}}</ref> <ref name=":3">{{cita publicación|título=Complementary and alternative medicine in multiple sclerosis|nombre1=R. J.|fecha=24 de marzo de 2014|publicación=Neurology|volumen=82|número=12|páginas=e103–e107|doi=10.1212/WNL.0000000000000307|apellidos1=Fox}}</ref>. Es importante reiterar que ninguna de estas terapias ha demostrado tener un efecto en modificar la actividad y progresión de la enfermedad, aunque algunas de ellas han demostrado tener un impacto positivo en la calidad de vida de los pacientes , siendo algunas de ellas relacionadas con rehabilitación física y ejercicio, alimentación, técnicas de meditación-relajación o psicoterapia <ref>{{cita publicación|título=Complementary and alternative treatments of multiple sclerosis: a review of the evidence from 2001 to 2016|nombre1=Suzi B|apellidos2=van der Mei|nombre2=Ingrid A F|fecha=de enero de 2018|publicación=Journal of Neurology, Neurosurgery & Psychiatry|volumen=89|número=1|páginas=34–41|doi=10.1136/jnnp-2016-314490|apellidos3=Taylor|nombre3=Bruce V|apellidos1=Claflin}}</ref>. |
|||
==== Terapia física: ==== |
|||
Las terapias de rehabilitación física tienen un impacto positivo en la recuperación de secuelas y en mejorar la movilidad, disminuir el grado de espasticidad e incrementar la fuerza de extremidades. Específicamente se ha descrito mejoría en velocidad de marcha y estabilidad <ref>{{Cita publicación|url=https://linkinghub.elsevier.com/retrieve/pii/S1474442217302818|título=Exercise in patients with multiple sclerosis|apellidos=Motl|nombre=Robert W|apellidos2=Sandroff|nombre2=Brian M|fecha=2017-10|publicación=The Lancet Neurology|volumen=16|número=10|páginas=848–856|fechaacceso=2018-09-11|issn=1474-4422|doi=10.1016/s1474-4422(17)30281-8|apellidos3=Kwakkel|nombre3=Gert|apellidos4=Dalgas|nombre4=Ulrik|apellidos5=Feinstein|nombre5=Anthony|apellidos6=Heesen|nombre6=Christoph|apellidos7=Feys|nombre7=Peter|apellidos8=Thompson|nombre8=Alan J}}</ref><ref name=":4">{{Cita publicación|url=https://link.springer.com/article/10.1007%2Fs00415-013-7183-9|título=Exercise therapy and multiple sclerosis: a systematic review|apellidos=Sá|nombre=Maria José|fecha=2013-11-22|publicación=Journal of Neurology|volumen=261|número=9|páginas=1651–1661|fechaacceso=2018-09-19|idioma=en|issn=0340-5354|doi=10.1007/s00415-013-7183-9}}</ref>. |
|||
Otras terapias alternativas como yoga, pilates o tai chi han mostrado en algunos estudios de calidad de vida mejoría similar o mejor a actividad física regular en fuerza muscular, estabilidad postural, disminuyendo niveles de estrés, específicamente en yoga, que es practicado en aproximadamente 30% de los pacientes con EM<ref>{{Cita publicación|url=https://jnnp.bmj.com/content/89/1/34|título=Complementary and alternative treatments of multiple sclerosis: a review of the evidence from 2001 to 2016|apellidos=Claflin|nombre=Suzi B.|apellidos2=Mei|nombre2=Ingrid A. F. van der|fecha=2018-01-01|publicación=J Neurol Neurosurg Psychiatry|volumen=89|número=1|páginas=34–41|fechaacceso=2018-09-19|idioma=en|issn=0022-3050|doi=10.1136/jnnp-2016-314490|pmid=28768821|apellidos3=Taylor|nombre3=Bruce V.}}</ref><ref name=":5">{{Cita publicación|url=http://n.neurology.org/content/82/12/1083|título=Summary of evidence-based guideline: Complementary and alternative medicine in multiple sclerosis: Report of the Guideline Development Subcommittee of the American Academy of Neurology|apellidos=Yadav|nombre=V.|apellidos2=Bever|nombre2=C.|fecha=2014-03-24|publicación=Neurology|volumen=82|número=12|páginas=1083–1092|fechaacceso=2018-09-19|idioma=en|issn=0028-3878|doi=10.1212/wnl.0000000000000250|pmc=PMC3962995|pmid=24663230|apellidos3=Bowen|nombre3=J.|apellidos4=Bowling|nombre4=A.|apellidos5=Weinstock-Guttman|nombre5=B.|apellidos6=Cameron|nombre6=M.|apellidos7=Bourdette|nombre7=D.|apellidos8=Gronseth|nombre8=G. S.|apellidos9=Narayanaswami|nombre9=P.}}</ref>. Resultados similares se han visto en quienes realizan pilates y tai chi<ref>{{Cita publicación|url=https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0170212|título=Tai chi for health benefits in patients with multiple sclerosis: A systematic review|apellidos=Zou|nombre=Liye|apellidos2=Wang|nombre2=Huiru|fecha=2017-02-09|publicación=PLOS ONE|volumen=12|número=2|páginas=e0170212|fechaacceso=2018-09-19|idioma=en|issn=1932-6203|doi=10.1371/journal.pone.0170212|pmc=PMC5300172|pmid=28182629|apellidos3=Xiao|nombre3=ZhongJun|apellidos4=Fang|nombre4=Qun|apellidos5=Zhang|nombre5=Mark|apellidos6=Li|nombre6=Ting|apellidos7=Du|nombre7=Geng|apellidos8=Liu|nombre8=Yang}}</ref><ref>{{Cita publicación|url=https://pinnacle-secure.allenpress.com/action/captchaChallenge?redirectUri=%2Fdoi%2F10.7224%2F1537-2073.2017-066%3Fcode%3Dcmsc-site&code=cmsc-site|título=Impact of Pilates Exercise in Multiple Sclerosis|apellidos=Duff|nombre=Whitney R.D.|apellidos2=Andrushko|nombre2=Justin W.|fecha=2018-03|publicación=International Journal of MS Care|volumen=20|número=2|páginas=92–100|fechaacceso=2018-09-19|idioma=en-US|issn=1537-2073|doi=10.7224/1537-2073.2017-066|pmc=PMC5898921|pmid=29670495|apellidos3=Renshaw|nombre3=Doug W.|apellidos4=Chilibeck|nombre4=Philip D.|apellidos5=Farthing|nombre5=Jonathan P.|apellidos6=Danielson|nombre6=Jana|apellidos7=Evans|nombre7=Charity D.}}</ref> al ser ejercicios que involucran estiramiento muscular y ejercitan músculos que mejoran la estabilidad postural, incluso en ciertos estudios comentando mejoría en fatiga<ref>{{Cita publicación|url=https://linkinghub.elsevier.com/retrieve/pii/S2211034816300293|título=Effects of Pilates exercises on sensory interaction, postural control and fatigue in patients with multiple sclerosis|apellidos=Soysal Tomruk|nombre=Melda|apellidos2=Uz|nombre2=Muhammed Zahid|fecha=2016-05|publicación=Multiple Sclerosis and Related Disorders|volumen=7|páginas=70–73|fechaacceso=2018-09-19|issn=2211-0348|doi=10.1016/j.msard.2016.03.008|apellidos3=Kara|nombre3=Bilge|apellidos4=İdiman|nombre4=Egemen}}</ref><ref>{{Cita publicación|url=https://content.iospress.com:443/articles/neurorehabilitation/nre162121|título=The effects of Mat Pilates and Reformer Pilates in patients with Multiple Sclerosis: A randomized controlled study|apellidos=Bulguroglu|nombre=I.|apellidos2=Guclu-Gunduz|nombre2=A.|fecha=2017-10-14|publicación=NeuroRehabilitation|volumen=41|número=2|páginas=413–422|fechaacceso=2018-09-19|idioma=en|issn=1053-8135|doi=10.3233/nre-162121|apellidos3=Yazici|nombre3=G.|apellidos4=Ozkul|nombre4=C.|apellidos5=Irkec|nombre5=C.|apellidos6=Nazliel|nombre6=B.|apellidos7=Batur-Caglayan|nombre7=H.Z.}}</ref>. |
|||
==== Psicoterapia/Meditación/reflexlogía/biofeedback/mindfulness: ==== |
|||
Así como la discapacidad física está presente en pacientes con esclerosis múltiple, la presencia de síntomas neuropsiquiátricos como trastornos depresivos, alteraciones cognoscitivas y de la conducta son síntomas bastante frecuentes en la enfermedad<ref name=":0" /><ref name=":1" />. Si bien la terapia psicológica no interfiere con la actividad inflamatoria o la progresión de la discapacidad, si impacta positivamente en la calidad de vida de los pacientes con EM<ref>{{Cita publicación|url=https://linkinghub.elsevier.com/retrieve/pii/S2211034818301731|título=Depression is a predictor for balance in people with multiple sclerosis|apellidos=Alghwiri|nombre=Alia A.|apellidos2=Khalil|nombre2=Hanan|fecha=2018-08|publicación=Multiple Sclerosis and Related Disorders|volumen=24|páginas=28–31|fechaacceso=2018-09-19|issn=2211-0348|doi=10.1016/j.msard.2018.05.013|apellidos3=Al-Sharman|nombre3=Alham|apellidos4=El-Salem|nombre4=Khalid}}</ref><ref>{{Cita publicación|url=https://bmcneurol.biomedcentral.com/articles/10.1186/s12883-014-0222-z|título=Symptom changes in multiple sclerosis following psychological interventions: a systematic review|apellidos=Pagnini|nombre=Francesco|apellidos2=Bosma|nombre2=Colin M|fecha=2014-11-30|publicación=BMC Neurology|volumen=14|número=1|fechaacceso=2018-09-19|idioma=En|issn=1471-2377|doi=10.1186/s12883-014-0222-z|pmc=PMC4253984|pmid=25433519|apellidos3=Phillips|nombre3=Deborah|apellidos4=Langer|nombre4=Ellen}}</ref>. |
|||
Terapias alternativas como biofeedback, mindfulness o meditación disminuyen niveles de estrés y mejora la capacidad de respuesta al mismo, encontrando en algunos estudios mejoría principalmente en la autopercepción de la discapacidad y calidad de vida<ref name=":0" /><ref name=":1" />. |
|||
Algunos estudios relacionan terapia con masajes y reflexología con disminución de niveles de estrés y reducción de secuelas sensitivas, como parestesias, en pacientes con EM<ref name=":0" /><ref name=":2" />. |
|||
==== Terapias herbales: ==== |
|||
Canabis: Tanto la marihuana como sus derivados canabinoides han probado tener una efectividad como relajante muscular y como terapia para la espasticidad, ya sea por eventos traumáticos, vasculares, congénitos o como en este caso, en pacientes con esclerosis múltiple, así como el manejo de ciertos tipos de dolor neuropático crónico<ref>{{Cita publicación|url=https://www.frontiersin.org/articles/10.3389/fneur.2018.00183/full|título=Cannabidiol to Improve Mobility in People with Multiple Sclerosis|apellidos=Rudroff|nombre=Thorsten|apellidos2=Sosnoff|nombre2=Jacob|fecha=2018|publicación=Frontiers in Neurology|volumen=9|fechaacceso=2018-09-19|idioma=English|issn=1664-2295|doi=10.3389/fneur.2018.00183|pmc=PMC5874292|pmid=29623067}}</ref>. |
|||
Sin embargo, no ha logrado relacionarse con modificación en la taza de recaídas o la aparición de lesiones nuevas en T2 en resonancia magnética o lesiones captantes de gadolinio<ref name=":1" />. También es bien conocido el efecto negativo en la cognición a largo plazo, por lo que no puede ser recomendado como como terapia complementaria en EM, salvo que sea para tratar específicamente espasticidad o manejo de dolor crónico, solo si no hay respuesta a tratamientos alternativos<ref>{{Cita publicación|url=https://link.springer.com/article/10.1007%2Fs11910-018-0814-x|título=The Use of Cannabis and Cannabinoids in Treating Symptoms of Multiple Sclerosis: a Systematic Review of Reviews|apellidos=Nielsen|nombre=Suzanne|apellidos2=Germanos|nombre2=Rada|fecha=2018-02|publicación=Current Neurology and Neuroscience Reports|volumen=18|número=2|fechaacceso=2018-09-19|idioma=en|issn=1528-4042|doi=10.1007/s11910-018-0814-x|apellidos3=Weier|nombre3=Megan|apellidos4=Pollard|nombre4=John|apellidos5=Degenhardt|nombre5=Louisa|apellidos6=Hall|nombre6=Wayne|apellidos7=Buckley|nombre7=Nicholas|apellidos8=Farrell|nombre8=Michael}}</ref>. |
|||
Ginkgo biloba: No se ha demostrado su eficacia en mejorar la cognición, concentración o atención en pacientes con esclerosis múltiple, sin embargo hay reportes que afirman su efectividad en el manejo de la fatiga, otro síntoma muy importante y discapacitante en estos pacientes<ref name=":0" />. |
|||
==== Ozonoterapia y oxígeno hiperbárico: ==== |
|||
Se ha utilizado la ozonoterapia para en múltiples enfermedades con el objetivo de mejorar la oxigenación tisular y disminuir el efecto nocivo de especies reactivas de oxigeno<ref>{{Cita publicación|url=https://www.hindawi.com/journals/dm/2009/325847/abs/|título=Oxidative Stress is Increased in Serum from Mexican Patients with Relapsing-Remitting Multiple Sclerosis|apellidos=Gabriel|nombre=Ortiz, Genaro|apellidos2=Ángel|nombre2=Macías-Islas, Miguel|publicación=Disease Markers|volumen=26|número=1|fechaacceso=2018-09-19|idioma=en|issn=0278-0240|doi=10.3233/dma-2009-0602|pmc=PMC3833233|pmid=19242067|apellidos3=P.|nombre3=Pacheco-Moisés, Fermín|apellidos4=A.|nombre4=Cruz-Ramos, José|apellidos5=Silvia|nombre5=Sustersik,|apellidos6=Alejandro|nombre6=Barba, Elías|apellidos7=Adriana|nombre7=Aguayo,}}</ref> siendo este último punto uno de los target terapéutico de la EM, incluso con una TME que actúa a este nivel<ref>{{Cita publicación|url=https://journals.sagepub.com/action/captchaChallenge?redirectUri=%2Fdoi%2F10.1177%2F1352458514537013|título=Efficacy and safety of delayed-release dimethyl fumarate in patients newly diagnosed with relapsing–remitting multiple sclerosis (RRMS)|apellidos=Gold|nombre=Ralf|apellidos2=Giovannoni|nombre2=Gavin|fecha=2014-07-02|publicación=Multiple Sclerosis Journal|volumen=21|número=1|páginas=57–66|fechaacceso=2018-09-19|idioma=en|issn=1352-4585|doi=10.1177/1352458514537013|pmc=PMC4361464|pmid=24990854|apellidos3=Phillips|nombre3=J Theodore|apellidos4=Fox|nombre4=Robert J|apellidos5=Zhang|nombre5=Annie|apellidos6=Meltzer|nombre6=Leslie|apellidos7=Kurukulasuriya|nombre7=Nuwan C}}</ref>. Desgraciadamente no hay artículos confiables en los que se haya demostrado eficacia en reducir número de reacaídas, progresión discapacidad o presencia de lesiones nuevas en resonancia magnética (signos que indican actividad de la enfermedad) con este tipo de terapias en pacientes con EM<ref name=":0" /> |
|||
=== Intervenciones en estilos de vida === |
|||
==== Tabaco: ==== |
|||
Es ampliamente conocida la relación negativa del consumo de tabaco con la actividad de la enfermedad. Múltiples estudios demuestran la asociación de mayor número de recaídas, aparición de nuevas lesiones y progresión de la discapacidad en pacientes fumadores versus su contraparte no fumadora<ref>{{Cita publicación|url=https://academic.oup.com/brain/article/136/7/2298/277962|título=Tobacco smoking and disability progression in multiple sclerosis: United Kingdom cohort study|apellidos=Manouchehrinia|nombre=Ali|apellidos2=Tench|nombre2=Christopher R.|fecha=2013-06-11|publicación=Brain|volumen=136|número=7|páginas=2298–2304|fechaacceso=2018-09-19|idioma=en|issn=1460-2156|doi=10.1093/brain/awt139|pmc=PMC3692034|pmid=23757766|apellidos3=Maxted|nombre3=Jonathan|apellidos4=Bibani|nombre4=Rashid H.|apellidos5=Britton|nombre5=John|apellidos6=Constantinescu|nombre6=Cris S.}}</ref>, asociado principalmente al incremento de radicales libres generados<ref>{{Cita publicación|url=https://link.springer.com/article/10.1007%2Fs10654-017-0250-2|título=The interaction between smoking and HLA genes in multiple sclerosis: replication and refinement|apellidos=Hedström|nombre=Anna Karin|apellidos2=Katsoulis|nombre2=Michail|fecha=2017-06-08|publicación=European Journal of Epidemiology|volumen=32|número=10|páginas=909–919|fechaacceso=2018-09-19|idioma=en|issn=0393-2990|doi=10.1007/s10654-017-0250-2|pmc=PMC5680370|pmid=28597127|apellidos3=Hössjer|nombre3=Ola|apellidos4=Bomfim|nombre4=Izaura L.|apellidos5=Oturai|nombre5=Annette|apellidos6=Sondergaard|nombre6=Helle Bach|apellidos7=Sellebjerg|nombre7=Finn|apellidos8=Ullum|nombre8=Henrik|apellidos9=Thørner|nombre9=Lise Wegner}}</ref>. |
|||
==== Alcohol: ==== |
|||
Al momento no hay una relación directa entre el consumo de alcohol y la progresión de la enfermedad, incluso un artículo sugiere disminución de riesgo.<ref>{{Cita publicación|url=https://journals.sagepub.com/action/captchaChallenge?redirectUri=%2Fdoi%2F10.1177%2F1352458518795418|título=Alcohol consumption in adolescence is associated with a lower risk of multiple sclerosis in a Danish cohort|apellidos=Andersen|nombre=Christina|apellidos2=Søndergaard|nombre2=Helle Bach|fecha=2018-08-20|publicación=Multiple Sclerosis Journal|páginas=135245851879541|fechaacceso=2018-09-19|idioma=en|issn=1352-4585|doi=10.1177/1352458518795418|apellidos3=Bang Oturai|nombre3=Ditte|apellidos4=Laursen|nombre4=Julie Hejgaard|apellidos5=Gustavsen|nombre5=Stefan|apellidos6=Larsen|nombre6=Nanna Katrine|apellidos7=Magyari|nombre7=Melinda|apellidos8=Just-Østergaard|nombre8=Emilie|apellidos9=Thørner|nombre9=Lise Wegner}}</ref> Sin embargo esto no es suficiente para poder recomendar su uso. Por otra parte, al haber en el paciente con EM síntomas y secuelas que alteran la función de equilibrio y cognitiva. |
|||
==== Sobrepeso y obesidad: ==== |
|||
Múltiples estudios han demostrado la el involucro que tiene el sobrepeso/obesidad en estados inflamatorios, dado principalmente por el incremento de estados proinflamatorios y reducción de estados antiinflamatorios<ref>{{Cita publicación|url=https://www.hindawi.com/journals/mi/2016/4036232/|título=Multiple Sclerosis and Obesity: Possible Roles of Adipokines|apellidos=Guerrero-García|nombre=José de Jesús|apellidos2=Carrera-Quintanar|nombre2=Lucrecia|fecha=2016|publicación=Mediators of Inflammation|volumen=2016|páginas=1–24|fechaacceso=2018-09-19|idioma=en|issn=0962-9351|doi=10.1155/2016/4036232|pmc=PMC5046034|pmid=27721574|apellidos3=López-Roa|nombre3=Rocío Ivette|apellidos4=Márquez-Aguirre|nombre4=Ana Laura|apellidos5=Rojas-Mayorquín|nombre5=Argelia Esperanza|apellidos6=Ortuño-Sahagún|nombre6=Daniel}}</ref><ref>{{Cita publicación|url=https://journals.sagepub.com/action/captchaChallenge?redirectUri=%2Fdoi%2F10.1177%2F1352458513483889|título=Childhood body mass index and multiple sclerosis risk: a long-term cohort study|apellidos=Munger|nombre=Kassandra L|apellidos2=Bentzen|nombre2=Joan|fecha=2013-04-02|publicación=Multiple Sclerosis Journal|volumen=19|número=10|páginas=1323–1329|fechaacceso=2018-09-19|idioma=en|issn=1352-4585|doi=10.1177/1352458513483889|pmc=PMC4418015|pmid=23549432|apellidos3=Laursen|nombre3=Bjarne|apellidos4=Stenager|nombre4=Egon|apellidos5=Koch-Henriksen|nombre5=Nils|apellidos6=Sørensen|nombre6=Thorkild IA|apellidos7=Baker|nombre7=Jennifer L}}</ref> demostrado a nivel celular y por la expresión de citosinas correspondientes. Específicamente en esclerosis múltiple, el sobrepeso/obesidad se ha relacionado con incremento de la actividad inflamatoria de la enfermedad, tanto en población mundial, como específicamente en población mexicana<ref>{{Cita publicación|url=https://journals.sagepub.com/action/captchaChallenge?redirectUri=%2Fdoi%2F10.1177%2F2055217317715049|título=Environmental factors influencing multiple sclerosis in Latin America|apellidos=Correale|nombre=Jorge|apellidos2=Farez|nombre2=Mauricio F|fecha=2017-06|publicación=Multiple Sclerosis Journal – Experimental, Translational and Clinical|volumen=3|número=2|páginas=205521731771504|fechaacceso=2018-09-19|idioma=en|issn=2055-2173|doi=10.1177/2055217317715049|pmc=PMC5472234|pmid=28638627|apellidos3=Gaitán|nombre3=María Inés}}</ref>. Si bien como medida aislada, no puede considerarse el control de peso como tratamiento de la enfermedad, si se ha demostrado que estilos de vida saludables, que lleven a mantener un peso adecuado, puede estar relacionado con disminución de la actividad inflamatoria, con mejoría en el estado funcional de pacientes con EM. |
|||
==== Alimentación: ==== |
|||
La única intervención nutricional que ha demostrado resultados en algunos estudios, que ha mostrado cambios en el estado inflamatorio de los pacientes con esclerosis múltiple, así como la cantidad de recaídas es la complementación con ácidos grasos omega 3 derivados de pescado<ref name=":1" />. Otros ácidos grasos, así como suplementación con vitaminas B, C, E, limitación calórica o dietas específicas no han mostrado diferencias significativas con respecto a placebo en enfermedad remitente-recurrente o en modalidades progresivas<ref name=":3" />. |
|||
Si bien es conocida la relación de la deficiencia de vitamina D como probable factor ambiental para el desarrollo de EM, la suplementación con esta vitamina no ha mostrado resultados significativos en la disminución de la actividad de la enfermedad per se<ref name=":0" />. Sin embargo, la disminución de niveles de vitamina D se relaciona con osteopenia y aumento de fracturas en pacientes con y sin esclerosis múltiple<ref>{{Cita publicación|url=https://link.springer.com/article/10.1007%2Fs00415-009-5139-x|título=Clinical implications of a possible role of vitamin D in multiple sclerosis|apellidos=Pierrot-Deseilligny|nombre=Charles|fecha=2009-04-28|publicación=Journal of Neurology|volumen=256|número=9|páginas=1468–1479|fechaacceso=2018-09-19|idioma=en|issn=0340-5354|doi=10.1007/s00415-009-5139-x|pmc=PMC2733195|pmid=19399382}}</ref><ref>{{Cita publicación|url=https://linkinghub.elsevier.com/retrieve/pii/S0025619613004047|título=Vitamin D for Health: A Global Perspective|apellidos=Hossein-nezhad|nombre=Arash|apellidos2=Holick|nombre2=Michael F.|fecha=2013-07|publicación=Mayo Clinic Proceedings|volumen=88|número=7|páginas=720–755|fechaacceso=2018-09-19|issn=0025-6196|doi=10.1016/j.mayocp.2013.05.011|pmc=PMC3761874|pmid=23790560}}</ref>, lo que empeora la funcionalidad, por lo que es recomendable complementación con vitamina D en todos los pacientes en los que se diagnostique EM<ref name=":0" /><ref name=":1" />. |
|||
==== Estrés: ==== |
|||
Hay un número considerable de estudios que sugieren una relación directa entre el nivel de estrés emocional con el incremento de recaídas clínicas y presencia de lesiones captantes de gadolinio por resonancia magnética<ref>{{Cita publicación|url=http://www.pnas.org/content/113/47/13444|título=Stress-induced brain activity, brain atrophy, and clinical disability in multiple sclerosis|apellidos=Weygandt|nombre=Martin|apellidos2=Meyer-Arndt|nombre2=Lil|fecha=2016-11-22|publicación=Proceedings of the National Academy of Sciences|volumen=113|número=47|páginas=13444–13449|fechaacceso=2018-09-19|idioma=en|issn=0027-8424|doi=10.1073/pnas.1605829113|pmc=PMC5127380|pmid=27821732|apellidos3=Behrens|nombre3=Janina Ruth|apellidos4=Wakonig|nombre4=Katharina|apellidos5=Bellmann-Strobl|nombre5=Judith|apellidos6=Ritter|nombre6=Kerstin|apellidos7=Scheel|nombre7=Michael|apellidos8=Brandt|nombre8=Alexander U.|apellidos9=Labadie|nombre9=Christian}}</ref><ref>{{Cita publicación|url=https://journals.sagepub.com/action/captchaChallenge?redirectUri=%2Fdoi%2F10.1177%2F1352458514564487|título=The incidence and prevalence of psychiatric disorders in multiple sclerosis: A systematic review|apellidos=Marrie|nombre=Ruth Ann|apellidos2=Reingold|nombre2=Stephen|fecha=2015-01-12|publicación=Multiple Sclerosis Journal|volumen=21|número=3|páginas=305–317|fechaacceso=2018-09-19|idioma=en|issn=1352-4585|doi=10.1177/1352458514564487|pmc=PMC4429164|pmid=25583845|apellidos3=Cohen|nombre3=Jeffrey|apellidos4=Stuve|nombre4=Olaf|apellidos5=Trojano|nombre5=Maria|apellidos6=Sorensen|nombre6=Per Soelberg|apellidos7=Cutter|nombre7=Gary|apellidos8=Reider|nombre8=Nadia}}</ref>. Al ser este el sustrato principal en la fisiopatogenia de la EM, es esperada esta respuesta en pacientes sometidos a estrés crónico o aumento transitorio de situaciones de estrés laboral, personal o social. |
|||
==== Calidad de sueño: ==== |
|||
Se ha propuesto en varios estudios la disminución en la función cognitiva y calidad de vida en pacentes con EM<ref>{{Cita publicación|url=https://academic.oup.com/sleep/article/39/8/1525/2706336|título=Sleep and Cognitive Function in Multiple Sclerosis|apellidos=Braley|nombre=Tiffany J.|apellidos2=Kratz|nombre2=Anna L.|fecha=2016-08|publicación=Sleep|volumen=39|número=8|páginas=1525–1533|fechaacceso=2018-09-19|idioma=en|issn=0161-8105|doi=10.5665/sleep.6012|pmc=PMC4945311|pmid=27166237|apellidos3=Kaplish|nombre3=Neeraj|apellidos4=Chervin|nombre4=Ronald D.}}</ref><ref>{{Cita publicación|url=http://www.mdpi.com/1422-0067/16/7/16514|título=Sleep Disorders Reduce Health-Related Quality of Life in Multiple Sclerosis (Nottingham Health Profile Data in Patients with Multiple Sclerosis)|apellidos=Veauthier|nombre=Christian|apellidos2=Gaede|nombre2=Gunnar|fecha=2015-07-21|publicación=International Journal of Molecular Sciences|volumen=16|número=7|páginas=16514–16528|fechaacceso=2018-09-19|idioma=en|doi=10.3390/ijms160716514|pmc=PMC4519963|pmid=26197315|apellidos3=Radbruch|nombre3=Helena|apellidos4=Wernecke|nombre4=Klaus-Dieter|apellidos5=Paul|nombre5=Friedemann|apellidos6=Veauthier|nombre6=Christian|apellidos7=Gaede|nombre7=Gunnar|apellidos8=Radbruch|nombre8=Helena|apellidos9=Wernecke|nombre9=Klaus-Dieter}}</ref> . Si bien es ampliamente conocido que una buena calidad de sueño mejora la calidad de vida percibida en la población general y disminuye riesgo de enfermedades cardiovasculares y estado anímico, no se han realizado estudios que relacionen este rubro con la actividad inflamatoria o estado de discapacidad en esclerosis múltiple. |
|||
==== Actividad física: ==== |
|||
Los pacientes con esclerosis múltiple no están exentos de desarrollar otro tipo de patologías relacionadas con estilos de vida. Mantener una vida sedentaria, tanto en personas con EM como en población sana, es un importante factor de riesgo para el desarrollo de enfermedades cardiovasculares y sus complicaciones<ref name=":4" />, por lo que debe fomentarse la importancia de mantener estilos de vida saludables que incluyan actividad física regular. Cuando además hay secuelas motoras o de coordinación, realizar ejercicio de manera habitual, así como la terapia específica de rehabilitación física, puede ayudar a mantener un adecuado tono muscular, peso saludable y articulaciones suficientemente laxas para mejorar la movilidad de los pacientes, así como disminuir globalmente niveles de estrés<ref name=":5" />. |
|||
== Pronóstico == |
== Pronóstico == |
||
Revisión del 23:42 19 sep 2018
| Esclerosis múltiple | ||
|---|---|---|
 Síntomas de la esclerosis múltiple. | ||
| Especialidad | neurología | |
| eMedicine | neuro/228 | |

La esclerosis múltiple (EM) o "esclerosis de placas" es una enfermedad neurológica crónica de naturaleza inflamatoria y autoinmune caracterizada por el desarrollo de lesiones desmielinizantes, y de daño axonal en el sistema nervioso central. Es una de las principales causas de discapacidad neurológica de origen no traumático en adultos jóvenes, principalmente mujeres, afectando a entre 2.3 y 2.5 millones de personas en el mundo.[1][2][3][4][5]
La causa de la enfermedad es desconocida, aunque se sabe que el desarrollo de ella se asocia con una serie de factores tales como infecciones virales, parasitosis, tabaquismo, deficiencia de vitamina D, toxinas ambientales y/o dietéticas.[1][3][6][5] La EM ocurre por daño a la mielina, estructura encargada de aislar las fibras nerviosas para lograr una conducción nerviosa eficiente y de proteger a las prolongaciones de las neuronas (axones. Debido a esto, la EM es una enfermedad desmielinizante y neurodegenerativa en la cual el daño se inicia por un proceso de inflamación de origen autoinmune. Al ocurrir desmielinización hay enlentecimiento de la conducción nerviosa entre el sistema nervioso central provocando en los pacientes una gran cantidad de síntomas neurológicos de carácter progresivo y generalmente irreversible.
El cuadro clínico de la EM es muy hetérogeneo e incluye un amplio espectro de síntomas, pudiendo encontrar pacientes con manifestaciones neurológicas leves hasta casos con una enfermedad rápidamente progresiva y discapacitante. Se distinguen diversos fenotipos de la EM,principalmente formas recurrentes (con brotes) y poca discapacidad y formas progresivas con discapacidad acumulativa.[1][2][6][7]
La EM se diagnostica cuando en la evaluación neurológica se encuentran síntomas y signos compatibles, idealmente acompañado de la demostración por resonancia magnética (IRM) de lesiones desmielinizantes en el sistema nervioso central. Los criterios de McDonald actualizados en 2017 son los admitidos internacionalmente para el diagnóstico de EM. El tratamiento consiste en fármacos que retrasan la acumulación de lesiones (tratamiento modificador de la enfermedad), tratamiento para las recaídas (brotes), tratamiento sintomático y de rehabilitación. Se recomienda un diagnóstico y tratamiento oportunos con el fin de prevenir la progresión de la discapacidad.
Descripción
La esclerosis múltiple se caracteriza por dos fenómenos:
- Aparición de focos de desmielinización esparcidos en el cerebro y parcialmente también en la médula espinal causados por el ataque del sistema inmunitario contra la vaina de mielina que recubre los nervios.
- Las neuronas, y en especial sus axones se ven dañados por diversos mecanismos.
Como resultado, las neuronas del cerebro pierden parcial o totalmente su capacidad de transmisión, causando los síntomas típicos de adormecimiento, cosquilleo, espasmos, parálisis, fatiga y alteraciones en la vista.
En la variante remitente-recurrente también se ha detectado inflamación en el tejido nervioso y transección axonal, o corte de los axones de las neuronas, lo que hace que las secuelas sean permanentes.
Clasificación

Se han definido cuatro tipos de esclerosis múltiple:[1][8][5]
Formas recurrentes:
- Síndrome clínico aislado es un primer evento clínico altamente sugestivo de enfermedad desmielinizante del sistema nervioso central, pero que aún no cumple con la diseminación en tiempo para el diagnóstico de esclerosis múltiple clínicamente definida.[9][10] Los síntomas de presentación generalmente son monofocales y evolucionan de forma aguda o subaguda durante días a semanas afectando principalmente al nervio óptico, médula espinal, tronco encefálico o cerebelo.[9] [11] Al igual que otros ataques de esclerosis múltiple, se espera que el episodio dure al menos 24 horas y ocurra en ausencia de fiebre o infección.[9]
- Remitente-recurrente es la forma más común de la enfermedad presentándose en el 85% de los casos, se caracteriza por periodos alternantes de disfunción neurológica (recaídas) y períodos de relativa estabilidad clínica sin nuevos síntomas neurológicos (remisiones). [9][11][12] Las recaídas llegan a producir déficit residual en casi la mitad de los episodios, lo que puede llevar a la acumulación de discapacidad.[9]
Formas progresivas:
- Primaria progresiva alrededor del 10% -20% de los pacientes desarrollarán este fenotipo de enfermedad, que se caracteriza por tener un empeoramiento gradual desde el inicio de la enfermedad, sin haberse precedido de la forma remitente recurrente. [9][11][13] La progresión no es uniforme a lo largo del curso y son posibles las recaídas superpuestas, así como los períodos de relativa estabilidad de la enfermedad.[9]
- Secundaria progresiva se presenta como empeoramiento gradual de la discapacidad después de un curso inicial de enfermedad remitente-recurrente. Puede cursar con o sin exacerbaciones agudas durante el curso progresivo. La mayoría de los pacientes con la forma remitente-recurrente no tratada, eventualmente evolucionarán a una forma secundaria progresiva.[9][13] Actualmente no existen criterios clínicos, de imagen, inmunológicos o patológicos para determinar el punto de transición en el cual la forma remitente-recurrente se convierte en secundaria progresiva, debido a que la transición es generalmente gradual por lo que el diagnóstico se establece frecuentemente años después de que comenzó la progresión real.[10][9] En la actualidad 15-30% de los pacientes con la forma remitente recurrente desarrolla una forma secundaria progresiva durante un seguimiento a largo plazo, estos porcentajes son más bajos que los informados anteriormente, y podrían reflejar cambios en la historia natural de la enfermedad y el efecto de los tratamientos actuales.[13]
Todas los tipos de esclerosis múltiple mencionados previamente pueden clasificarse como enfermedad activa si existe evidencia de nuevas recaídas clínicas; nuevas lesiones captantes de gadolinio y/o nuevas lesiones T2 o que aumentan de tamaño en la resonancia magnética en un periodo de tiempo.[9][10] Este concepto aplica tanto para las formas recurrentes, como para las progresivas. Las formas progresivas además pueden clasificarse como con progresión si presentan un empeoramiento constante de la discapacidad neurológica durante un período de tiempo determinado, o sin progresión cuando se mantiene estable. Para las formas recurrentes se reserva el término empeoramiento confirmado el cual ocurre como resultado de recaídas.[10][9][11]
Historia
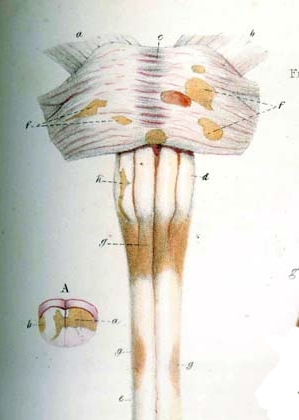
Robert Hooper (1773-1835), un patólogo británico y médico en ejercicio, Robert Carswell (1793-1857), profesor británico de patología, y Jean Cruveilhier (1791-1873), un profesor de anatomía patológica francés, fueron los primeros en describir la enfermedad con ilustraciones médicas y detalles clínicos, pero no lo identificaron como una enfermedad distinta.[14] Para ser más exactos, Carswell describió lesiones que eran "remarcables lesiones de la médula espinal acompañadas de atrofia".[15] También usando el microscopio, el patólogo sueco Georg Eduard von Rindfleisch (1836–1908) anotó en 1863 que las lesiones asociadas estaban distribuidas alrededor de los vasos sanguíneos.[16][17]
Basándose en esto, Jean-Martin Charcot (1825-1893), un neurólogo francés, resumió los datos anteriores y realizó importantes contribuciones con las observaciones clínicas y patológicas propias. Reconoció la esclerosis múltiple (a la que denominó sclérose en plaques disséminées como una enfermedad distinta y separada).[18][19]
Tras los trabajos de Charcot, varios investigadores como Eugène Devic (1858-1930), Jozsef Balo (1895-1979), Paul Ferdinand Schilder (1886-1940) y Otto Marburg (1874-1948) encontraron casos especiales de la enfermedad que ahora se conocen como formas limítrofes de la esclerosis múltiple, ya que algunos autores los clasifican como esclerosis múltiple y otros no. Estos casos son un caso clínico especial, la enfermedad de Devic, también conocida como esclerosis múltiple óptico-espinal o neuromielitis óptica, NMO), tres formas patológicas (esclerosis concéntrica de Balo, esclerosis de Schilder (o esclerosis difusa) y Esclerosis de Marburg, también llamada esclerosis aguda o esclerosis maligna), una forma asociada (neuropatía periférica autoinmune) y una enfermedad asociada (encefalomielitis diseminada aguda o ADEM).
Epidemiología
Desde la casi completa erradicación de la poliomielitis, la esclerosis múltiple es ―tras la epilepsia― la enfermedad neurológica más frecuente entre los adultos jóvenes y la causa más frecuente de parálisis en los países occidentales. Afecta aproximadamente a 1 de cada 1000 personas, en particular a las mujeres.
Los primeros síntomas suelen aparecer en personas entre los 20 y los 40 años, pero también se puede presentar en niños o sobre los 50 años. En niños y personas jóvenes la incidencia en mujeres es el doble que la de los hombres; por otro lado, en paciente sobre 50 años, la incidencia es igual en ambos sexos.[1]
Factores geográficos

La esclerosis múltiple está ampliamente extendida en Europa septentrional donde su mayor prevalencia (200 por cada 100 000 habitantes) se ha relacionado con la falta de vitamina D. En Europa Central su prevalencia es de 80 por cada 100 000 habitantes; en Estados Unidos 8,3 por cada 100 000; en el Sudeste asiático 2,8 por cada 100 000; en África es de menos de 0,5 por cada 100 000.[1]
En los migrantes, si la migración ocurre antes de los 15 años, el inmigrante adquiere la susceptibilidad a la esclerosis de la región a la que se ha desplazado. Si el desplazamiento ocurre después de los 15 años, la persona mantiene la susceptibilidad de su país de origen.[1]
En cambio, en la península arábiga, Asia, América Central y América del Sur continental la frecuencia es mucho menor. En el África Subsahariana es extremadamente rara. Con excepciones importantes, hay un gradiente norte-sur en el hemisferio norte y sur-norte en el hemisferio sur, con las menores frecuencias en las zonas ecuatoriales. En España este gradiente norte-sur se mantiene, la prevalencia media de la península ibérica se puede cifrar en 45 casos por cada 100 000 habitantes.
Según una investigación de Anne-Louise Ponsonby de la Australian National University en Canberra, la probabilidad de enfermar es tanto menor cuanto más tiempo se haya convivido con los hermanos. Más de cinco años de contacto reducen el riesgo un 90 %. La científica explica el fenómeno por el contagio mutuo de enfermedades infecciosas entre hermanos, lo que protege de las enfermedades autoinmunes. Sin embargo, la enfermedad no se transmite directamente como se ha demostrado en estudios con niños adoptados.[cita requerida]
Factores ambientales
Se considera que la esclerosis múltiple aparece cuando se da una combinación de factores ambientales en personas genéticamente predispuestas a adquirirla. El clima, la dieta, toxinas, la luz solar y/o enfermedades infecciosas son algunos de los factores planteados como desencadenantes de la enfermedad. Muchos microorganismos han sido propuestos como agentes generadores de la EM, pero ninguno ha sido confirmado en estudios científicos. El virus de Epstein Barr (VEB) ha sido el mas frecuentemente asociado a EM ya que incrementa el riesgo de contraer Esclerosis Múltiple.[20][21] [22] Otros agente asociado es el Virus de Varicella Zoster virus (VZV) y el resto de la familia de los Herpes Virus Humanos.[21][23] También pueden estar incluidas otras enfermedades, incluidas la rubeola, las paperas y el sarampión.
Radiación Ultravioleta (UV) y vitamina D
Los individuos que migran a regiones de alta prevalencia antes de los 15 años tiene mayor riesgo de desarollar la enfermedad; este fenómeno ha sido atribuido al grado de exposición a los rayos UV, ya que en latitudes de 40° al norte o sur, donde es mas frecuente la enfermedad, la exposición a los rayos solares y el indice de radiación UV es menor.[24] Por otro lado, la forma activa de la vitamina D o 1,25-hydroxyvitamin D3, se sintetiza en la piel gracias a la exposición de luz solar. Los niveles bajos en sangre de esta hormona esteroidea ha sido asociada al incremento en el riesgo de padecer EM atribuido por un efecto en la inmunidad [25]
Otros factores ambientales
El tabaquismo, la exposición a metales (mercurio, plata, oro, solventes orgánicos, pegamento), están estrechamente asociados a la aparición o empeoramiento de las lesiones desmielinizantes.[26][27][28] Además de todo esto también se han propuesto otras causas como el estrés, aunque hay pruebas que sustentan que es débilmente relacionado. La vacunación fue estudiada también como un factor causal, sin embargo, no se encontró ninguna relación.
También se ha determinado la hipótesis de la higiene que propone que la exposición a ciertos agentes infecciosos en las primeras etapas de la vida es protectora para EM, y si existen condiciones higiénicas en extremo, como los países desarrollados, donde se evita este contacto, entonces no se cuenta con esta profilaxis y se desarrolla la enfermedad. Este supuesto no se ha demostrado, por lo que no existe una recomendación para someterse a una exposición innecesaria a agentes infecciosos.
En 2009 se propuso la relación con una enfermedad vascular conocida como insuficiencia venosa cerebroespinal crónica. No obstante, actualmente las evidencias demuestran que se trata de una hipótesis equivocada.
Etiología
Las causas de la enfermedad son desconocidas. Se ha lanzado la hipótesis de que puede ser producida por una combinación de varios factores genéticos y medioambientales.[29] Esto incluye posibles infecciones virales u otros factores en la niñez o durante el embarazo que puedan preparar el sistema inmunitario para una reacción anormal más tarde.
Se considera que la esclerosis múltiple aparece cuando se da una combinación de factores ambientales en personas genéticamente predispuestas a adquirirla. El clima, la dieta, el geomagnetismo, toxinas, la luz solar, factores genéticos y enfermedades infecciosas han sido propuestos como posibles dadas las diferencias de prevalencia regionales. Se ha postulado que algún factor medioambiental en la infancia podría tener un papel importante en el desarrollo de la esclerosis múltiple en la vida del adulto.[cita requerida]
Muchos microorganismos han sido porpuestos como desencadenantes de la esclerosis múltiple, pero ninguno ha sido confirmado. Una explicación para esto puede ser que algún tipo de infección, producida por microorganismos comunes mayormente, esté relacionada con la enfermedad. Los mecanismos propuestos incluyen la hipótesis de la higiene y la de la prevalencia. La hipótesis de la higiene propone que la exposición a ciertos agentes infecciosos en las primeras etapas de la vida es protectora, el problema viene cuando nos volvemos a encontrar con esos agentes más tarde. Por otra parte, la hipótesis de la prevalencia expone que esta enfermedad es debida a un agente infeccioso más común en regiones donde la Esclerosis Múltiple es habitual y donde causa una infección sin síntomas. Solamente en unos pocos casos y después de muchos años causa desmielinización. La hipótesis de la higiene ha recibido más apoyos que la de la prevalencia.
Entre las pruebas acerca de un virus como causante de esta enfermedad se incluyen la presencia de bandas de inmunoglobulinas en el cerebro y el líquido cefaloraquídeo de la mayoría de la gente con Esclerosis Múltiple, la asociación de varios virus con encefalomielitis desmielinizante humana, y la desmielinización en animales es causada por algunas infecciones virales. Un grupo de virus candidato son los Herpes Virus Humanos. Una persona que nunca haya sido infectada por el virus de Epstein-Barr tiene un bajo riesgo de contraer Esclerosis Múltiple, mientras que aquellos infectados siendo jóvenes tienen un riesgo mayor que los que se infectan en edades más tempranas. Aunque hay quien piensa que esto va en contra de la hipótesis de la higiene, dado que los no infectados probablemente han tenido una educación más higiénica, otros creen que no hay contradicción, ya que un primer encuentro con el virus causante de la enfermedad en edades más avanzadas es el desencadenante de esta patología. También pueden estar incluidas otras enfermedades, incluidas la rubeola, las paperas y el sarampión.
La presencia de rasgos de autoinmunidad y defectos en la producción de enzimas antioxidantes son factores de riesgo para padecer la enfermedad.[30]
Entre los factores ambientales, diversos componentes dietéticos parecen jugar un papel en el desarrollo y progreso de la esclerosis múltiple y otras enfermedades autoinmunes, tales como la carencia de vitamina D, la presencia del gluten y las proteínas de la leche, entre otros.[31]
En 2009 se propuso la relación con una enfermedad vascular conocida como insuficiencia venosa cerebroespinal crónica. No obstante, actualmente las evidencias demuestran que se trata de una hipótesis equivocada.[32]
Además de todo esto también se han propuesto otras causas. Fumar es un factor de riesgo independiente de padecer Esclerosis Múltiple. El estrés puede ser un factor perjudicial, aunque hay pruebas que sustentan que es débilemente relacionado. La asociación con exposiciones laborales y toxinas (principalmente disolventes) ha sido evaluada, pero no se han sacado conclusiones claras. La vacunación fue estudiada también como un factor causal, sin embargo, no se encontró ninguna relación. Hay otros muchos factores de riesgo posibles, tales como la dieta o tomar hormonas, pero cuya relación con esta enfermedad es escasa y poco convincente. En pacientes con Esclerosis Múltiple la gota aparece con menos frecuencia y los niveles de ácido úrico son inferiores de lo que cabría esperar. Esto ha llevado a la teoría de que el ácido úrico es protector, aunque su importancia exacta sigue siendo desconocida.
Factores genéticos
La esclerosis múltiple (EM) aparece principalmente en caucásicos. Es 20 veces menos frecuente entre los inuit de Canadá que entre los demás canadienses que viven en la misma región. También es rara entre las tribus indias americanas de América del Norte, los aborígenes australianos y los maorí de Nueva Zelanda. Estos ejemplos señalan que la genética tiene un papel importante en el desarrollo de la enfermedad.
La esclerosis múltiple no es una enfermedad hereditaria. Sin embargo, la enfermedad está influenciada por la constitución genética del individuo y se ha demostrado que existen genes que están relacionados con un mayor riesgo de contraer la enfermedad. La probabilidad de desarrollar la enfermedad es mayor en familiares de una persona infectada, siendo aún mayor si estas personas se parecen al afectado.[10]
Genes específicos que se han relacionado con EM incluyen diferencias en el sistema HLA (Human Leukocyte Antigen) -un grupo de genes del cromosoma 6 equivalentes al Sistema Mayor de Histocompatibilidad (MHC). El descubrimiento más importante en la asociación entre EM y alelos del sistema MHC fueron DR15 y DQ6; existen otros loci a los que se les ha asociado un efecto protector, tales como HLA-C554 y HLA-DRB1*11.[10] Nuevos métodos genéticos han demostrado que al menos existen doce genes fuera del sistema HLA capaces de aumentar la probabilidad de padecer EM.[33]
En general, uno de cada 25 hermanos de un individuo con la enfermedad también se verá afectado. Si un gemelo univitelino se ve afectado, existe hasta un 50 % de probabilidad que el otro gemelo también enferme. Pero solo uno de cada 20 gemelos bivitelinos se verá afectado si su hermano ha enfermado. Si uno de los padres está afectado por la enfermedad, cada uno de los hijos tendrá una probabilidad de 1 entre 40 de desarrollarla de adulto.
Dos estudios realizados en Canadá y Gran Bretaña muestran la siguiente tabla de probabilidades de enfermar según el grado de parentesco:
| Grado de parentesco | Probabilidad de enfermar | |
| En la población | ~ 0,2 % | |
| Familia en 1.er grado | ~ 3 % | |
| Familia en 2o grado | ~ 1 % | |
| Familia en 3.er grado | ~ 0,9 % | |
| Gemelos univitelinos | ~ 35 % | |
| Hermanos | ~ 4 % |
Fisiopatología
Las principales características de la EM son la formación de lesiones en el sistema nervioso central (también denominadas placas), en las cuales hay inflamación y la destrucción de las vainas de mielina (formadas por los oligodendrocitos) que recubren los axones (prolongaciones neuronales). Las lesiones interactúan de una manera compleja dañando el tejido nervioso dando, lo cual provoca los signos y síntomas de la enfermedad. El daño está causado al menos en parte, por el ataque del sistema nervioso de una persona mediado por su propio sistema inmune.[34] [35]
Los tejidos del sistema nervioso y de la médula espinal están protegidos por un sistema de vasos capilares, llamado barrera hematoencefálica, que en los pacientes de esclerosis múltiple disfunciona. Por causas desconocidas, macrófagos y linfocitos pueden cruzar la BHE y comenzar un ataque autoinmune.
Se ha conseguido reconstruir el proceso del ataque del sistema inmunitario a la mielina a partir de observaciones en los tejidos dañados y el estudio de la encefalomielitis experimental autoinmune (o EAE, de sus siglas en inglés), que es una enfermedad similar a la EM que puede ser inducida en los roedores para fines de investigación.
En la EM hay inflamación, desmielinización, gliosis reactiva (generación de cicatrices) y daño axonal. El daño al tejido en la EM es el resultado de una interacción compleja y dinámica entre el sistema inmune, la glía (oligodendrocitos que producen mielina y sus precursores, la microglía y los astrocitos) y las neuronas .
La barrera hematoencefálica (BHE) normalmente protege al sistema nervioso central. En la EM hay disfunción de la BHE, lo cual permite la infiltración de células del sistema inmune hacia el tejido del sistema nervioso central. Cuando se realizan estudios de resonancia magnética (IRM) se puede detectar el daño en la BHE al observar lesiones que captan el medio de contraste (gadolinio). La permeabilidad vascular anormal precede a la desmielinización inflamatoria, en la cual hay daño a los oligodendrocitos que recubren los axones.
Desmielinización e inflamación en Esclerosis Múltiple
Los linfocitos T, llamados células CD4-Th1-T, tienen una función clave en el desarrollo de la enfermedad. Bajo circunstancias normales, estos linfocitos pueden distinguir entre células propias y ajenas. En una persona con esclerosis múltiple, sin embargo, las células reconocen partes sanas del sistema central como ajenas y las atacan como lo harían con un virus. En la EM, la parte atacada es la mielina, una sustancia grasa que cubre los axones de las células nerviosas y que es importante para una transmisión nerviosa adecuada.
En estado normal, existe una barrera entre el sistema nervioso central y la sangre llamada barrera hematoencefálica, que está formada por células endoteliales tapizando las paredes de los vasos sanguíneos. Por causas desconocidas, en los pacientes de EM esta barrera no funciona bien, y las células T autorreactivas la cruzan. A partir de este momento, estas células T van a atacar la mielina del sistema nervioso, produciendo desmielinización. La inflamación es facilitada por otras células inmunitarias y elementos solubles, como la citocinas y los anticuerpos. A causa de este comportamiento anormal del sistema inmunitario, la esclerosis múltiple es considerada una enfermedad autoinmunitaria.
La inflamación finalmente lleva al daño de la barrera hematoencefálica, lo que puede acarrear problemas como inflamación (edema). También causa la activación de macrófagos, de metaloproteinasas y otras proteasas y citocinas. Finalmente llevará a la destrucción de la mielina, proceso llamado desmielinización.
Las células involucradas en el daño inflamatorio de origen auto inmune en EM son principalmente linfocitos (linfocitos T y linfocitos B), macrófagos y microglia. Se han descrito linfocitos T auxiliares (CD4 +) y citotóxicos (CD8 +) en lesiones de esclerosis múltiple: las células T CD4 + están más concentradas en el manguito perivascular, mientras que las células T CD8 + están ampliamente distribuidas dentro del parénquima . A medida que avanza la enfermedad, aumenta la proporción relativa de linfocitos B y las células plasmáticas. El papel de las linfocitos B en EM también se demuestra al detectar anticuerpos de producción intratecal (bandas oligoclonales). Otras funciones de los linfocitos B son: la presentación de antígenos a los linfocitos T y la producción de citocinas. La microglia y los macrófagos mantienen un estado crónico de activación en el transcurso de la enfermedad, formando placas que lesionan la mielina y los oligodendrocitos. También los oligodendrocitos pueden volverse disfuncionales y morir, causando daño tisular por pérdida del soporte metabólico a los axones. Entonces, de manera secundaria, hay muerte neuronal y pérdida de tejido (atrofia cerebral) . Dicho proceso se autoperpetúa llevando a discapacidad irreversible (Jarius 2017). En las lesiones crónicamente desmielinizadas, los axones desnudos permanecen vulnerables y pueden degenerarse lentamente; posibles mecanismos incluyen el transporte axonal alterado, la disfunción mitocondrial y el aumento de la demanda de energía relacionada con los canales iónicos .
La EM en su evolución conduce a la pérdida gradual neuroaxonal que se correlaciona con la discapacidad del paciente, atrofia cerebral y múltiples cicatrices gliales escleróticas en la sustancia blanca. La desmielinización también afecta sustancia gris de la corteza, los núcleos de la base y la médula espinal. La neuroplasticidad se encarga de remielinización aunque generalmente de manera incompleta.
La inflamación está presente en todas las etapas de la EM, pero es más pronunciada en las fases agudas que en las crónicas. A medida que la enfermedad progresa, la inflamación se focaliza dentro del SNC. Se pueden formar estructuras linfáticas terciarias en las meninges [36], y hay evidencia creciente de que la inflamación meníngea desempeña un papel importante en la patología de la corteza en etapas progresivas [37] .
Tipos de lesiones
La National Multiple Sclerosis Society (de Estados Unidos) ha lanzado un proyecto llamado The Lesion Project[38] para catalogar todos los tipos de lesiones posibles y desarrollar un modelo más preciso de cómo ocurren las cosas. Se han encontrado cuatro familias de lesiones diferentes pero no hay un consenso en cuanto al significado de este hecho. Unos piensan que esto significa que la esclerosis múltiple es realmente una familia de enfermedades. Otros piensan que las lesiones pueden cambiar de un tipo a otro con el tiempo o según el individuo. Las cuatro familias o "patrones" son los siguientes:
- Patrón I: La lesión presenta células T y macrófagos alrededor de vasos capilares. Los oligodendrocitos están más o menos intactos y no hay signos de activación del sistema inmune complementario (anticuerpos).
- Patrón II: La lesión también presenta células T y macrófagos alrededor de los capilares. Los oligodendrocitos también se preservan, pero aparencen signos de activación del complemento.
- Patrón III: Las lesiones son difusas y presentan inflamación. Los oligodendrocitos presentes están dañados (oligodendrogliopatía distal). Hay también signos de activación de la microglia y pérdida de MAG (proteína constituyente de la mielina, del inglés myelin associated glycoprotein). Las lesiones no rodean los vasos capilares y hay un anillo de mielina intacta alrededor de ellos. También aparece una remielinización parcial y apóptosis de oligodendrocitos.
- Patrón IV: La lesión presenta bordes abruptos y oligodendrocitos degenerados, con un anillo de mielina. Ausencia de oligodendrocitos en el centro de la lesión. No está activado el complemento ni hay perdida de MAG.
Los dos primeros patrones se consideran ataques autoinmunes contra la mielina y los dos últimos contra los oligodendrocitos.[39] Los dos primeros patrones son además similares a los producidos en EAE (encefalomielitis alérgica experimental).
Las formas limítrofes de la esclerosis múltiple también presentan lesiones incluidas en estos patrones. Así la neuromielitis óptica tendría lesiones mediadas por activación de complemento (patrón II). La esclerosis concéntrica de Baló mostraría pérdida de MAG según el patrón III y la esclerosis múltiple progresiva primaria se correlacionaría con el patrón IV.[39]
Tipos de placas en la EM
Las lesiones de EM pueden ser clasificadas en cuatro inmunopatrones sobre la base de la pérdida específica de proteína de la mielina, la extensión de la placa y la topografía, la destrucción de oligodendrocitos, la deposición de inmunoglobulinas y la activación del complemento.[40]
Patrón I: se encuentran en el 15% de los pacientes con EM, se asocian principalmente con inflamación de células T, desmielinización activa, con muchos macrófagos activados, ausencia de inmunoglobulina y deposición del complemento. Estas características sugieren que la desmielinización y la lesión tisular pueden estar mediadas por productos tóxicos producidos por macrófagos activados. Estas lesiones tienen bordes claramente demarcados y la típica distribución perivenosa que, por confluencia, da como resultado grandes placas desmielinizadas.
Patrón II: encontradas en el 58% de pacientes con EM, muestran no solo infiltración densa con linfocitos T y macrófagos cargados de mielina, sino también deposición de inmunoglobulina y activación del complemento sobre mielina y dentro de macrófagos en sitios desmielinizantes activos sitios, con axones conservados. Este hallazgo sugiere que los mecanismos mediados por anticuerpos y el complemento pueden inducir la desmielinización y la lesión tisular. Estas lesiones también tienen bordes demarcados, típica distribución perivenosa que por confluencia dan grandes placas desmielinizadas, y exhiben pérdida variable de oligodendrocitos en el borde lesional activo, con la reaparición de numerosos oligodendrocitos en el centro de la placa inactiva.
Patrón III: encontradas en el 26% de pacientes con EM se definen por apoptosis de oligodendrocitos, inflamación de linfocitos T, activación de macrófagos y microglías y pérdida preferencial temprana de glicoproteína asociada a la mielina. Hay una pérdida pronunciada de oligodendrocitos en el borde de la placa activa. El centro inactivo está desprovisto de oligodendrocitos. La deposición de inmunoglobulina y complemento está ausente. Las lesiones tienen bordes mal definidos y no están centradas en venas o vénulas.[10]
Daño axonal en EM
La neurodegeneración es una parte temprana de EM que se autoperpetúa y debe considerarse una segunda fase de la EM, sino un proceso concomitante que ya está en marcha en el momento del diagnóstico clínico.[41] El daño axonal puede detectarse incluso en lesiones de la EM donde los axones aún están mielinizados y la pérdida de la reserva funcional se correlaciona con la discapacidad.
La EM es también una enfermedad de la sustancia gris, la desmielinización cortical es más extensa de lo que se creía previamente. La corteza se afecta con placas clásicas desmielinizadas o como pérdida neuronal y atrofia después de la degeneración retrógrada de las lesiones de la sustancia blanca.[42]
Debido a su ubicación, se han descrito tres tipos de lesiones corticales.[43]
Las lesiones subpiales se extienden desde la superficie pial hacia las capas corticales más profundas, alcanzando generalmente la capa cortical tres o cuatro, y son más comunes en la EM crónica. También pueden extenderse a todo el ancho de la corteza, con o sin afección de la sustancia blanca subcortical, y pueden afectar varias circunvoluciones.
Las lesiones intracorticales son pequeñas perivasculares confinadas a la corteza y que evitan tanto la corteza superficial como la sustancia blanca.
Las lesiones leucocorticales afectan tanto a la sustancia gris como a la blanca en su unión y evitan las capas corticales superficiales.
La desmielinización cortical más extensa se ha detectado en la circunvolución cingulada y las cortezas temporales, frontales, insulares y cerebelosas. También se ha detectado una desmielinización extensa en el hipocampo de pacientes con EM progresiva. La desmielinización cortical es más prominente en la EM progresivas, y puede tener un importante correlato patológico de discapacidad irreversible y deterioro cognitivo.[44]
Desmielinización
En estado normal, existe una barrera entre el sistema nervioso central y la sangre llamada barrera hematoencefálica, que está formada por células endoteliales tapizando las paredes de los vasos sanguíneos. Por causas desconocidas, en los pacientes de esclerosis esta barrera no funciona bien, y las células T autorreactivas la cruzan. A partir de este momento, estas células T van a atacar la mielina del sistema nervioso, produciendo una desmielinización.
A la vez aparece un proceso inflamatorio. La inflamación es facilitada por otras células inmunitarias y elementos solubles, como la citocina y los anticuerpos. A causa de este comportamiento anormal del sistema inmunitario, la esclerosis múltiple es considerada una enfermedad autoinmunitaria.
Ampliamente aceptado es que un subtipo especial de linfocitos, llamados células CD4-Th1-T, tienen una función clave en el desarrollo de la enfermedad. Bajo circunstancias normales, estos linfocitos pueden distinguir entre células propias y ajenas. En una persona con esclerosis múltiple, sin embargo, las células reconocen partes sanas del sistema central como ajenas y las atacan como lo harían con un virus. En la esclerosis, la parte atacada es la mielina, una sustancia grasa que cubre los axones de las células nerviosas y que es importante para una transmisión nerviosa adecuada.
La inflamación finalmente lleva a la apertura de la barrera hematoencefálica, lo que puede acarrear problemas como edemas. También causa la activación de macrófagos, de metaloproteinasas y otras proteasas y citocinas. Finalmente llevará a la destrucción de la mielina, proceso llamado desmielinización.
Remielinización
Los pacientes con EM con una mayor capacidad de remielinización tienen menor discapacidad.[45] Más del 40% de las lesiones crónicas de EM muestran evidencia de remielinización y en aproximadamente el 20% de los pacientes con EM, la remielinización es extensa.[46]
La sustancia gris remieliniza más rápidamente que la sustancia blanca en las lesiones leucocorticales, y puede estar relacionada con niveles más bajos de inhibidores de la remielinización dentro de las lesiones corticales o diferencias en la actividad de las células inmunes innatas.[47]
La remielinización es una de las razones por las que, especialmente en las primeras fases de la enfermedad, los síntomas tienden a disminuir o desaparecer después de días a meses. La remielinización en EM también debe considerarse en el contexto del envejecimiento, ya que, independientemente del curso de la enfermedad, los pacientes más jóvenes tienen una mayor probabilidad de recuperación. Aún se desconoce por qué la remielinización es extensa en algunos pacientes cuando falla en otros y por qué las áreas remielinizadas son más vulnerables que la sustancia blanca normal a la desmielinización secundaria.[48] Una hipótesis sería que una lesion inmunomediada inicial también afectaría a las células precursoras de oligodendrocitos y a las nuevas vainas de mielina.[49] Los insultos desmielinizantes repetidos podrían agotar la fuente de las células precursoras de oligodendrocitos [50] , que sumado a la lesión axonal alteran las interacciones apropiadas para la remielinización, ya que los axones proporcionan señales críticas a los oligodendrocitos en el proceso de mielinización [51]. La cicatriz glia densa que se forma dentro de las placas y en sus bordes funciona como una barrera entre el tejido dañado inflamado y el cerebro normal, lo que impide que las células precursoras de oligodendrocitos migren hacia las lesiones.
Daño axonal en esclerosis múltiple
A través de la resonancia magnética y otros sistemas, se ha demostrado que el daño a los axones es una de los principales causas del desarrollo de discapacidad y pérdida del volumen cerebral (atrofia). Se ha demostrado que esta lesión interviene no solo en formas crónicas o en estadios tardíos de la enfermedad, sino que está presente formas tempranas de la enfermedad.
Los síntomas de la EM son causados por lesiones múltiples en el sistema nervioso central y pueden variar mucho entre individuos, dependiendo de dónde ocurran las lesiones. La plasticidad del cerebro a menudo puede compensar una parte del daño, sobre todo en las primeras etapas de la enfermedad.
Factores que provocan una recaída
En general, las recaídas tienden a ocurrir con más frecuencia durante la primavera y el verano que en otoño o en invierno. Infecciones como un catarro, un resfriado o una diarrea aumentan el riesgo de recaída. Sin embargo, la vacuna contra la gripe es inocua y no provoca recaídas como se ha demostrado en diversos estudios recientes. La vacuna del tétanos también se considera inocua, aunque no ha sido estudiada con detalle. En general, las vacunas con virus vivos atenuados aumentan el riesgo de recaída.
El embarazo puede afectar directamente la probabilidad de recaída. Los últimos tres meses de embarazo ofrecen una protección natural contra la recaída, mientras que los primeros meses y especialmente las primeras seis semanas el riesgo aumenta entre un 20 y un 40 %. Según estudios modernos, el embarazo no afecta la incapacidad a largo plazo. La esclerosis múltiple no aumenta la probabilidad de tener un niño disminuido, aunque sí existe la posibilidad de transmisión de la enfermedad. (Ver sección «Genética»).
Estadísticamente no hay evidencias de que accidentes u operaciones provoquen recaídas. En principio, la cirugía no precisa de cuidados especiales que no sean causadas por discapacidades existentes.
El deporte es posible, aunque se desaconsejan extremos como maratones.
El estrés puede causar una recaída, aunque los datos de los estudios son inconsistentes.
El calor y el agotamiento pueden aumentar los síntomas temporalmente, fenómeno conocido como síntomas de Uhthoff. Esta es la razón de que algunos pacientes eviten saunas o incluso duchas calientes. Sin embargo, el calor no es un factor demostrado de recaída. Una fuerte exposición al sol debe ser evitada, ya que los rayos ultravioleta son un fuerte estímulo del sistema inmunitario. -->
Cuadro clínico
Los síntomas de la esclerosis múltiple se desarrollan a lo largo de varios días, expresándose de acuerdo a la zona afectada y en un tiempo variable de forma máxima tras transcurrir una a dos semanas de enfermedad, para luego en la mayoría de los casos ir disminuyendo y eventualmente resolverse en semanas o meses. Los síntomas usualmente son múltiples. Pueden quedar síntomas remanentes crónicos, especialmente los sensitivos. Las manifestaciones dependen de la localización del foco de desmielinización, pero típicamente se presenta como un trastorno sensitivo y/o motor en una o más extremidades (50% de los pacientes), neuritis óptica (síntoma inicial en el 25% de los pacientes), diplopia, ataxia, vejiga neurogénica, fatiga, disartria, neuralgia del trigémino (en menos del 10%), nistagmo, vértigo. En forma más rara puede presentarse afasia, apraxia, convulsiones, demencia, corea y rigidez.[5]
El signo de Lhermitte es un rasgo clínico frecuente de la esclerosis múltiple; se trata de una sensación de tipo eléctrica que recorre la espalda en sentido caudal hasta las piernas, cuando el cuello es flexionado. Dicha sensación se da en el 30% o más de los pacientes.
El fatiga es otro de los síntomas comunes de la esclerosis múltiple, que suele en muchas ocasiones interferir su vida diaria imposibilitando o entorpeciendo su desempeño académico, laboral e incluso sus relaciones interpersonales.
Las lesiones del sistema nervioso central que causan la esclerosis múltiple no siempre se manifiestan directamente como síntomas clínicos detectables y claramente atribuibles a la enfermedad, por lo que en ocasiones se tiende a restar importancia a los primeros signos.
Aunque en algunas ocasiones al principio de la esclerosis múltiple se acumula poca discapacidad y la calidad de vida no se ve demasiado afectada, la realidad es que el sustrato de la enfermedad ya se está desarrollando. De lo que ocurra en las fases iniciales de la esclerosis múltiple, depende en gran medida su evolución posterior. En otras palabras, las lesiones de hoy en el sistema nervioso central, son la causa de la discapacidad de mañana.
Síntomas motores
Las alteraciones motoras suelen presentarse como diversos grados de debilidad, rara vez presentando pérdida total de la fuerza de algún lado del cuerpo (hemiplejía). Los reflejos tendinosos profundos (p. ej., el rotuliano y el aquileano) suelen estar aumentados y a menudo se presenta una respuesta plantar extensora (signo de Babinski) y clonus. Los diversos grados de debilidad, pueden ir desde una leve paresia hasta grados de debilidad avanzada que puede dejar al paciente confinado a una silla de ruedas y/o cama. Más tarde pueden aparecer espasmos flexores dolorosos en respuesta a los estímulos sensitivos. Las lesiones cerebrales o de la médula espinal con más frecuencia cervical pueden producir una hemiparesia, que a veces es el síntoma de presentación.
Neuritis óptica
Se manifiesta típicamente con las siguientes características;
- Dolor. La mayoría de las personas que padecen neuritis óptica sienten dolor ocular que empeora con el movimiento del ojo.
- Pérdida de visión de un ojo. Se sufre por lo menos alguna reducción temporal de la visión, pero el grado de pérdida varía. La pérdida notoria de visión generalmente se produce con el paso de las horas o después de unos días y mejora en el transcurso de varias semanas o meses.
- Pérdida del campo visual. La pérdida de visión periférica se puede producir en cualquier patrón.
- Pérdida de visión cromática. A menudo afecta la percepción de la intensidad de los colores.
Vértigo
El vértigo es una sensación en las que las personas tienen la percepción de que el entorno o ellas mismas se mueven. Se calcula que alrededor del 20% de los afectados de EM pueden sufrirlo en alguna ocasión, cuando la enfermedad provoca algún problema en la zona del cerebro que controla el equilibrio o como cualquier otra persona, cuando se afecta alguno de los sistemas que regulan la sensación del equilibrio.
Sintomatología cognitiva
Si bien antiguamente se consideraba que no existían déficits cognitivos en la esclerosis múltiple, sino que era una enfermedad fundamentalmente física; actualmente se sabe que es común un patrón de déficit cognitivo específico.
El patrón que siguen los déficits cognitivos es un patrón fronto-subcortical; afectando por tanto a las funciones localizadas en el lóbulo frontal y en las zonas subcorticales.
El déficit cognitivo más acentuado y observado en la esclerosis múltiple es la disminución de la velocidad de procesamiento. Esto es explicado por la desmielinización de los axones de las neuronas, que aparte de proteger el axón de las neuronas, hacen que el impulso nervioso se desplace más rápido. Seguidamente se observan otros déficits cognitivos, pero que pueden deberse al déficit de base anteriormente mencionado. Entre estas otras alteraciones estaría la atención, principalmente atención sostenida, selectiva y alternante. La atención sostenida puede ser difícilmente disociable de la fatiga que estos pacientes muestran. Las alteraciones en la atención conllevan a déficits en la memoria, especialmente en la memoria de trabajo (funciones ejecutivas), y déficits en la codificación y recuperación.
Respecto a los déficits frontales puede haber cambios conductuales (apatía, falta de motivación, pseudodepresión; o por el contrario desinhibición, impulsividad, agresividad e irascibilidad, infantilismo...) y en las funciones ejecutivas (capacidad para planificar, flexibilidad mental, razonamiento...) además de las anteriormente mencionadas.
Los déficits cognitivos que muestran los pacientes son evaluados neuropsicológicamente, y la terapia de rehabilitación suele ayudar a ralentizar el curso de la enfermedad.
Aspectos emocionales
Dado que la esclerosis múltiple afecta el cerebro y la espina dorsal, es de naturaleza degenerativa y a menudo lleva a una discapacidad progresiva, no es extraño que las personas afectadas sufran dificultades emocionales. Depresión, ansiedad, ira, miedo, junto con otras emociones se diagnostican a menudo entre las personas que sufren esclerosis múltiple o los allegados.
A pesar de que estos sentimientos son comprensibles, tienen implicaciones sociales, especialmente cuando interfieren con el trabajo, la escuela y la vida familiar. En particular, la depresión lleva asociada el peligro de suicidio.
Todos estos problemas pueden ser solucionados con tratamientos psicológicos y medicación adecuada.
- Depresión
La depresión en estos casos puede originarse tanto en las implicaciones del diagnóstico como en los efectos que produce la enfermedad en el cerebro. El cerebro es un órgano altamente especializado y es el origen de todas las emociones. Cuando un brote afecta la parte del cerebro en que se procesan las emociones, el resultado puede incluir depresiones.
También se ha informado de casos de depresión en algunos pacientes que toman interferón beta (Avonex® o Rebif®) para tratar la enfermedad.
- Ansiedad
La ansiedad también es un problema frecuentemente asociado con la esclerosis múltiple. Al igual que la depresión, puede estar originada por la enfermedad o por las implicaciones del diagnóstico. Las consecuencias cognitivas de la esclerosis múltiple también suelen estar asociadas a ella. No es raro que personas que sufren la enfermedad desarrollen falta de memoria, dificultades en explicar conceptos abstractos, organizar, planificar u olviden determinadas palabras. Estos síntomas pueden generar ansiedad y resultar en una retirada de la vida social.
- Otras alteraciones
La ira es otro sentimiento que puede ir asociado a la esclerosis múltiple y, de hecho, con todas las enfermedades crónicas graves. También se ha informado de la aparición de "risa patológica" y "llanto patológico". Esencialmente se refiere a una reacción inapropiada a la situación, tal como risas en un funeral o llanto al oír buenas noticias. A menudo es consecuencia de la desmielinización de las áreas del cerebro encargadas del juicio.
Diagnóstico de Esclerosis Múltiple
El diagnóstico de la Esclerosis Múltiple (EM) depende de la documentación de múltiples episodios neurológicos de exacerbación y remisión de la enfermedad a través del tiempo y en diversos sitios del sistema nervioso central. No existe ninguna prueba o marcador biológico que permita en forma aislada establecer el diagnóstico definitivo de EM, se requiere en su conjunto de una evaluación clínica que se apoye con estudios paraclínicos como la Resonancia Magnética (IRM), Bandas Oligoclonales en líquido cefalorraquídeo y potenciales evocados. [52][53]
Criterios de Diagnóstico
El Panel Internacional para el diagnóstico de la Esclerosis Múltiple, estableció las últimas revisiones a los criterios diagnósticos de McDonald en 2017, estos criterios se basan en el número de brotes y la evidencia objetiva de daño neurológico mediante signos clínicos así como en dos pilares fundamentales que son la demostración de la diseminación de las lesiones desmielinizantes en espacio y en el tiempo.[54]
| Número de Brotes | Signos Clínicos | Requisitos para complementar diagnóstico |
|---|---|---|
| 2 | 2 | Ninguno |
| 2 | 1 | Diseminación en espacio |
| 1 | 2 | Diseminación en tiempo |
| 1 | 1 | Diseminación en tiempo y en espacio |
Brote, Recaída ó Exacerbación-Síntomas de instauración aguda con signos típicos de una afección inflamatoria desmielinizante en SNC, con una duración al menos de 24 hrs. en ausencia de fiebre o infección.
Signos Clínicos-Evidencia Clínica de una lesión desmielinizante que se documenta de forma objetiva mediante la exploración neurológica.
Criterios de Diseminación en espacio de Swanton
Lesiones desmielinizantes en diferentes regiones del sistema nervioso central. Se requiere al menos una lesión en Resonancia Magnética en secuencia T2 en por lo menos dos de las siguientes 4 áreas:
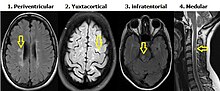
Criterios de Diseminación en tiempo de Montalban
Afectación en diferentes momentos de la evolución de la enfermedad. La demostración de los cambios temporales de las lesiones desmielinizantes (progresión en número y tamaño de las lesiones), se realiza mediante estudios de seguimiento en IRM cerebral que deben encontrar:
1.-Una nueva lesión en IRM en la secuencia T2
2.-Una lesión que capta gadolineo en el seguimiento por IRM, con referencia a una IRM basal
3.-Presencia de lesiones asintomáticas gadolineo positivas y no gadolineo positivas en cualquier momento.
4.-Nuevo brote.
5.-Bandas Oligoclonales positivas en LCR[55]
Resonancia Magnética
La IRM es la técnica más sensible en la identificación de las placas desmielinizantes, detecta en más del 97% pacientes con EM clínicamente definida. Como consecuencia de esta alta sensibilidad, la RM se ha convertido en una técnica esencial, no solo en el diagnóstico de la EM sino también como marcador pronóstico.
Las lesiones desmielinizantes son múltiples y de pequeño tamaño (menores de 25 mm) de morfología ovoidea o nodular.
Detección de Bandas Oligoclonales (BOC) de IgG
El análisis del LCR sirve para obtener evidencia de la naturaleza inmunitaria e inflamatoria de la enfermedad, en el 50% de los pacientes hay un incremento discreto de linfocitos en LCR (pleocitosis linfocítica).
El 87-95% de los pacientes con EM tiene BOC positivas. Se considera que hay síntesis intratecal de inmunoglobulinas si hay más de dos bandas oligoclonales en el LCR que no se encuentren en suero.
El isoelectroenfoque(IEF) y una tinción inmuno específica para las moléculas de IgG, se ha propuesto como el método más adecuado para la detección de las BOC. [56][57]
Detección de bandas Oligoclonales de IgM
La presencia de BOC de IgM principalmente, las BOC de IgM se han asociado a un pronóstico más agresivo de la enfermedad.
Diagnóstico Diferencial
Dentro de los diagnósticos diferenciales de la Esclerosis Múltiple hay que descartar principalmente neuromielitis óptica que es más prevalente en la población latinoamericana, encefalomielitis diseminada aguda(EMDA) principalmente en la población pediátrica, manifestaciones neurológicas del VIH, enfermedad de Behcet, sarcoidosis, síndrome de Sjögren, lupus eritematoso sistémico, neuropatía aguda óptica isquémica, enfermedad de Susac, síndrome antifosfolípidos, neurosífilis, neurocisticercosis, enfermedad de Lyme, deficiencia de cobre o zinc, enfermedad celíaca, deficiencia de vitamina E, enfermedad de Wilson, porfiria, arteriopatía cerebral autosómica dominante con infartos subcorticales y leucoencefalopatia, linfoma de sistema nervioso central, síndrome paraneoplásico, malformación vascular medular, lesiones desmielinizantes por tóxicos, entre otros.[58]
Criterios de Diagnóstico en EM Primaria Progresiva
Al menos un año de progresión continua de la enfermedad y al menos 2 de los 3 siguientes hallazgos: IRM de Cráneo con 9 lesiones en T2, IRM medular con 2 lesiones desmielinizantes y un LCR positivo (que demuestre BOC o elevación del índice de IgG).[59]
Tratamiento
Hasta ahora, no existe un tratamiento curativo disponible para la EM, de manera que la estrategia se enfoca a reducir la actividad tanto clínica como radiológica y la progresión de discapacidad.[60]
El objetivo primario en el tratamiento de la esclerosis múltiple, especialmente en la variante recurrente, es la reducción de la actividad de la enfermedad para optimizar la reserva neurológica, la cognición y la función física. Esto se consigue mediante el uso de «fármacos modificadores de la enfermedad» tales como interferon, acetato de glatiramer, anticuerpos monoclonales y moduladores del receptor esfingosina-1-fosfato.[7][61]
Los fármacos modificadores de la enfermedad aprobados para el tratamiento de la esclerosis múltiple son:[61]
- IFN 1a
- Cladribina
- Interferón β-1b
- Interferón β-1a
- Peginterferón β-1a
- Acetato de glatiramer
- Dimetilfumarato
- Teriflunomida
- Fingolimod
- Daclizumab beta
- Alemtuzumab
- Natalizumab
- Ocrelizumab
- Mitoxantrona
En general, podemos dividir el tratamiento para Esclerosis Múltiple en 3 apartados:
- Terapia Modificadora de la Enfermedad (TME)
- El tratamiento durante las recaídas (Tratamiento agudo)
- Tratamiento sintomático
TME
Las metas de las TME son: Modificar la historia natural de la enfermedad, reducir la actividad inflamatoria en el Sistema Nervioso Central (SNC) y prevenir o enlentecer la progresión de la discapacidad. Según lo anterior, la recomendación actual es “la optimización” del tratamiento , lo cual significa hacer una selección de un fármaco que tenga un perfil de riesgo/beneficio favorable para el paciente de acuerdo a múltiples factores pronósticos que pueden considerarse al iniciar el tratamiento y en el monitoreo subsecuente para lograr definir si la respuesta es adecuada o se requiere un cambio oportuno de fármaco
En 1993, la Food and Drug Administration (FDA) autorizó el primer interferón beta para el tratamiento de la EM; a partir de entonces, múltiples tratamientos se han introducido para su manejo.
Para finales de 2017 se contaban con 11 fármacos aprobados por FDA para el tratamiento de la Esclerosis Múltiple en su forma Recurrente-Remitente, lo cual permite una mejor oportunidad de individualizar el manejo según factores pronósticos de cada paciente considerando eficacia, efectos adversos, mecanismos de acción y aspectos de conveniencia [62]
Podemos dividirlos como:
1 Terapias inyectables
Interferones [10]
El Interferón B1b estuvo disponible por primera vez en Australia en 1995. Su mecanismo de acción no es del todo claro, pero se sabe que regula las células y sustancias proinflamatorias, así como su paso al SNC. Se han generado nuevas formulaciones a fin de disminuir la frecuencia de su aplicación y con ello mejorar el apego terapéutico.
Acetato de Glatiramer[63][64]
Su primer estudio pivotal se publicó en 1995; su mecanismo de acción no es completamente claro pero se sabe que genera u cambio en la diferenciación de células pro-inflamatorias a anti-inflamatorias y recientemente ha cambiado su presentación de 20mg a 40mg con lo cual su forma de aplicación cambió de ser diaria a ser en días alternos.
2 Terapias orales
La Cladrinina[1] fue aprobada por parte de la Agencia Europea de Medicamentos fue agosto de 2017 y a partir de ahí se ha registrado en más de 38 países en todo el mundo. Las Tabletas de Cladribina son una terapia oral de cursos cortos que se cree que actúa selectivamente sobre los linfocitos. Las tabletas de Cladribina se encuentran actualmente bajo investigación clínica y no están aprobadas para el tratamiento de ningún uso en los Estados Unidos. Actualmente ha recibido aprobaciones para pacientes con EMR de alta actividad según lo definido por las características clínicas o de imagen en la Unión Europea (UE), Israel, Argentina, Emiratos Árabes Unidos, Chile y Líbano. En diciembre de 2017, Canadá y Australia aprobaron Tabletas de Cladribina para el tratamiento de EM recurrente-remitente (RRMS).”
El fingolimod, aprobado en más de 60 países, es el primer tratamiento oral modificador de la enfermedad aprobado en primera línea en EE. UU. para la esclerosis múltiple recidivante, la forma más frecuente. En la Unión Europea se aprobó en marzo de 2011 para los pacientes con esclerosis múltiple recidivante-remitente grave de evolución rápida o muy activa.
La esclerosis múltiple progresiva primaria es muy difícil de tratar. Los corticoesteroides a altas dosis cada tres meses pueden tener algún efecto. En principio no existe un tratamiento preventivo efectivo para la esclerosis múltiple progresiva primaria. El tratamiento de los síntomas, y la rehabilitación llevada a cabo principalmente desde terapia ocupacional, fisioterapia y logopedia, tienen un papel importante. Es muy importante, igualmente, la evaluación por parte de un neuropsicólogo para poder abordar cualquier déficit cognitivo que pudiera instaurarse.
Entre las intervenciones dietéticas, en ocasiones se ha empleado la dieta sin gluten, debido a la existencia de casos documentados que confirman la remisión de la esclerosis múltiple simplemente tras la retirada estricta y mantenida de los alimentos que contienen gluten en la dieta.[65][66] Otras intervenciones dietéticas en estudio incluyen la suplementación con vitamina D, ácidos grasos poliinsaturados, antioxidantes (vitaminas A, C y E) y probióticos.[31]
Medicamentos experimentales y terapias alternativas se describen en el artículo Tratamiento de la esclerosis múltiple. El estado de las terapias experimentales, llamadas "pipeline", pueden ser consultadas en sitios especializados.
Es el segundo fármaco oral aprobado (2012) para las formas recurrentes de EM. Funciona disminuyendo la capacidad de replicación de los linfocitos responsables de la inflamación en el SNC con lo cual se busca una reducción de actividad clínica y radiológica de la enfermedad según los estudios clínicos. Es el único fármaco oral que ha mostrado eficacia en fases tempranas de la enfermedad (Síndrome Clínico Aislado).
Está disponible en nuestro país para formas recurrentes de EM. La dosis es una toma cada 12h. Su mecanismo de acción no está bien entendido pero sus efectos son antiinflamatorios e inmunomoduladores a través de la regulación de la función del sistema inmunológico al estrés oxidativo, lo cual ha demostrado reducir la cantidad de recaídas y las lesiones vistas en la resonancia magnética.
3 Anticuerpos Monoclonales
Primer anticuerpo monoclonal aprobado en 2004 en Estados Unidos y en 2006 por la Unión Europea para el tratamiento de la EM. Su indicación es como monoterapia en pacientes con formas recurrentes que han presentado respuesta inadecuada a otros fármacos o como primera opción en casos de enfermedad agresiva.
Su mecanismo de acción es evitar el paso de las células del sistema inmunológico (linfocitos) al Sistema Nervioso Central (SNC), limitando así el proceso inflamatorio con lo que disminuye el número de recaídas clínicas, la progresión de discapacidad y el número de lesiones por Resonancia Magnética, siendo considerado uno de los medicamentos con mayor eficacia. Se aplica de manera mensual con pocas reacciones asociadas a la infusión.
Es un anticuerpo monoclonal aprobado para pacientes con EM Recurrente-Remitente en la Unión Europea desde 2013 y más recientemente en Estados Unidos. Su indicación es como monoterapia en pacientes con formas recurrentes y activas de EM.
Su mecanismo de acción consiste en reducir el número de linfocitos en la sangre de manera significativa y después de algunas semanas generar una repoblación de estas células generando un nuevo balance del sistema inmunológico, con lo cual que ha demostrado una reducción significativa en el número de recaídas, la progresión de discapacidad, las lesiones vistas en resonancia magnética incluyendo el nivel de atrofia cerebral, etc. Su forma de administración es a través de una infusión que dura alrededor de 4 horas en dos ciclos de tratamiento, el primero de ellos administrando una dosis diaria por cinco días y el segundo doce meses después aplicando una dosis diaria por tres días.
El efecto clínico de estas aplicaciones se mantiene a largo plazo en los estudios clínicos, aunque de ser necesario, los pacientes pueden recibir más ciclos de tratamiento de acuerdo a su evolución.
4 Transplante Autólogo de Células Madre [10]
Con la finalidad de reconstituir el sistema inmunológico de los pacientes. Sin embargo, no se cuenta con un protocolo definido y tiene muchas limitantes, por lo que se considera aún como un tratamiento experimental en desarrollo.
Tratamiento agudo
Es importante que los paciente que cursan con la enfermedad reconozcan cuales son los signos y síntomas de un brote, que traduce actividad clínica de la enfermedad, y así puedan acudir a la brevedad posible a su neurólogo, quien deberá identificar el brote o bien descartar procesos infecciosos o condiciones que simulan un brote " pseudobrotes", instaurando el tratamiento medico en agudo.
En pacientes con EM tipo RR en brote, con síntomas neurológicos que condicionan discapacidad o involucro en la visión, la fuerza o la función cerebelosa, se recomienda el tratamiento con glucocorticoides. La metilprednisolona vía intravenosa es de elección, sin embargo estudios también sugieren que el régimen oral es igual de efectivo. Los brotes que condicionen síntomas sensitivos moderados no deben ser tratados.[78]
La inyección con corticotropina en gel es una alternativa para pacientes en brote, los cuales no pueden tolerar altas dosis de glucocorticoides vía intravenosa. Se deben descartar procesos infecciosos. [79]
En pacientes que cursan con déficit neurológico agudo, severo, con poca respuesta al tratamiento con altas dosis de glucocorticoides, se sugiere el tratamiento con plasmaferesis. [80]
En los pacientes con EM tipo remitente recurrente con actividad manifestada por síntomas clínicos o por lesiones que realzan al contraste, se debe ofrecer terapia modificadora de la enfermedad.
Tratamiento Sintomático
Entre los problemas sintomáticos que padecen los pacientes con EM se encuentran la disfunción cognitiva, la depresión, la fatiga y las alteraciones en la marcha, las cuales se presentan con mayor frecuencia con la progresión de la enfermedad. La espasticidad, el temblor, las crisis epilépticas, la disfunción esfintérica y vesical pueden también complicar la progresión de la enfermedad.[81]
Trastornos urológicos
Es importante categorizar al paciente en el tipo de disfunción: falla del detrusor por hiperactividad, falla en el vaciamiento por hipoactividad de la vejiga, o una combinación de ambas fallas.
Las metas para el tratamiento del paciente con disfunción vesical neurogenica inluyen: preservar la función renal, minimizar las complicaciones del tracto urinario y lograr continencia.
El tratamiento de la disfunción vesical en pacientes con EM involucra suprimir la urgencia y asegurar un adecuado drenaje urinario.
La terapia inicial para el ajuste de la disfunción esfintérica incluye restricción de líquidos ≤2 L al día y coordinar los tiempos para realizar la micción.[82]
En pacientes con hiperctivdad del detrusor, los medicamentos anticolinérgicos y antimuscarinicos representan la primera opción. La Oxibutinina es el medicamento de primera elección. Otros medicamentos anticolinérgicos incluyen tolterodina, propantelina, propiverina, fesoterodina y solifenacina.
Una terapia adjunta con cateterización intermitente puede ser de ayuda en el vaciado eficaz vesical y la continencia.
La terapia dual es efectiva y bien tolerada en algunos pacientes, se pueden incluir medicamentos con diferentes mecanismos de acción como anticolinérgicos, agonistas colinérgicos, bloqueadores alfa adrenérgicos, antidepresivos tricíclicos y agentes simpaticomiméticos.
Se debe tener cuidado con los efectos adversos de los anticolinergicos que incluyen confusión, sobre todo en pacientes mayores.
La inyección con toxina botulínica es una opción en pacientes con disfunción vesical debido a hiperactividad del detrusor que son resistentes a tratamiento o intolerantes a terapia con anticolinérgicos/ antimuscarínicos.[83]
La hiperactividad del detrusor que no responde al tratamiento con toxina botulínica puede beneficiarse con la neuromodulación sacra y estimulación eléctrica a nivel de raíces S3, asi como de la estimulación nerviosa del nervio periférico de del nervio dorsal del pene, clítoris o nervio tibial posterior.[84] Dicho tratamiento inhibe el reflejo de micción.
En pacientes con disinergia del esfínter del detrusor, los alfa antagonistas como prazocina, terazocina, doxacocina y tamosulocina pueden ser beneficiosos.
La desmopresina es una buena opción para tratar la nicturia.[85]
Los pacientes con infecciones recurrentes del tracto urinario deben ser investigados con ultrasonido y cistoscopia para descartar anormalidades que puedan estar subyacentes, de ser así el caso, se recomienda iniciar con dosis bajas de antibióticos de forma preventiva. [86]
Trastornos intestinales
Los problemas comunes incluyen constipación, falta de evacuación, e incontinencia.
Otras causas de disfunción intestinal son consecuencia de la disminución en la actividad física y motilidad, lo cual puede impactar en la frecuencia del movimiento intestinal, de manera secundaria otras condiciones médicas relacionadas con la EM y los efectos adversos de los medicamentos relacionados con el tratamiento de la espasticidad, dolor y disfunción vesical.
El estreñimiento se trata mediante una dieta rica en fibra y una ingesta hídrica adecuada. Si esto no es suficiente, se pueden asociar laxantes.[87]
Las terapias de biofeedback han demostrado también su utilidad.[88]
El tratamiento de la incontinencia es sintomático, se basa en asegurar una dieta rica en fibra para producir heces blandas pero formadas que resultan más fáciles de controlar que las heces liquidas, en terapias de biofeedback y, en casos extremos, en el uso de obturadores anales.
Deterioro cognitivo
Las alteraciones más comunes son la falta de atención, en la función ejecutiva, conceptualización abstracta, memoria a corto plazo, recordar palabras, lenguaje y procesamiento de la información. Es importante evaluar la depresión, las alteraciones en la higiene del sueño, síndromes dolorosos y la fatiga en todos los pacientes con déficit cognitivo, ya que dichos problemas pueden tener impacto en las experiencias de los pacientes. El régimen de medicación deberá ser analizado para medicamentos asociados con efectos sedantes, hipnóticos y efectos psicomotores.
Tratamiento farmacológico
No hay terapias que prueben eficacia para el tratamiento del déficit cognitivo relacionado con EM, sin embargo los efectos de algunos agentes modificadores de la enfermedad en EM e inhibidores de la colinestersada se encuentran en estudio en relación de su beneficio e impacto en la función cognitiva.[89]
Los inhibidores de la colinesterasa fueron investigados inicialmente para el tratamiento de la enfermedad de Alzheimer, donde existe un déficit colinérgico en la corteza.[90] Se sabe también que existe un deficit colinerico asociado con EM, sin embargo ensayos pequeños sugieren que el donepezilo puede tener un beneficio modesto en el tratamiento.[91].
Tratamiento y estrategias no farmacológicas
Organizadores de uso personal, como alarmas, pueden ser de utilidad en pacientes con dificultad en la áreas de la memoria y la organización. Recordatorios por escrito, directorios, logos telefónicos son otros instrumentos que cumplen con el mismo propósito.
La neurorrehabilitacion se plantea como un apoyo importante para estos pacientes. Tiene como objetivo intentar mejorar el déficit de atención y memoria, recuperar habilidades deterioradas, así como potenciar el desarrollo de mecanismos de adaptación y habilidades compensadoras. No obstante, la evidencia de su utilidad es escasa.[92]
Depresión
Entre un 15-50% de los pacientes con EM presentan síntomas de depresión mayor. El tratamiento con interferón no parece aumentar las tasas de depresión como inicialmente se sugirió. [93] Se recomienda un abordaje integral, psicoterapéutico y farmacológico en estos pacientes. Los antidepresivos tricíclicos y los inhibidores de la recaptura de la serotonina pueden ser útiles en el tratamiento; la elección debe individualizarse en función de la situación basal de cada paciente y el perfil de efectos secundarios.[94]
Fatiga
Es un síntoma frecuente en los pacientes con EM. Se debe intentar identificar y tratar los posibles factores concomitantes que puedan generar o empeorar la fatiga, como los trastornos del sueño, la depresión o el dolor.
Algunos fármacos como el interferón o los empleados en el tratamiento sintomático de la espasticidad pueden ser causa de fatiga.
Ciertas medidas no farmacológicas como planificar la mayor parte de la actividad a primera hora de la mañana, realizar descansos regulares, ejercicio físico o estructurar los horarios pueden resultar útiles. Si la fatiga persiste, se puede valorar el tratamiento farmacológico.
El único tratamiento que ha demostrado tener cierta base para su uso es la amantadina.[95]
Alteraciones en la marcha
Las alteraciones en la marcha en pacientes con EM pueden ser el resultado de diversas complicaciones como la espasticidad, debilidad, fatiga, alteraciones sensoriales, pérdida visual y disfunción vestibular. La fampridina, un bloqueador de los canales de potasio, es el primer tratamiento aprobado con la indicación de mejorar la capacidad de la marcha de los pacientes con EM. [96] Esta contraindicada en pacientes con historia de crisis epilépticas y en pacientes que reciben fármacos inhibidores del transportador de cationes orgánicos 2 (OCT2) renal.
Dolor
Existen síndromes dolorosos paroxísticos asociados a la EM como la neuralgia del trigémino y el fenómeno de Lhermitte. Episodios recurrentes del signo de Lhermitte, incluyendo aquellos sin lesión medular, pueden responder a terapia con gabapentina, pregabalina y cabamazepina. La terapia farmacológica utilizada de primera línea incluye carbamazepina, oxcarbazepina y como segunda línea baclofeno, lamotrigina y misoprostol Síntomas paroxísticos. Los ataques paroxísticos pueden responder con dosis bajas de antiepilépticos como carbamazepina, ácido valproico después de varias semanas a meses, usualmente sin recurrencia.[97]
Espasticidad
Es uno de los factores que mas contribuye a la discapacidad en la EM, limitando la movilidad, generando dolor, condicionando posiciones articulares erróneas y, en fases mas avanzadas, dificultando la higiene.
En pacientes con debilidad en las extremidades, el desarrollo de espasticidad puede conllevar una mejoría funcional, por lo que su desaparición implicaría un empeoramiento de la discapacidad. En otras ocasiones la espasticidad, o su empeoramiento se debe a la existencia de otros factores (por ejemplo, infecciones), por lo que es importante identificar la causa y tratarla.[98]
La decisión de tratar la espasticidad requiere una evaluación cuidadosa e individualizada. En los casos leves la espasticidad puede aliviarse con fisioterapia y ejercicio.
Hay que considerar el tratamiento con fármacos orales cuando el tratamiento rehabilitador fracase o la espasticidad sea moderada. Si la monoterapia no es efectiva, se pueden combinar fármacos con distintos mecanismos de acción. Dentro de las terapias farmacológicas para el tratamiento de la espasticidad se encuentran el baclofeno, el dantroleno, la tizanidina, diacepam, gabapentina, toxina botulínica tipo A[99].
Ataxia y temblor
Hasta un 80% de los pacientes con EM referirían temblor o ataxia a lo largo de la evolución de la enfermedad. Las terapias rehabilitadoras pueden resultar útiles en el tratamiento de la ataxia.[100]
Dentro de los medicamentos utilizados para el temblor se encuentran la isoniacida. El propranolol no ha demostrado utilidad en pacientes con EM . Entre los fármacos antiepilépticos, la carbamazepina puede ser útil en el tratamiento del temblor de origen cerebeloso.[101]
Disfunción sexual
Requiere un manejo multidisciplinario, pues puede existir un componente psicogeno asociado. La disfunción erectil en varones con EM es frecuente. La utilidad de los inhibidores de la fosfodiesterasa-5, como el sildenafilo, vardenafilo o tadalafilo, se ha estudiado en pacientes con EM. Los dispositivos de vacío y las prótesis peneanas constituyen el último escalón del tratamiento.[102]
Entre las mujeres, los principales problemas son: anorgasmia, falta de lubricación vaginal y disminución de la libido. La falta de lubricación vaginal se resuelve con lubricantes. La anorgasmia en ocasiones puede mejorar con dosis bajas de estrógenos en crema de aplicación vaginal. El sildenafilo se ha probado en mujeres con EM y disfunción sexual sin éxito.[103]
Terapias alternativas y complementarias
En EM entre 30 y 80% de los pacientes utilizan terapias alternativas y complementarias [10] [9], que son terapias no convencionales pueden utilizarse como ayuda o en lugar de tratamientos establecidos de la enfermedad, principalmente como parte del manejo de síntomas específicos relacionados con la enfermedad [11] [13]. Es importante reiterar que ninguna de estas terapias ha demostrado tener un efecto en modificar la actividad y progresión de la enfermedad, aunque algunas de ellas han demostrado tener un impacto positivo en la calidad de vida de los pacientes , siendo algunas de ellas relacionadas con rehabilitación física y ejercicio, alimentación, técnicas de meditación-relajación o psicoterapia [104].
Terapia física:
Las terapias de rehabilitación física tienen un impacto positivo en la recuperación de secuelas y en mejorar la movilidad, disminuir el grado de espasticidad e incrementar la fuerza de extremidades. Específicamente se ha descrito mejoría en velocidad de marcha y estabilidad [105][106].
Otras terapias alternativas como yoga, pilates o tai chi han mostrado en algunos estudios de calidad de vida mejoría similar o mejor a actividad física regular en fuerza muscular, estabilidad postural, disminuyendo niveles de estrés, específicamente en yoga, que es practicado en aproximadamente 30% de los pacientes con EM[107][108]. Resultados similares se han visto en quienes realizan pilates y tai chi[109][110] al ser ejercicios que involucran estiramiento muscular y ejercitan músculos que mejoran la estabilidad postural, incluso en ciertos estudios comentando mejoría en fatiga[111][112].
Psicoterapia/Meditación/reflexlogía/biofeedback/mindfulness:
Así como la discapacidad física está presente en pacientes con esclerosis múltiple, la presencia de síntomas neuropsiquiátricos como trastornos depresivos, alteraciones cognoscitivas y de la conducta son síntomas bastante frecuentes en la enfermedad[10][9]. Si bien la terapia psicológica no interfiere con la actividad inflamatoria o la progresión de la discapacidad, si impacta positivamente en la calidad de vida de los pacientes con EM[113][114].
Terapias alternativas como biofeedback, mindfulness o meditación disminuyen niveles de estrés y mejora la capacidad de respuesta al mismo, encontrando en algunos estudios mejoría principalmente en la autopercepción de la discapacidad y calidad de vida[10][9].
Algunos estudios relacionan terapia con masajes y reflexología con disminución de niveles de estrés y reducción de secuelas sensitivas, como parestesias, en pacientes con EM[10][11].
Terapias herbales:
Canabis: Tanto la marihuana como sus derivados canabinoides han probado tener una efectividad como relajante muscular y como terapia para la espasticidad, ya sea por eventos traumáticos, vasculares, congénitos o como en este caso, en pacientes con esclerosis múltiple, así como el manejo de ciertos tipos de dolor neuropático crónico[115].
Sin embargo, no ha logrado relacionarse con modificación en la taza de recaídas o la aparición de lesiones nuevas en T2 en resonancia magnética o lesiones captantes de gadolinio[9]. También es bien conocido el efecto negativo en la cognición a largo plazo, por lo que no puede ser recomendado como como terapia complementaria en EM, salvo que sea para tratar específicamente espasticidad o manejo de dolor crónico, solo si no hay respuesta a tratamientos alternativos[116].
Ginkgo biloba: No se ha demostrado su eficacia en mejorar la cognición, concentración o atención en pacientes con esclerosis múltiple, sin embargo hay reportes que afirman su efectividad en el manejo de la fatiga, otro síntoma muy importante y discapacitante en estos pacientes[10].
Ozonoterapia y oxígeno hiperbárico:
Se ha utilizado la ozonoterapia para en múltiples enfermedades con el objetivo de mejorar la oxigenación tisular y disminuir el efecto nocivo de especies reactivas de oxigeno[117] siendo este último punto uno de los target terapéutico de la EM, incluso con una TME que actúa a este nivel[118]. Desgraciadamente no hay artículos confiables en los que se haya demostrado eficacia en reducir número de reacaídas, progresión discapacidad o presencia de lesiones nuevas en resonancia magnética (signos que indican actividad de la enfermedad) con este tipo de terapias en pacientes con EM[10]
Intervenciones en estilos de vida
Tabaco:
Es ampliamente conocida la relación negativa del consumo de tabaco con la actividad de la enfermedad. Múltiples estudios demuestran la asociación de mayor número de recaídas, aparición de nuevas lesiones y progresión de la discapacidad en pacientes fumadores versus su contraparte no fumadora[119], asociado principalmente al incremento de radicales libres generados[120].
Alcohol:
Al momento no hay una relación directa entre el consumo de alcohol y la progresión de la enfermedad, incluso un artículo sugiere disminución de riesgo.[121] Sin embargo esto no es suficiente para poder recomendar su uso. Por otra parte, al haber en el paciente con EM síntomas y secuelas que alteran la función de equilibrio y cognitiva.
Sobrepeso y obesidad:
Múltiples estudios han demostrado la el involucro que tiene el sobrepeso/obesidad en estados inflamatorios, dado principalmente por el incremento de estados proinflamatorios y reducción de estados antiinflamatorios[122][123] demostrado a nivel celular y por la expresión de citosinas correspondientes. Específicamente en esclerosis múltiple, el sobrepeso/obesidad se ha relacionado con incremento de la actividad inflamatoria de la enfermedad, tanto en población mundial, como específicamente en población mexicana[124]. Si bien como medida aislada, no puede considerarse el control de peso como tratamiento de la enfermedad, si se ha demostrado que estilos de vida saludables, que lleven a mantener un peso adecuado, puede estar relacionado con disminución de la actividad inflamatoria, con mejoría en el estado funcional de pacientes con EM.
Alimentación:
La única intervención nutricional que ha demostrado resultados en algunos estudios, que ha mostrado cambios en el estado inflamatorio de los pacientes con esclerosis múltiple, así como la cantidad de recaídas es la complementación con ácidos grasos omega 3 derivados de pescado[9]. Otros ácidos grasos, así como suplementación con vitaminas B, C, E, limitación calórica o dietas específicas no han mostrado diferencias significativas con respecto a placebo en enfermedad remitente-recurrente o en modalidades progresivas[13].
Si bien es conocida la relación de la deficiencia de vitamina D como probable factor ambiental para el desarrollo de EM, la suplementación con esta vitamina no ha mostrado resultados significativos en la disminución de la actividad de la enfermedad per se[10]. Sin embargo, la disminución de niveles de vitamina D se relaciona con osteopenia y aumento de fracturas en pacientes con y sin esclerosis múltiple[125][126], lo que empeora la funcionalidad, por lo que es recomendable complementación con vitamina D en todos los pacientes en los que se diagnostique EM[10][9].
Estrés:
Hay un número considerable de estudios que sugieren una relación directa entre el nivel de estrés emocional con el incremento de recaídas clínicas y presencia de lesiones captantes de gadolinio por resonancia magnética[127][128]. Al ser este el sustrato principal en la fisiopatogenia de la EM, es esperada esta respuesta en pacientes sometidos a estrés crónico o aumento transitorio de situaciones de estrés laboral, personal o social.
Calidad de sueño:
Se ha propuesto en varios estudios la disminución en la función cognitiva y calidad de vida en pacentes con EM[129][130] . Si bien es ampliamente conocido que una buena calidad de sueño mejora la calidad de vida percibida en la población general y disminuye riesgo de enfermedades cardiovasculares y estado anímico, no se han realizado estudios que relacionen este rubro con la actividad inflamatoria o estado de discapacidad en esclerosis múltiple.
Actividad física:
Los pacientes con esclerosis múltiple no están exentos de desarrollar otro tipo de patologías relacionadas con estilos de vida. Mantener una vida sedentaria, tanto en personas con EM como en población sana, es un importante factor de riesgo para el desarrollo de enfermedades cardiovasculares y sus complicaciones[106], por lo que debe fomentarse la importancia de mantener estilos de vida saludables que incluyan actividad física regular. Cuando además hay secuelas motoras o de coordinación, realizar ejercicio de manera habitual, así como la terapia específica de rehabilitación física, puede ayudar a mantener un adecuado tono muscular, peso saludable y articulaciones suficientemente laxas para mejorar la movilidad de los pacientes, así como disminuir globalmente niveles de estrés[108].
Pronóstico
Actualmente no hay pruebas clínicas establecidas que permitan un pronóstico o decidir una respuesta terapéutica, aunque existen investigaciones prometedoras que necesitan ser confirmadas, como la detección de los anticuerpos anti-MOG (anticuerpo sérico contra la MOG [myelin oligodendrocyte glycoprotein: ‘glicoproteína de la mielina de los oligodendrocitos’]) y anti-MBP (anticuerpo contra la MBP [myelin basic protein: ‘proteína básica de la mielina’]), como factores predictores de evolución a la enfermedad instaurada. La incertidumbre es uno de los aspectos psicológicos que resulta más difíciles de llevar en la esclerosis múltiple.
Debido a la mejora en el tratamiento de complicaciones como infecciones pulmonares o en la vejiga urinaria, la esperanza de vida de las personas diagnosticadas con esclerosis múltiple solo se ve ligeramente reducida.
Cuanto más joven se es cuando aparece la enfermedad, más lentamente avanza la discapacidad. Esto es debido a que en personas mayores es más frecuente la forma crónica progresiva, con una acumulación mayor de discapacidad.
La discapacidad tras cinco años se corresponde con la discapacidad a los 15 años: 2/3 de los pacientes con esclerosis múltiple que tengan poca discapacidad a los 5 años, no se deteriorarán mucho en los 10 años siguientes. Otros casos de esclerosis múltiple en la familia no influyen en la progresión de la enfermedad. Uno de cada tres pacientes seguirá siendo capaz de trabajar después de 15 a 20 años.
Pérdida de visión o síntomas sensoriales (entumecimiento u hormigueo) como síntomas iniciales son signos de un pronóstico benigno. Perturbaciones en el andar y cansancio son signos de un pronóstico negativo.
Una rápida regresión de los síntomas iniciales, edad a la que aparece la enfermedad por debajo de los 35, solo un síntoma inicialmente, desarrollo rápido de los síntomas iniciales y corta duración de la última recaída indican un buen pronóstico.
Si la forma es con recaídas y remisiones, estadísticamente serán necesarios 20 años hasta que la silla de ruedas sea necesaria. Esto quiere decir que muchos pacientes nunca la necesitarán. Si la forma es progresiva primaria, como media, se necesitará una silla de ruedas tras 6 o 7 años. Hay que tener en cuenta que estos datos a largo plazo fueron tomados antes de la llegada de los medicamentos inmunomoduladores modernos, a principios de los años 2000. Estos medicamentos consiguen retrasar el progreso de la enfermedad varios años.
Información general
Necesidades no cubiertas
Las personas que padecen Esclerosis Múltiple (EM) enfrentan diversas situaciones que afectan su calidad de vida. El vivir con EM puede causar deterioro en diversos ámbitos de la vida que pueden influir en la vida familiar, laboral y actividades de la vida diaria. La forma en que evoluciona la enfermedad puede causar incertidumbre y limitar el desarrollo de planes a futuro lo cual genera importante estrés psicológico. Las necesidades de los pacientes son muy variadas y dependerá de entre otros factores de la edad, sexo, gravedad de la enfermedad, tipo de empleo, redes de apoyo con los que cuenten los pacientes. Algunas de las principales necesidades identificadas tanto en pacientes como en familiares y cuidadores son: mayor conocimiento y entendimiento de la enfermedad, apoyo psicológico a pacientes, familiares y cuidadores sobre todo en pacientes cuya enfermedad ha causado algún grado de discapacidad, acceso a tratamientos multidisciplinarios, un diagnóstico y tratamientos oportunos que modifiquen el curso de la enfermedad y eviten discapacidad. Otros puntos que se han identificado son la necesidad de una mejor comunicación con todos los involucrados en el cuidado de los pacientes con EM (médicos, enfermeras, rehabilitadores, psicólogos, cuidadores). Acceso a grupos de apoyo a nivel local.[131] Es muy importante para los pacientes el poder sentir que tienen control de su vida , sentirse productivos y tener soporte emocional.[132]
Día mundial de la Esclerosis múltiple
Desde el 2009 la Federación Internacional de Esclerosis Múltiple (MSIF, por sus siglas en inglés), inició con la campaña de celebrar cada año el día mundial de la EM. Con esta campaña se ha llegado a miles de personas y cada año se centra en un tema diferente.[133] Se considera que es un día para celebrar la solidaridad mundial y la esperanza para el futuro. El Día Mundial de la EM está establecido el último miércoles del mes de mayo pero los eventos y campañas se celebran durante todo el mes de mayo. Reúne a la comunidad global de EM para compartir historias, sensibilizar y hacer campaña con y para todos los afectados por la esclerosis múltiple. [134]
Comités para el tratamiento e investigación en EM
Los comités para el tratamiento e investigación en EM a nivel mundial son asociaciones sin fines de lucro las cuales tienen como principal objetivo entender y tratar a la esclerosis múltiple. Estos comités contribuyen a nivel global trabajando con investigadores y clínicos en el desarrollo de investigación tanto básica como clínica, apoyan educación y enseñanza en la materia, estimulan a investigadores jóvenes a involucrarse en la EM, organizan congresos anuales, crean alianzas y colaboraciones a nivel internacional todo con el fin de tener un mejor entendimiento de la enfermedad.
Existen diversos comités a nivel mundial divididos por continentes y dentro de estos hay países que han formado sus propios comités. Uno de los más grandes y que fue creado hace más de 30 años es ECTRIMS (European Committe for treatment and research in Multiple Sclerosis) organiza anualmente el congreso anual que convoca al mayor número de personas interesadas en una sola enfermedad. [135] Otros comités a nivel continental son ACTRIMS (American Committe for treatment and research in Multiple Sclerosis) [136], LACTRIMS (Latin American Committe for treatment and research in Multiple Sclerosis) [137] PACTRIMS (Pan Asian Committe for treatment and research in Multiple Sclerosis) [138] MENACTRIMS (Middle East North Africa Committe for treatment and research in multiple sclerosis) [139], los cuales tiene como objeto el desarrollo de investigación y conocimiento de la enfermedad en las diferentes regiones. Existen también algunos países que han creado sus propios comités como MEXCTRIMS (Mexican Committe for treatment and research in Multiple Sclerosis) [140], BCTRIMS (Brazilian Committe for Treatment and research in Multiple Sclerosis) [141] . Estas asociaciones también se encargan de difundir y concientizar acerca del conocimiento de la enfermedad.
Existen también otras iniciativas a nivel global como MS Brain Health las cuales buscan alertar de la importancia de un diagnóstico y tratamiento oportunos, generando información para población general y para todas las personas involucradas en el cuidado de los pacientes con EM.[142]
En modelos murinos se ha logrado reducir la infiltración por linfocitos T CD4 de la vaina de mielina y las lesiones desmielinizantes características de la EM utilizando naltrexona en dosis bajas (LDN) [143]. Dicho tratamiento restablece los niveles circulantes de 5-metaencefalina que se encontraban reducidos en sujetos con EM [144] y tras 8 semanas de uso, se reducen citocinas proinflamatorias fuertemente implicadas en su fisiopatología [145]. Tres ensayos clínicos han encontrado que este tratamiento es seguro, no causa eventos adversos serios y su uso es bien tolerado[146] además de mejorar la calidad de vida [147] y reducir la espasticidad en sujetos con EM [148]. Todo ello ha justificado la realización de ensayos clínicos en diferentes patologías tales como: CHRON, fibromialgia, cáncer, etc. [149]
Véase también
- Epidemiología de la esclerosis múltiple en España
- Habla escandida
- Trastornos neurológicos relacionados con el gluten
- Ataxia
- Carles Vilariño-Güell
Referencias
- ↑ a b c d e f g Koriem, Khaled Mohamed Mohamed (mayo de 2017). «Corrigendum to ‘Multiple sclerosis: New insights and trends’» [Corrección de «Esclerosis múltiple: consideraciones y tendencias nuevas»]. En Hainan Medical University, ed. Asian Pacific Journal of Tropical Biomedicine (en inglés) (El Cairo, Egipto: Elsevier B.V.) 7 (5): 493-504. doi:10.1016/j.apjtb.2017.02.001. Consultado el 13 de enero de 2018.
- ↑ a b Didonna, Alessandro; Oksenberg, Jorge R. (noviembre de 2017). «Chapter 1. The Genetics of Multiple Sclerosis» [Capítulo 1. La genética de la esclerosis múltiple]. En Zagon, I. S.; McLaughlin, P. J., eds. Multiple Sclerosis: Perspectives in Treatment and Pathogenesis [Internet] [Esclerosis múltiple: perspectivas en el tratamiento y la patogenia [Internet]] (en inglés). Brisbane, Australia: Codon Publications. PMID 29261259. doi:10.15586/codon.multiplesclerosis.2017.ch1. Consultado el 13 de enero de 2018.
- ↑ a b Zahoor, Insha; Haq, Ehtishamul (noviembre de 2017). «Chapter 5. Vitamin D and Multiple Sclerosis: An Update» [Capítulo 5. Vitamina D y esclerosis múltiple: una actualización]. En Zagon, I. S.; McLaughlin, P. J., eds. Multiple Sclerosis: Perspectives in Treatment and Pathogenesis [Internet] [Esclerosis múltiple: perspectivas en el tratamiento y la patogenia [Internet]] (en inglés). Brisbane, Australia: Codon Publications. PMID 29261266. doi:10.15586/codon.multiplesclerosis.2017.ch5. Consultado el 13 de enero de 2018.
- ↑ García Merino, A.; Ara Callizo, J.R.; Fernández Fernández, O.; Landete Pascual, L.; Moral Torres, E.; Rodríguez-Antigüedad Zarrantz, A. (marzo de 2017). «Consenso para el tratamiento de la esclerosis múltiple 2016». En Sociedad Española de Neurología, ed. Neurología (English Edition) (Elsevier España, S.L.U.) 32 (2): 113-119. doi:10.1016/j.nrl.2016.02.026. Consultado el 13 de enero de 2018.
- ↑ a b c d Domínguez Morenoa, Rogelio; Morales Esponda, Mario; Rossiere Echazarreta, Natalia Lorena; Olan Triano, Román; Gutiérrez Morales, José Luis (septiembre a octubre de 2012). «Esclerosis múltiple: revisión de la literatura médica». Rev. Fac. Med. (Méx.) vol.55 no.5 Ciudad de México sep./oct. 2012 (Ciudad de México: Scielo) 55 (5): 26-35. ISSN 2448-4865. Consultado el 13 de enero de 2018.
- ↑ a b Choi, Bo Young; Jung, Jong Won; Suh, Sang Won (octubre de 2017). «The Emerging Role of Zinc in the Pathogenesis of Multiple Sclerosis» [El rol emergente del zinc en la patogenia de la esclerosis múltiple]. Int J Mol Sci (en inglés) (Multidisciplinary Digital Publishing Institute (MDPI)) 18 (10): 2070. PMID 28956834. doi:10.3390/ijms18102070. Consultado el 13 de enero de 2018.
- ↑ a b Dargahi, Narges; Katsara, Maria; Tselios, Theodore; Androutsou, Maria-Eleni; de Courten, Maximilian; Matsoukas, John; Apostolopoulos, Vasso (julio de 2017). «Multiple Sclerosis: Immunopathology and Treatment Update» [Esclerosis múltiple: Actualización de la inmunopatología y el tratamiento]. Brain Sci (en inglés) (Multidisciplinary Digital Publishing Institute (MDPI)) 7 (7): 78. PMID 28686222. doi:10.3390/brainsci7070078. Consultado el 13 de enero de 2018.
- ↑ Goldenberg, Marvin M. (marzo de 2012). «Multiple Sclerosis Review» [Revisión de esclerosis múltiple]. P T. 2012 (en inglés) (Estados Unidos: MediMedia, USA) 37 (3): 175-184. PMID 22605909. Consultado el 14 de enero de 2018.
- ↑ a b c d e f g h i j k l m n ñ o p Klineova S., Lublin F.D. Clinical Course of Multiple Sclerosis. Cold Spring Harb Perspect Med. 2018. DOI: 10.1101/cshperspect.a028928 Error en la cita: Etiqueta
<ref>no válida; el nombre «:1» está definido varias veces con contenidos diferentes - ↑ a b c d e f g h i j k l m n ñ o p Compston, Alastair; Coles, Alasdair (25 de octubre de 2008). «Multiple sclerosis». The Lancet (en english) 372 (9648). ISSN 0140-6736. doi:10.1016/S0140-6736(08)61620-7. Consultado el 10 de enero de 2018. Error en la cita: Etiqueta
<ref>no válida; el nombre «:0» está definido varias veces con contenidos diferentes - ↑ a b c d e f Thompson, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17: 162–73. DOI: 10.1016/S1474-4422(17)30470-2 Error en la cita: Etiqueta
<ref>no válida; el nombre «:2» está definido varias veces con contenidos diferentes - ↑ Yamout B., Alroughani R. Multiple Sclerosis. Semin Neurol 2018; 38:212–225. DOI: 10.1055/s-0038-1649502
- ↑ a b c d e Thompson Alan J, Baranzini Sergio E. Multiple sclerosis. The Lancet Neurology 2018; (18): 30481-1. DOI: 10.1016/ S0140-6736(18)30481-1 Error en la cita: Etiqueta
<ref>no válida; el nombre «:3» está definido varias veces con contenidos diferentes - ↑ Compston, A. (1 de octubre de 1988). «The 150th anniversary of the first depiction of the lesions of multiple sclerosis.». Journal of Neurology, Neurosurgery & Psychiatry (en inglés) 51 (10): 1249-1252. ISSN 0022-3050. PMID 3066846. doi:10.1136/jnnp.51.10.1249. Consultado el 10 de enero de 2018.
- ↑ Compston, Alastair; Coles, Alasdair. «Multiple sclerosis». The Lancet 372 (9648): 1502-1517. doi:10.1016/s0140-6736(08)61620-7. Consultado el 10 de enero de 2018.
- ↑ Lassmann, H. (29 de octubre de 1999). «The pathology of multiple sclerosis and its evolution». Philosophical Transactions of the Royal Society of London B: Biological Sciences (en inglés) 354 (1390): 1635-1640. ISSN 0962-8436. PMID 10603616. doi:10.1098/rstb.1999.0508. Consultado el 10 de enero de 2018.
- ↑ Lassmann, Hans (1 de julio de 2005). «Multiple Sclerosis Pathology: Evolution of Pathogenetic Concepts». Brain Pathology (en inglés) 15 (3): 217-222. ISSN 1750-3639. doi:10.1111/j.1750-3639.2005.tb00523.x. Consultado el 10 de enero de 2018.
- ↑ Clanet M (junio de 2008). «Jean-Martin Charcot. 1825 to 1893» (PDF). Int MS J 15 (2): 59-61. PMID 18782501.
* Charcot, J. (1868). «Histologie de la sclerose en plaques». Gazette des hopitaux, Paris 41: 554-5. - ↑ Bourneville, D. M.; y Guérard, L. (1869). De la sclérose en plaques disséminées: nouvelle étude sur quelques points de la sclérose en plaques disséminées par Bourneville. Adrien Delahaye.
- ↑ Rito Y, Torre-Villalvazo I, Flores J, Rivas V, Corona T. Epigenetic in Multiple Sclerosis: Molecular mechanisms and dietary intervention. Cent Nerv Syst Agents Med Chem. 2016 Feb 26. [Epub ahead of print] PubMed PMID 26915659.
- ↑ a b Giovannoni, G.; Cutter, G.R.; Lunemann, J.; Martin, R.; Munz, C.; Sriram, S.; Steiner, I.; Hammerschlag, M.R.; Gaydos, C.A., Infectious causes of multiple sclerosis. The Lancet. Neurology, 2006, 5, (10), 887-894.
- ↑ Lunemann, J.D.; Munz, C., Epstein-Barr virus and multiple sclerosis. Current neurology and neuroscience reports, 2007, 7, (3), 253-258.
- ↑ Sotelo, J.; Corona, T., Varicella zoster virus and relapsing remitting multiple sclerosis. Multiple sclerosis international, 2011, 2011, 214763.
- ↑ Taylor, B.V.; Lucas, R.M.; Dear, K.; Kilpatrick, T.J.; Pender, M.P.; van der Mei, I.A.; Chapman, C.; Coulthard, A.; Dwyer, T.; McMichael, A.J.; Valery, P.C.; Williams, D.; Ponsonby, A.L., Latitudinal variation in incidence and type of first central nervous system demyelinating events. Multiple sclerosis (Houndmills, Basingstoke, England), 2010, 16, (4), 398-405
- ↑ Munger, K.L.; Levin, L.I.; Hollis, B.W.; Howard, N.S.; Ascherio, A., Serum 25-hydroxyvitamin D levels and risk of multiple sclerosis. Jama, 2006, 296, (23), 2832-2838.
- ↑ Healy, B.C.; Ali, E.N.; Guttmann, C.R.; Chitnis, T.; Glanz, B.I.; Buckle, G.; Houtchens, M.; Stazzone, L.; Moodie, J.; Berger, A.M.; Duan, Y.; Bakshi, R.; Khoury, S.; Weiner, H.; Ascherio, A., Smoking and disease progression in multiple sclerosis. Archives of neurology, 2009, 66, (7), 858-864.
- ↑ Martinez-Zamudio, R.; Ha, H.C., Environmental epigenetics in metal exposure. Epigenetics : official journal of the DNA Methylation Society, 2011, 6, (7), 820-827.
- ↑ Barragan-Martinez, C.; Speck-Hernandez, C.A.; Montoya-Ortiz, G.; Mantilla, R.D.; Anaya, J.M.; Rojas-Villarraga, A., Organic solvents as risk factor for autoimmune diseases: a systematic review and meta-analysis. PloS one, 2012, 7, (12), e51506.
- ↑ Compston, A.; y Coles, A. (2008): «Multiple sclerosis», en revista The Lancet, 372 (9648): págs. 1502-1517, octubre de 2008. doi: 10.1016/S0140-6736(08)61620-7. PMID 18970977
- ↑ Flores-Alvarado LJ, Gabriel-Ortiz G, Pacheco-Mois FP, Bitzer-Quintero K (2015 Jun). «[Pathogenic mechanisms of neuronal damage in multiple sclerosis]». Invest Clin 56 (6): 201-14. PMID 26299060.
- ↑ a b von Geldern G, Mowry EM (2012 Dec). «The influence of nutritional factors on the prognosis of multiple sclerosis». Nat Rev Neurol 8 (12): 678-89. PMID 23026980. doi:10.1038/nrneurol.2012.194.
- ↑ Kugler N, Patel PJ, Lee CJ (2015 Mar). «Chronic Cerebrospinal Venous Insufficiency in Multiple Sclerosis: A Failed Concept». Vasc Specialist Int 31 (1): 11-4. PMC 4480289. PMID 26217638. doi:10.5758/vsi.2015.31.1.11.
- ↑ Baranzini, Sergio E. (2011-6). «Revealing the genetic basis of multiple sclerosis: Are we there yet?». Current opinion in genetics & development 21 (3): 317-324. ISSN 0959-437X. PMC 3105160. PMID 21247752. doi:10.1016/j.gde.2010.12.006. Consultado el 10 de enero de 2018.
- ↑ Reich, Daniel S.; Lucchinetti, Claudia F.; Calabresi, Peter A. (11 de enero de 2018). «Multiple Sclerosis». New England Journal of Medicine (en inglés) 378 (2): 169-180. ISSN 0028-4793. doi:10.1056/nejmra1401483. Consultado el 4 de agosto de 2018.
- ↑ «MEXCTRIMS: ¿Qué es el sistema inmune y por qué es importante en esclerosis múltiple?».
- ↑ «Microglia: scapegoat, saboteur, or something else?». Microglia: scapegoat, saboteur, or something else?. doi:https://doi.org/10.1126/science.1227901
|doi=incorrecto (ayuda). - ↑ «Glia Disease and Repair-Remyelination.». Glia Disease and Repair-Remyelination. doi:https://doi.org/10.1101/cshperspect.a020594
|doi=incorrecto (ayuda). - ↑ The Lesion Project, artículo en el sitio web de la National Multiple Sclerosis Society.
- ↑ a b Miguel Guerrero Fernández. «Revista nº 12 - Actualidad». Archivado desde el original el 2 de octubre de 2007. Consultado el 31 de mayo de 2017.
- ↑ «Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination.». Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Consultado el 4 de agosto de 2018.
- ↑ «Direct MRI detection of impending plaque development in multiple sclerosis.». Direct MRI detection of impending plaque development in multiple sclerosis. doi:10.1212/NXI.0000000000000145.
- ↑ «Neocortical neuronal, synaptic, and glial loss in multiple sclerosis.». Neocortical neuronal, synaptic, and glial loss in multiple sclerosis. doi:https://doi.org/10.1212/01.wnl.0000237551.26858.39
|doi=incorrecto (ayuda). - ↑ «Transected neurites, apoptotic neurons, and reduced inflammation in cortical multiple sclerosis lesions.».
- ↑ «Widespread demyelination in the cerebellar cortex in multiple sclerosis.». Widespread demyelination in the cerebellar cortex in multiple sclerosis. doi:https://doi.org/10.1111/j.1750-3639.2006.00041.x
|doi=incorrecto (ayuda). - ↑ «A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis.». A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. doi:https://doi.org/10.1038/nm.2324
|doi=incorrecto (ayuda). - ↑ «Remyelination is extensive in a subset of multiple sclerosis patients.». Remyelination is extensive in a subset of multiple sclerosis patients. doi:https://doi.org/10.1093/brain/awl217
|doi=incorrecto (ayuda). - ↑ «Pathological mechanisms in progressive multiple sclerosis.». Pathological mechanisms in progressive multiple sclerosis. doi:https://doi.org/10.1016/S1474-4422(14)70256-X
|doi=incorrecto (ayuda). - ↑ «Demyelination versus remyelination in progressive multiple sclerosis.». Demyelination versus remyelination in progressive multiple sclerosis. doi:https://doi.org/10.1093/brain/awq250
|doi=incorrecto (ayuda). - ↑ «Modelling large areas of demyelination in the rat reveals the potential and possible limitations of transplanted glial cells for remyelination in the CNS.». Modelling large areas of demyelination in the rat reveals the potential and possible limitations of transplanted glial cells for remyelination in the CNS.
- ↑ «Differentiation block of oligodendroglial progenitor cells as a cause for remyelination failure in chronic multiple sclerosis.». Differentiation block of oligodendroglial progenitor cells as a cause for remyelination failure in chronic multiple sclerosis. doi:https://doi.org/10.1093/brain/awn096
|doi=incorrecto (ayuda). - ↑ «Axonal signals in central nervous system myelination, demyelination and remyelination.». Axonal signals in central nervous system myelination, demyelination and remyelination. doi:https://doi.org/10.1016/j.jns.2005.03.029
|doi=incorrecto (ayuda). - ↑ Thompson, A. J. et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol. 2017; 17:162–173.
- ↑ WI McDonald. (2001). Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. In: Annals of neurology. Band 50, Nummer 1, Juli 2001, S. 121–127, PMID 11456302.
- ↑ Polman CH, Reingold SC, Banwell B, et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald Criteria. Ann Neurol 2011; 69: 292–302.
- ↑ Filippi M, Rocca MA, Ciccarelli O, et al. MRI criteria for the diagnosis of multiple sclerosis: MAGNIMS consensus guidelines. Lancet Neurol 2016; 15: 292–303.
- ↑ R Dobson, S Ramagopalan, A Davis, G Giovannoni (2013).Cerebrospinal fluid oligoclonal bands in multiple sclerosis and clinically isolated syndromes: a meta-analysis of prevalence, prognosis and effect of latitude. J Neurol Neurosurg Psychiatry. 2013 Aug;84(8):909-14. doi: 10.1136/jnnp-2012-304695.
- ↑ E Thouvenot.(2018).Multiple sclerosis biomarkers: Helping the diagnosis?. Rev Neurol (Paris). 2018 Jun;174(6):364-371.doi: 10.1016/j.neurol.2018.04.002.
- ↑ YD Fragoso, FG Elso and A Carra. (2017). Differential diagnosis of multiple sclerosis in Latin America. Multiple Sclerosis Journal Experimental, Translationaland Clinical. July-September 2017: 17. DOI: 10.1177/2055217317714279.
- ↑ Montalban X, Sastre-Garriga J, Filippi M, et al. Primary progressive multiple sclerosis diagnostic criteria: a reappraisal. Mult Scler2009;15:1459–1465.
- ↑ ECTRIMS/EAN Guideline on the pharmacological treatment of people with multiple sclerosis (6). pp. 449-457. ISSN 0035-3787. doi:[http://dx.doi.org/1i.o0rg.1%2F110.71177%2F7%2F1352458517751049%0A1ht3tp5s%3A%2F2%2Fd4oi5.o8rg5%2F10.71177571%2F103542945 1i.o0rg.1/110.71177/7/1352458517751049
1ht3tp5s:/2/d4oi5.o8rg5/10.71177571/103542945]
|doi=incorrecto (ayuda). - ↑ a b Pardo, Gabriel; Jones, David E. (septiembre de 2017). «The sequence of disease-modifying therapies in relapsing multiple sclerosis: safety and immunologic considerations» [La secuencia de terapias modificadores de la enfermedad en la esclerosis múltiple recidivante: seguridad y consideraciones inmunológicas]. J Neurol (en inglés) 264 (12): 2351-2374. PMID 28879412. doi:10.1007/s00415-017-8594-9. Consultado el 14 de enero de 2018.
- ↑ Le Page, E.; Edan, G. (2018-06). «Induction or escalation therapy for patients with multiple sclerosis?». Revue Neurologique 174 (6): 449-457. ISSN 0035-3787. doi:10.1016/j.neurol.2018.04.004. Consultado el 4 de agosto de 2018.
- ↑ McKeage, Kate (24 de abril de 2015). «Glatiramer Acetate 40 mg/mL in Relapsing–Remitting Multiple Sclerosis: A Review». CNS Drugs (en inglés) 29 (5): 425-432. ISSN 1172-7047. doi:10.1007/s40263-015-0245-z. Consultado el 4 de agosto de 2018.
- ↑ Cohen, Jeffrey; Belova, Anna; Selmaj, Krzysztof; Wolf, Christian; Sormani, Maria Pia; Oberyé, Janine; Tweel, Evelyn van den; Mulder, Roel et al. (1 de diciembre de 2015). «Equivalence of Generic Glatiramer Acetate in Multiple Sclerosis: A Randomized Clinical Trial». JAMA Neurology (en inglés) 72 (12): 1433-1441. ISSN 2168-6149. doi:10.1001/jamaneurol.2015.2154. Consultado el 4 de agosto de 2018.
- ↑ El-Chammas K, Danner E (Jun 2011). «Gluten-free diet in nonceliac disease». Nutr Clin Pract (Revisión) 26 (3): 294-9. PMID 21586414. doi:10.1177/0884533611405538. «Historically, a GFD was occasionally used in the management of multiple sclerosis (MS), because anecdotal reports indicated a positive effect (reversal of symptoms) of a GFD in MS patients. (GFD=gluten-free diet) TRADUCCIÓN: Históricamente, la DSG se ha utilizado ocasionalmente en el tratamiento de la esclerosis múltiple (EM), porque casos documentados indican un efecto positivo (reversión de los síntomas) de una DSG en pacientes con EM. DSG=dieta sin gluten».
- ↑ Hernández-Lahoz C, Rodrigo L (2013 Apr 15). «Gluten-related disorders and demyelinating diseases». Med Clin (Barc) (Revisión) 140 (7): 314-9. PMID 22998972. doi:10.1016/j.medcli.2012.07.009.
- ↑ O'Connor, Paul; Comi, Giancarlo; Freedman, Mark S.; Miller, Aaron E.; Kappos, Ludwig; Bouchard, Jean-Pierre; Lebrun-Frenay, Christine; Mares, Jan et al. (8 de marzo de 2016). «Long-term safety and efficacy of teriflunomide: Nine-year follow-up of the randomized TEMSO study». Neurology (en inglés) 86 (10): 920-930. ISSN 0028-3878. PMC 4782117. PMID 26865517. doi:10.1212/WNL.0000000000002441. Consultado el 4 de agosto de 2018.
- ↑ Miller, Aaron E. (2017-12). «Oral teriflunomide in the treatment of relapsing forms of multiple sclerosis: clinical evidence and long-term experience». Therapeutic Advances in Neurological Disorders 10 (12): 381-396. ISSN 1756-2856. PMC 5703103. PMID 29204190. doi:10.1177/1756285617722500. Consultado el 4 de agosto de 2018.
- ↑ Miller, Aaron E; Wolinsky, Jerry S; Kappos, Ludwig; Comi, Giancarlo; Freedman, Mark S; Olsson, Tomas P; Bauer, Deborah; Benamor, Myriam et al. (2014-10). «Oral teriflunomide for patients with a first clinical episode suggestive of multiple sclerosis (TOPIC): a randomised, double-blind, placebo-controlled, phase 3 trial». The Lancet Neurology 13 (10): 977-986. ISSN 1474-4422. doi:10.1016/s1474-4422(14)70191-7. Consultado el 4 de agosto de 2018.
- ↑ Xu, Zhu; Zhang, Feng; Sun, FangLi; Gu, KeFeng; Dong, Shuai; He, Dian (22 de abril de 2015). The Cochrane Library (en inglés). John Wiley & Sons, Ltd. doi:10.1002/14651858.cd011076.pub2. Consultado el 4 de agosto de 2018.
- ↑ Burness, Celeste B.; Deeks, Emma D. (13 de marzo de 2014). «Dimethyl Fumarate: A Review of Its Use in Patients with Relapsing-Remitting Multiple Sclerosis». CNS Drugs (en inglés) 28 (4): 373-387. ISSN 1172-7047. doi:10.1007/s40263-014-0155-5. Consultado el 4 de agosto de 2018.
- ↑ Cree, Bruce A. C.; Stuart, William H.; Tornatore, Carlo S.; Jeffery, Douglas R.; Pace, Amy L.; Cha, Choon H. (2011-4). «Efficacy of natalizumab therapy in patients of African descent with relapsing multiple sclerosis: analysis of AFFIRM and SENTINEL data». Archives of Neurology 68 (4): 464-468. ISSN 1538-3687. PMID 21482925. doi:10.1001/archneurol.2011.45. Consultado el 4 de agosto de 2018.
- ↑ Radue, Ernst-Wilhelm; Stuart, William H.; Calabresi, Peter A.; Confavreux, Christian; Galetta, Steven L.; Rudick, Richard A.; Lublin, Fred D.; Weinstock-Guttman, Bianca et al. (15 de mayo de 2010). «Natalizumab plus interferon beta-1a reduces lesion formation in relapsing multiple sclerosis». Journal of the Neurological Sciences 292 (1-2): 28-35. ISSN 1878-5883. PMID 20236661. doi:10.1016/j.jns.2010.02.012. Consultado el 4 de agosto de 2018.
- ↑ Horga, A.; Horga de la Parte, J. F. (2007 Sep 1-15). «[Natalizumab in the treatment of multiple sclerosis]». Revista De Neurologia 45 (5): 293-303. ISSN 0210-0010. PMID 17876741. Consultado el 4 de agosto de 2018.
- ↑ «Alemtuzumab CARE-MS I 5-year follow-up: Durable efficacy in the absence of continuous MS therapy». Neurology 90 (16): 755. 17 de abril de 2018. ISSN 1526-632X. PMID 29661899. doi:10.1212/WNL.0000000000004908. Consultado el 4 de agosto de 2018.
- ↑ Caon, Christina; Namey, Marie; Meyer, Cathy; Mayer, Lori; Oyuela, Pedro; Margolin, David H.; Rizzo, Marco (2015-07). «Prevention and Management of Infusion-Associated Reactions in the Comparison of Alemtuzumab and Rebif®Efficacy in Multiple Sclerosis (CARE-MS) Program». International Journal of MS Care (en inglés estadounidense) 17 (4): 191-198. ISSN 1537-2073. PMC 4542714. PMID 26300705. doi:10.7224/1537-2073.2014-030. Consultado el 4 de agosto de 2018.
- ↑ Coles, Alasdair J.; Cohen, Jeffrey A.; Fox, Edward J.; Giovannoni, Gavin; Hartung, Hans-Peter; Havrdova, Eva; Schippling, Sven; Selmaj, Krzysztof W. et al. (12 de septiembre de 2017). «Alemtuzumab CARE-MS II 5-year follow-up: Efficacy and safety findings». Neurology 89 (11): 1117-1126. ISSN 1526-632X. PMC 5595276. PMID 28835403. doi:10.1212/WNL.0000000000004354. Consultado el 4 de agosto de 2018.
- ↑ Brusaferri, Fabio; Candelise, Livia (21 de junio de 2000). «Steriods for multiple sclerosis and optic neuritis: a meta-analysis of randomized controlled clinical trials». Journal of Neurology 247 (6): 435-442. ISSN 0340-5354. doi:10.1007/s004150070172. Consultado el 5 de agosto de 2018.
- ↑ Thompson, A. J.; Kennard, C.; Swash, M.; Summers, B.; Yuill, G. M.; Shepherd, D. I.; Roche, S.; Perkin, G. D. et al. (1 de julio de 1989). «Relative efficacy of intravenous methylprednisolone and ACTH in the treatment of acute relapse in MS». Neurology 39 (7): 969-969. ISSN 0028-3878. doi:10.1212/wnl.39.7.969. Consultado el 5 de agosto de 2018.
- ↑ Bashir, Khurram. Demyelinating Disorders of the Central Nervous System in Childhood. Cambridge University Press. pp. 87-91. ISBN 9780511974373. Consultado el 5 de agosto de 2018.
- ↑ Chow, Y. W.; Pietranico, R.; Mukerji, A. (27 de octubre de 1975). «Relation between objective and subjective measures of bladder dysfunction in multiple sclerosis.». Biochemical and Biophysical Research Communications 66 (4): 1424-1431. ISSN 0006-291X. PMID 6.
- ↑ 3. Fowler CJ, Panicker JN, Drake M, et al. A UK consensus on the management of the bladder in multiple sclerosis. J Neurol Neurosurg Psychiatry 2009; 80:470.
- ↑ Chow, Y. W.; Pietranico, R.; Mukerji, A. (27 de octubre de 1975). [3. Fowler CJ, Panicker JN, Drake M, et al. A UK consensus on the management of the bladder in multiple sclerosis. J Neurol Neurosurg Psychiatry 2009; 80:470. «Studies of oxygen binding energy to hemoglobin molecule»]. Biochemical and Biophysical Research Communications 66 (4): 1424-1431. ISSN 0006-291X. PMID 6. Consultado el 4 de agosto de 2018.
- ↑ Marniemi, J.; Parkki, M. G. (1 de septiembre de 1975). «Radiochemical assay of glutathione S-epoxide transferase and its enhancement by phenobarbital in rat liver in vivo». Biochemical Pharmacology 24 (17): 1569-1572. ISSN 0006-2952. PMID 9. Consultado el 4 de agosto de 2018.
- ↑ Fowler, C. J.; Panicker, J. N.; Drake, M.; Harris, C.; Harrison, S. C. W.; Kirby, M.; Lucas, M.; Macleod, N. et al. (1 de octubre de 2009). «A UK consensus on the management of the bladder in multiple sclerosis». Postgraduate Medical Journal (en inglés) 85 (1008): 552-559. ISSN 0032-5473. PMID 19789195. doi:10.1136/jnnp.2008.159178. Consultado el 4 de agosto de 2018.
- ↑ Phé, Véronique; Pakzad, Mahreen; Curtis, Carmel; Porter, Bernadette; Haslam, Collette; Chataway, Jeremy; Panicker, Jalesh N (18 de febrero de 2016). «Urinary tract infections in multiple sclerosis». Multiple Sclerosis Journal (en inglés) 22 (7): 855-861. ISSN 1352-4585. doi:10.1177/1352458516633903. Consultado el 4 de agosto de 2018.
- ↑ Wiesel, P. H (1 de agosto de 2000). [Prevalence of bowel dysfunction in multiple sclerosis. A population survey «Gut focused behavioural treatment (biofeedback) for constipation and faecal incontinence in multiple sclerosis»]
|url=incorrecta (ayuda). Journal of Neurology, Neurosurgery & Psychiatry 69 (2): 240-243. ISSN 0022-3050. doi:10.1136/jnnp.69.2.240. Consultado el 4 de agosto de 2018. - ↑ Wiesel, P. H (1 de agosto de 2000). «Gut focused behavioural treatment (biofeedback) for constipation and faecal incontinence in multiple sclerosis». Journal of Neurology, Neurosurgery & Psychiatry 69 (2): 240-243. ISSN 0022-3050. doi:10.1136/jnnp.69.2.240. Consultado el 4 de agosto de 2018.
- ↑ Bellman, Susan (2017-09). «Pharmacological treatment for memory disorder in multiple sclerosis». International Journal of Evidence-Based Healthcare: 1. ISSN 1744-1595. doi:10.1097/xeb.0000000000000123. Consultado el 4 de agosto de 2018.
- ↑ Patti, Francesco (9 de agosto de 2012). «Treatment of cognitive impairment in patients with multiple sclerosis». Expert Opinion on Investigational Drugs 21 (11): 1679-1699. ISSN 1354-3784. doi:10.1517/13543784.2012.716036. Consultado el 4 de agosto de 2018.
- ↑ Krupp, L. B.; Christodoulou, C.; Melville, P.; Scherl, W. F.; MacAllister, W. S.; Elkins, L. E. (8 de noviembre de 2004). «Donepezil improved memory in multiple sclerosis in a randomized clinical trial». Neurology 63 (9): 1579-1585. ISSN 0028-3878. doi:10.1212/01.wnl.0000142989.09633.5a. Consultado el 4 de agosto de 2018.
- ↑ Rosti-Otajärvi, Eija M; Hämäläinen, Päivi I (11 de febrero de 2014). «Neuropsychological rehabilitation for multiple sclerosis». Cochrane Database of Systematic Reviews. ISSN 1465-1858. doi:10.1002/14651858.cd009131.pub3. Consultado el 4 de agosto de 2018.
- ↑ Patten, S B; Metz, L M (2001-08). «Interferon β-1a and depression in relapsing - remitting multiple sclerosis: an analysis of depression data from the PRISMS clinical trial». Multiple Sclerosis Journal 7 (4): 243-248. ISSN 1352-4585. doi:10.1177/135245850100700406. Consultado el 4 de agosto de 2018.
- ↑ Cooper, Cindy (6 de diciembre de 2012). «Cognitive behavioural therapy software for the treatment of depression in people with multiple sclerosis». http://isrctn.org/>. Consultado el 4 de agosto de 2018.
- ↑ Murray, T.J. (1985-08). «Amantadine Therapy for Fatigue in Multiple Sclerosis». Canadian Journal of Neurological Sciences / Journal Canadien des Sciences Neurologiques 12 (03): 251-254. ISSN 0317-1671. doi:10.1017/s0317167100047107. Consultado el 4 de agosto de 2018.
- ↑ Minagar, A. (2011-01). «A Phase 3 Trial of Extended Release Oral Dalfampridine in Multiple Sclerosis». Yearbook of Neurology and Neurosurgery 2011: 106-107. ISSN 0513-5117. doi:10.1016/j.yneu.2011.03.003. Consultado el 4 de agosto de 2018.
- ↑ Sakurai, Masaki; Kanazawa, Ichiro (1999-01). «Positive symptoms in multiple sclerosis: their treatment with sodium channel blockers, lidocaine and mexiletine». Journal of the Neurological Sciences 162 (2): 162-168. ISSN 0022-510X. doi:10.1016/s0022-510x(98)00322-0. Consultado el 4 de agosto de 2018.
- ↑ Chou, Roger; Peterson, Kim; Helfand, Mark (2004-08). «Comparative efficacy and safety of skeletal muscle relaxants for spasticity and musculoskeletal conditions: a systematic review». Journal of Pain and Symptom Management 28 (2): 140-175. ISSN 0885-3924. doi:10.1016/j.jpainsymman.2004.05.002. Consultado el 4 de agosto de 2018.
- ↑ Feldman, R. G.; Kelly-Hayes, M.; Conomy, J. P.; Foley, J. M. (1 de noviembre de 1978). «Baclofen for spasticity in multiple sclerosis Double-blind crossover and three-year study». Neurology 28 (11): 1094-1094. ISSN 0028-3878. doi:10.1212/wnl.28.11.1094. Consultado el 4 de agosto de 2018.
- ↑ Armutlu, Kadriye; Karabudak, Rana; Nurlu, Gülay (2001-09). «Physiotherapy Approaches in the Treatment of Ataxic Multiple Sclerosis: A Pilot Study». Neurorehabilitation and Neural Repair 15 (3): 203-211. ISSN 1545-9683. doi:10.1177/154596830101500308. Consultado el 4 de agosto de 2018.
- ↑ Sechi, G. P.; Zuddas, M.; Piredda, M.; Agnetti, V.; Sau, G.; Piras, M. L.; Tanca, S.; Rosati, G. (1 de agosto de 1989). «Treatment of cerebellar tremors with carbamazepine: A controlled trial with long-term follow-up». Neurology 39 (8): 1113-1113. ISSN 0028-3878. doi:10.1212/wnl.39.8.1113. Consultado el 4 de agosto de 2018.
- ↑ Zorzon, M.; Zivadinov, R.; Bosco, A.; Monti Bragadin, L.; Moretti, R.; Bonfigli, L.; Morassi, P.; Iona, L.G. et al. (1 de junio de 1999). «Sexual dysfunction in multiple sclerosis: a case-control study. I. Frequency and comparison of groups». Multiple Sclerosis 5 (6): 418-427. ISSN 1477-0970. doi:10.1191/135245899678846456. Consultado el 4 de agosto de 2018.
- ↑ DasGUPTA, RANAN; WISEMAN, OLIVER J.; KANABAR, GORANDE; FOWLER, CLARE J. (2004-03). «Efficacy of Sildenafil in the Treatment of Female Sexual Dysfunction Due to Multiple Sclerosis». The Journal of Urology 171 (3): 1189-1193. ISSN 0022-5347. doi:10.1097/01.ju.0000113145.43174.24. Consultado el 4 de agosto de 2018.
- ↑ Claflin, Suzi B; van der Mei, Ingrid A F; Taylor, Bruce V (de enero de 2018). «Complementary and alternative treatments of multiple sclerosis: a review of the evidence from 2001 to 2016». Journal of Neurology, Neurosurgery & Psychiatry 89 (1): 34-41. doi:10.1136/jnnp-2016-314490.
- ↑ Motl, Robert W; Sandroff, Brian M; Kwakkel, Gert; Dalgas, Ulrik; Feinstein, Anthony; Heesen, Christoph; Feys, Peter; Thompson, Alan J (2017-10). «Exercise in patients with multiple sclerosis». The Lancet Neurology 16 (10): 848-856. ISSN 1474-4422. doi:10.1016/s1474-4422(17)30281-8. Consultado el 11 de septiembre de 2018.
- ↑ a b Sá, Maria José (22 de noviembre de 2013). «Exercise therapy and multiple sclerosis: a systematic review». Journal of Neurology (en inglés) 261 (9): 1651-1661. ISSN 0340-5354. doi:10.1007/s00415-013-7183-9. Consultado el 19 de septiembre de 2018.
- ↑ Claflin, Suzi B.; Mei, Ingrid A. F. van der; Taylor, Bruce V. (1 de enero de 2018). «Complementary and alternative treatments of multiple sclerosis: a review of the evidence from 2001 to 2016». J Neurol Neurosurg Psychiatry (en inglés) 89 (1): 34-41. ISSN 0022-3050. PMID 28768821. doi:10.1136/jnnp-2016-314490. Consultado el 19 de septiembre de 2018.
- ↑ a b Yadav, V.; Bever, C.; Bowen, J.; Bowling, A.; Weinstock-Guttman, B.; Cameron, M.; Bourdette, D.; Gronseth, G. S. et al. (24 de marzo de 2014). «Summary of evidence-based guideline: Complementary and alternative medicine in multiple sclerosis: Report of the Guideline Development Subcommittee of the American Academy of Neurology». Neurology (en inglés) 82 (12): 1083-1092. ISSN 0028-3878. PMC 3962995. PMID 24663230. doi:10.1212/wnl.0000000000000250. Consultado el 19 de septiembre de 2018.
- ↑ Zou, Liye; Wang, Huiru; Xiao, ZhongJun; Fang, Qun; Zhang, Mark; Li, Ting; Du, Geng; Liu, Yang (9 de febrero de 2017). «Tai chi for health benefits in patients with multiple sclerosis: A systematic review». PLOS ONE (en inglés) 12 (2): e0170212. ISSN 1932-6203. PMC 5300172. PMID 28182629. doi:10.1371/journal.pone.0170212. Consultado el 19 de septiembre de 2018.
- ↑ Duff, Whitney R.D.; Andrushko, Justin W.; Renshaw, Doug W.; Chilibeck, Philip D.; Farthing, Jonathan P.; Danielson, Jana; Evans, Charity D. (2018-03). «Impact of Pilates Exercise in Multiple Sclerosis». International Journal of MS Care (en inglés estadounidense) 20 (2): 92-100. ISSN 1537-2073. PMC 5898921. PMID 29670495. doi:10.7224/1537-2073.2017-066. Consultado el 19 de septiembre de 2018.
- ↑ Soysal Tomruk, Melda; Uz, Muhammed Zahid; Kara, Bilge; İdiman, Egemen (2016-05). «Effects of Pilates exercises on sensory interaction, postural control and fatigue in patients with multiple sclerosis». Multiple Sclerosis and Related Disorders 7: 70-73. ISSN 2211-0348. doi:10.1016/j.msard.2016.03.008. Consultado el 19 de septiembre de 2018.
- ↑ Bulguroglu, I.; Guclu-Gunduz, A.; Yazici, G.; Ozkul, C.; Irkec, C.; Nazliel, B.; Batur-Caglayan, H.Z. (14 de octubre de 2017). «The effects of Mat Pilates and Reformer Pilates in patients with Multiple Sclerosis: A randomized controlled study». NeuroRehabilitation (en inglés) 41 (2): 413-422. ISSN 1053-8135. doi:10.3233/nre-162121. Consultado el 19 de septiembre de 2018.
- ↑ Alghwiri, Alia A.; Khalil, Hanan; Al-Sharman, Alham; El-Salem, Khalid (2018-08). «Depression is a predictor for balance in people with multiple sclerosis». Multiple Sclerosis and Related Disorders 24: 28-31. ISSN 2211-0348. doi:10.1016/j.msard.2018.05.013. Consultado el 19 de septiembre de 2018.
- ↑ Pagnini, Francesco; Bosma, Colin M; Phillips, Deborah; Langer, Ellen (30 de noviembre de 2014). «Symptom changes in multiple sclerosis following psychological interventions: a systematic review». BMC Neurology (en inglés) 14 (1). ISSN 1471-2377. PMC 4253984. PMID 25433519. doi:10.1186/s12883-014-0222-z. Consultado el 19 de septiembre de 2018.
- ↑ Rudroff, Thorsten; Sosnoff, Jacob (2018). «Cannabidiol to Improve Mobility in People with Multiple Sclerosis». Frontiers in Neurology (en english) 9. ISSN 1664-2295. PMC 5874292. PMID 29623067. doi:10.3389/fneur.2018.00183. Consultado el 19 de septiembre de 2018.
- ↑ Nielsen, Suzanne; Germanos, Rada; Weier, Megan; Pollard, John; Degenhardt, Louisa; Hall, Wayne; Buckley, Nicholas; Farrell, Michael (2018-02). «The Use of Cannabis and Cannabinoids in Treating Symptoms of Multiple Sclerosis: a Systematic Review of Reviews». Current Neurology and Neuroscience Reports (en inglés) 18 (2). ISSN 1528-4042. doi:10.1007/s11910-018-0814-x. Consultado el 19 de septiembre de 2018.
- ↑ Gabriel, Ortiz, Genaro; Ángel, Macías-Islas, Miguel; P., Pacheco-Moisés, Fermín; A., Cruz-Ramos, José; Silvia, Sustersik,; Alejandro, Barba, Elías; Adriana, Aguayo,. «Oxidative Stress is Increased in Serum from Mexican Patients with Relapsing-Remitting Multiple Sclerosis». Disease Markers (en inglés) 26 (1). ISSN 0278-0240. PMC 3833233. PMID 19242067. doi:10.3233/dma-2009-0602. Consultado el 19 de septiembre de 2018.
- ↑ Gold, Ralf; Giovannoni, Gavin; Phillips, J Theodore; Fox, Robert J; Zhang, Annie; Meltzer, Leslie; Kurukulasuriya, Nuwan C (2 de julio de 2014). «Efficacy and safety of delayed-release dimethyl fumarate in patients newly diagnosed with relapsing–remitting multiple sclerosis (RRMS)». Multiple Sclerosis Journal (en inglés) 21 (1): 57-66. ISSN 1352-4585. PMC 4361464. PMID 24990854. doi:10.1177/1352458514537013. Consultado el 19 de septiembre de 2018.
- ↑ Manouchehrinia, Ali; Tench, Christopher R.; Maxted, Jonathan; Bibani, Rashid H.; Britton, John; Constantinescu, Cris S. (11 de junio de 2013). «Tobacco smoking and disability progression in multiple sclerosis: United Kingdom cohort study». Brain (en inglés) 136 (7): 2298-2304. ISSN 1460-2156. PMC 3692034. PMID 23757766. doi:10.1093/brain/awt139. Consultado el 19 de septiembre de 2018.
- ↑ Hedström, Anna Karin; Katsoulis, Michail; Hössjer, Ola; Bomfim, Izaura L.; Oturai, Annette; Sondergaard, Helle Bach; Sellebjerg, Finn; Ullum, Henrik et al. (8 de junio de 2017). «The interaction between smoking and HLA genes in multiple sclerosis: replication and refinement». European Journal of Epidemiology (en inglés) 32 (10): 909-919. ISSN 0393-2990. PMC 5680370. PMID 28597127. doi:10.1007/s10654-017-0250-2. Consultado el 19 de septiembre de 2018.
- ↑ Andersen, Christina; Søndergaard, Helle Bach; Bang Oturai, Ditte; Laursen, Julie Hejgaard; Gustavsen, Stefan; Larsen, Nanna Katrine; Magyari, Melinda; Just-Østergaard, Emilie et al. (20 de agosto de 2018). «Alcohol consumption in adolescence is associated with a lower risk of multiple sclerosis in a Danish cohort». Multiple Sclerosis Journal (en inglés): 135245851879541. ISSN 1352-4585. doi:10.1177/1352458518795418. Consultado el 19 de septiembre de 2018.
- ↑ Guerrero-García, José de Jesús; Carrera-Quintanar, Lucrecia; López-Roa, Rocío Ivette; Márquez-Aguirre, Ana Laura; Rojas-Mayorquín, Argelia Esperanza; Ortuño-Sahagún, Daniel (2016). «Multiple Sclerosis and Obesity: Possible Roles of Adipokines». Mediators of Inflammation (en inglés) 2016: 1-24. ISSN 0962-9351. PMC 5046034. PMID 27721574. doi:10.1155/2016/4036232. Consultado el 19 de septiembre de 2018.
- ↑ Munger, Kassandra L; Bentzen, Joan; Laursen, Bjarne; Stenager, Egon; Koch-Henriksen, Nils; Sørensen, Thorkild IA; Baker, Jennifer L (2 de abril de 2013). «Childhood body mass index and multiple sclerosis risk: a long-term cohort study». Multiple Sclerosis Journal (en inglés) 19 (10): 1323-1329. ISSN 1352-4585. PMC 4418015. PMID 23549432. doi:10.1177/1352458513483889. Consultado el 19 de septiembre de 2018.
- ↑ Correale, Jorge; Farez, Mauricio F; Gaitán, María Inés (2017-06). «Environmental factors influencing multiple sclerosis in Latin America». Multiple Sclerosis Journal – Experimental, Translational and Clinical (en inglés) 3 (2): 205521731771504. ISSN 2055-2173. PMC 5472234. PMID 28638627. doi:10.1177/2055217317715049. Consultado el 19 de septiembre de 2018.
- ↑ Pierrot-Deseilligny, Charles (28 de abril de 2009). «Clinical implications of a possible role of vitamin D in multiple sclerosis». Journal of Neurology (en inglés) 256 (9): 1468-1479. ISSN 0340-5354. PMC 2733195. PMID 19399382. doi:10.1007/s00415-009-5139-x. Consultado el 19 de septiembre de 2018.
- ↑ Hossein-nezhad, Arash; Holick, Michael F. (2013-07). «Vitamin D for Health: A Global Perspective». Mayo Clinic Proceedings 88 (7): 720-755. ISSN 0025-6196. PMC 3761874. PMID 23790560. doi:10.1016/j.mayocp.2013.05.011. Consultado el 19 de septiembre de 2018.
- ↑ Weygandt, Martin; Meyer-Arndt, Lil; Behrens, Janina Ruth; Wakonig, Katharina; Bellmann-Strobl, Judith; Ritter, Kerstin; Scheel, Michael; Brandt, Alexander U. et al. (22 de noviembre de 2016). «Stress-induced brain activity, brain atrophy, and clinical disability in multiple sclerosis». Proceedings of the National Academy of Sciences (en inglés) 113 (47): 13444-13449. ISSN 0027-8424. PMC 5127380. PMID 27821732. doi:10.1073/pnas.1605829113. Consultado el 19 de septiembre de 2018.
- ↑ Marrie, Ruth Ann; Reingold, Stephen; Cohen, Jeffrey; Stuve, Olaf; Trojano, Maria; Sorensen, Per Soelberg; Cutter, Gary; Reider, Nadia (12 de enero de 2015). «The incidence and prevalence of psychiatric disorders in multiple sclerosis: A systematic review». Multiple Sclerosis Journal (en inglés) 21 (3): 305-317. ISSN 1352-4585. PMC 4429164. PMID 25583845. doi:10.1177/1352458514564487. Consultado el 19 de septiembre de 2018.
- ↑ Braley, Tiffany J.; Kratz, Anna L.; Kaplish, Neeraj; Chervin, Ronald D. (2016-08). «Sleep and Cognitive Function in Multiple Sclerosis». Sleep (en inglés) 39 (8): 1525-1533. ISSN 0161-8105. PMC 4945311. PMID 27166237. doi:10.5665/sleep.6012. Consultado el 19 de septiembre de 2018.
- ↑ Veauthier, Christian; Gaede, Gunnar; Radbruch, Helena; Wernecke, Klaus-Dieter; Paul, Friedemann; Veauthier, Christian; Gaede, Gunnar; Radbruch, Helena et al. (21 de julio de 2015). «Sleep Disorders Reduce Health-Related Quality of Life in Multiple Sclerosis (Nottingham Health Profile Data in Patients with Multiple Sclerosis)». International Journal of Molecular Sciences (en inglés) 16 (7): 16514-16528. PMC 4519963. PMID 26197315. doi:10.3390/ijms160716514. Consultado el 19 de septiembre de 2018.
- ↑ Lorefice, Lorena; Mura, Gioia; Coni, Giulia; Fenu, Giuseppe; Sardu, Claudia; Frau, Jessica; Coghe, Giancarlo; Melis, Marta et al. (15 de noviembre de 2013). «What do multiple sclerosis patients and their caregivers perceive as unmet needs?». BMC Neurology (en inglés) 13 (1). ISSN 1471-2377. PMC 3840560. PMID 24237586. doi:10.1186/1471-2377-13-177. Consultado el 4 de agosto de 2018.
- ↑ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3952521/pdf/jpm.2013.0497.pdf. Falta el
|título=(ayuda) - ↑ «Home | MS International Federation». MS International Federation (en inglés estadounidense). Consultado el 4 de agosto de 2018.
- ↑ «Sobre el Día Mundial de la EM». World MS Day 2018. Consultado el 4 de agosto de 2018.
- ↑ «Home - ECTRIMS | European Committee for Treatment and Research in Multiple Sclerosis». ECTRIMS | European Committee for Treatment and Research in Multiple Sclerosis (en inglés estadounidense). Consultado el 4 de agosto de 2018.
- ↑ «Welcome». ACTRIMS (en inglés estadounidense). Consultado el 4 de agosto de 2018.
- ↑ «LACTRIMS ORG – Otro sitio realizado con WordPress». www.lactrimsweb.org. Consultado el 4 de agosto de 2018.
- ↑ «PACTRIMS – Pan-Asian Committee for Treatment and Research in Multiple Sclerosis». www.pactrims.org (en inglés estadounidense). Consultado el 4 de agosto de 2018.
- ↑ «MENA Committee for Research and Treatment in Multiple Sclerosis». www.menactrims.com (en inglés). Consultado el 4 de agosto de 2018.
- ↑ «Mexctrims». mexctrims.com (en inglés). Consultado el 4 de agosto de 2018.
- ↑ «BCTRIMS». www.bctrims.com.br. Consultado el 4 de agosto de 2018.
- ↑ «Multiple Sclerosis Brain Health initiative». MS Brain Health (en inglés). Consultado el 4 de agosto de 2018.
- ↑ Hammer LA, Waldner H, Zagon IS, McLaughlin PJ. (2016 Jan). Opioid growth factor and low-dose naltrexone impair central nervous system infiltration by CD4 + T lymphocytes in established experimental autoimmune encephalomyelitis, a model of multiple sclerosis. 1. pp. 71-8. doi:10.1177/1535370215596384. Consultado el 12 de agosto de 2018.
- ↑ Ludwig, M. D., Zagon, I. S., & McLaughlin, P. J. (2017). Serum [Met 5 ]-enkephalin levels are reduced in multiple sclerosis and restored by low-dose naltrexone. Experimental Biology and Medicine 15 (24). pp. 1524-1533. Consultado el 12 de agosto de 2018.
- ↑ Parkitny L, Younger J. (abr 2017). Reduced Pro-Inflammatory Cytokines after Eight Weeks of Low-Dose Naltrexone for Fibromyalgia. 5 (18). p. 2. doi:10.3390/biomedicines5020016.
|doi=incorrecto (ayuda). - ↑ Sharafaddinzadeh N, Moghtaderi A, Kashipazha D, Majdinasab N, Shalbafan B. (2010 Aug). The effect of low-dose naltrexone on quality of life of patients with multiple sclerosis: a randomized placebo-controlled trial.. doi:10.1177/1352458510366857.
- ↑ Cree BA, Kornyeyeva E, Goodin DS. (2010 Aug). Pilot trial of low-dose naltrexone and quality of life in multiple sclerosis. (68). doi:10.1002/ana.22006.
|doi=incorrecto (ayuda). - ↑ Gironi M, Martinelli-Boneschi F, Sacerdote P, Solaro C, Zaffaroni M, Cavarretta R, Moiola L, Bucello S, Radaelli M, Pilato V, Rodegher M, Cursi M, Franchi S, Martinelli V, Nemni R, Comi G, Martino G. (2008). A pilot trial of low-dose naltrexone in primary progressive multiple sclerosis. doi:10.1177/1352458508095828.
|doi=incorrecto (ayuda). - ↑ «LDN SCIENCE».
Bibliografía
- «MS (multiple sclerosis: esclerosis múltiple): esperanza en la investigación», extenso artículo en el sitio web del National Institute of Neurological Disorders and Stroke; publicado bajo dominio público.
- OMIM 126200
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Esclerosis múltiple.
Wikimedia Commons alberga una categoría multimedia sobre Esclerosis múltiple.
