Reemplazo de fluidos
| Reemplazo de fluidos | ||
|---|---|---|
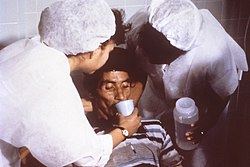 Una persona con cólera que toma solución de rehidratación oral (SRO) | ||
| Clasificación y recursos externos | ||
El reemplazo de líquidos o la reanimación con líquidos es la práctica médica de reponer los líquidos corporales perdidos a través de la sudoración, sangrado, cambios de líquidos u otros procesos patológicos. Los líquidos pueden reemplazarse con terapia de rehidratación oral (bebida), terapia intravenosa, rectalmente, como con un goteo de Murphy, o mediante hipodermoclisis, la inyección directa de líquido en el tejido subcutáneo. Los líquidos administrados por vía oral e hipodérmica se absorben más lentamente que los administrados por vía intravenosa.
Oral[editar]
La terapia de rehidratación oral (TRO) es un tratamiento simple para la deshidratación asociada con la diarrea, en particular la gastroenteritis/gastroenterapia, como la causada por el cólera o el rotavirus. ORT consiste en una solución de sales y azúcares que se toma por vía oral. Para la deshidratación más leve a moderada en niños, el tratamiento preferible en un servicio de urgencias es la TRO en lugar de la sustitución intravenosa de líquidos.[1]
Se usa en todo el mundo, pero es más importante en el mundo en desarrollo, donde salva a millones de niños al año de la muerte debido a la diarrea, la segunda causa de muerte en niños menores de cinco años.[2]
Intravenosa[editar]
| Requerimientos diarios | |
|---|---|
| Agua | 30 ml/kg/24 h |
| Na+ | ~ 1 mmol/kg/24 h |
| K+ | ~ 1 mmol/kg/24 h |
| Glucosa | 5 (3 to 8) g/hora |
En la deshidratación severa, se prefiere el reemplazo de líquidos por vía intravenosa, y puede salvar la vida. Es especialmente útil cuando hay un agotamiento del líquido tanto en el espacio intracelular como en el espacio vascular.
El reemplazo de líquidos también está indicado en el agotamiento de líquidos debido a hemorragia, quemaduras extensas y sudoración excesiva (como por una fiebre prolongada) y diarrea prolongada (cólera).
Durante los procedimientos quirúrgicos, el requerimiento de líquidos aumenta por el aumento de la evaporación, los cambios de líquidos y/o la producción excesiva de orina, entre otras posibles causas. Incluso una pequeña cirugía puede causar una pérdida de aprox. 4 ml/kg/hora y una cirugía grande de aproximadamente 8 ml/kg/hora, además del requerimiento de líquido basal.
La tabla muestra los requisitos diarios para algunos componentes importantes de fluidos. Si no pueden administrarse por vía enteral, es posible que deban administrarse por vía intravenosa por completo. Si se continúa a largo plazo (más de aproximadamente 2 días), puede requerirse un régimen más completo de nutrición parenteral total.
Tipos de fluidos utilizados[editar]
Los tipos de fluidos intravenosos utilizados en la sustitución de líquidos están generalmente dentro de la clase de expansores de volumen. La solución salina fisiológica, o solución de cloruro de sodio al 0.9%, se usa a menudo porque es isotónica y, por lo tanto, no causa cambios de líquidos potencialmente peligrosos. Además, si se anticipa que se administrará sangre, se utilizará solución salina normal porque es el único líquido compatible con la administración de sangre.
La transfusión de sangre es el único reemplazo de líquidos aprobado capaz de transportar oxígeno; Algunos sustitutos de sangre que transportan oxígeno están en desarrollo.
La solución de lactato de Ringer es otra solución cristaloide isotónica y está diseñada para que coincida con el plasma sanguíneo. Si se administra por vía intravenosa, los fluidos cristaloides isotónicos se distribuirán a los espacios intravascular e intersticial.
Plasma-lyte es otro cristaloide isotónico.
Los productos sanguíneos, productos no sanguíneos y combinaciones se utilizan en la sustitución de líquidos, incluidas las soluciones coloides y cristaloides. Los coloides se utilizan cada vez más, pero son más caros que los cristaloides. Una revisión sistemática no encontró pruebas de que la reanimación con coloides, en lugar de cristaloides, reduzca el riesgo de muerte en pacientes con traumatismo, quemaduras o después de una cirugía.[3]
Mantenimiento[editar]
Los fluidos de mantenimiento se utilizan en aquellos que normalmente están hidratados pero que no pueden beber lo suficiente para mantener esta hidratación. En niños se recomiendan fluidos isotónicos para mantener la hidratación.[4]
Procedimiento[editar]
Es importante lograr un estado fluido que sea lo suficientemente bueno para evitar la baja producción de orina. La baja producción de orina tiene varios límites, pero una producción de 0,5 ml/kg/h en adultos generalmente se considera adecuada y sugiere una perfusión de órganos adecuada. La fórmula de Parkland no es perfecta y la terapia de líquidos deberá ajustarse a los valores hemodinámicos y a la producción de orina.
La velocidad de reemplazo de líquidos puede diferir entre los procedimientos. La planificación del reemplazo de líquidos para pacientes con quemaduras se basa en la fórmula de Parkland (4 ml de lactato de Ringer X peso en kg X%TBSA quemado = Cantidad de líquido (en ml) para dar más de 24 horas). La fórmula de Parkland da la cantidad mínima que se dará en 24 horas. La mitad del volumen se administra durante las primeras ocho horas después del momento de la quemadura (no desde el momento de ingreso al ED) y la otra mitad durante las siguientes 16 horas. En la deshidratación, 2/3 del déficit se puede administrar en 4 horas, y el resto durante aprox. 20 horas.
Usos clínicos[editar]
Shock séptico[editar]
El reemplazo de líquidos en pacientes con shock séptico se puede dividir en cuatro etapas, como se muestra a continuación:
- Fase de reanimación: el objetivo de esta fase es corregir la hipotensión. El cristaloide intravenoso es la primera opción de terapia. La Campaña Sobrevivir a la Sepsis recomienda 30 ml/kg de resucitación con líquido en esta fase. La reanimación con líquidos anterior se asocia con una mejor supervivencia. La presión arterial media debe dirigirse a más de 65 mmHg.[5] Mientras tanto, para la terapia temprana dirigida por objetivos (EGDT), los fluidos deben administrarse dentro de las primeras seis horas del shock séptico hasta que la presión venosa central (CVP) alcance entre 8 y 12 mmHg, con una mejora de los niveles de lactato en sangre, saturación de oxígeno venoso central> 70 % y producción de orina ≥ 0.5 ml/kg / hora.[6] Se pueden utilizar presiones arteriales medias más altas en pacientes con hipertensión crónica para reducir el uso de la terapia de reemplazo renal. Sin embargo, si el reemplazo de líquidos es inadecuado para elevar la presión arterial, entonces se debe usar el vasopresor. Sin embargo, no hay un tiempo definido para iniciar vasopresores. El inicio de vasopresores en la primera hora de la sepsis puede llevar a una mala perfusión de los órganos y una mala función de los órganos. El inicio tardío de vasopresor puede causar daño a los órganos y aumentar el riesgo de muerte. Se requiere un control frecuente del estado del líquido del paciente para evitar la sobrecarga del líquido.
- Fase de optimización: en esta fase, el objetivo es aumentar el suministro de oxígeno a los tejidos para satisfacer las demandas de oxígeno de los tejidos. El suministro de oxígeno se puede mejorar al aumentar el volumen de la apoplejía del corazón (a través del desafío con líquidos), la concentración de hemoglobina (a través de la transfusión de sangre) y la saturación de oxígeno arterial (a través de la terapia de oxígeno). La prueba de fluidos es el procedimiento para administrar grandes cantidades de líquidos en un corto período de tiempo.[7] Sin embargo, el 50% de los que no responden al desafío fluido. Los desafíos adicionales de fluidos solo causan una sobrecarga de fluidos Sin embargo, no existe un estándar de oro para determinar la capacidad de respuesta del fluido. Entre otras formas de determinar la capacidad de respuesta del líquido y el punto final de la reanimación con líquido están: saturación venosa central de oxígeno (ScvO2), prueba de elevación pasiva de la pierna, mediciones ecográficas de la variación de la presión del pulso, variación del volumen sistólico y variaciones respiratorias en la vena cava superior, vena cava inferior y vena yugular interna.[6]
- Fase de estabilización: en esta etapa, la perfusión del tejido comienza a estabilizarse y la necesidad de líquido o vasopresores comienza a reducirse. Se pueden dar desafíos adicionales de fluidos solo para aquellos que responden. El fluido de mantenimiento se puede detener si el estado de perfusión es adecuado.[6]
- Fase de evacuación: en esta fase, el objetivo es eliminar el exceso de líquidos de quienes lograron una perfusión tisular adecuada. El balance negativo de líquidos se asocia con un menor riesgo de muerte. Sin embargo, no hay consenso con respecto al momento óptimo para la eliminación del fluido y el riesgo de reducción de la perfusión después de la extracción del fluido tampoco es concluyente. Un enfoque razonable es comenzar la restricción de líquidos cuando la perfusión del tejido sea adecuada, y considerar un tratamiento diurético para aquellos con evidencia clínica de sobrecarga de líquidos y balance positivo de líquidos. Aquellos con presión arterial media de más de 60 mmHg, sin vasopresores durante más de 12 horas, con una producción adecuada de orina pueden recibir furosemida para alcanzar una presión venosa central inferior a 4 mmHg y presión de oclusión de la arteria pulmonar (PAOP) de menos de 8 mmHg. Los niveles de péptido natriurético cerebral también pueden usarse para guiar la eliminación de líquidos.[6]
Lesión renal aguda[editar]
La sepsis representa el 50% de los pacientes con lesión renal aguda en (unidad de cuidados intensivos) (UCI).[5] Se recomienda el uso de cristaloides por vía intravenosa como tratamiento de primera línea para prevenir o tratar la lesión renal aguda (LRA) en comparación con los coloides, ya que los coloides aumentan el riesgo de LRA.[8] Se puede usar 4% de albúmina humana en pacientes cirróticos con peritonitis bacteriana espontánea, ya que puede reducir la tasa de insuficiencia renal y mejorar la supervivencia.[5] Sin embargo, la sobrecarga de líquidos puede excerbar la lesión renal aguda. El uso de diuréticos no previene ni trata la LRA, incluso con la ayuda de una terapia de reemplazo renal. Las pautas de KDIGO (Enfermedad renal: Mejora de los resultados globales) de 2012 establecieron que los diuréticos no deben usarse para tratar la LRA, excepto para el manejo de la sobrecarga de volumen.[8] En el síndrome de dificultad respiratoria en adultos (SDRA), el manejo conservador de líquidos se asocia con una mejor oxigenación y función pulmonar con menos prevalencia de diálisis en los primeros 60 días de hospitalización en comparación con el manejo liberal de líquidos.[5]
Sobrecarga de fluidos[editar]
La sobrecarga de líquidos se define como un aumento en el peso corporal de más del 10%.[5] La reanimación con líquidos agresiva puede provocar una sobrecarga de líquidos que puede provocar daños en múltiples órganos, como el odema cerebral que conduce a delirio, edema pulmonar y derrame pleural que conduce a dificultad respiratoria, edema miocárdico y derrame pericárdico, lo que conduce a una contractilidad cardíaca dañada. El edema gastrointestinal que conduce a la malabsorción, la congestión hepática que conduce a colestasis, la lesión renal aguda y el odema tisular producen una cicatrización deficiente de las heridas. Todos estos efectos pueden causar discapacidad y muerte, y aumentar los costos de hospitalización.[6]
La sobrecarga de líquidos causa la dilatación cardíaca, lo que conduce a un aumento de la tensión de la pared ventricular, la insuficiencia mitral y conduce a la disfunción cardíaca. La hipertensión pulmonar puede llevar a insuficiencia tricuspídea. La administración excesiva de líquido causa la acumulación de líquido extracelular, lo que lleva a un edema pulmonar y la falta de suministro de oxígeno a los tejidos. El uso de ventilación mecánica en tal caso puede causar barotrauma, infección y toxicidad por oxígeno, lo que lleva al síndrome de dificultad respiratoria aguda.[5] La sobrecarga de líquidos también estira el endotelio arterial, lo que causa daño al glucocalix, lo que provoca una fuga capilar y empeora la lesión renal aguda.[9]
Otros tratamientos[editar]
La proctoclisis, un enema, es la administración de líquido en el recto como terapia de hidratación. Algunas veces se usa para personas muy enfermas con cáncer. El goteo Murphy es un dispositivo mediante el cual se puede realizar este tratamiento.[10]
Véase también[editar]
Referencias[editar]
- ↑ «Ten Things Physicians and Patients Should Question», Choosing Wisely (American College of Emergency Physicians), 27 de octubre de 2014 [October 14, 2013], archivado desde el original el 7 de marzo de 2014, consultado el 6 de abril de 2015.
- ↑ The State of the World’s Children 2008: Child Survival. UNICEF. December 2007. p. 8. ISBN 9789280641912. Archivado desde el original el 8 de diciembre de 2017. Consultado el 16 de febrero de 2009.
- ↑ Perel, P; Roberts, I (2011). «Colloids versus crystalloids for fluid resuscitation in critically ill patients». Cochrane Database of Systematic Reviews (3): CD000567. PMID 21412866. doi:10.1002/14651858.CD000567.pub4.
- ↑ McNab, S; Ware, RS; Neville, KA; Choong, K et al. (2014). «Isotonic versus hypotonic solutions for maintenance intravenous fluid administration in children». Cochrane Database of Systematic Reviews (12): CD009457. PMID 25519949. doi:10.1002/14651858.CD009457.pub2.
- ↑ a b c d e f W Schrier, Robert (2010). «Fluid Administration in Critically Ill Patients with Acute Kidney Injury». Clinical Journal of American Society of Nephrology 5 (4): 733-739. doi:10.2215/CJN.00060110.
- ↑ a b c d e C Ogbu, Ogbonna; J Murphy, David; S Martin, Greg (August 2015). «How to Avoid Fluid Overload». Current Opinion in Critical Care 21 (4): 315-321. PMC 4691845. doi:10.1097/MCC.0000000000000211.
- ↑ Vincent, J; Weil, M (2006). «Fluid challenge revisited». Critical Care Medicine 34 (5): 1333-7. PMID 16557164. doi:10.1097/01.CCM.0000214677.76535.A5.
- ↑ a b Claire, Annie; Fredette, Nadeau; Bouchard, Josée (January 2013). «Fluid Management and Use of Diuretics in Acute Kidney Injury». Advances in chronic kidney disease 20 (1): 45-55. doi:10.1053/j.ackd.2012.09.005.
- ↑ Ostermann, Marlies; Oudemans-van Straaten, Heleen M; G. Forni, Lui (27 de diciembre de 2015). «Fluid overload and acute kidney injury: cause or consequence?». Critical Care 19: 443. doi:10.1186/s13054-015-1163-7.
- ↑ Bruera, E; Pruvost, M; Schoeller, T; Montejo, G et al. (April 1998). «Proctoclysis for hydration of terminally ill cancer patients». Journal of Pain and Symptom Management 15 (4): 216-9. PMID 9601155. doi:10.1016/s0885-3924(97)00367-9.
