Tumor
| Tumor | ||
|---|---|---|
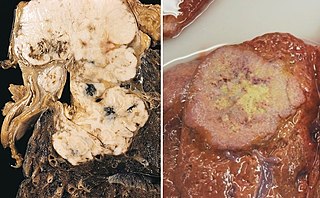 Dos imágenes de tumores distintos. | ||
| Especialidad | Oncología | |
| Síntomas | Edemas | |
| Complicaciones | Cáncer | |
| Causas | Radiación, factor ambiental o infección | |
Un tumor es cualquier alteración de los tejidos que produzca un aumento de volumen. Es un agrandamiento anormal de una parte del cuerpo que aparece, por lo tanto, hinchada o distendida. El tumor, junto con el rubor, el dolor y el calor, forman la tétrada clásica de los síntomas y signos de la inflamación.
En sentido restringido, un tumor es cualquier masa o bulto que se deba a un aumento en el número de células que lo componen. Si este crecimiento celular tiene su origen en diversas células (policlonal) hablamos de hiperplasia y si se trata de una neoformación celular que tiene su origen en una única célula (monoclonal) la llamamos neoplasia independientemente de que sean de carácter benigno o maligno en función de su capacidad o no de infiltrar los tejidos que le rodean. Cuando un tumor es maligno tiene capacidad de invasión o infiltración y de producir metástasis a lugares distantes del tumor primario, siendo un cáncer metastásico.
Tumores o neoplasias benignos
[editar]Un tumor benigno es una neoplasia que no posee la malignidad de los tumores cancerosos. Esto implica que este tipo de tumor no crece en forma desproporcionada ni agresiva, no invade tejidos adyacentes, y no hace metástasis a tejidos u órganos distantes. Las células de tumores benignos permanecen juntas y a menudo son rodeadas por una membrana de contención o cápsula. Los tumores benignos no constituyen generalmente una amenaza para la vida; se pueden extirpar y, en la mayoría de los casos, no reaparecen. Para denominar estos tumores se usa como prefijo el nombre del tejido que lo origina acompañado del sufijo «-oma» (tumor).[1]
Ejemplos de tumores benignos:
- Papiloma: masa más protuberante en la piel (por ejemplo, un quiste).
- Adenoma: tumor que crece en las glándulas y en torno a las mismas.
- Lipoma: tumor en un tejido adiposo.
- Osteoma: tumor de origen en el hueso.
- Mioma: tumor del tejido muscular.
- Angioma: tumor compuesto generalmente de pequeños vasos sanguíneos o linfáticos (por ejemplo, una marca de nacimiento).
- Nevus: pequeño tumor cutáneo de una variedad de tejidos (por ejemplo, un lunar).
- Teratoma: tumor encapsulado con componentes de tejidos u órganos que recuerdan los derivados normales de las tres capas germinales.
- Tumor de Warthin: hiperplasia quística especialmente de la glándula parótida.
Tumores malignos o cáncer
[editar]Los tumores malignos son cancerosos. Las células cancerosas pueden invadir y dañar tejidos y órganos cercanos al tumor. Las células cancerosas pueden separarse del tumor maligno y entrar al sistema linfático o al flujo sanguíneo, que es la manera en que el cáncer alcanza otras partes del cuerpo. El aspecto característico del cáncer es la capacidad de la célula de crecer rápidamente, de manera descontrolada e independiente del tejido donde comenzó. La propagación del cáncer a otros sitios u órganos en el cuerpo mediante el flujo sanguíneo o el sistema linfático se llama metástasis. Los tumores malignos generalmente se pueden clasificar en seis categorías:
- Carcinomas. Estos cánceres se originan en el epitelio que es el recubrimiento de las células de un órgano. Los carcinomas constituyen el tipo más común de cáncer. Lugares comunes de carcinomas son la piel, la boca, el pulmón, los senos, el estómago, el colon y el útero.
- Sarcomas. Los sarcomas son cánceres del tejido conectivo y de sostén (tejidos blandos) de todos los tipos. Los sarcomas se encuentran en cualquier parte del cuerpo y frecuentemente forman crecimientos secundarios en los pulmones.
- Gliomas. Son cánceres del cerebro o la médula espinal producidos por neoplasias en las células gliales.
- Leucemias. Son cánceres de la sangre. Afectan a la línea mielocítica (es decir, afectan a los granulocitos, monocitos o mastocitos); comenzando en esos mismos grupos celulares o en algún progenitor común.
- Linfomas. Son cánceres que surgen en línea linfocítica (Es decir, afectando a los linfocitos) o en algún progenitor común; o que afectan a otras líneas celulares como las de las células presentadoras de antígenos (CPA), diversos tipos de Macrófagos, o algún progenitor común.
- Teratoma inmaduro.
| Características de tumores benignos y malignos | ||
|---|---|---|
| Característica | Benigno | Maligno |
| Diferenciación | Las células tumorales se asemejan a las células maduras originales | Las células tumorales tal vez no se asemejan a las células maduras originales |
| Tasa de crecimiento | Lenta; puede interrumpirse o retroceder | Rápida, autónoma; generalmente no interrumpe ni retrocede |
| Tipo de crecimiento | Se expande y desplaza | Invade, destruye y reemplaza |
| Metástasis | No | Sí |
| Efecto en la salud | Generalmente no ocasiona la muerte | Puede ocasionar la muerte si no se diagnostica y suministra tratamiento |
Daños en el ADN
[editar]
El daño en el ADN se considera la principal causa subyacente de las neoplasias malignas conocidas como cánceres.[2] Su papel central en la progresión al cáncer se ilustra en la figura de esta sección, en el recuadro cercano a la parte superior. (Las características centrales del daño en el ADN, las alteraciones epigenéticas y la reparación deficiente del ADN en la progresión al cáncer se muestran en rojo). El daño en el ADN es muy común. Los daños en el ADN de origen natural (debidos principalmente al metabolismo celular y a las propiedades del ADN en el agua a temperatura corporal) se producen a un ritmo de más de 60.000 nuevos daños, de media, por célula humana, al día. Pueden producirse daños adicionales en el ADN por la exposición a agentes exógenos. El humo del tabaco causa un mayor daño exógeno en el ADN, y estos daños en el ADN son la causa probable del cáncer de pulmón debido al tabaquismo.[3] La UV de la radiación solar causa daños en el ADN que son importantes en el melanoma. [4] La infección por Helicobacter pylori' produce altos niveles de especies reactivas de oxígeno que dañan el ADN y contribuyen al cáncer gástrico.[5] Los ácidos biliaress, en niveles elevados en el colon de los seres humanos que siguen una dieta rica en grasas, también causan daños en el ADN y contribuyen al cáncer de colon. [6] Katsurano et al. indicaron que macrófagos y neutrófilos en un epitelio colónico inflamado son la fuente de especies reactivas de oxígeno que causan los daños en el ADN que inician la tumorigénesis colónica (creación de tumores en el colon). [7]. Algunas fuentes de daño del ADN se indican en los recuadros de la parte superior de la figura de esta sección.
Los individuos con una mutación en la línea germinal que cause deficiencia en cualquiera de los 34 genes de reparación del ADN tienen un mayor riesgo de cáncer. Algunas mutaciones de la línea germinal en genes de reparación del ADN causan hasta un 100% de probabilidades de cáncer a lo largo de la vida (por ejemplo, mutaciones p53).[8] Estas mutaciones de la línea germinal se indican en un recuadro a la izquierda de la figura con una flecha que indica su contribución a la deficiencia en la reparación del ADN.
Alrededor del 70% de las neoplasias malignas (cancerosas) no tienen ningún componente hereditario y se denominan "cánceres esporádicos". [9] Sólo una minoría de los cánceres esporádicos tienen una deficiencia en la reparación del ADN debido a la mutación en un gen de reparación del ADN. Sin embargo, la mayoría de los cánceres esporádicos presentan deficiencias en la reparación del ADN debido a alteraciones epigenética que reducen o silencian la expresión del gen de reparación del ADN. Por ejemplo, de 113 cánceres colorrectales secuenciales, sólo cuatro tenían una mutación de sentido erróneo en el gen de reparación del ADN MGMT, mientras que la mayoría tenían una expresión reducida de MGMT debido a la metilación de la región promotora de MGMT (una alteración epigenética). [10] Cinco informes presentan pruebas de que entre el 40% y el 90% de los cánceres colorrectales tienen una expresión reducida de MGMT debido a la metilación de la región promotora de MGMT. [11][12][13][14][15]
De manera similar, de 119 casos de cánceres colorrectales deficientes en reparación de emparejamientos erróneos que carecían de expresión del gen de reparación del ADN PMS2, en 6 de ellos la expresión de PMS2 era deficiente debido a mutaciones en el gen PMS2, mientras que en 103 casos la expresión de PMS2 era deficiente porque su compañero de emparejamiento MLH1 estaba reprimido debido a la metilación del promotor (la proteína PMS2 es inestable en ausencia de MLH1). [16] En los otros 10 casos, la pérdida de expresión de PMS2 se debió probablemente a la sobreexpresión epigenética del microARN, miR-155, que regula a la baja MLH1. [17]
En otros ejemplos, se encontraron defectos epigenéticos en frecuencias de entre el 13%-100% para los genes de reparación del ADN BRCA1, WRN FANCB, FANCF, MGMT, MLH1, MSH2, MSH4, ERCC1, XPF, NEIL1 y ATM. Estos defectos epigenéticos se produjeron en varios tipos de cáncer, incluidos los de mama, ovario, colorrectal y cabeza y cuello. Dos o tres deficiencias en la expresión de ERCC1, XPF o PMS2 se producen simultáneamente en la mayoría de los 49 cánceres de colon evaluados por Facista et al. [18] Las alteraciones epigenéticas que causan una expresión reducida de los genes de reparación del ADN se muestra en un recuadro central en el tercer nivel desde la parte superior de la figura en esta sección, y la consiguiente deficiencia de reparación del ADN se muestra en el cuarto nivel. Cuando se reduce la expresión de los genes de reparación del ADN, los daños en el ADN se acumulan en las células a un nivel superior al normal, y estos daños en exceso provocan un aumento de las frecuencias de mutación o epimutación. Las tasas de mutación aumentan fuertemente en las células defectuosas en reparación de errores de emparejamiento del ADN[19][20] o en reparaciión por recombinación homóloga (HRR). [21].
Durante el reparación de roturas de doble cadena del ADN, o la reparación de otros daños en el ADN, los sitios de reparación incompletamente despejados pueden causar epigenética. silenciamiento génico. [22][23] Las deficiencias en la reparación del ADN (nivel 4 en la figura) causan un aumento de los daños en el ADN (nivel 5 en la figura) que dan lugar a un aumento de mutaciones somáticas y alteraciones epigenéticas (nivel 6 en la figura).
Los defectos de campo, tejido de apariencia normal con múltiples alteraciones (y que se comentan en la sección siguiente), son precursores comunes del desarrollo del clon de tejido desordenado y con proliferación inadecuada en una neoplasia maligna. Tales defectos de campo (segundo nivel desde la parte inferior de la figura) pueden presentar múltiples mutaciones y alteraciones epigenéticas.
Una vez formado el cáncer, suele presentar inestabilidad del genoma. Esta inestabilidad se debe probablemente a una reducción de la reparación del ADN o a un daño excesivo del ADN. Debido a esa inestabilidad, el cáncer sigue evolucionando y produciendo subclones. Por ejemplo, un cáncer renal, muestreado en 9 áreas, tenía 40 mutaciones ubicuas, lo que demuestra heterogeneidad tumoral (es decir, presentes en todas las áreas del cáncer), 59 mutaciones compartidas por algunas (pero no todas las áreas) y 29 mutaciones "privadas" sólo presentes en una de las áreas del cáncer. [24]
Teratoma
[editar]Un teratoma es un tipo de tumor de origen embrionario. El término teratoma procede del griego teras- Teratos "pesadilla", "monstruo" y Oma significado de "hinchazon", "tumor".
El diagnóstico definitivo de un teratoma se basa en su estudio histológico: un teratoma es un tumor con tejido biológico o componentes de órgano que provienen de derivados normales de las tres capas germinativas. Es decir, los teratomas contienen regiones celulares con las tres líneas embrionarias germinales: endodermo (epitelio glandular) mesodermo (cartílago, hueso y músculo liso y estriado) y ectodermo (epitelio neural y epitelio escamoso estratificado).
Raramente, pueden no ser de alguna de esas tres capas la identificación. Los tejidos de un teratoma, aunque en apariencia normales en sí, pueden ser algo diferentes de los tejidos circundantes, y ser altamente incongruentes: los teratomas pueden contener pelo, diente, hueso y muy raramente órganos más complejos como glóbulo ocular, torso y mano. Usualmente, un teratoma no contiene ningún órgano, sino uno o más tejidos normalmente encontrados en órganos como cerebro, tiroides, hígado y pulmón. El teratoma tiene una forma benigna llamada teratoma maduro, y una forma cancerosa llamada teratoma inmaduro.
El teratoma maduro más frecuente es el "tumor ovárico de células germinales", que en general afecta a mujeres en edad de procreación (desde adolescentes hasta mujeres de cincuenta años). A menudo se denomina "quiste dermoide" debido a que su revestimiento se asemeja a la piel. Estos tumores o quistes contienen diversos tejidos benignos que podrían parecerse a las vías respiratorias, los huesos, el tejido nervioso, los dientes y otros tejidos de un adulto. Su tratamiento consiste en la extirpación quirúrgica del quiste.
Los teratomas inmaduros se presentan en niñas y mujeres jóvenes, por lo general menores de 18 años. Estos tumores cancerosos son poco frecuentes, se asemejan a tejidos embrionarios o fetales, como el tejido conectivo, las vías respiratorias y el cerebro. Cuando no se han extendido más allá del ovario y la inmadurez no es prominente (teratoma inmaduro de grado 1), se curan mediante la extirpación quirúrgica del ovario. Cuando se han extendido más allá del ovario o una gran parte del tumor tiene un aspecto muy inmaduro (teratomas inmaduros de grado 2 o 3), se recomienda quimioterapia, además de la extirpación quirúrgica del ovario.
Causas
[editar]

Los tumores en humanos se producen como resultado de alteraciones genéticas y epigenéticas acumuladas dentro de células individuales, que hacen que la célula se divida y se expanda sin control.[25] Una neoplasia puede estar causada por una proliferación anormal de los tejidos, que puede estar causada por mutacións genéticas. Sin embargo, no todos los tipos de neoplasias causan un crecimiento tumoral excesivo de los tejidos (como la leucemia o el carcinoma in situ) y las similitudes entre los crecimientos neoplásicos y los procesos regenerativos, por ejemplo, la desdiferenciación y la rápida proliferación celular, han sido señaladas.[26]
El crecimiento de los tumores se ha estudiado utilizando las matemáticas y la mecánica del continuo. Así, los tumores vasculares como hemangiomas y linfangiomas (formados a partir de vasos sanguíneos o linfáticos) se consideran amalgamas de un esqueleto sólido formado por células pegajosas y un líquido orgánico que rellena los espacios en los que las células pueden crecer. [27] Con este tipo de modelo se pueden tratar las tensiones y deformaciones mecánicas y dilucidar su influencia en el crecimiento del tumor y del tejido y la vasculatura circundantes. Hallazgos recientes de experimentos que utilizan este modelo muestran que el crecimiento activo del tumor se restringe a los bordes exteriores del mismo y que la rigidez del tejido normal subyacente inhibe también el crecimiento tumoral. [28]
Sin embargo, las afecciones benignas que "no" están asociadas con una proliferación anormal de tejido (como los quistes sebáceos) también pueden presentarse como tumores, pero no tienen potencial maligno. Los quistes mamarios (como los que suelen aparecer durante el embarazo y en otras ocasiones) son otro ejemplo, al igual que otras inflamaciones glandulares encapsuladas (tiroides, glándula suprarrenal, páncreas).
Los hematomas encapsulados, el tejido necrótico encapsulado (por picadura de insecto, cuerpo extraño u otro mecanismo nocivo), los queloides (crecimientos discretos de tejido cicatricial) y los granulomas también pueden presentarse como tumores.
Los agrandamientos localizados discretos de estructuras normales (uréteres, vasos sanguíneos, conductos biliares intrahepáticos o extrahepáticos, inclusiones pulmonares o quistes de duplicación gastrointestinales debidos a obstrucciones o estrechamientos del flujo de salida, o a conexiones anormales, también pueden presentarse como un tumor. Algunos ejemplos son las fístulas o aneurismas arteriovenosos (con o sin trombosis), las fístulas o aneurismas biliares, la colangitis esclerosante, la cisticercosis o los quistes hidatídicos, las duplicaciones intestinales y las inclusiones pulmonares que se observan en la fibrosis quística. Puede ser peligroso realizar la biopsia de una serie de tipos de tumores en los que la fuga de su contenido sería potencialmente catastrófica. Cuando se encuentran este tipo de tumores, se emplean modalidades diagnósticas como la ecografía, la tomografía computarizada, la resonancia magnética, los angiogramas y las exploraciones de medicina nuclear antes (o durante) la biopsia o la exploración/escisión quirúrgica en un intento de evitar complicaciones tan graves.
Tumores en vegetales
[editar]La bacteria Agrobacterium tumefaciens se caracteriza por producir tumores en las plantas dicotiledóneas. En la Fitopatología estos tumores son denominados como "agallas" o "tumores del cuello", ya que crecen en la zona donde se unen la raíz y el tallo (cuello).
Véase también
[editar]- Basalioma
- Cáncer
- Inflamación
- Lesiones cutáneas elementales
- Neoplasia
- Teratoma sacrococcígeo
- Tumor glómico
- Tumorectomía
Referencias
[editar]- ↑ Ramzi Cotran, Vinay Kumar, Tucker Collins (1999). Robbins Pathologic Basis of Disease, 6th Edition. W.B. Saunders. pp. 327. ISBN 072167335X.
- ↑ Kastan MB (2008). «Respuestas al daño en el ADN: mecanismos y funciones en la enfermedad humana: 2007 G.H.A. Clowes Memorial Award Lecture». Mol. Cancer Res. 6 (4): 517-24. PMID 18403632. doi:10.1158/1541-7786.MCR-08-0020.
- ↑ Cunningham FH, Fiebelkorn S, Johnson M, Meredith C (Noviembre 2011). «Una nueva aplicación del enfoque del Margen de Exposición: segregación de tóxicos del humo del tabaco». Food Chem. Toxicol. 49 (11): 2921-33. PMID 21802474. doi:10.1016/j.fct.2011.07.019.
- ↑
- ↑ Handa O, Naito Y, Yoshikawa T (2011). «Biología redox y carcinogénesis gástrica: el papel de Helicobacter pylori». Redox Rep. 16 (1): 1-7. PMC 6837368. PMID 21605492. doi:10.1179/174329211X12968219310756.
- ↑ Bernstein C, Holubec H, Bhattacharyya AK, Nguyen H, Payne CM, Zaitlin B, Bernstein H (August 2011). «Carcinogenicity of deoxycholate, a secondary bile acid». Arch. Toxicol. 85 (8): 863-71. PMC 3149672. PMID 21267546. doi:10.1007/s00204-011-0648-7.
- ↑ Katsurano M, Niwa T, Yasui Y, Shigematsu Y, Yamashita S, Takeshima H, Lee MS, Kim YJ, Tanaka T, Ushijima T (Enero 2012). «Formación en fase temprana de un defecto epigenético de campo en un modelo de colitis de ratón, and non-essential roles of T- and B-cells in DNA methylation induction». Oncogene 31 (3): 342-51. PMID 21685942. doi:10.1038/onc.2011.241.
- ↑ Malkin D (Abril 2011). «Síndrome de Li-fraumeni». Genes Cancer 2 (4): 475-84. PMC 3135649. PMID 21779515. doi:10.1177/1947601911413466.
- ↑ Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, Pukkala E, Skytthe A, Hemminki K (July 2000). «Environmental and heritable factors in the causation of cancer--analyses of cohorts of twins from Sweden, Denmark, and Finland». N. Engl. J. Med. 343 (2): 78-85. PMID 10891514. doi:10.1056/NEJM200007133430201.
- ↑ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (June 2005). «O(6)-metilguanina metiltransferasa en cánceres colorrectales: detección de mutaciones, pérdida de expresión y débil asociación con transiciones G:C>A:T». Gut 54 (6): 797-802. PMC 1774551. PMID 15888787. doi:10.1136/gut.2004.059535.
- ↑ Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, Houlihan PS, Krouse RS, Prasad AR, Einspahr JG, Buckmeier J, Alberts DS, Hamilton SR, Issa JP (September 2005). «MGMT promoter methylation and field defect in sporadic colorectal cancer». J. Natl. Cancer Inst. 97 (18): 1330-8. PMID 16174854. doi:10.1093/jnci/dji275.
- ↑ Psofaki V, Kalogera C, Tzambouras N, Stephanou D, Tsianos E, Seferiadis K, Kolios G (July 2010). «Estado de metilación del promotor de hMLH1, MGMT y CDKN2A/p16 en adenomas colorrectales». World J. Gastroenterol. 16 (28): 3553-60. PMC 2909555. PMID 20653064. doi:10.3748/wjg.v16.i28.3553.
- ↑ Lee KH, Lee JS, Nam JH, Choi C, Lee MC, Park CS, Juhng SW, Lee JH (October 2011). «Estado de metilación del promotor de los genes hMLH1, hMSH2, and MGMT genes in colorectal cancer associated with adenoma-carcinoma sequence». Langenbecks Arch Surg 396 (7): 1017-26. PMID 21706233. S2CID 8069716. doi:10.1007/s00423-011-0812-9.
- ↑ Amatu A, Sartore-Bianchi A, Moutinho C, Belotti A, Bencardino K, Chirico G, Cassingena A, Rusconi F, Esposito A, Nichelatti M, Esteller M, Siena S (Abril 2013). «Promoter CpG island hypermethylation of the DNA repair enzyme MGMT predicts clinical response to dacarbazine in a phase II study for metastatic colorectal cancer». Clin. Cancer Res. 19 (8): 2265-72. PMID 23422094. doi:10.1158/1078-0432.CCR-12-3518.
- ↑ Mokarram P, Zamani M, Kavousipour S, Naghibalhossaini F, Irajie C, Moradi Sarabi M, Hosseini SV (May 2013). «Diferentes patrones de metilación del ADN de las dos regiones promotoras distintas de la O6-metilguanina-ADN metiltransferasa (O6-MGMT) en el cáncer colorrectal». Mol. Biol. Rep. 40 (5): 3851-7. PMID 23271133. S2CID 18733871. doi:10.1007/s11033-012-2465-3.
- ↑ Truninger K, Menigatti M, Luz J, Russell A, Haider R, Gebbers JO, Bannwart F, Yurtsever H, Neuweiler J, Riehle HM, Cattaruzza MS, Heinimann K, Schär P, Jiricny J, Marra G (May 2005). «El análisis inmunohistoquímico revela una alta frecuencia de defectos de PMS2 en el cáncer colorrectal». Gastroenterology 128 (5): 1160-71. PMID 15887099. doi:10.1053/j.gastro.2005.01.056.
- ↑ Valeri N, Gasparini P, Fabbri M, Braconi C, Veronese A, Lovat F, Adair B, Vannini I, Fanini F, Bottoni A, Costinean S, Sandhu SK, Nuovo GJ, Alder H, Gafa R, Calore F, Ferracin M, Lanza G, Volinia S, Negrini M, McIlhatton MA, Amadori D, Fishel R, Croce CM (April 2010). «Modulación de la reparación de desajustes y la estabilidad genómica por miR-155». Proc. Natl. Acad. Sci. U.S.A. 107 (15): 6982-7. Bibcode:2010PNAS..107.6982V. PMC 2872463. PMID 20351277. doi:10.1073/pnas.1002472107.
- ↑ Facista A, Nguyen H, Lewis C, Prasad AR, Ramsey L, Zaitlin B, Nfonsam V, Krouse RS, Bernstein H, Payne CM, Stern S, Oatman N, Banerjee B, Bernstein C (2012). «Expresión deficiente de enzimas de reparación del ADN en la progresión temprana a cáncer de colon esporádico». Genome Integr 3 (1): 3. PMC 3351028. PMID 22494821. doi:10.1186/2041-9414-3-3.
- ↑ Narayanan L, Fritzell JA, Baker SM, Liskay RM, Glazer PM (Abril 1997). «Niveles elevados de mutación en múltiples tejidos de ratones deficientes en el gen de reparación de errores de emparejamiento del ADN Pms2». Proc. Acad. Sci. U.S.A. 94 (7): 3122-7. Bibcode:3122N 1997PNAS...94. 3122N. PMC 20332. PMID 9096356. doi:10.1073/pnas.94.7.3122.
- ↑ Hegan DC, Narayanan L, Jirik FR, Edelmann W, Liskay RM, Glazer PM (December 2006). «Diferentes patrones de inestabilidad genética en ratones deficientes en los genes de reparación de errores de emparejamiento Pms2, Mlh1, Msh2, Msh3 y Msh6». Carcinogenesis 27 (12): 2402-8. PMC 2612936. PMID 16728433. doi:10.1093/carcin/bgl079.
- ↑ Tutt AN, van Oostrom CT, Ross GM, van Steeg H, Ashworth A (Marzo 2002). «La alteración de Brca2 aumenta la tasa de mutaciones espontáneas in vivo: sinergia con la radiación ionizante». EMBO Rep. 3 (3): 255-60. PMC 1084010. PMID 11850397. doi:10.1093/embo-reports/kvf037.
- ↑ O'Hagan HM, Mohammad HP, Baylin SB (2008). «Las roturas de doble cadena pueden iniciar el silenciamiento génico y el inicio dependiente de SIRT1 de la metilación del ADN en una isla CpG promotora exógena». En Lee, Jeannie T, ed. PLOS Genet. 4 (8): e1000155. PMC 2491723. PMID 18704159. doi:10.1371/journal.pgen.1000155.
- ↑ Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, Messina S, Iuliano R, Fusco A, Santillo MR, Muller MT, Chiariotti L, Gottesman ME, Avvedimento EV (July 2007). «Daño en el ADN, reparación dirigida por homología y metilación del ADN». PLOS Genet. 3 (7): e110. PMC 1913100. PMID 17616978. doi:10.1371/journal.pgen.0030110.
- ↑ Gerlinger M, Rowan AJ, Horswell S, Larkin J, Endesfelder D, Gronroos E, Martinez P, Matthews N, Stewart A, Tarpey P, Varela I, Phillimore B, Begum S, McDonald NQ, Butler A, Jones D, Raine K, Latimer C, Santos CR, Nohadani M, Eklund AC, Spencer-Dene B, Clark G, Pickering L, Stamp G, Gore M, Szallasi Z, Downward J, Futreal PA, Swanton C (Marzo 2012). «Heterogeneidad intratumoral y evolución ramificada revelada por secuenciación multirregional». N. Engl. J. Med. 366 (10): 883-92. PMC 4878653. PMID 22397650. doi:10.1056/NEJMoa1113205.
- ↑ Tammela, Tuomas; Sage, Julien (2020). «Investigación de la heterogeneidad tumoral en modelos de ratón». Annual Review of Cancer Biology 4 (1): 99-119. PMC 8218894. PMID 34164589. doi:10.1146/annurev-cancerbio-030419-033413.
- ↑ Asashima M, Oinuma T, Meyer-Rochow VB (1987). «Tumores en anfibios». Zoological Science 4: 411-425.
- ↑ Ambrosi D, Mollica F (2002). «Sobre la mecánica de un tumor en crecimiento». International Journal of Engineering Science 40 (12): 1297-316. doi:10.1016/S0020-7225(02)00014-9.
- ↑ Volokh KY (September 2006). «Stresses in growing soft tissues». Acta Biomater 2 (5): 493-504. PMID 16793355. doi:10.1016/j.actbio.2006.04.002.
Bibliografía
[editar]- ATSDR en Español - Hoja Informativa: ¿Qué es el cáncer?
- Tumores Malignos - Cáncer de Piel
- Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA et al. Embryonic stem cell lines derived from human blastocysts. Science, 1998 Nov 6;282(5391):1145-7
Enlaces externos
[editar]- En MedlinePlus hay más información sobre Tumor
- Tumor de células germinales del ovario (PDQ®): Tratamiento
- Teratoma. Clasificación Internacional de las Enfermedades, ICD-10
