Diferencia entre revisiones de «Tabla periódica de los elementos»
| Línea 32: | Línea 32: | ||
=== Metales, no metales y metaloides o metales de transición=== |
=== Metales, no metales y metaloides o metales de transición=== |
||
La primera clasificación de elementos conocida fue propuesta por [[Antoine Lavoisier]], quien propuso que los elementos se clasificaran en [[metales]], [[no metales]] y metaloides o [[metal de transición|metales de transición]]. Aunque muy práctico y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias en las [[propiedades físicas]] como [[propiedades químicas|químicas]]. |
La primera clasificación de elementos conocida fue propuesta por [[Antoine Lavoisier]], quien propuso que los elementos se clasificaran en [[metales]], [[no metales]] y metaloides o [[metal de transición|metales de transición]]. Aunque muy práctico y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias en las [[propiedades físicas]] como [[propiedades químicas|químicas]]. |
||
ana valeria estubieron aqui |
|||
=== Triadas de Döbereiner === |
=== Triadas de Döbereiner === |
||
Revisión del 18:48 16 sep 2009
La tabla periódica de los elementos es la organización que, atendiendo a diversos criterios, distribuye los distintos elementos químicos conforme a ciertas características.
Suele atribuirse la tabla a Dimitri Mendeleiev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos.
Historia
La historia de la tabla periódica está íntimamente relacionada con varias cosas, clave para el desarrollo de la química y la física:
- El descubrimiento de los elementos de la tabla periódica
- El estudio de las propiedades comunes y la clasificación de los elementos
- La noción de masa atómica (inicialmente denominada "peso atómico") y, posteriormente, ya en el siglo XX, de número atómico y
- Las relaciones entre la masa atómica (y, más adelante, el número atómico) y las propiedades periódicas de los elementos.
El descubrimiento de los elementos
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y el mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo XVIII se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino-térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.
La noción de elemento y las propiedades periódicas
Lógicamente, un requisito previo necesario a la construcción de la tabla periódica era el descubrimiento de un número suficiente de elementos individuales, que hiciera posible encontrar alguna pauta en comportamiento químico y sus propiedades. Durante los siguientes 2 siglos, se fue adquiriendo un gran conocimiento sobre estas propiedades, así como descubriendo muchos nuevos elementos. La palabra "elemento" procede de la ciencia griega pero su noción moderna apareció a lo largo del siglo XVII, aunque no existe un consenso claro respecto al proceso que condujo a su consolidación y uso generalizado. Algunos autores citan como precedente la frase de Robert Boyle en su famosa obra "The Sceptical Chymist", donde denomina elementos "ciertos cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos de otros, y que son los ingredientes de que se componen inmediatamente y en que se resuelven en último término todos los cuerpos perfectamente mixtos". En realidad, esa frase aparece en el contexto de la crítica de Robert Boyle a los cuatro elementos aristotélicos. A lo largo del siglo XVIII, las tablas de afinidad recogieron un nuevo modo de entender la composición química, que aparece claramente expuesto por Lavoisier en su obra "Tratado elemental de Química". Todo ello condujo a diferenciar en primer lugar qué sustancias de las conocidas hasta ese momento eran elementos químicos, cuáles eran sus propiedades y cómo aislarlos.
El descubrimiento de un gran número de nuevos elementos, así como el estudio de sus propiedades, pusieron de manifiesto algunas semejanzas entre ellos, lo que aumentó el interés de los químicos por buscar algún tipo de clasificación.
Los pesos atómicos
A principios del siglo XIX, John Dalton (1766-1844) desarrolló una nueva concepción del atomismo, al que llegó gracias a sus estudios meteorológicos y de los gases de la atmósfera. Su principal aportación consistió en la formulación de un "atomismo químico" que permitía integrar la nueva definición de elemento realizada por Antoine Lavoisier (1743-1794) y las leyes ponderales de la química (proporciones definidas, proporciones múltiples, proporciones recíprocas). Dalton empleó los conocimientos sobre las proporciones en las que reaccionaban las sustancias de su época y realizó algunas suposiciones sobre el modo cómo se combinaban los átomos de las mismas. Estableció como unidad de referencia la masa de un átomo de hidrógeno (aunque se sugirieron otros en esos años) y refirió el resto de los valores a esta unidad, por lo que pudo construir un sistema de masas atómicas relativas. Por ejemplo, en el caso del oxígeno, Dalton partió de la suposición de que el agua era un compuesto binario, formado por un átomo de hidrógeno y otro de oxígeno. No tenía ningún modo de comprobar este punto, por lo que tuvo que aceptar esta posibilidad como una hipótesis a priori. Dalton conocía que 1 parte de hidrógeno se combinaba con 7 partes (8 afirmaríamos en la actualidad) de oxígeno para producir agua. Por lo tanto, si la combinación se producía átomo a átomo, es decir, un átomo de hidrógeno se combinaba con un átomo de wolframio, la relación entre las masas de estos átomos debía ser 1:7 (o 1:8 se calcularía en la actualidad). El resultado fue la primera tabla de masas atómicas relativas (o pesos atómicos como los llamaba Dalton) que fue posteriormente modificada y desarrollada en los años posteriores. Las incertidumbres antes mencionadas dieron lugar a toda una serie de polémicas y disparidades respecto a las fórmulas y los pesos atómicos que sólo comenzarían a superarse, aunque no totalmente, con el congreso de Karlsruhe en 1860.
Metales, no metales y metaloides o metales de transición
La primera clasificación de elementos conocida fue propuesta por Antoine Lavoisier, quien propuso que los elementos se clasificaran en metales, no metales y metaloides o metales de transición. Aunque muy práctico y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias en las propiedades físicas como químicas. ana valeria estubieron aqui
Triadas de Döbereiner
Uno de los primeros intentos para agrupar los elementos de propiedades análogas y relacionarlo con los pesos atómicos se debe al químico alemán Johann Wolfgang Döbereiner(1780-1849) quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último. Posteriormente (1827) señaló la existencia de otros grupos de tres elementos en los que se daba la misma relación (cloro, bromo y yodo; azufre, selenio y telurio; litio, sodio y potasio).
| Litio | LiCl LiOH |
Calcio | CaCl2 CaSO4 |
Azufre | H2S SO2 | ||||||
| Sodio | NaCl NaOH |
Estroncio | SrCl2 SrSO4 |
Selenio | H2Se SeO2 | ||||||
| Potasio | KCl KOH |
Bario | BaCl2 BaSO4 |
Telurio | H2Te TeO2 |
A estos grupos de tres elementos se les denominó triadas y hacia 1850 ya se habían encontrado unas 20, lo que indicaba una cierta regularidad entre los elementos químicos.
Döbereiner intentó relacionar las propiedades químicas de estos elementos (y de sus compuestos) con los pesos atómicos, observando una gran analogía entre ellos, y una variación gradual del primero al último.
En su clasificación de las triadas (agrupación de tres elementos) Döbereiner explicaba que el peso atómico promedio de los pesos de los elementos extremos, es parecido al peso atómico del elemento de en medio. Por ejemplo, para la triada Cloro, Bromo, Yodo los pesos atómicos son respectivamente 36, 80 y 127; si sumamos 36 + 127 y dividimos entre dos, obtenemos 81, que es aproximadamente 80 y si le damos un vistazo a nuestra tabla periódica el elemento con el peso atómico aproximado a 80 es el bromo lo cual hace que concuerde un aparente ordenamiento de triadas.
Chancourtois
En 1864, Chancourtois construyó una hélice de papel, en la que se estaban ordenados por pesos atómicos (masa atómica) los elementos conocidos, arrollada sobre un cilindro vertical. Se encontraba que los puntos correspondientes estaban separados unas 16 unidades. Los elementos similares estaban prácticamente sobre la misma generatriz, lo que indicaba una cierta periodicidad, pero su diagrama pareció muy complicado y recibió poca atención.
Ley de las octavas de Newlands
En 1864, el químico inglés John Alexander Reina Newlands comunicó al Real Colegio de Química su observación de que al ordenar los elementos en orden creciente de sus pesos atómicos (prescindiendo del hidrógeno), el octavo elemento a partir de cualquier otro tenía unas propiedades muy similares al primero. En esta época, los llamados gases nobles no habían sido aún descubiertos.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Li 6,9 Na 23,0 K 39,0 |
Be 9,0 Mg 24,3 Ca 40,0 |
B 10,8 Al 27,0 |
C 12,0 Si 28,1 |
N 14,0 P 31,0 |
O 16,0 S 32,1 |
F 19,0 Cl 35,5 |
Esta ley mostraba una cierta ordenación de los elementos en familias (grupos), con propiedades muy parecidas entre sí y en Periodos, formados por ocho elementos cuyas propiedades iban variando progresivamente.
El nombre de octavas se basa en la intención de Newlands de relacionar estas propiedades con la que existe en la escala de las notas musicales, por lo que dio a su descubrimiento el nombre de ley de las octavas.
Como a partir del calcio dejaba de cumplirse esta regla, esta ordenación no fue apreciada por la comunidad científica que lo menospreció y ridiculizó, hasta que 23 años más tarde fue reconocido por la Royal Society, que concedió a Newlands su más alta condecoración, la medalla Davy.
Tabla periódica de Mendeleiev
En 1869, el ruso Dimitri Mendeleiev publica su primera Tabla Periódica en Alemania. Un año depués lo hace Lothar Meyer, que basó su clasificación periódica en la periodicidad de los volúmenes atómicos en función de la masa atómica de los elementos.
Por ésta fecha ya eran conocidos 63 elementos de los 90 que existen en la naturaleza. La clasificación la llevaron a cabo los dos químicos de acuerdo con los criterios siguientes:
- Colocaron los elementos por orden creciente de sus masas atómicas.
- Situaron en el mismo grupo elementos que tenían propiedades comunes como la valencia.
La primera clasificación periódica de Mendeleiev no tuvo buena acogida al principio. Después de varias modificaciones publicó en el año 1872 una nueva Tabla Periódica constituida por ocho columnas desdobladas en dos grupos cada una, que al cabo de los años se llamaron familia A y B.
En su nueva tabla consigna las fórmulas generales de los hidruros y óxidos de cada grupo y por tanto, implícitamente, las valencias de esos elementos.
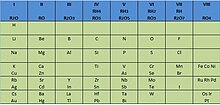
Esta tabla fue completada a finales del siglo XIX con un grupo más, el grupo cero, constituido por los gas noble descubiertos durante esos años en el aire. El químico ruso no aceptó en principio tal descubrimiento, ya que esos elementos no tenían cabida en su tabla. Pero cuando, debido a su inactividad química (valencia cero), se les asignó el grupo cero, la Tabla Periódica quedó más completa.
El gran mérito de Mendeleiev consistió en pronosticar la existencia de elementos. Dejó casillas vacías para situar en ellas los elementos cuyo descubrimiento se realizaría años después. Incluso pronosticó las propiedades de algunos de ellos: el galio (Ga), al que llamó eka-aluminio por estar situado debajo del aluminio; el germanio (Ge), al que llamó eka-sicilio; el escandio (Sc); y el tecnecio (Tc), que sería el primer elemento artificial obtenido en el laboratorio, por síntesis química, en 1937.
La noción de número atómico y la mecánica cuántica
La tabla periódica de Mendeléiev presentaba ciertas irregularidades y problemas. En las décadas posteriores tuvo que integrar los descubrimientos de los gases nobles, las "tierras raras" y los elementos radioactivos. Otro problema adicional eran las irregularidades que existían para compaginar el criterio de ordenación por peso atómico creciente y la agrupación por familias con propiedades químicas comunes. Ejemplos de esta dificultad se encuentran en las parejas telurio-yodo, argon-potasio y cobalto-niquel, en las que se hace necesario alterar el criterio de pesos atómicos crecientes en favor de la agrupación en familias con propiedades químicas semejantes. Durante algún tiempo, esta cuestión no pudo resolverse satisfactoriamente hasta que Henry Moseley (1867-1919) realizó un estudio sobre los espectros de rayos X en 1913. Moseley comprobó que al representar la raíz cuadrada de la frecuencia de la radiación en función del número de orden en el sistema periódico se obtenía una recta, lo cual permitía pensar que este orden no era casual sino reflejo de alguna propiedad de la estructura atómica. Hoy sabemos que esa propiedad es el número atómico (Z) o número de cargas positivas del núcleo. La explicación que aceptamos actualmente de la "ley periódica" descubierta por los químicos de mediados del siglo pasado surgió tras los desarrollos teóricos producidos en el primer tercio del siglo XX. En el primer tercio del siglo XX se construyó la mecánica cuántica. Gracias a estas investigaciones y a los desarrollos posteriores, hoy se acepta que la ordenación de los elementos en el sistema periódico está relacionada con la estructura electrónica de los átomos de los diversos elementos, a partir de la cual se pueden predecir sus diferentes propiedades químicas.
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| I | II | III | IV | V | VI | VII | VIII | |||||||||||
| Periodo | ||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
| 6 | 55 Cs |
56 Ba |
* | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 7 | 87 Fr |
88 Ra |
** | 104 Rf |
105 Db |
106 Sg |
| Lantánidos | * | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
|
| Actínidos | ** | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
| Alcalinos | Alcalinotérreos | Lantánidos | Actínidos | Metales de transición |
| Metales del bloque p | Metaloides | No metales | Halógenos | Gases nobles |
Clasificación
Grupos
A las columnas verticales de la tabla periódica se les conoce como grupos. Todos los elementos que pertenecen a un grupo tienen la misma valencia, y por ello, tienen características o propiedades similares entre sí. Por ejemplo, los elementos en el grupo IA tienen valencia de 1 (un electrón en su último nivel de energía) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son todos extremadamente no reactivos.
Numerados de izquierda a derecha, los grupos de la tabla periódica son:
- Grupo 1 (IA): los metales alcalinos
- Grupo 2 (IIA): los metales alcalinotérreos
- Grupo 3 (IIIB): Familia del Escandio
- Grupo 4 (IVB) : Familia del titanio.
- Grupo 5 (VB) : Familia del vanadio
- Grupo VIB: Familia del Cromo.
- Grupo VIIB: Familia del Manganeso.
- Grupo VIIB: Familia del hierro
- Grupo IB : Familia del Cobre
- GrupoIIB: Familia del Zinc.
- Grupo 13 (IIIA): los térreos
- Grupo 14 (IVA): los carbonoideos
- Grupo 15 (VA): los nitrogenoideos
- Grupo 16 (VIA): los calcógenos o anfígenos
- Grupo 17 (VIIA): los halógenos
- Grupo 18 (VIIIA): los gases nobles
Períodos
Las filas horizontales de la tabla periódica son llamadas períodos. Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica. El primer período solo tiene dos miembros: hidrógeno y helio; ambos tienen sólo el orbital 1s.
La tabla periódica consta de 7 períodos:
La tabla también esta dividida en cuatro grupos, s, p, d, f, que están ubicados en el orden sdp, de izquierda a derecha, y f lantánidos y actínidos. Esto depende de la letra en terminación de los elementos de este grupo, según el principio de Aufbau.
Bloques
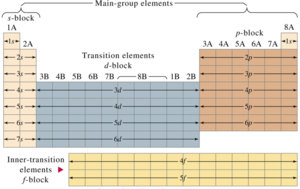
La tabla periódica se puede tambien dividir en bloques de elementos según el orbital que estén ocupando los electrones más externos.
Los bloques se llaman según la letra que hace referencia al orbital más externo: s, p, d y f. Podría haber más elementos que llenarían otros orbitales, pero no se han sintetizado o descubierto; en este caso se continúa con el orden alfabético para nombrarlos.
Otras formas de representar la tabla periódica
Varias formas (en espiral, en 3D) [1];
1951. Forma en espiral, [2] ;
1960. Forma en espiral, profesor Theodor Benfey[3];
1995. Forma en espiral-fractal, Melinda E Green *[4];
2004, noviembre. Forma en espiral sobre dibujo de galaxia, Philip J. Stewart [5];
Véase también
- Tabla periódica de los elementos ampliada
- Tabla periódica de los elementos curvada
- Lista de elementos por símbolo
- Listado alfabético de elementos químicos
- Dmitri Mendeléyev, el creador de la tabla periódica.
Bibliografía
- AGAFOSHIN, N.P., Ley periódica y sistema periódico de los elementos de Mendeleiev Madrid Editorial Reverté, 1977, 200 p.
- BENSAUDE-VICENT, B. D. Mendeleiev: El sistema periódico de los elementos, Mundo científico, (1984), 42, 184-189.
- MUÑOZ, R. y BERTOMEU SANCHEZ, J.R.La historia de la ciencia en los libros de texto: la(s) hipótesis de Avogadro, Enseñanza de las ciencias (2003), 21 (1), 147-161. Texto completo
- ROCKE, A.J. 1984 Chemical Atomism in the Nineteenth Century. From Dalton to Cannizzaro. Ohio. Ohio State University Press, 1984.
- ROMÁN POLO, P: El profeta del orden químico: Mendeléiev. Madrid: Nivola, 2002, 190 p
- SCERRI, E.R., "Evolución del sistema periódico" Investigación y Ciencia (1998), 266, p. 54-59.
- SCERRI, E.R., The Periodic Table: Its Story and Its Significance, Oxford, University Pres, 2006, 400 p.
- STRATHERN, PAUL (2000) , El sueño de Mendeléiev, de la alquimia a la química, Madrid : Siglo XXI de España Editores, 288 p.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Tabla periódica de los elementos.
Wikimedia Commons alberga una galería multimedia sobre Tabla periódica de los elementos. Wikcionario tiene definiciones y otra información sobre tabla periódica de los elementos.
Wikcionario tiene definiciones y otra información sobre tabla periódica de los elementos.- TablaPeriodicaIMPRIMIBLE Contiene una tabla periódica para imprimir en A3 o A4, con peso atómico, temperaturas de fusión y ebullición, valencias, densidad y estructura atómica, especial para ser usada en clases de química de enseñanza secundaria.
- Tabla periódica Plantilla en blanco de la tabla periódica, tablas periódicas con valencias.
- Los elementos químicos
- Exámen sobre la tabla periódica
- Tabla periódica estilo "calendario maya", organizada de acuerdo a los orbitales atómicos (configuración electrónica); en inglés.
- Tabla Periódica de los elementos en LENNTECH Información general sobre los elementos químicos en español.
- Tabla periódica virtual con buscador de elementos
- Flash Periodic Table Un flash interactivo basado en la tabla periódica.
- Tabla periódica dinámica o Tabla periódica dinámica simplificada
- Ejemplos de elementos Imágenes de cada elemento.
- La Galaxia Química, en la Wikipedia en Inglés
- El arreglo de elementos químicos periódicos
