Síndrome de Birt-Hogg-Dubé
| Síndrome de Birt-Hogg-Dubé | ||
|---|---|---|
 Los fibrofoliculomas característicos del síndrome de Birt-Hogg-Dubé vistos en la cara de una persona. | ||
| Especialidad | Medicina genética | |
El síndrome de Birt-Hogg-Dubé (BHD), también síndrome de Hornstein-Birt-Hogg-Dubé, síndrome de Hornstein-Knickenberg y fibrofoliculomas con tricodiscomas y acrocordones[1] es un trastorno genético autosómico dominante, de aparición en la edad adulta, causado por una mutación en el gen de la foliculina (FLCN). Puede causar predisposición al cáncer de riñón, quistes renales y pulmonares, y tumores no cancerosos de los folículos pilosos, denominados fibrofoliculomas. Los síntomas observados en cada familia son únicos y pueden incluir cualquier combinación de los tres síntomas. Los fibrofoliculomas son la manifestación más común, se encuentran en la cara y en la parte superior del tronco en más del 80% de las personas con BDH mayores de 40 años. Los quistes pulmonares son igualmente frecuentes (84%) y el 24% de las personas con BDH acaban sufriendo un colapso pulmonar (neumotórax espontáneo). Los tumores renales, tanto cancerosos como benignos, aparecen en el 14-34% de las personas con BHD; los cánceres renales asociados suelen ser tumores híbridos poco frecuentes.
Cualquiera de estas afecciones que se dé en una familia puede indicar un diagnóstico de síndrome de Birt-Hogg-Dubé, aunque sólo se confirma mediante una prueba genética para detectar una mutación en el gen FLCN, que codifica la proteína foliculina. Aunque su función no se conoce del todo, parece ser un gen supresor de tumores que restringe el crecimiento y la división celular. Se han encontrado versiones del FLCN en otros animales, como moscas de la fruta, pastores alemanes, ratas y ratones. La enfermedad se descubrió en 1977, pero la conexión con el FLCN no se dilucidó hasta 2002, después de que el cáncer de riñón, el colapso pulmonar y los quistes pulmonares se relacionaran definitivamente con la BHD.
El síndrome de Birt-Hogg-Dubé puede manifestarse de forma similar a otras enfermedades, que deben descartarse al hacer el diagnóstico. Entre ellas están la esclerosis tuberosa, que provoca lesiones cutáneas similares a fibrofoliculomas, y la enfermedad de Von Hippel-Lindau, que causa cánceres renales hereditarios. Una vez diagnosticada, el BHD se trata de forma preventiva, controlando los riñones y los pulmones mediante pruebas de imagen. Los fibrofoliculomas pueden extirparse quirúrgicamente y el neumotórax y el cáncer de riñón se tratan de acuerdo con el tratamiento habitual. También deben tenerse en cuenta los exámenes dermatológicos, las ecografías de cuello y las colonoscopias.[1]
Señales y síntomas
[editar]Piel
[editar]El síndrome de Birt-Hogg-Dubé afecta a la piel y aumenta el riesgo de tumores en los riñones y los pulmones. La enfermedad se caracteriza por la
 Individuo con síndrome de Birt-Hogg-Dubé, mostrando los fibrofoliculomas faciales característicos. | ||
 |
aparición de múltiples tumores no cancerosos en forma de cúpula de los folículos pilosos (fibrofoliculomas), sobre todo en la cara, el cuello y, más raramente, en la parte superior del tórax.[2] Los fibrofoliculomas suelen tener un color blanco opaco[3] o un tono amarillento[4] y una textura cerosa y lisa.[3] Los tumores siempre se encuentran en la nariz y alrededor de ella, y en la oreja externa y detrás de ella. Suelen aparecer por primera vez entre los 20 y los 30 años, y se encuentran en más del 80% de las personas con el síndrome por encima de los 40.[2] Los tumores se hacen más grandes y más numerosos con el tiempo.[5] Los tumores difieren entre individuos; pueden aparecer fusionados en placas, tener un aspecto similar a un comedón con un tapón de queratina o incluir quistes epidermoides. Un gran número de tumores en la cara puede asociarse a hiperseborrea (producción anormalmente elevada de sebo).[2] La presencia de fibrofoliculomas en la cara de una persona puede causar una importante angustia psicológica.[6]
Otros tumores pueden ser tricodiscomas (tumores del disco piloso, que pueden ser idénticos a los fibrofoliculomas), angiofibromas y fibromas perifoliculares.[5] Sin embargo, los angiofibromas son más frecuentes en la esclerosis tuberosa.[6] Junto con los tumores, se observan otras afecciones cutáneas en las personas con síndrome de Birt-Hogg-Dubé. Alrededor del 40% de las personas o familias con la enfermedad presentan pápulas en la boca, que pueden localizarse en las mejillas (mucosa bucal), la lengua, las encías o los labios. Pueden ser blancas o del color de la mucosa, son discretas, pequeñas y blandas, y están formadas por tejido fibroso recubierto de epitelio engrosado.[2] En algunas familias también se encuentran colagenomas cutáneos.[5] Muchas personas con BHD tienen lesiones cutáneas que parecen acrocordones (papilomas cutáneos), pero que en realidad pueden ser fibrofoliculomas. Estas lesiones suelen encontrarse en la axila, en los párpados y en los pliegues de la piel.[3] No todas las personas desarrollan tumores faciales; algunas familias con la mutación que causa la BHD sólo desarrollan tumores renales o neumotórax espontáneo.[5]
Riñones
[editar]
Las personas mayores de 20 años con DHB tienen un mayor riesgo de desarrollar tumores renales de crecimiento lento (carcinoma renal cromófobo y oncocitoma renal), quistes renales y, posiblemente, tumores en otros órganos y tejidos.[2] Estos tumores suelen aparecer en ambos riñones y en múltiples localizaciones en cada riñón.[2] El número medio de tumores renales encontrados en una persona con DHB es de 5,3, aunque se han encontrado hasta 28 tumores.[7] El oncocitoma híbrido/carcinoma cromófobo, presente en el 50% de los casos,[8] es el cáncer más frecuente, seguido del carcinoma renal cromófobo, el carcinoma renal de células claras, el oncocitoma renal y el carcinoma papilar de células renales.[5][8] Las personas mayores de 40 años y los hombres son más propensos a desarrollar tumores renales, que se diagnostican a una edad media de 48.[2][5] El cáncer de riñón asociado a la BHD se ha diagnosticado en personas de tan solo 20 años.[6]
En general, las personas con este síndrome tienen un riesgo aproximadamente siete veces mayor de padecer cáncer de riñón que la población no afectada. Las estimaciones de la incidencia entre las personas con la enfermedad oscilan entre el 14 y el 34%.[2][8] En raras ocasiones, se asocia con el carcinoma renal de células claras y el carcinoma papilar de células renales.[5] Si se desarrolla en alguien con BDH, el carcinoma de células renales se produce más tarde en la vida y tiene un mal pronóstico.[9] Aunque los tipos de tumores típicamente asociados con BDH se consideran menos agresivos, se han observado casos de cáncer de riñón avanzado o metastásico en personas con el síndrome. Tanto los tumores benignos como los cancerosos pueden reducir la función renal con el tiempo a medida que aumentan de tamaño.[8]
Pulmones
[editar]Junto con los fibrofoliculomas y los tumores renales, los individuos afectados desarrollan con frecuencia quistes (ampollas o bullas) en la base subpleural del pulmón o en el espacio intraparenquimatoso que pueden romperse y causar una acumulación anormal de aire en la cavidad torácica (neumotórax), que podría provocar el colapso de un pulmón.[5][10] Los quistes no causan otros síntomas[5] y la función pulmonar suele ser normal.[6] Más del 83% de las personas con DHB tienen quistes, pero el síndrome no causa afecciones como la enfermedad pulmonar obstructiva crónica progresiva o la insuficiencia respiratoria generalizada,[2] aunque sí enfisema.[4] El neumotórax espontáneo, a veces recurrente,[5] se produce con mucha más frecuencia y a una edad más temprana con el DHB que en la población no afectada. Alrededor del 24% de las personas con la enfermedad tienen al menos un neumotórax espontáneo, 30 veces más que las personas no afectadas. Aunque el neumotórax causado por la EHB suele producirse en la mediana edad, con una edad media de 38 años, el 17% de las personas afectadas sufren un neumotórax espontáneo antes de cumplir los 40.[2] Se han observado neumotórax en personas de tan sólo 7 y 16 años.[6] Algunas familias tienen una forma de EHB que sólo afecta a los pulmones.[11]
Otros órganos
[editar]Los nódulos tiroideos[2] se han asociado con el fenotipo Birt-Hogg-Dubé, presente en el 65% de los individuos y en el 90% de las familias con el síndrome.[2] Sin embargo, no se ha corroborado una conexión entre el síndrome BHD y el cáncer de tiroides.[3] Se ha informado de otras afecciones asociadas, pero puede que no estén causadas por la mutación en FLCN o que no estén relacionadas en absoluto. Estas incluyen bocio multinodular, carcinoma medular de tiroides, oncocitoma parotídeo, poliposis colónica,[12] nevus del tejido conectivo, lipomas, angiolipomas, adenomas paratiroideos, coriorretinopatía moteada, neurotekeoma, meningiomas, angiofibromas de la cara,[3] tricoblastomas, mucinosis cutánea focal, leiomioma cutáneo, cáncer de mama, cáncer de amígdalas, cáncer colorrectal, sarcoma de pierna, cáncer de pulmón, melanoma, dermatofibrosarcoma protuberans, carcinoma basocelular, leiomiosarcoma cutáneo y carcinoma de células escamosas.[6]
Fisiopatología
[editar]Genética
[editar]
En 2002 se notificó por primera vez una asociación con el gen de la foliculina (FLCN).[13] Este gen de 14 exones está situado en el brazo corto del cromosoma 17 (17p11.2) y tiene una región rica en citosina en el exón 11 particularmente susceptible de mutación.[2][5] La mutación más común en esta región es la inserción o deleción de un residuo de citosina, que se encuentra en el 53% de las familias afectadas por el síndrome BHD. No se han encontrado diferencias significativas en los síntomas experimentados por las familias con una inserción en esa localización en comparación con las que tienen una deleción, pero las mutaciones en FLCN asociadas al síndrome de BHD son heterogéneas, y a menudo son mutaciones sin sentido o mutaciones por desplazamiento del marco de lectura (frameshift) que causan un truncamiento temprano del producto proteico en el extremo carboxi.[3][14] Muy raramente se observan mutaciones con cambio de sentido (missense).[6] Las mutaciones en el gen FLCN que causan el síndrome de Birt-Hogg-Dubé son mutaciones de la línea germinal, lo que significa que se producen en todas las células del cuerpo y pueden transmitirse a las generaciones futuras.[15] Estas mutaciones suelen transmitirse de una generación a otra de forma autosómica dominante, pero pueden producirse como una mutación nueva en un individuo sin antecedentes familiares previos (una mutación de novo).[16] Los hijos de un progenitor afectado tienen cada uno un 50% de probabilidades de padecer la enfermedad. La BHD tiene una penetrancia muy alta.[5] No se ha descubierto una correlación entre los distintos genotipos y fenotipos de FLCN.[16]
Función
[editar]El FLCN crea una proteína, la foliculina, que tiene dos isoformas.[3] Parece actuar como supresor de tumores y se expresa fuertemente en la piel, las nefronas distales y los neumocitos de tipo I.[5] También se ha encontrado en la glándula parótida, el cerebro, la mama, el páncreas, la próstata y los ovarios.[4][8] Los supresores de tumores normalmente evitan que las células crezcan y se dividan demasiado rápido o de forma incontrolada. Las mutaciones en el gen FLCN pueden interferir con la capacidad de la folliculina para frenar el crecimiento y la división celular, lo que conduce a la formación de tumores cancerosos y no cancerosos. Estudios recientes sugieren que la foliculina cumple esta función a través de su implicación con el metabolismo celular, posiblemente a través de la modulación de la vía mTOR y/o la fosforilación oxidativa en las mitocondrias.[17] La foliculina interactúa con FNIP1 y FNIP2 (proteína que interactúa con FLCN) para formar un complejo con la proteína quinasa activada por AMP.[4][8] La participación de la foliculina en la vía mTOR puede explicar la similitud del fenotipo entre el síndrome BHD, el síndrome de Cowden, la esclerosis tuberosa y el síndrome de Peutz-Jeghers.[3]
La mayoría de las mutaciones causantes de cáncer hacen que la proteína se trunque en el extremo carboxi.[8] El extremo C-terminal de la foliculina ha demostrado ser el dominio a través del cual interactúa con FNIP1, y por lo tanto posiblemente con la vía mTOR.[14] FLCN está altamente conservada en vertebrados-es muy similar entre muchas especies de vertebrados.[5] El aminoácido 508, normalmente lisina, está afectado por una mutación sin sentido en algunas personas con BHD. La lisina en esta posición está conservada entre los ortólogos invertebrados y vertebrados de la foliculina, lo que indica que es importante para la función de la proteína.[14]
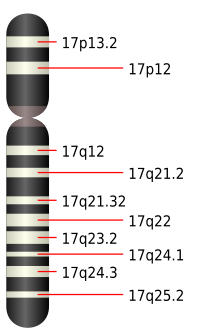
Las personas con DHB nacen con una copia mutada del gen FLCN en cada célula.[6] La haploinsuficiencia -sólo tener una copia funcional del gen FLCN- es suficiente para causar los fibrofoliculomas y los quistes pulmonares, aunque una copia del gen es suficiente para mantener las células renales bajo control.[1] Durante la vida de una persona, mutaciones aleatorias pueden inactivar la copia normal del gen en un subconjunto de células. Cuando esto ocurre, el resultado es que estas células no tienen copias funcionales del gen FLCN, lo que permite que las células crezcan sin control. Esta pérdida de heterocigosidad es un mecanismo común en el cáncer, y se detecta con frecuencia en los cánceres renales asociados a la BHD. Los defectos genéticos moleculares en los tumores renales de las personas con BHD son diferentes de otros dos tumores renales similares, el carcinoma cromófobo de células renales y el oncocitoma renal. La tumorigénesis asociada a la BHD difiere entre el riñón, donde la pérdida de heterocigosidad de FLCN es responsable de los cánceres, y la piel, donde FLCN se expresa fuertemente en los heterocigotos.[6] Se ha descubierto que FLCN se sobreexpresa en el tejido del fibrofoliculoma y que tiene niveles muy bajos de expresión en los riñones afectados.[4] Además, se ha demostrado que la vía mTOR se activa en el tejido tumoral tanto de humanos como de ratones.[7]
Se ha demostrado que la cistogénesis renal y la tumorigénesis en la BHD están impulsadas por la activación constitutiva de TFEB.[18]
Diagnóstico
[editar]El BHD puede sugerirse por hallazgos clínicos, pero se diagnostica definitivamente mediante pruebas genéticas moleculares para detectar mutaciones en el gen FLCN. La tríada clínica clásica incluye crecimientos benignos de los folículos pilosos, quistes pulmonares y neumotórax espontáneo, y tumores renales bilaterales multifocales.[5]
Tríada clínica
[editar]Las manifestaciones cutáneas de la BHD se describieron originalmente como fibrofoliculomas (crecimientos anormales de un folículo piloso), tricodiscomas (lesiones hamartomatosas con un folículo piloso en la periferia, a menudo en la cara) y acrocordones (papilomas cutáneos). Las manifestaciones cutáneas se confirman por histología. La mayoría de los individuos (89%) con BHD presentan múltiples quistes en ambos pulmones, y el 24% han tenido uno o más episodios de neumotórax. Los quistes pueden detectarse mediante TC torácica. Los tumores renales pueden manifestarse como múltiples tipos de carcinoma de células renales, pero ciertos subtipos patológicos (incluidos los tumores cromófobo, oncocitoma e híbrido oncocítico) se observan con mayor frecuencia. Aunque el síndrome original se descubrió sobre la base de hallazgos cutáneos, los individuos con BHD pueden manifestar únicamente los hallazgos pulmonares y/o renales, sin ninguna lesión cutánea. Aunque estos signos indican DHB, sólo se confirma con una prueba genética de mutaciones de FLCN.[5]
Pruebas genéticas
[editar]Las mutaciones de FLCN se detectan mediante secuenciación en el 88% de los probandos con este síndrome. Esto significa que algunas personas con el diagnóstico clínico tienen mutaciones que no son detectables por la tecnología actual, o que mutaciones en otro gen actualmente desconocido podrían ser responsables de una minoría de casos. Además, también se analizan las amplificaciones y deleciones en regiones exónicas. Las pruebas genéticas pueden ser útiles para confirmar el diagnóstico clínico y proporcionar un medio para determinar otros individuos de riesgo en una familia, incluso si aún no han desarrollado síntomas de DHB.[5][6]
Diagnóstico diferencial
[editar]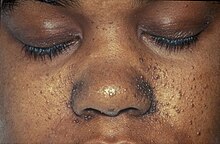
El BHD puede ser difícil de diagnosticar sólo a partir de los síntomas, porque los cánceres renales hereditarios, el neumotórax y los tumores cutáneos aparecen con otros síndromes. Los tumores renales hereditarios bilaterales y multifocales similares a los observados en el BHD pueden aparecer con la enfermedad de von Hippel-Lindau (carcinoma de células renales de células claras), el cáncer renal papilar hereditario (carcinoma de células renales papilares) y el síndrome de leiomiomatosis hereditaria y cáncer de células renales. Se diferencian con el examen de la histología de los tumores.[5]
El neumotórax recurrente hereditario o los quistes pulmonares se asocian al síndrome de Marfan, el síndrome de Ehlers-Danlos, el complejo de esclerosis tuberosa, el déficit de alfa-1-antitripsina y la fibrosis quística. El neumotórax y/o los quistes pulmonares recurrentes no hereditarios pueden aparecer en la histiocitosis de células de Langerhans y la linfangioleiomiomatosis. Estas afecciones se diferencian de la BHD mediante el examen de los antecedentes de la paciente y la realización de una exploración física.[5] En las mujeres en las que se sospecha la enfermedad, puede ser necesario descartar una endometriosis pulmonar o torácica.[9]
Aunque los fibrofoliculomas son exclusivos del BHD, pueden presentar un aspecto ambiguo y deben confirmarse histológicamente. Otras enfermedades pueden imitar las manifestaciones dermatológicas del BHD, como el complejo de esclerosis tuberosa, el síndrome de Cowden, los tricoepiteliomas familiares y la neoplasia endocrina múltiple tipo 1.[5] La esclerosis tuberosa debe distinguirse porque ambos trastornos pueden presentar angiofibromas en la cara, aunque son más frecuentes en la esclerosis tuberosa.[6]
Manejo
[editar]Las distintas manifestaciones del BHD se controlan de diferentes maneras. Los fibrofoliculomas pueden extirparse quirúrgicamente, mediante curetaje, escisión por afeitado, rejuvenecimiento cutáneo o ablación con láser; sin embargo, ésta no es una solución permanente, ya que los tumores suelen reaparecer.[2][5] Examen dermatológico cada 6-12 meses debido al riesgo de melanoma. Debe considerarse la realización de ecografías tiroideas/parotídeas anualmente. Debe considerarse la realización de colonoscopias. Los síntomas renales y pulmonares se tratan de forma preventiva: Se recomienda realizar TC, ecografías o RM de los riñones con regularidad, y se aconseja a los familiares que no fumen.[2] Las RM son el método preferido para la vigilancia de los riñones en personas con BHD porque no conllevan el mismo riesgo de complicaciones por radiación que las TC, y son más sensibles que las ecografías.[6] Los fumadores con Birt-Hogg-Dubé tienen síntomas pulmonares más graves que los no fumadores.[6][19] Aunque a veces está indicada la nefrectomía, los tumores renales en los casos de BHD suelen extirparse sin tomar todo el riñón, en una nefrectomía parcial.[5] Los estudios con ratones knockout han demostrado que la administración de rapamicina puede mitigar los efectos de las mutaciones de FLCN en los riñones y mejorar el pronóstico del cáncer renal debido a la interacción de la foliculina con la vía mTOR.[6]
Epidemiología
[editar]El trastorno se ha descrito en más de 100 familias de todo el mundo,[14] aunque algunas fuentes citan hasta 400 familias,[1] y se hereda con un patrón autosómico dominante. Se considera que está infradiagnosticado[3][6] debido a la variabilidad de su expresión.[20] El patrón de mutaciones y el espectro de síntomas son heterogéneos entre individuos.[14] Se observan fenotipos cutáneos menos graves en mujeres y personas de ambos sexos con un inicio tardío de los síntomas cutáneos.[5]
Registro de pacientes
[editar]Animamos a los pacientes, familiares y cuidadores del Síndrome de Birt-Hogg-Dubé a unirse al Registro de Contactos del Consorcio de Enfermedades Pulmonares Raras de los NIH. Se trata de un sitio protegido que proporciona información actualizada a las personas interesadas en las últimas noticias científicas, ensayos y tratamientos relacionados con las enfermedades pulmonares raras.
Historia
[editar]El síndrome fue bien descrito por primera vez en 1977,[21] por tres médicos canadienses, Arthur R. Birt, Georgina R. Hogg y William J. Dubé. El caso más antiguo de posible BHD en la literatura médica fue publicado por Burnier y Rejsek en 1927,[22] que describieron un caso de fibromas perifoliculares en la cara de una mujer de 56 años. Los tricodiscomas fueron descritos por primera vez en 1974 por H. S. Zackheim y H. Pinkus, pero no se asociaron al BHD hasta Birt, Hogg y Dubé.[3] El primer caso de BHD con síntomas sistémicos fue descrito por Hornstein y Knickenberg en dos hermanos y su padre, todos los cuales presentaban pólipos de colon y los fibrofoliculomas característicos.[23] Aunque los hermanos no presentaban síntomas renales ni pulmonares, su padre tenía quistes en los pulmones y los riñones.[3] El síndrome de Hornstein-Knickenberg es un nombre ahora en desuso para los fibrofoliculomas hereditarios inherentes a la EHB.[5]
Birt, Hogg y Dubé examinaron a una familia con un cáncer de tiroides hereditario y descubrieron que muchos de sus miembros tenían fibrofoliculomas, tricodiscomas y acrocordones, que pasaron a definirse como los síntomas clásicos de la enfermedad epónima. El primer caso de neumotórax espontáneo asociado al BHD se descubrió en 1986;[3] el primer caso de cáncer renal se produjo en 1993,[6] y la presencia de quistes pulmonares en personas con BHD se confirmó en 1999.[4] Antes se pensaba que las personas con DHB tenían un mayor riesgo de padecer pólipos y neoplasias colorrectales, pero esto se ha refutado.[2] La Fundación DHB apoya la investigación sobre el síndrome y celebra simposios periódicos sobre DHB y trastornos relacionados para investigadores, médicos y familiares.[24][25][26]
Otros animales
[editar]Se han encontrado genes relacionados con la FLCN y enfermedades similares a la BDH en perros, moscas de la fruta, ratas y ratones. En los perros pastor alemán, las mutaciones sin sentido en el ortólogo canino de FLCN causan un fenotipo similar al del BHD humana: cánceres de riñón (en este caso, cistoadenocarcinoma renal multifocal) y tumores de piel (dermatofibrosis nodular). Presentaban un patrón de tumorigénesis similar al del BHD humana en el sentido de que las lesiones cutáneas eran heterocigotas para la mutación FLCN, y los tumores renales probablemente estaban causados por pérdida de heterocigosidad.[6] Las hembras de pastor alemán con una mutación FLCN también son propensas a padecer leiomiomas uterinos.[3]
Se ha descubierto un homólogo de FLCN denominado DBHD en la mosca común de la fruta, Drosophila melanogaster.[3][27] La disminución de la expresión del DBHD provoca la pérdida de células madre de la línea germinal masculina (CGM), lo que sugiere que el DBHD es necesario para el mantenimiento de las CGM masculinas en los testículos de la mosca.[28] Además, el DBHD regula el mantenimiento de las CGM de forma descendente o paralela a las vías de transducción de señales JAK/STAT y Dpp, lo que sugiere que el BHD regula la tumorigénesis mediante el control de las células madre en humanos {Singh et al. 2006}.[29]
Investigadores japoneses han desarrollado una línea de ratas con cáncer de riñón hereditario. Presentan una mutación en el homólogo de FLCN que produce una proteína truncada, aunque no desarrollan los síntomas cutáneos o pulmonares observados en humanos. Los heterocigotos presentan anomalías renales que se manifiestan muy pronto en la vida y se convierten en tumores de células claras e híbridos, lo que acorta considerablemente la esperanza de vida de los animales; también son propensos a la hiperplasia endometrial y de glándulas salivales de células claras, así como a la rabdomiólisis. Los homocigotos no sobreviven hasta el nacimiento.[3] Cuando se añadió un gen FLCN de tipo salvaje, se rescató el fenotipo.[6]
Se han creado ratones knockout para una mutación de BHD causante de cáncer de riñón; los heterocigotos desarrollan quistes renales y tumores que conducen a insuficiencia renal a las tres semanas de nacer. En estos ratones, la vía mTOR se activó de forma inapropiada, lo que indica que el homólogo de ratón de FLCN desempeña un papel regulador en esta vía. La rapamicina rescató parcialmente el fenotipo mediante la regulación de mTOR. Los homocigotos mueren en el útero.[3]
Referencias
[editar]- ↑ a b c d «Birt-Hogg-Dubé syndrome: MedlinePlus Genetics». medlineplus.gov (en inglés). Consultado el 27 de septiembre de 2024.
- ↑ a b c d e f g h i j k l m n ñ o James, William D.; Berger, Timothy; Elston, Dirk (2011). «Andrew's Diseases of the Skin: Clinical Dermatology (11th ed.)». Elsevier Health Sciences. ISBN 978-1-4377-3619-9.
- ↑ a b c d e f g h i j k l m n ñ o Reese, Erin; Sluzevich, Jason; Kluijt, Irma; Teertstra, H. Jelle; De Jong, Daphne; Horenblas, Simon; Ryu, Jay (2009). Riegert-Johnson, Douglas L., ed. Birt-Hogg-Dubé Syndrome. National Center for Biotechnology Information (US). Consultado el 27 de septiembre de 2024.
- ↑ a b c d e f Palmirotta, Raffaele; Savonarola, Annalisa; Ludovici, Giorgia; Donati, Pietro; Cavaliere, Francesco; Marchis, Maria Laura De; Ferroni, Patrizia; Guadagni, Fiorella (1 de marzo de 2010). «Association Between Birt Hogg Dubé Syndrome and Cancer Predisposition». Anticancer Research (en inglés) 30 (3): 751-757. ISSN 0250-7005. PMID 20392993. Consultado el 27 de septiembre de 2024.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w Sattler, Elke C.; Steinlein, Ortrud K. (1993). Adam, Margaret P., ed. Birt-Hogg-Dubé Syndrome. University of Washington, Seattle. Consultado el 27 de septiembre de 2024.
- ↑ a b c d e f g h i j k l m n ñ o p q Menko, Fred H; Van Steensel, Maurice AM; Giraud, Sophie; Friis-Hansen, Lennart; Richard, Stéphane; Ungari, Silvana; Nordenskjöld, Magnus; Hansen, Thomas vO; Solly, John; Maher, Eamonn R; European Bhd, Consortium (2009). «"Birt-Hogg-Dubé syndrome: Diagnosis and management"». The Lancet Oncology,. PMID 19959076. doi:10.1016/S1470-2045(09)70188-3.
- ↑ a b Chan-Smutko, Gayun (2012). «Genetic Testing by Cancer Site». The Cancer Journal. PMID 22846736. doi:10.1097/PPO.0b013e31826246ac.
- ↑ a b c d e f g Coleman, Jonathan A; Russo, Paul (2009). «"Hereditary and familial kidney cancer"». Current Opinion in Urology. PMID 19584731. doi:10.1097/MOU.0b013e32832f0d40.
- ↑ a b Furuya, M.; Nakatani, Y. (2012). «"Birt-Hogg-Dube syndrome: Clinicopathological features of the lung"». Journal of Clinical Pathology. PMID 23223565. doi:10.1136/jclinpath-2012-201200.
- ↑ Grant, L.A.; Babar, J.; Griffin, N. (2009). «"Cysts, cavities, and honeycombing in multisystem disorders: Differential diagnosis and findings on thin-section CT"». Clinical Radiology. PMID 19264190. doi:10.1016/j.crad.2008.09.015.
- ↑ Devine, Megan Stuebner; Garcia, Christine Kim (2012). «"Genetic Interstitial Lung Disease"». Clinics in Chest Medicine. PMID 22365249. doi:10.1016/j.ccm.2011.11.001.
- ↑ Coleman, Jonathan A; Russo, Paul (2009). «"Hereditary and familial kidney cancer"». Current Opinion in Urology. PMID 19584731. doi:10.1097/MOU.0b013e32832f0d40.
- ↑ Nickerson, Michael L.; Warren, Michelle B.; Toro, Jorge R.; Matrosova, Vera; Glenn, Gladys; Turner, Maria L.; Duray, Paul; Merino, Maria; Choyke, Peter; et al. (2002). «Mutations in a novel gene lead to kidney tumors, lung wall defects, and benign tumors of the hair follicle in patients with the Birt-Hogg-Dubé syndrome». Cancer Cell,. PMID 12204536. doi:10.1016/S1535-6108(02)00104-6.
- ↑ a b c d e Toro, J R; Wei, M-H; Glenn, G M; Weinreich, M; Toure, O; Vocke, C; Turner, M; Choyke, P; Merino, M J; et al. (2008). «"BHD mutations, clinical and molecular genetic investigations of Birt-Hogg-Dube syndrome: A new series of 50 families and a review of published reports"». Journal of Medical Genetics. PMID 18234728. doi:10.1136/jmg.2007.054304.
- ↑ «Diseases». www.rarediseasesnetwork.org. Consultado el 28 de septiembre de 2024.
- ↑ a b Maher, Eamonn R. (2011). «"Genetics of Familial Renal Cancers"». Nephron Experimental Nephrology. PMID 21071978. doi:10.1159/000320892.
- ↑ Sudarshan, Sunil; Karam, Jose A.; Brugarolas, James; Thompson, R. Houston; Uzzo, Robert; Rini, Brian; Margulis, Vitaly; Patard, Jean-Jacques; Escudier, Bernard; Linehan, W. Marston (2013). «"Metabolism of Kidney Cancer: From the Lab to Clinical Practice"». European Urology. PMID 23063455. doi:10.1016/j.eururo.2012.09.054.
- ↑ Napolitano, Gennaro; Di Malta, Chiara; Esposito, Alessandra; de Araujo, Mariana E.G.; Pece, Salvatore; Bertalot, Giovanni; Matarese, Maria; Benedetti, Valerio et al. (1 de septiembre de 2020). «A substrate-specific mTORC1 pathway underlies Birt-Hogg-Dubé syndrome». Nature 585 (7826): 597-602. ISSN 0028-0836. PMC 7610377. PMID 32612235. doi:10.1038/s41586-020-2444-0. Consultado el 28 de septiembre de 2024.
- ↑ Ayo, Dereje S.; Aughenbaugh, GL; Yi, ES; Hand, JL; Ryu, JH (2007). «Cystic Lung Disease in Birt-Hogg-Dubé Syndrome». Chest. PMID 17505035. doi:10.1378/chest.07-0042.
- ↑ Verine, Jérôme; Pluvinage, Amélie; Bousquet, Guilhem; Lehmann-Che, Jacqueline; De Bazelaire, Cédric; Soufir, Nadem; Mongiat-Artus, Pierre (2010). «Hereditary Renal Cancer Syndromes: An Update of a Systematic Review». European Urology. PMID 20817385. doi:10.1016/j.eururo.2010.08.031.
- ↑ Birt, A. R.; Hogg, GR; Dubé, WJ (1977). «Hereditary multiple fibrofolliculomas with trichodiscomas and acrochordons». Archives of Dermatology. PMID 596896. doi:10.1001/archderm.113.12.1674.
- ↑ Burnier; Rejsek (2009). Appendix: The original description of perifollicular fibromas (Birt-Hogg-Dubé syndrome.) (en inglés). National Center for Biotechnology Information (US). Consultado el 28 de septiembre de 2024.
- ↑ «OMIM Entry - # 135150 - BIRT-HOGG-DUBE SYNDROME; BHD». web.archive.org. 10 de marzo de 2017. Consultado el 28 de septiembre de 2024.
- ↑ «BHD Foundation – Birt-Hogg-Dubé Syndrome». web.archive.org. 11 de junio de 2021. Consultado el 28 de septiembre de 2024.
- ↑ «organizations — National Organization for Rare Disorders». web.archive.org. 3 de noviembre de 2013. Consultado el 28 de septiembre de 2024.
- ↑ «Birt-Hogg-Dubé syndrome - Educational resources - Information pages - Genetics Home Reference». web.archive.org. 15 de marzo de 2016. Consultado el 28 de septiembre de 2024.
- ↑ Liu, Wei; Chen, Zhi; Ma, Yansen; Wu, Xiaochun; Jin, Yaping; Hou, Steven (2013). «"Genetic Characterization of the Drosophila Birt-Hogg-Dubé Syndrome Gene"». PLOS ONE. PMID 23799055. doi:10.1371/journal.pone.0065869.
- ↑ Singh SR, Zhen W, Zheng Z, Wang H, Oh SW, Liu W, Zbar B, Schmidt LS, Hou SX (2006). «The Drosophila homolog of the human tumor suppressor gene BHD interacts with the JAK-STAT and Dpp signaling pathways in regulating male germline stem cell maintenance.». Oncogene.
- ↑ Singh SR, Zhen W, Zheng Z, Wang H, Oh SW, Liu W, Zbar B, Schmidt LS, Hou SX (2006). «The Drosophila homolog of the human tumor suppressor gene BHD interacts with the JAK-STAT and Dpp signaling pathways in regulating male germline stem cell maintenance». Oncogene.
