Diferencia entre revisiones de «Proteína»
| Línea 7: | Línea 7: | ||
Las proteínas de todo ser vivo están determinadas genéticamente, es decir, la información genética ([[gen]]es) determinan qué proteínas tendrá un individuo. |
Las proteínas de todo ser vivo están determinadas genéticamente, es decir, la información genética ([[gen]]es) determinan qué proteínas tendrá un individuo. |
||
Las proteinas son la madre del rey de españa que por cierto se pone muchisimo me encantaría penetrar a fuencisla merino y marcarla de por vida porque es una ramera y merece la horca anal |
|||
== Características == |
|||
Las proteínas son macromoléculas de gran tamaño; son [[biopolímero]]s, es decir, están constituidas por gran número de unidades estructurales simples repetitivas ([[monómero]]s). Debido a su gran tamaño, cuando estas moléculas se dispersan en un [[disolvente]] adecuado, forman siempre [[dispersión coloidal|dispersiones coloidales]], con características que las distinguen de las soluciones de moléculas más pequeñas. |
|||
Por [[hidrólisis]], las moléculas proteínicas son escindidas en numerosos compuestos relativamente simples, de pequeño peso, que son las unidades fundamentales constituyentes de la [[macromolécula]]. Estas unidades son los [[aminoácido]]s, de los cuales existen veinte [[especie química|especies]] diferentes y que se unen entre sí mediante [[enlace peptídico|enlaces peptídicos]]. Cientos y miles de estos [[aminoácido]]s pueden participar en la formación de la gran molécula polimérica de una proteína. |
|||
Todas las proteínas contienen [[carbono]], [[hidrógeno]], [[oxígeno]] y [[nitrógeno]] y casi todas poseen también [[azufre]]. Si bien hay ligeras variaciones en diferentes proteínas, el contenido de [[nitrógeno]] representa, término medio, 16% de la masa total de la [[molécula]]; es decir, cada 6,25 g de proteínas contienen 1 g de N. El factor 6,25 se utiliza para estimar la cantidad de proteína existente en una muestra a partir de la medición de N de la misma. |
|||
La [[síntesis proteica]] es un proceso complejo cumplido por las células según las directrices de la información suministrada por los [[gen]]es. |
|||
Las proteínas son largas cadenas de aminoácidos unidas por enlaces peptídicos entre el grupo carboxyl (-COOH) y los grupos amino (NH2) de residuos de aminoácido adyacentes. La secuencia de aminoácidos en una proteína es definida por un [[gen]] y codificada en el código genético. Aunque este código genético especifique 21 aminoácidos "estándar" más [[selenocisteína]] y - en ciertos [[Archaea]] - [[pirrolisina]], los residuos en una proteína a veces químicamente son cambiados en la modificación postraducción: antes de que la proteína puede funcionar en la célula, o como la parte de mecanismos de control. Las proteínas también pueden trabajar juntos para alcanzar una función particular, y ellos a menudo se asocian para formar complejos estables. |
|||
me corro en la boca de la wikipedia que solo tiene mamonadas |
|||
== Funciones == |
== Funciones == |
||
Revisión del 17:30 27 may 2008
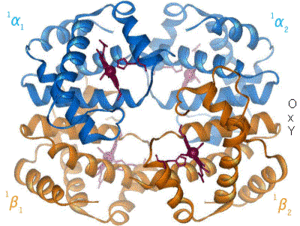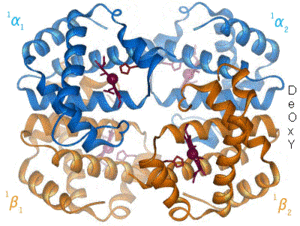
Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos. El nombre proteína proviene de la palabra griega πρώτα ("prota"), que significa "lo primero" o del dios proteo, por la cantidad de formas que pueden tomar.
Las proteínas desempeñan un papel fundamental en los seres vivos y son las biomolécula más versátiles y más diversas. Realizan una enorme cantidad de funciones diferentes, entre las que destacan la enzimática, hormonal, transportadora (hemoglobina), defensiva (anticuerpos), estructural (colágeno), etc.
Las proteínas de todo ser vivo están determinadas genéticamente, es decir, la información genética (genes) determinan qué proteínas tendrá un individuo.
Las proteinas son la madre del rey de españa que por cierto se pone muchisimo me encantaría penetrar a fuencisla merino y marcarla de por vida porque es una ramera y merece la horca anal
me corro en la boca de la wikipedia que solo tiene mamonadas
Funciones
Las proteínas ocupan un lugar de máxima importancia entre las moléculas constituyentes de los seres vivos (biomoléculas). Prácticamente todos los procesos biológicos dependen de la presencia y/o actividad de este tipo de sustancias. Bastan algunos ejemplos para dar idea de la variedad y trascendencia de funciones a ellas asignadas. Son proteínas casi todas las enzimas, catalizadores de reacciones químicas en organismos vivientes; muchas hormonas, reguladores de actividades celulares; la hemoglobina y otras moléculas con funciones de transporte en la sangre; los anticuerpos, encargados de acciones de defensa natural contra infecciones o agentes extraños; los receptores de las células, a los cuales se fijan moléculas capaces de desencadenar una respuesta determinada; la actina y la miosina, responsables finales del acortamiento del músculo durante la contracción; el colágeno, integrante de fibras altamente resistentes en tejidos de sostén.
Estructura

Es la manera en como se organiza una proteína para adquirir cierta forma, esta comprende cuatro niveles de organización, aunque el cuarto no siempre esta presente. Presentan una disposición característica en condiciones ambientales, si se cambian estas condiciones como temperatura, pH, etc. pierde la conformación y su función, proceso el cual se denomina desnaturalización. La función depende de la conformación y ésta viene determinada por la secuencia de aminoácidos.
Conformaciones o niveles estructurales de la disposición tridimensional: Estructura primaria. Estructura secundaria. Nivel de dominio. Estructura terciaria. Estructura cuaternaria. A partir del nivel de dominio sólo las hay globulares.
Propiedades de las proteínas
- Solubilidad: mantiene siempre y cuando los enlaces fuertes y débiles estén presentes. Si se aumenta la temperatura y el pH, se pierde la solubilidad.
- Capacidad Electrolítica: Se determina a través de la electrólisis, en la cual si las proteínas se trasladan al polo positivo es porque su radical tiene carga negativa y viceversa.
- Especificidad: Cada proteína tiene una función específica que esta determinada por su estructura primaria.
Desnaturalización
Las proteínas pueden desnaturalizarse al perder todas sus estructuras menos la primaria. Al desnaturalizarse una proteína, esta pierde solubilidad en el agua y precipita. La desnaturalización se produce por cambios de temperatura o variaciones de pH, sales de metales pesados, radiación UV, rayos X. En algunos casos, las proteínas desnaturalizadas pueden volver a su estado original a través de un proceso llamado renaturalización.
Reacciones de Reconocimiento
El reactivo de Biuret esta formado por una solución de sulfato de cobre en medio alcalino, este reconoce el enlace peptídico de las proteínas mediante la formación de un complejo de coordinación entre los iones Cu2+ y los pares de electrones no compartidos del nitrógeno que forma parte de los enlaces peptídicos, lo que produce una coloración rojo-violeta.
Reconoce residuos fenólicos, o sea aquellas proteínas que contengan tirosina. Las proteínas se precipitan por acción de los ácidos inorgánicos fuertes del reactivo, dando un precipitado blanco que se vuelve gradualmente rojo al calentar.
Reconoce grupos aromáticos, o sea aquellas proteínas que contengan tanto tirosina como fenilalanina, con el cual el ácido nítrico forma compuestos nitrados amarillos.
Determinación de la estabilidad proteica
La estabilidad de una proteína es una medida de la energía que diferencia al estado nativo de otros estados "no nativos" o desnaturalizados. Hablaremos de estabilidad termodinámica cuando podamos hacer la diferencia de energía entre el estado nativo y el desnaturalizado, para lo cual se requiere reversibilidad en el proceso de desnaturalización. Y hablaremos de estabilidad cinética cuando, dado que la proteína desnaturaliza irreversiblemente, sólo podemos diferenciar energéticamente la proteína nativa del estado de transición (el estado limitante en el proceso de desnaturalización) que da lugar al estado final. En el caso de las proteínas reversibles, también se puede hablar de estabilidad cinética, puesto que el proceso de desnaturalización también presenta un estado limitante. Actualmente se ha demostrado que algunas proteínas reversibles pueden carecer de dicho estado limitante, si bien es un tema aún controvertido en la bibliografía científica.
La determinación de la estabilidad proteica puede realizarse con diversas técnicas. La única de ellas que mide directamente los parámetros energéticos es la calorimetría (normalmente en la modalidad de calorimetría diferencial de barrido). En esta se mide la cantidad de calor que absorbe una disolución de proteína cuando es calentada, de modo que al aumentar la temperatura se produce una transición entre el estado nativo y el estado desnaturalizado que lleva asociada la absorción de una gran cantidad de calor.
El resto de técnicas miden propiedades de las proteínas que son distintas en el estado nativo y en el estado desplegado. Entre ellas se podrían citar la fluorescencia de triptófanos y tirosinas, el dicroísmo circular, radio hidrodinámico, espectroscopía infrarroja, resonancia magnética nuclear,... Una vez hemos elegido la propiedad que vamos a medir para seguir la desnaturalización de la proteína, podemos distinguir dos modalidades: Aquellas que usan como agente desnaturalizante el incremento de temperatura y aquellas que hacen uso de agentes químicos (como urea, cloruro de guanidinio, tiocianato de guanidinio, alcoholes,...). Estas últimas relacionan la concentración del agente utilizado con la energía necesaria para la desnaturalización. Una de las últimas técnicas que han emergido en el estudio de las proteínas es la microscopía de fuerza atómica. Esta técnica es cualitativamente distinta de las demás, puesto que no trabaja con sistemas macroscópicos sino con moléculas individuales. Mide la estabilidad de la proteína a través del trabajo necesario para desnaturalizarla cuando se aplica una fuerza por un extremo mientras se mantiene el otro extremo fijo a una superficie.
La importancia del estudio de la estabilidad proteica está en sus implicaciones biomédicas y biotecnológicas. Así, enfermedades como el Alzheimer o el Parkinson están relacionadas con la formación de amiloides (polímeros de proteínas desnaturalizadas). El tratamiento eficaz de estas enfermedades podría encontrarse en el desarrollo de fármacos que desestabilizaran las formas amiloidogénicas o bien que estabilizaran las formas nativas. Por otro lado, cada vez más proteínas van siendo utilizadas como fármacos. Resulta obvio que los fármacos deben presentar una estabilidad que les de un alto tiempo de vida cuando están almacenados y un tiempo de vida limitado cuando están realizando su acción en el cuerpo humano. En cuanto a la importancia en las aplicaciones biotecnológicas radica en que pese a su extrema eficacia catalítica su baja estabilidad dificulta su uso (muchas proteínas de potencial interés apenas mantienen su configuración nativa y funcional por unas horas).
Clasificación
Según su forma
- Globulares: se caracterizan por doblar sus cadenas en una forma esférica apretada o compacta dejando grupos hidrófobos hacia adentro de la proteínas y grupos hidrófilos hacia afuera, lo que produce que sean solubles en solventes polares como el agua. La mayoría de las enzimas, anticuerpos, algunas hormonas, proteínas de transporte, son ejemplo de proteínas globulares
- Mixtas: posee una parte fibrilar (en el centro de la proteína) y otra parte globular (en los extremos). Como por ejemplo, albúmina, queratina.
Según su composición química
- Simples u holoproteínas: su hidrólisis sólo produce aminoácidos. Ejemplos de estas son la insulina y el colágeno (fibrosas y globulares).
- Conjugadas o heteroproteínas: su hidrólisis produce aminoácidos y otras sustancias no proteicas llamado grupo prostético (sólo globulares)
Véase también
- Aminoácido
- Citocina
- Timina
- Código genético
- Holoproteínas
- Heteroproteínas
- Proteómica (o proteinómica)
- Biosíntesis de proteínas
- Síntesis proteica
- Cucumisina
- Biuret
- Catepsina
- Acuaporina
- Receptor intracelular
- Proteína G
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Proteína.
Wikimedia Commons alberga una categoría multimedia sobre Proteína.- Lecturas sobre biomoléculas (CBC,UBA,Argentina)
- Estructura de las proteínas
