Nitrato de bario
| Nitrato de bario | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Otros nombres | Dinitrato de bario | |
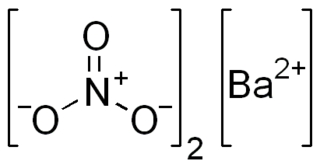
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 10022-31-8[1] | |
| ChEMBL | CHEMBL3184584 | |
| Propiedades físicas | ||
| Apariencia | cristales blancos | |
| Densidad | 3240 kg/m³; 3,24 g/cm³ | |
| Masa molar | 261,337 g/mol | |
| Punto de descomposición | 592 °C (865 K) | |
| Índice de refracción (nD) | 1.5659 | |
| Peligrosidad | ||
| NFPA 704 |
0
3
3
| |
| Frases R | R20/22 | |
| Frases S | S2 S28 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El nitrato de bario de fórmula química Ba(NO3)2 es una sal de compuesto de bario y el ion nitrato.
El nitrato de bario existe como un sólido blanco a temperatura ambiente. Es soluble en agua, y al igual que otros compuestos de bario solubles, es tóxico y debe ser manejado con cuidado. En la naturaleza está presente en un mineral raro, la nitrobarita .
El baratol es un compuesto explosivo de nitrato de bario, TNT y aglutinante; la alta densidad del nitrato de bario hace que el baratol también sea bastante denso. El nitrato de bario se mezcla con polvo de aluminio produce una pólvora destellante. Se mezcla con la termita para formar termate-TH3, que se utiliza en granadas de termita militares. También se utiliza en el proceso de fabricación de óxido de bario, en la industria de tubos de vacío y para dar fuego de color verde en pirotecnia.
Síntesis[editar]
Nitrato de bario se sintetiza en dos procesos. Uno consiste en disolver pequeños trozos de carbonato de bario en ácido nítrico, permitiendo todas las impurezas de hierro a precipitar, después se filtra, se evapora, y se cristaliza. El otro requiere la combinación de cloruro de bario con una solución calentada de nitrato de sodio, formándose cristales de nitrato de bario que precipitan.
Reacciones[editar]
A temperaturas elevadas, nitrato de bario se descompone en óxido de bario, dióxido de nitrógeno, y oxígeno :
- 2Ba(NO3)2 + calor → 2BaO + 4NO2 + O2
En una atmósfera de óxido nítrico, la descomposición térmica produce nitrito de bario. Las reacciones con sulfatos metálicos solubles o sulfato ácido sulfúrico rendimiento de bario. Muchas sales de bario insolubles, tales como el carbonato, oxalato y fosfato del metal, se precipitó por similares reacciones de descomposición dobles. El nitrato de bario es un oxidante y reacciona violentamente con agentes reductores comunes. El sólido en polvo, cuando se mezcla con muchos otros metales tales como aluminio o zinc finamente dividido, o combinados con aleaciones tales como aluminio y magnesio, se enciende y explota por impacto.[2]
Riesgos para la salud[editar]
Al igual que todos los compuestos solubles de bario, nitrato de bario es tóxico por ingestión o inhalación. regularidad cardiaca y convulsiones. La muerte puede sobrevenir por insuficiencia cardíaca o respiratoria, y por lo general se produce pocas horas hasta varios días después de la exposición al compuesto. El nitrato de bario también pueden causar daño a los riñones.[3]
Se puede dar como primeros auxilios para el envenenamiento de bario soluciones de sales de sulfato tales como sales de Epsom o sulfato de sodio, ya que precipitar el bario como insoluble (y no tóxico) sulfato de bario.
La inhalación puede causar irritación del tracto respiratorio.
Aunque el contacto con la piel o los ojos es menos nocivo que la ingestión o inhalación, todavía puede resultar en irritación, picazón, enrojecimiento y dolor.
Referencias[editar]
- ↑ Número CAS
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ Barium Nitrate

