Hipocampo (anatomía)
| Hipocampo | ||
|---|---|---|
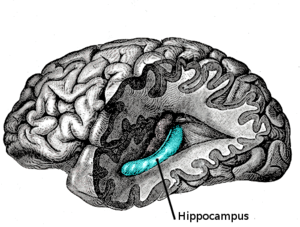 El hipocampo está localizado en la parte medial del lóbulo temporal del cerebro. En esta vista lateral del cerebro humano, el lóbulo frontal está a la izquierda, el lóbulo occipital a la derecha, y los lóbulos temporal y parietal han sido retirados en gran medida para revelar el hipocampo subyacente. | ||
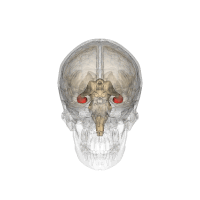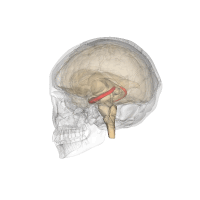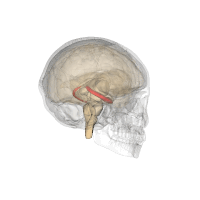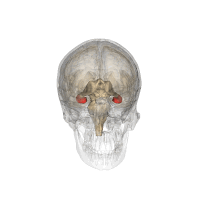 | ||
| Latín | [TA]: hippocampus | |
| TA | A14.1.09.321 | |
| Enlaces externos | ||
| NeuroLex ID | hippocampus | |
| NeuroNames | hippocampus | |


El hipocampo (del latín hippocampus, y este del griego ιππος, hippos: ‘caballo’, y καμπος, kampos: el monstruo marino ‘Campe’) es una de las principales estructuras del cerebro humano y otros mamíferos. Nominado por el anatomista del siglo XVI Giulio Cesare Aranzio, quien apreció una semejanza con la forma del caballito de mar, hipocampo.
Se trata de una estructura marginal y de estructura de capas más sencilla de la misma sustancia gris cortical del lóbulo temporal. Por ello pertenece, por una parte al sistema límbico y por otra a la arquicorteza, componiendo junto al subículo y el giro dentado la llamada formación hipocampal. Al igual que el resto de la corteza cerebral es una estructura pareada, con dos mitades que son imágenes especulares en ambos hemisferios cerebrales. Tanto en humanos como en otros primates, el hipocampo se localiza en el interior de la parte medial o interna del lóbulo temporal, bajo la superficie cortical. La forma de caballito de mar es típica de primates, pero en otros mamíferos tiene formas variadas, como la del plátano.
Aunque tiene origen en una estructura del cerebro de los vertebrados denominada palio, que comprendía funciones olfativas, en su actual diseño en los mamíferos desempeña principalmente funciones importantes en la memoria y el manejo del espacio. Los estudios sobre su función en humanos son escasos, pero se ha investigado ampliamente en roedores como parte del sistema cerebral responsable de la memoria espacial y la navegación. Muchas neuronas del hipocampo de ratas y ratones responden disparando potenciales de acción cuando el individuo atraviesa por una zona específica de su entorno, como «células de lugar» o células de posición. Las «células del lugar» del hipocampo interactúan en gran medida con las «células de orientación» de la cabeza, que actúan a modo de compás inercial, y también con las «células grid» o células de red, en las cercanías de la corteza entorrinal.
Debido a sus capas de neuronas densamente empaquetadas, el hipocampo ha sido utilizado frecuentemente como un sistema modelo para el estudio de la neurofisiología. La forma de la plasticidad neuronal conocida como potenciación a largo plazo (LTP) fue descubierta por primera vez en el hipocampo, y todavía se estudia en esta estructura. Está muy extendida la hipótesis de que la LTP es uno de los mecanismos neurales principales por los que la memoria se almacena en el cerebro.
En la enfermedad de Alzheimer el hipocampo es una de las primeras regiones del cerebro en sufrir daño.[1] Los problemas de memoria y desorientación aparecen entre los primeros síntomas. El daño al hipocampo también puede proceder de situaciones de carencia de oxígeno (hipoxia), inflamación del encéfalo (encefalitis) o epilepsia del lóbulo temporal. Las personas que han sufrido un daño extenso en el hipocampo pueden experimentar incapacidad para adquirir o retener nuevos recuerdos (amnesia).
Historia
[editar]
La primera descripción del hipocampo fue escrita por el anatomista Giulio Cesare Aranzi (Julius Caesar Arantius - circa 1587, un alumno poco aventajado de Andreas Vesalius), quien comparó la protrusión en el suelo del asta lóbulo temporal con el hipocampo, o caballo de mar, puesto que, junto con su fimbria, recuerda mucho a este último en su forma. Sin embargo, debe señalarse que dudó entre utilizar el término «caballo de mar» y «gusano de seda».[2] Bartholomeo Eustachio presenta en algunas placas con esta estructura, no siendo hasta 1714 que la expone en ilustraciones.[3] En 1729, J.G. Duvernoy también presentó una ilustración del hipocampo, y también dudó entre «hipocampo» y «gusano de seda». En 1732, Winslow sugirió el término «Asta de carnero». Hipocampo, gusano de seda y asta de carnero fueron los nombres utilizados durante este periodo inicial, todos basados en la apariencia intraventricular del hipocampo. Posteriormente hubo un segundo periodo caracterizado por una imaginación excesiva entre los anatomistas, quienes compararon el hipocampo con símbolos mitológicos:[2]
- El «asta de carnero» se transformó en el cornu Ammonis, asociado al dios egipcio Amón (Ammun Kneph). Este nombre, probablemente fue utilizado por primera vez en 1742 por De Garengeot, y continúa en uso.
- El término pes hippocampi, fue el siguiente en introducirse. Aun cuando se desconoce quién le agregó un «pie» al hipocampo, Lewis en 1923 cita a Diemerbroeck (1627), mientras que otros están en desacuerdo.
Para complicar aún más las cosas, el hipocampo fue descrito con dos pies: pes hippocampi major para el hipocampo y pes hippocampi minor para el calcar avis, una protrusión en el asta occipital. En la terminología actual, los términos Asta de Amón y pie del hipocampo son utilizados como sinónimos, aunque este último término generalmente se reserva para las digitaciones del hipocampo ([TA]: digitationes hippocampi), las cuales elevan la porción anterior del hipocampo.
Este órgano fue inicialmente relacionado con el sentido del olfato, más que por su función ya conocida en la adquisición de la memoria. El ruso Vladímir Béjterev tomó nota del papel del hipocampo en la memoria en los años 1900, basado en observaciones de un paciente con problemas graves de memoria. Sin embargo, por muchos años, el conocimiento convencional del hipocampo era que, al igual que el resto de sistema límbico, era responsable de la emoción.[3]
Funciones
[editar]
Históricamente, la hipótesis más ampliamente sostenida consistía en que el hipocampo estaba implicado en el olfato. Esta idea se fundaba en gran medida en la creencia, de la que posteriormente se demostró su falsedad, de que el hipocampo recibe aferencias directas del bulbo olfatorio.[3] Continúa existiendo algún interés en lo referente a respuestas olfatorias de origen hipocampal, particularmente sobre el papel del hipocampo en la memoria de los olores, pero pocas personas creen hoy en día que el olfato es su función principal.[4][5]
Con el paso de los años, tres ideas sobre la función del hipocampo han acabado dominando la literatura: inhibición, memoria y espacio. La teoría de la inhibición de la conducta (caricaturizada por O'Keefe y Nadel bajo el título slam on the brakes!, es decir, una frenada en seco)[6] fue muy popular en los años 1960. Su justificación se fundamenta esencialmente en dos observaciones: en primer lugar, que los animales con lesiones en el hipocampo tienden a ser hiperactivos. En segundo lugar, que los animales sometidos a este tipo de lesiones también tienen problemas para inhibir respuestas que previamente se les había enseñado. Jeffrey Gray desarrolló esta línea teórica en un ensayo exhaustivo sobre el papel del hipocampo en la ansiedad.[7] La teoría de la inhibición es actualmente la menos popular de las tres.[8]
La segunda línea teórica principal relaciona al hipocampo con la memoria. Aunque tuvo precursores históricos, los mayores impulsos de esta idea se dan a partir de un famoso artículo de Scoville y Brenda Milner,[9] que describe los resultados de la destrucción quirúrgica del hipocampo (en el intento de aliviar los ataques epilépticos de un paciente llamado Henry Gustav Molaison,[10] conocido hasta su muerte en 2008 como H.M.). El resultado inesperado de la intervención quirúrgica fue una amnesia anterógrada grave y una amnesia retrógrada parcial: Molaison era incapaz de formar nuevos recuerdos episódicos tras la operación y no podía recordar lo que le había sucedido justo después de la misma, pero era capaz de retener recuerdos de lo que le había sucedido años antes, por ejemplo, en la infancia. Este caso suscitó un interés tan grande que, según se ha publicado, H.M. se convirtió en el sujeto más intensivamente estudiado en la historia médica.[11] En los siguientes años, se estudió a otros pacientes con niveles similares de daño en el hipocampo y amnesia (producida por accidente o enfermedad), además de miles de experimentos que han estudiado la fisiología de los cambios en las conexiones sinápticas del hipocampo. Actualmente existe un acuerdo prácticamente universal en que el hipocampo desempeña algún tipo importante de papel en la memoria. No obstante, la naturaleza precisa de este papel continúa siendo ampliamente debatida.[4][12]
La tercera teoría sobre la función del hipocampo lo relaciona con la percepción espacial. La teoría espacial tuvo originalmente sus mayores defensores en O'Keefe y Nadel, quienes estaban influidos por las teorías de E.C. Tolman's sobre los «mapas cognitivos» en humanos y animales. O'Keefe y su alumno Dostrovsky descubrieron en 1971 neuronas en el hipocampo de rata que les parecía que mostraban actividad relacionada con la localización de la rata en su entorno.[13] A pesar del escepticismo de otros investigadores, O'Keefe y sus colaboradores, especialmente Lynn Nadel, continuaron investigando sobre esta cuestión, en una línea de trabajo que eventualmente les condujo a redactar en 1978 un libro muy influyente titulado The Hippocampus as a Cognitive Map (‘El hipocampo como mapa cognitivo’).[14] Como sucede con la teoría de la memoria, actualmente existe un acuerdo casi universal en que el hipocampo desempeña un papel importante en la función de la codificación espacial, pero los detalles están ampliamente sometidos a debate.[15]
Papel en la memoria
[editar]Los psicólogos y neurocientíficos están generalmente de acuerdo en que el hipocampo tiene un papel importante en la formación de nuevos recuerdos de los acontecimientos experimentados, tanto episódicos como autobiográficos.[4][16] Parte de este papel en que está implicado el hipocampo consiste en la detección de acontecimientos, lugares y estímulos novedosos.[17] Algunos investigadores conciben al hipocampo como parte de un sistema mayor de memoria de la parte medial del lóbulo temporal responsable de la memoria declarativa general. La razón, por ejemplo, es que los recuerdos pueden ser verbalizados explícitamente, lo que afecta, por ejemplo, a la memoria de hechos además de la memoria episódica.[12]
Lesiones severas del hipocampo producen profundas dificultades en la formación de nuevos recuerdos (amnesia anterógrada), y a menudo también afecta a los recuerdos formados antes de la lesión (amnesia retrógrada). Aunque el efecto retrógrado normalmente se extiende a algunos años antes del daño cerebral, en algunos casos los recuerdos más antiguos permanecen. Esta preservación de los recuerdos antiguos ha llevado a la idea de que la consolidación a lo largo del tiempo implica la transferencia de recuerdos desde el hipocampo a otras partes del cerebro.[16]
El daño al hipocampo no afecta a algunos tipos de memoria, como la capacidad de adquirir nuevas competencias motoras o cognitivas (tocar un instrumento musical o resolver ciertos tipos de acertijos lógicos, por ejemplo). Este hecho sugiere que tales capacidades dependen de diferentes tipos de memoria (memoria procedimental, por ejemplo) y diferentes regiones cerebrales. Además, los pacientes amnésicos muestran con frecuencia una memoria «implícita» para las experiencias, incluso en ausencia de conocimiento consciente. Por ejemplo, cuando se pregunta a un paciente que diga cuál de entre dos caras es la que ha visto más recientemente, casi siempre puede acertar en la respuesta correcta, a pesar de afirmar que nunca había visto antes ninguna de ellas. Algunos investigadores distinguen entre recolección consciente, que depende del hipocampo, y familiaridad, que depende de partes de la corteza temporal medial.[18]
Papel en la memoria espacial y la orientación
[editar]
Los estudios que se han llevado a cabo en ratas que se mueven libremente y en ratones han demostrado que las neuronas del hipocampo tienen «campos de lugar», esto es, son neuronas que desencadenan potenciales de acción cuando una rata pasa por un lugar en concreto de su entorno. Las evidencias de este tipo de neuronas en primates son limitadas, quizá en parte porque es difícil registrar la actividad cerebral en monos que se mueven libremente. Se ha registrado actividad neuronal a nivel del hipocampo relacionada con el lugar donde monos de experimentación transitaban dentro de una habitación mientras permanecían en una silla que limitaba hasta cierto punto sus movimientos.[20] Por otra parte, Edmund Rolls y sus colaboradores describieron en lugar de esto células hipocampales que se disparan en relación con el lugar al que el primate dirige su mirada, en vez del lugar donde se sitúa su cuerpo.[21] En humanos, se han encontrado células de lugar en un estudio de pacientes con epilepsia resistente a fármacos y sujetos a un procedimiento invasivo para localizar la fuente de sus ataques. Esto permitía la exploración a través de la zona sometida a resección quirúrgica. Los pacientes tenían electrodos de diagnóstico implantados en su hipocampo. Posteriormente se les pidió que emplearan una computadora para desplazarse en un entorno virtual que representaba una ciudad.[22]
Se han estudiado las respuestas dependientes de lugar en cientos de experimentos en cuatro décadas, dando lugar a una gran cantidad de información.[15] Las respuestas de las células de lugar se muestran mediante células piramidales en el mismo hipocampo, y en las células granulosas de la circunvolución dentada. Estas constituyen la gran mayoría de neuronas en las capas densamente empaquetadas del hipotálamo. Las interneuronas inhibidoras, que constituyen la mayoría de la población celular restante, muestran frecuentemente variaciones significativas dependientes de lugar en la tasa de disparo, pero mucho más débil de lo mostrado previamente por las células piramidales o granulosas. No hay apenas, si es que hay, topografía espacial en la representación: las células que se sitúan próximas entre sí en el hipocampo por lo general presentan patrones espaciales de disparo no correlativos. Las células de lugar son típicamente casi silentes cuando la rata se mueve fuera del campo de lugar, pero alcanzan tasas sostenidas de disparo de hasta 40 Hz cuando la rata está cerca del centro. La actividad neural muestreada de 30-40 células de lugar tomadas al azar tienen suficiente información para permitir que la localización de la rata sea reconstruida con suficiente exactitud. El tamaño de los campos de lugar varía en un gradiente a lo largo de la longitud del hipocampo, con las células del extremo dorsal mostrando los campos más pequeños, las células próximas al centro mostrando los campos mayores, y las células del ápice ventral cubriendo el ambiente completo.[15] En algunos casos, la tasa de disparo de las células del hipocampo de rata dependen no solo del lugar, sino también de la dirección en que se mueve el animal, del destino hacia el que se dirige u otras variables relacionadas con la tarea que realiza.[23]
El descubrimiento de las células de lugar en los años 1970 condujo a la teoría de que el hipocampo puede actuar como un mapa cognitivo, es decir, una representación neural del esquema espacial del entorno.[14] Algunas líneas de evidencia apoyan esta hipótesis. Es una observación frecuente que sin un hipocampo plenamente funcional, los humanos no recordarían dónde han estado y cómo llegar al lugar donde se dirigen: la sensación de extravío es uno de los síntomas más comunes de amnesia.[24] Los estudios con animales han mostrado que se requiere un hipocampo intacto para algunas tareas de memoria espacial, en particular aquellas que precisan encontrar un camino a un objetivo oculto.[25] La «hipótesis del mapa cognitivo» ha recibido posteriormente un impulso por el descubrimiento reciente de las «células de dirección de la cabeza», las «células de red» y las «células de límite» en diferentes partes del cerebro de roedor que están fuertemente conectadas al hipocampo.[15][26]
Las técnicas de neuroimagen aplicadas al cerebro muestran que las personas tienen un hipocampo más activo cuando se orientan correctamente, como se ha comprobado mediante tareas de orientación en un entorno virtual.[27] No obstante, también existen pruebas de que el hipocampo desempeña un papel en la actividad de encontrar atajos y nuevas rutas entre lugares familiares. Por ejemplo, los taxistas de Londres deben aprender un gran número de lugares y las rutas más directas entre ellas (y tienen que demostrarlo superando un estricto examen, conocido como The Knowledge antes de obtener la licencia para conducir los famosos black cabs). Un estudio del University College de Londres realizado por Maguire, et alii. (2000)[28] mostró que una parte del hipocampo es mayor en los taxistas que en el público en general, y que los conductores más experimentados tenían un hipocampo más voluminoso. Aún se debe elucidar si el tener un hipocampo mayor contribuye a que un individuo se convierta en taxista, o a encontrar atajos en la vida haga que crezca su hipocampo. No obstante, en el estudio de Maguire, et ál. se examinó la correlación entre la sustancia gris y el tiempo empleado por un taxista en sus carreras, encontrando una correlación positiva entre ambas. Se veía que el volumen total del hipocampo permanecía constante entre el grupo control y el de taxistas. Esto es lo mismo que decir que la porción posterior del hipocampo del taxista realmente se incrementaba, pero a expensas de la porción anterior. No se han encontrado efectos perjudiciales en esta disparidad en las proporciones del hipocampo.[27]
Anatomía
[editar]
Anatómicamente, el hipocampo es una elaboración del extremo de la corteza cerebral.[29] Se puede distinguir como una zona donde el córtex se estrecha en una capa única de neuronas densamente empaquetadas, que se recurvan en forma de S apretada. Las estructuras que perfilan el borde o límite del córtex componen el llamado sistema límbico (expresión que procede precisamente del latín limbus: ‘límite’): Entre estas estructuras encontramos el hipocampo, la corteza cingulada, la corteza olfatoria y la amígdala cerebral. Paul MacLean sugirió en una ocasión, formando parte de la teoría del cerebro triúnico, que las estructuras límbicas comprenden la base neural de la emoción. No obstante, la mayoría de los neurocientíficos han dejado de creer que el concepto de un sistema límbico unificado sea válido.[30]

El hipocampo en su conjunto tiene forma de un tubo curvado, cuyo aspecto recordó a los anatomistas formas tan variadas como la del caballito de mar, el cuerno de un carnero o del dios Amón (el Cornu Ammonis actualmente designa una parte del hipocampo que comprende las divisiones entre CA1 y CA4), y también una banana.[29] Comprende porciones ventrales y dorsales, compartiendo ambas una composición similar, pero siendo partes de diferentes circuitos neurales.[31]
Este esquema general se mantiene a lo largo de todo el rango de especies de mamíferos, desde el erizo a los humanos, aunque los detalles varían. En ratas, los dos hipocampos recuerdan por su forma a bananas unidas por su tallo, mientras que en el cerebro de primates o el humano, la porción del hipocampo que se encuentra hacia el fondo, cerca de la base del lóbulo temporal, es mucho más ancha que la de la parte superior. Una de las consecuencias de esta compleja geometría es que las secciones cruzadas a través del hipocampo pueden adoptar una gran variedad de formas dependiendo del ángulo de localización del corte.

La corteza entorrinal es la mayor fuente de aferencias del hipocampo y también el objetivo de sus eferencias, y está conectada de forma fuerte y recíproca con otras áreas de la corteza cerebral, y por ello actúa como el mayor «interfaz» entre el hipocampo y otras partes del cerebro. Las capas superficiales de la corteza entorrinal proporcionan el input más importante al hipocampo, y las capas profundas de esta estructura el output más prominente. En el interior del hipocampo el flujo de información es en gran medida unidireccional, con señales que se propagan a través de una serie de capas de células empaquetadas de forma apretada, primero en dirección a la circunvolución dentada, después a la capa C3 y posteriormente a la C1, siguiendo por el subículo y finalmente saliendo del hipocampo hacia la corteza entorrinal. Cada una de estas capas contiene también un circuiteado intrínseco complejo y gran cantidad de conexiones longitudinales.[29]
Otras conexiones menos visibles desempeñan papeles importantes en la función del hipocampo.[29] Más allá de las eferencias hacia la corteza entorrinal, existen rutas eferentes hacia otras áreas corticales, incluyendo el córtex prefrontal y otras áreas eferentes hacia el área septal lateral. El hipocampo recibe inputs moduladores de los sistemas serotoninérgico, dopaminérgico y de la norepinefrina, y del nucleus reuniens del tálamo. Una proyección muy importante procede del área medial septal, que envía fibras colinérgicas y gabérgicas hacia todas las partes del hipocampo. Los inputs del área septal desempeñan un papel central en el control del estado fisiológico del hipocampo: la destrucción del área septal elimina el ritmo theta y afecta gravemente a ciertos tipos de memoria.[32]
La región cortical adyacente al hipocampo se conoce colectivamente como la circunvolución parahipocampal.[33] Incluye la corteza entorrinal y también la corteza perirrinal, la cual deriva su nombre del hecho de que se sitúa al lado de la cisura rinal. La corteza perirrinal tiene un papel importante en el reconocimiento visual de objetos complejos, pero también hay evidencias importantes de que contribuye a la memoria, distinguiéndose de la contribución del hipocampo,[34] y la amnesia completa solo tiene lugar cuando ambas estructuras se encuentran dañadas.[33]
Desarrollo
[editar]Los hemisferios cerebrales comienzan a formarse a partir de la quinta semana del desarrollo embrionario, en forma de evaginaciones a cada lado de la pared externa del prosencéfalo. Hacia la segunda mitad del segundo mes estas evaginaciones comienzan a aumentar de tamaño. Para el tercer mes las evaginaciones sobresalen de tal manera por encima del diencéfalo que son identificables como los hemisferios cerebrales.[35]
Esta nueva región de los hemisferios cerebrales está unida al techo del diencéfalo por las comisuras del cuerpo calloso,[36] que es muy delgada porque posee una sola capa de células ependimarias cubiertas por mesénquima vascularizado que dará origen al plexo coroideo. El plexo coroideo sobresale en el ventrículo lateral siguiendo la fisura coroidea y por arriba de esta fisura se forma el hipocampo.
En el pasado era ampliamente aceptado el hecho de que el desarrollo de nuevas neuronas, o neurogénesis en el cerebro mamífero estaba limitado a las etapas iniciales del desarrollo y terminaba con la pubertad.[37] A finales del siglo XIX, evidencias contundentes han demostrado que el desarrollo de neuronas en la región del hipocampo continúa durante toda la adultez y de manera independiente a las etapas tempranas del desarrollo.[37] Además, la magnitud de la neurogénesis adulta se correlaciona estrechamente con las funciones del aprendizaje y la memoria del hipocampo.[38]
Ciertas citocinas proinflamatorias bloquean la neurogénesis en la región del hipocampo, pero más importante aún es el hecho de que el bloqueo inflamatorio con indometacina, un antiinflamatorio no esteroideo (AINE), restaura de manera importante la neurogénesis en esta región.[39]
Fisiología
[editar]
En el hipocampo se observan principalmente dos «modos» de actividad, cada uno de ellos asociado con un patrón distinto de actividad de su población neuronal y ondas de actividad eléctrica según las medidas de electroencefalografía (EEG). Estos modos reciben su nombre correspondiendo con los patrones de EEG asociados con ellos: las ondas theta y los patrones mayores de actividad irregular (LIA). Las principales características descritas más abajo se han observado en ratas, que es el animal más ampliamente estudiado.[40]
El modo theta aparece durante los estados de alerta y actividad (especialmente en la locomoción) y también durante el sueño REM.[41] En este modo, el EEG está dominado por ondas largas e irregulares con un rango de frecuencia entre 6-9 Hz, y los grupos principales de células del hipocampo (las células piramidales y las células granulosas) muestran una actividad poblacional escasa, lo que significa que en un corto intervalo de tiempo, la gran mayoría de las células se encuentran silentes, mientras que la pequeña fracción restante se dispara a tasas relativamente altas, superiores a 50 picos por segundo en el caso de las más activas. Una célula activa típicamente permanece en este estado desde medio segundo a unos cuantos segundos. A medida que la rata realiza sus actividades, las células activas quedan silentes y nuevas células se vuelven activas, pero el porcentaje global de células activas permanece más o menos constante. En muchas situaciones, la actividad celular está determinada en gran medida por la localización espacial del animal, pero otras variables de comportamiento también influyen claramente sobre ello.
El modo LIA aparece durante el sueño de onda corta sin sueños, y también durante los estados de inmovilidad al caminar, como cuando se está descansando o comiendo.[41] En el modo LIA, el EEG está dominado por ondas afiladas , que están ajustadas a tiempos aleatorios correspondientes a señales de EEG que duran en torno a los 200-300 ms (milisegundos). Estas ondas afiladas también determinan los patrones de actividad de la población neural. Entre ellas, las células piramidales y granulares son muy poco activas (pero no silentes). A lo largo de una onda afilada, una cantidad tan grande como entre el 5-10 % de la población neural puede emitir un potencial de acción durante un periodo de 50 ms; muchas de estas células emiten brotes de varios potenciales de acción.
Estos modos de actividad del hipocampo se pueden verificar en primates al igual que en ratas, con la excepción de que ha sido difícil ver una ritmicidad theta robusta en el hipocampo de primates. Hay, no obstante, ondas afiladas cualitativamente semejantes, y cambios similares estado-dependientes en la actividad de la población neural.[42]
Ritmo Theta
[editar]Por razón de sus capas neurales densamente empaquetadas, el hipocampo genera algunas de las señales más fuertes de todo el EEG en toda la estructura cerebral. En algunas situaciones el EEG está dominado por ondas regulares a 3-10 Hz, que frecuentemente continúan durante muchos segundos. Estas reflejan los potenciales subumbral y modulan fuertemente la tasa de disparo de las neuronas del hipocampo y se sincronizan a lo largo del hipocampo mediante un patrón errático.[43] Este patrón de EEG se conoce como ritmo theta.[44] La ritmicidad theta es muy obvia en conejos y roedores, y también claramente presente en perros y gatos. El que se encuentran presentes de manera apreciable en primates resulta un tanto controversial.[45] En ratas (los animales que han sido más ampliamente estudiados), las ondas theta han sido investigadas principalmente en dos condiciones: en primer lugar, cuando un animal deambula o está interactuando de algún modo con su entorno; en segundo lugar, durante el sueño REM.[46]
Ondas lentas angulares
[editar]Durante el sueño, o en los estados de vigilia, cuando un animal está reposando o sin interacciones importantes con su entorno, el EEG del hipocampo muestra un patrón irregular de ondas lentas que de algún modo son más largas en amplitud que las ondas theta. Este patrón está interrumpido ocasionalmente por grandes picos llamados ondas lentas angulares.[47] Estos eventos se asocian con brotes de actividad de pulsos que duran entre 50 y 100 ms (milisegundos) en células piramidales de las capas CA3 y CA1. También están asociadas con oscilaciones EEG de alta frecuencia llamadas ripples o rizaduras, con frecuencias que cubren el rango de 150-200 Hz en ratas. Las ondas lentas angulares son más frecuentes durante el sueño, donde se dan a una tasa media de una por segundo (en ratas), pero con un patrón temporal muy irregular. Las ondas angulares son menos frecuentes en los estados inactivos, y normalmente son menores. También han sido observadas en humanos y en monos. En macacos, estas ondas son robustas, pero no se dan tan frecuentemente como en ratas.[42]
Uno de los aspectos más interesantes de las ondas angulares es que parecen estar asociadas con la memoria. Wilson y McNaughton, en 1994,[48] y numerosos estudios posteriores, publicaron que cuando las células de lugar del hipocampo tienen campos de disparo espacial solapados (y por tanto se disparan de manera prácticamente simultánea) tienden a mostrar una actividad correlacionada durante el sueño posterior a la sesión en que ha tenido lugar este suceso. Se ha visto que esta intensificación de la correlación, conocida comúnmente como reactivación tiene lugar principalmente cuando se registran ondas angulosas.[49] Se ha propuesto que las ondas angulosas son, de hecho, reactivaciones de los patrones de actividad neural que fueron memorizados durante una conducta, dirigidas por el fortalecimiento de las conexiones sinápticas con el hipocampo.[50] Esta idea forma un componente clave de la teoría de la «memoria en dos estadios», defendida por Buzsáki y otros, que propone que los recuerdos se almacenan en el hipocampo cuando se experimentan, y posteriormente son transferidos al neocórtex durante el sueño. Se sugiere que las ondas angulosas dirigen cambios sinápticos hebbianos en los objetivos neocorticales de las rutas eferentes del hipocampo.[51]
Potenciación a largo plazo
[editar]Desde por lo menos los tiempos de Ramón y Cajal, los psicólogos han especulado que el cerebro almacena la memoria alterando las conexiones entre neuronas que están activas simultáneamente.[52] Esta idea fue formalizada por Donald Hebb en 1948,[53] pero por muchos años después, los intentos de encontrar un mecanismo cerebral para estos cambios fueron en vano. En 1973, Tim Bliss y Terje Lømo describieron un fenómeno en el hipocampo de conejo que parecía encajar con las especificaciones de Hebb: un cambio en la responsividad sináptica inducida por una activación breve y fuerte y que duraba durante horas, días o más.[54] Pronto los científicos se refirieron a este fenómeno como «potenciación a largo plazo», abreviado LTP del inglés long-term potentiation. Como mecanismo candidato para la memoria, el LPT ha sido estudiado intensivamente en los siguientes años, del cual mucho se ha aprendido.
El hipocampo es un lugar particularmente favorable para estudiar la LTP por sus capas de neuronas densamente empaquetadas y netamente definidas, pero actualmente se han encontrado cambios sinápticos similares dependientes de la actividad en muchas otras áreas cerebrales.[55] La forma mejor estudiada de LTP tiene lugar en las sinapsis que terminan en las espinas dendríticas y usan el neurotransmisor glutamato. Varias de las vías más importantes del hipocampo encajan en esta descripción, y presentan LTP.[56] Los cambios sinápticos dependen de un tipo especial de receptor de glutamato o receptor NMDA que tiene la propiedad especial de permitir al calcio la entrada a la espina postsináptica solo cuando la activación presináptica y la despolarización postsináptica tienen lugar al mismo tiempo.[57] Los fármacos que interfieren con los receptores de NMDA bloquean la LTP y también tienen efectos importantes en algunos tipos de memoria, especialmente en la memoria espacial. Los ratones transgénicos modificados genéticamente para desactivar el mecanismo de LPT, también muestran por lo general graves déficits de memoria.[57]
Patología
[editar]Envejecimiento
[editar]Las afecciones relacionadas con el envejecimiento, como la enfermedad de Alzheimer (donde la disrupción del hipocampo es uno de los signos más tempranos,[58]) tienen un impacto severo en muchos tipos de cognición, pero incluso un envejecimiento normal y saludable está asociado con un declive gradual en algunos tipos de memoria, incluyendo la memoria episódica y la memoria de trabajo. Puesto que se piensa que el hipocampo desempeña un papel central en la memoria, existe un interés considerable en verificar la posibilidad de que los declives asociados a la edad puedan estar producidos por el deterioro del hipocampo.[59] Algunos estudios iniciales demostraron una pérdida sustancial de neuronas en el hipocampo en personas mayores, pero posteriores estudios utilizando técnicas más precisas encontraron tan solo diferencias mínimas.[59] De modo similar, algunos estudios de Resonancia Magnética han publicado una retracción del hipocampo en los ancianos, pero otros estudios han fracasado en el intento de reproducir este hallazgo. Hay, no obstante, una relación fiable entre el tamaño del hipocampo y la ejercitación de la memoria, lo que significa que no todos los ancianos muestran una retracción del hipocampo, sino solo aquellos que tienden a tener una memoria deficiente en algunas de sus tareas.[59] También se han publicado informes que estudian si las tareas de memoria tienden a producir menos activación hipocampal en los sujetos ancianos que en los sujetos jóvenes.[59]
En ratas, cuando los estudios detallados de fisiología celular son posibles, el envejecimiento no causa una pérdida sustancial de masa celular en el hipocampo, pero altera la conectividad sináptica de muchas formas.[60] Las sinapsis funcionales se pierden en la circunvolución dentada y en la región CA1, y las respuestas mediadas por receptores NMDA se reducen. Estos cambios pueden explicar los déficits en la inducción y mantenimiento de la potenciación a largo plazo, una forma de plasticidad sináptica que ha sido implicada en la memoria. También se encuentran declives relacionados con la edad en la expresión hipocampal de varios genes asociados con la plasticidad sináptica.[61] Finalmente existen diferencias en la estabilidad de las representaciones de las «células de lugar». En ratas jóvenes, la disposición de los campos de lugar está habitualmente alterada si la rata se cambia a un ambiente distinto, pero permanece igual si la rata retorna al ambiente que había sido visitado con anterioridad. En ratas viejas, los campos de lugar frecuentemente fallan al remapear cuando una rata se lleva a un ambiente distinto, y también con frecuencia fallan al restablecer el «mapa» original cuando la rata se retorna al mismo ambiente.
Estrés
[editar]El hipocampo contiene altos niveles de receptores de los mineralocorticoides lo que lo hace más vulnerable al estrés biológico a largo plazo que otras áreas cerebrales[62] Los esteroides relacionados con el estrés afectan al hipocampo en al menos tres modos: primero, reduciendo la excitabilidad de algunas neuronas del hipocampo. Segundo, inhibiendo la génesis de nuevas neuronas en la circunvolución dentada, y tercero, produciendo la atrofia de las dendritas de las células piramidales de la región CA3. Existen pruebas de que los humanos que han experimentado estrés traumático severo y a largo plazo(por ejemplo, los supervivientes del Holocausto) muestran atrofia del hipocampo en mayor medida que otras áreas del cerebro. Estos efectos se observan en el trastorno por estrés postraumático y pueden contribuir a la atrofia del hipocampo que se observa en la esquizofrenia y en la depresión mayor.[63] Un estudio reciente ha revelado también que se puede producir atrofia como consecuencia de estados depresivos, pero esto puede ser revertido con tratamiento con antidepresivos, incluso si estos no son eficaces para aliviar otros síntomas.[64] La atrofia del hipocampo también se observa con frecuencia en el síndrome de Cushing, un trastorno producido por altos niveles de cortisol en el torrente sanguíneo. Al menos alguno de esos efectos parecen reversibles si se interrumpe el estrés. Hay, no obstante, evidencias derivadas principalmente por estudios que usan ratas de que el estrés puede afectar poco después del nacimiento a la función del hipocampo de modo que el daño persiste a lo largo de la vida.[65]
Epilepsia
[editar]El hipocampo es con frecuencia el foco de los ataques epilépticos: La esclerosis del hipocampo es el tipo más comúnmente visible de daño tisular en la epilepsia del lóbulo temporal.[66] Sin embargo, aún no está claro si la epilepsia está producida por anormalidades en el hipocampo, o bien si éste está dañado por efectos acumulativos de ataques.[67] En condiciones experimentales donde los ataques repetitivos son inducidos artificialmente en animales, el daño en el hipocampo es uno de los resultados frecuentes: Esto puede ser consecuencia de que el hipocampo es una de las partes más eléctricamente excitables del cerebro. También puede estar relacionado con el hecho de que el hipocampo es una de las pocas regiones del cerebro donde la neurogénesis continúa produciéndose a lo largo de la vida.[68]
Esquizofrenia
[editar]No se comprenden bien las causas de la esquizofrenia, pero se han publicado numerosas anormalidades en la estructura cerebral. Las alteraciones más ampliamente estudiadas implican la corteza cerebral, pero también se han descrito efectos sobre el hipocampo. Muchos estudios han encontrado reducciones en el tamaño del hipocampo en sujetos esquizofrénicos.[69] Los cambios probablemente tienen lugar por una alteración del desarrollo más que por un daño tisular, y aparecen incluso en sujetos que nunca han sido medicados. Diversas líneas de evidencia implican cambios en la organización sináptica y en la conectividad.[69] No está claro si las alteraciones en el hipocampo desempeñan un papel produciendo los síntomas psicóticos que son el rasgo más importante de la esquizofrenia. Anthony Grace y sus colaboradores han sugerido, basándose en trabajos experimentales con animales, que la disfunción del hipocampo podría producir una alteración de la liberación de dopamina en los ganglios basales y por ello afectando indirectamente la integración de información en la corteza prefrontal.[70] Otros han sugerido que la disfunción del hipocampo podría explicar los problemas en la memoria a largo plazo que se observan con frecuencia en los esquizofrénicos.[71]
Evolución
[editar]El hipocampo tiene un aspecto similar entre los mamíferos, desde monotremas como el equidna a primates como los humanos.[72] La proporción del tamaño del hipocampo con respecto al tamaño corporal aumenta a grandes rasgos, siendo dos veces mayor en los primates en comparación con el equidna. No se incrementa en ningún organismo de una forma que se aproxime siquiera a cómo lo hace la tasa del neocórtex/tamaño corporal. Por tanto, el hipocampo ocupa una fracción mucho mayor de la corteza en roedores que en primates. En humanos adultos, el volumen del hipocampo en cada lado del cerebro es de unos 3-3,5 cm³, en comparación con los 320-420 cm³ que ocupa el volumen del neocórtex.[73]
También se da una relación general entre el tamaño del hipocampo y la memoria espacial. Cuando se establecen las comparaciones entre especies similares, las que tienen una capacidad espacial mayor tienden a tener mayores volúmenes hipocampales.[74] Esta relación también se extiende al dimorfismo sexual: en especies donde los machos y las hembras muestran diferencias muy fuertes en la capacidad de memoria espacial, también tienden a corresponderse con diferencias en el volumen del hipocampo.[75]
Las especies de no-mamíferos no tienen estructuras cerebrales que se parezcan al hipocampo de mamífero, pero tienen una que es considerada homóloga. El hipocampo, como se ha apuntado más arriba, es esencialmente el extremo medial del córtex. Solo los mamíferos tienen un córtex completamente desarrollado, pero la estructura a partir de la cual evolucionó, llamado el pallium, está presente en todos los vertebrados, incluso los más primitivos como las lampreas o los mixinos.[76] El palio o pallium se divide habitualmente en tres zonas: medial, lateral y dorsal. El pallium medial forma el precursor del hipocampo. No recuerda visualmente al hipocampo porque las capas no están arrolladas en forma de S o envueltas por la circunvolución dentada, pero la homología está sugerida por afinidades químicas y funcionales muy fuertes. Actualmente existen pruebas de que estas estructuras similares al hipocampo están implicadas también en la cognición espacial en aves, reptiles y peces.[77]
En aves, la correspondencia entre estructuras está tan aceptablemente bien establecida, que la mayor parte de los anatomistas se refieren a la zona del palio medio como el hipocampo aviar.[78] Numerosas especies de aves tienen robustas capacidades espaciales, sobre todo las que almacenan alimento en escondites. Existen pruebas de que este tipo de aves tienen un hipocampo mayor que el de otros tipos de aves, y que las lesiones en el hipocampo producen problemas en la memoria espacial.[79]
La historia evolutiva de esta estructura en los peces es más compleja. En teleósteos (que comprenden la gran mayoría de las especies existentes), el cerebro anterior está distorsionado en comparación con otros tipos de vertebrados: la mayor parte de los neuroanatomistas creen que el cerebro anterior de los teleósteos está esencialmente evertido, como un calcetín vuelto del revés, de modo que las estructuras que se localizan en el interior, próximas a los ventrículos, para la mayor parte de los vertebrados, se encuentran en el exterior en los teleósteos y viceversa.[80] Una de las consecuencias de esto es que se piensa que el palio medial (o área "hipocampal") de un vertebrado típico se correspondería con el pallium lateral de un pez típico. Varios tipos de peces (en particular el carpín dorado) han mostrado experimentalmente que tienen grandes capacidades en cuanto a memoria espacial, incluso mediante la formación de "mapas cognitivos" de las áreas que habitan.[74] Existen pruebas de que el daño al palio lateral afecta a la memoria espacial.[81][82]
Por ello, el papel de la región hipocampal en la orientación parece haber tenido origen muy al comienzo de la evolución de los vertebrados, en las ramificaciones que surgieron por la presión de predación que tuvo lugar hace cientos de millones de años.[83] Aún no se sabe si el palio o pallium medial desempeña un papel similar en vertebrados aún más primitivos, como los tiburones o las rayas, o incluso en las lampreas o mixines. Algunos tipos de insectos y moluscos como los pulpos también tienen grandes capacidades de aprendizaje y orientación espacial, pero esto parece funcionar de modo distinto al sistema de percepción espacial de mamíferos, de modo que hasta la fecha no existe una buena razón para pensar que tengan un origen evolutivo común, ni tampoco hay suficientes similitudes en la estructura cerebral para permitir nada que se asemeje a un «hipocampo» que pueda ser identificado en estas especies. Algunos, sin embargo, han propuesto que los cuerpos fungiformes de insectos tienen una función similar a la del hipocampo.[84]
Curiosidades
[editar]Veces que se le ha hecho referencia
[editar]Steins Gate
[editar]Durante la serie, la científica neurológica Kurisu Makise amenaza varias veces con golpear con un táser en el hipocampo del científico loco Okabe Rintarou para que pierda la memoria cada vez que este la molesta.
En 2020, se describió por primera vez en 3D las conexiones neuronales del hipocampo. Un trabajo internacional, liderado por investigadores del Laboratorio Cajal de Circuitos Corticales del Centro Tecnología Biomédica de la Universidad Politécnica de Madrid (UPM), el Instituto Cajal, CSIC de la UPM, y de la Universidad Nacional de Educación a Distancia (UNED), mapeó por primera vez en tres dimensiones las conexiones neuronales del hipocampo, avanzando así en la comprensión del cerebro sano y sus alteraciones en las patologías.[85]
Véase también
[editar]Referencias
[editar]- ↑ Apostolova, L. G. et al. 2015. Relationship between hippocampal atrophy and neuropathology markers: A 7T MRI validation study of the EADC-ADNI Harmonized Hippocampal Segmentation Protocol. En: "Alzheimer's & Dementia: The Journal of the Alzheimer's Association", Vol. 11 , N.º 2, 139-150. DOI 10.1016/j.jalz.2015.01.001
- ↑ a b Duvernoy, Henry M (diciembre de 2005). The Human Hippocampus Functional Anatomy, Vascularization and Serial Sections with MRI (3.ª edición). Springer. ISBN 3540231919.
- ↑ a b c Finger, Stanley (2001). Origins of neuroscience: a history of explorations into brain function. Oxford University Press. p. 363. ISBN 9780195146943.
- ↑ a b c Eichenbaum, H; Otto TA, Wible CG, Piper JM (1991). «Ch 7. Building a model of the hippocampus in olfaction and memory». En Davis JL, Eichenbaum H,, ed. Olfaction. MIT Press. ISBN 9780262041249.
- ↑ Vanderwolf CH (2001). «The hippocampus as an olfacto-motor mechanism: were the classical anatomists right after all?». Behav Brain Res 127: 25-47. PMID 11718883. doi:10.1016/S0166-4328(01)00354-0.
- ↑ Nadel L, O'Keefe J, Black A (1975). «Slam on the brakes: a critique of Altman, Brunner, and Bayer's response-inhibition model of hippocampal function». Behav Biol 14: 151-162. PMID 1137539. doi:10.1016/S0091-6773(75)90148-0.
- ↑ Gray, JA; McNaughton N (2000). The Neuropsychology of Anxiety: An Enquiry into the Functions of the Septo-Hippocampal System. Oxford University Press.
- ↑ Best PJ, White AM (1999). «Placing hippocampal single-unit studies in a historical context». Hippocampus 9: 346-351. PMID 10495017. doi:10.1002/(SICI)1098-1063(1999)9:4<346::AID-HIPO2>3.0.CO;2-3.
- ↑ Scoville, WB; Milner B (1957). «Loss of Recent Memory After Bilateral Hippocampal Lesions». J. Neurol. Neurosurg. Psych. 20: 11-21. PMID 13406589. doi:10.1136/jnnp.20.1.11. Archivado desde el original el 4 de mayo de 2008. Consultado el 16 de agosto de 2007.
- ↑ Carey, B (4 de diciembre de 2008). «H. M., an Unforgettable Amnesiac, Dies at 82». New York Times. Consultado el 27 de abril de 2009.
- ↑ Squire LR (2009). «The legacy of patient H.M. for neuroscience». Neuron 61: 6-9. PMC 2649674. PMID 19146808. doi:10.1016/j.neuron.2008.12.023.
- ↑ a b Squire, LR (1992). «Memory and the hippocampus: a synthesis from findings with rats, monkeys, and humans». Psych. Rev. 99: 195-231. doi:10.1037/0033-295X.99.2.195.
- ↑ O'Keefe J, Dostrovsky J (1971). «The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat». Brain Res 34: 171-175. PMID 5124915. doi:10.1016/0006-8993(71)90358-1.
- ↑ a b O'Keefe, J; Nadel L (1978). The Hippocampus as a Cognitive Map. Oxford University Press. Archivado desde el original el 24 de marzo de 2011. Consultado el 1 de diciembre de 2009.
- ↑ a b c d Moser, EI; Kropf E, Moser M-B (2008). «Place Cells, Grid Cells, and the Brain's Spatial Representation System». Ann. Rev. Neurosci. 31: 69. doi:10.1146/annurev.neuro.31.061307.090723.
- ↑ a b Squire, LR; Schacter DL (2002). The Neuropsychology of Memory. Guilford Press.
- ↑ VanElzakker, MB; Fevurly RD, Breindel T, Spencer RL (2008). «Environmental novelty is associated with a selective increase in Fos expression in the output elements of the hippocampal formation and the perirhinal cortex». Learning & Memory 15: 899-908. PMID 19050162. doi:10.1101/lm.1196508.
- ↑ Diana RA, Yonelinas AP, Ranganath C (2007). «Imaging recollection and familiarity in the medial temporal lobe: a three-component model». Trends Cogn Sci 11: 379-386. PMID 17707683. doi:10.1016/j.tics.2007.08.001.
- ↑ Skaggs WE, McNaughton BL (1996) "Replay of neuronal firing sequences in rat hippocampus during sleep following spatial experience" en Science Vol. 271(5257), pp. 1870-1873. PMID 8596957
- ↑ Matsumura N, Nishijo H, Tamura R, Eifuku S, Endo S, Ono T (1999). «Spatial- and task-dependent neuronal responses during real and virtual translocation in the monkey hippocampal formation». J Neurosci 19: 2381-2393. PMID 10066288. Consultado el 27 de abril de 2009.
- ↑ Rolls ET, Xiang JZ (2006). «Spatial view cells in the primate hippocampus and memory recall». Rev Neurosci 17 (1-2): 175-200. PMID 16703951.
- ↑ Ekstrom, AD; Kahana MJ, Caplan JB, Fields TA, Isham EA, Newman EL, Fried I (2003). «Cellular networks underlying human spatial navigation» (PDF). Nature 425: 184-188. PMID 12968182. doi:10.1038/nature01964. Archivado desde el original el 11 de mayo de 2008. Consultado el 19 de abril de 2008.
- ↑ Smith DM, Mizumori SJ (2006). «Hippocampal place cells, context, and episodic memory». Hippocampus 16: 716-729. PMID 16897724. doi:10.1002/hipo.20208.
- ↑ Chiu YC, Algase D, Whall A, et ál. (2004). «Getting lost: directed attention and executive functions in early Alzheimer's disease patients». Dement Geriatr Cogn Disord 17: 174-180. PMID 14739541. doi:10.1159/000076353.
- ↑ Morris et ál., 1982
- ↑ Solstad T, Boccara CN, Kropff E, Moser MB, Moser EI (2008). «Representation of geometric borders in the entorhinal cortex». Science 322: 1865-1868. PMID 19095945. doi:10.1126/science.1166466.
- ↑ a b Maguire, EA; Burgess N, Donnett JG, Frackowiak RSJ, Firth CD, O'Keefe J (1998). «Knowing Where and Getting There: A Human Navigation Network». Science 280: 921-924. PMID 9572740. doi:10.1126/science.280.5365.921.
- ↑ Maguire, EA; Gadian DG, Johnsrude IS, Good CD, Ashburner J, Frackowiak RS, Frith CD (2000). «Navigation-related structural change in the hippocampi of taxi drivers». PNAS 97: 4398-4403. PMID 10716738. doi:10.1073/pnas.070039597.
- ↑ a b c d Amaral, D; Lavenex P (2006). «Ch 3. Hippocampal Neuroanatomy». En Andersen P, Morris R, Amaral D, Bliss T, O'Keefe J, ed. The Hippocampus Book. Oxford University Press. ISBN 9780195100273.
- ↑ Kötter R, Stephan KE (1997). «Useless or helpful? The "limbic system" concept». Rev Neurosci 8: 139-145. PMID 9344183.
- ↑ Moser, EI; Moser M-B (1998). «Functional differentiation in the hippocampus». Hippocampus 8: 608-619. PMID 9882018. doi:10.1002/(SICI)1098-1063(1998)8:6<608::AID-HIPO3>3.0.CO;2-7.
- ↑ Winson J (1978). «Loss of hippocampal theta rhythm results in spatial memory deficit in the rat». Science 201: 160-163. PMID 663646. doi:10.1126/science.663646.
- ↑ a b Eichenbaum H, Yonelinas AP, Ranganath C (2007). «The medial temporal lobe and recognition memory». Annu Rev Neurosci 30: 123-152. PMC 2064941. PMID 17417939. doi:10.1146/annurev.neuro.30.051606.094328.
- ↑ KRIVOY DE TAUB, Francis. Nuevos aportes en neurociencias y psicoanálisis (en español). Gac Méd Caracas. [online]. jun. 2009, vol.117, no.2 [citado 21 Enero de 2010], p.123-127. ISSN 0367-4762.
- ↑ Netter, Frank H.; Alister Brass (1994). Sistema nervioso: anatomía y fisiología. Elsevier, España. p. 132. ISBN 8445801880.
- ↑ Moore, Keith L. (2004). Embriologia Clinica (7 edición). Elsevier, España. p. 450. ISBN 8481747254.
- ↑ a b Rakic P. DNA synthesis and cell division in the adult primate brain (en inglés). Ann N Y Acad Sci 1985;457:193-211. Último acceso 21 de enero de 2010
- ↑ HENAO, Jorge Alejandro et al. El virus de la inmunodeficiencia humana tipo 1 y el sistema nervioso central en desarrollo (en español). Biomédica [online]. 2005, vol.25, n.1, pp. 136-147. ISSN 0120-4157. Último acceso 21 de enero de 2010
- ↑ Veld BA, Ruitenberg A, Hofman A, Launer LJ, van Duijn CM, Stijnen T, et al. Nonsteroidal antiinflammatory drugs and the risk of Alzheimer's disease (en inglés). N Engl J Med 2001;345:1515-21. Último acceso 21 de enero de 2010
- ↑ Buzsáki, G (2006). Rhythms of the Brain. Oxford University Press. ISBN 0195301064.
- ↑ a b Buzsáki G, Chen LS, Gage FH (1990). «Spatial organization of physiological activity in the hippocampal region: relevance to memory formation». Prog Brain Res 83: 257-268. PMID 2203100. doi:10.1016/S0079-6123(08)61255-8.
- ↑ a b Skaggs WE, McNaughton BL, Permenter M, et ál. (2007). «EEG sharp waves and sparse ensemble unit activity in the macaque hippocampus». J Neurophysiol 98: 898-910. PMID 17522177. doi:10.1152/jn.00401.2007. Archivado desde el original el 31 de julio de 2010. Consultado el 3 de diciembre de 2009.
- ↑ Lubenov EV, Siapas AG (mayo de 2009). «Hippocampal theta oscillations are travelling waves». Nature 459: 534. PMID 19448612. doi:10.1038/nature08010.
- ↑ Buzsáki, G (2002). «Theta oscillations in the hippocampus» (PDF). Neuron 33: 325-340. PMID 11832222. doi:10.1016/S0896-6273(02)00586-X. Archivado desde el original el 25 de junio de 2008. Consultado el 22 de abril de 2008.
- ↑ Cantero, JL; Atienza M, Stickgold R, Kahana MJ, Madsen JR, Kocsis B (26 de noviembre de 2003). «Sleep-dependent theta oscillations in the human hippocampus and neocortex». J Neurosci 23 (34): 10897-10903. PMID 14645485.
- ↑ Vanderwolf, 1969
- ↑ Buzsáki G (1986). «Hippocampal sharp waves: their origin and significance». Brain Res. 398: 242-252. PMID 3026567. doi:10.1016/0006-8993(86)91483-6.
- ↑ Wilson MA, McNaughton BL (1994). «Reactivation of hippocampal ensemble memories during sleep». Science 265: 676-679. PMID 8036517. doi:10.1126/science.8036517.
- ↑ Jackson JC, Johnson A, Redish AD (2006). «Hippocampal sharp waves and reactivation during awake states depend on repeated sequential experience». J. Neurosci. 26: 12415-12426. PMID 17135403. doi:10.1523/JNEUROSCI.4118-06.2006.
- ↑ Sutherland GR, McNaughton B (2000). «Memory trace reactivation in hippocampal and neocortical neuronal ensembles». Curr. Opin. Neurobiol. 10: 180-186. PMID 10753801. doi:10.1016/S0959-4388(00)00079-9.
- ↑ Buzsáki G (1989). «Two-stage model of memory trace formation: a role for "noisy" brain states». Neuroscience 31: 551-570. PMID 2687720. doi:10.1016/0306-4522(89)90423-5.
- ↑ Ramón y Cajal S (1894). «The Croonian Lecture: La Fine Structure des Centres Nerveux». Proc Roy Soc London 55: 444-468. doi:10.1098/rspl.1894.0063.
- ↑ Hebb DO (1949). Organization of Behavior: a Neuropsychological Theory. New York: John Wiley. ISBN 0-471-36727-3.
- ↑ Bliss T, Lømo T (1973). «Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path». J Physiol 232: 331-356. PMC 1350458. PMID 4727084.
- ↑ Cooke SF, Bliss TV (2006). «Plasticity in the human central nervous system». Brain 129: 1659-1673. PMID 16672292. doi:10.1093/brain/awl082.
- ↑ Malenka RC, Bear MF (2004). «LTP and LTD: an embarrassment of riches». Neuron 44: 5-21. PMID 15450156. doi:10.1016/j.neuron.2004.09.012.
- ↑ a b Nakazawa K, McHugh TJ, Wilson MA, Tonegawa S (2004). «NMDA receptors, place cells and hippocampal spatial memory». Nat Rev Neurosci 5: 361-372. PMID 15100719. doi:10.1038/nrn1385.
- ↑ Hampel H, Bürger K, Teipel SJ, Bokde AL, Zetterberg H, Blennow K (2008). «Core candidate neurochemical and imaging biomarkers of Alzheimer's disease». Alzheimers Dement 4: 38-48. PMID 18631949. doi:10.1016/j.jalz.2007.08.006.
- ↑ a b c d Prull MW, Gabrieli JDE, Bunge SA (2000). «Ch 2. Age-related changes in memory: A cognitive neuroscience perspective». En Craik FIM, Salthouse TA, ed. The handbook of aging and cognition. Erlbaum. ISBN 9780805829662.
- ↑ Rosenzweig ES, Barnes CA (2003). «Impact of aging on hippocampal function: plasticity, network dynamics, and cognition». Prog Neurobiol 69: 143-179. PMID 12758108. doi:10.1016/S0301-0082(02)00126-0.
- ↑ Burke SN, Barnes CA (2006). «Neural plasticity in the ageing brain». Nat Rev Neurosci 7: 30-40. PMID 16371948. doi:10.1038/nrn1809.
- ↑ McEwen BS (1999). «Stress and hippocampal plasticity». Annu Rev Neurosci 22: 105-122. PMID 10202533. doi:10.1146/annurev.neuro.22.1.105.
- ↑ Campbell S, Macqueen G (2004). «The role of the hippocampus in the pathophysiology of major depression». J Psychiatry Neurosci 29: 417-426. PMC 524959. PMID 15644983.
- ↑ Campbell S, Macqueen G (2004). «The role of the hippocampus in the pathophysiology of major depression». J Psychiatry Neurosci 29 (6): 417-426. PMC 524959. PMID 15644983.
- ↑ Garcia-Segura LM (2009). Hormones and Brain Plasticity. Oxford University Press US. ISBN 9780195326611.
- ↑ Chang, BS; Lowenstein DH (2003). «Epilepsy». N. Engl. J. Med. 349: 1257-1266. PMID 14507951. doi:10.1056/NEJMra022308. Archivado desde el original el 22 de junio de 2008.
- ↑ Sloviter RS (2005). «The neurobiology of temporal lobe epilepsy: too much information, not enough knowledge». C R Biol 328: 143-153. PMID 15771000. doi:10.1016/j.crvi.2004.10.010.
- ↑ Kuruba R, Hattiangady B, Shetty AK (2009). «Hippocampal neurogenesis and neural stem cells in temporal lobe epilepsy». Epilepsy Behav. 14 Suppl 1: 65-73. PMID 18796338. doi:10.1016/j.yebeh.2008.08.020.
- ↑ a b Harrison PJ (2004). «The hippocampus in schizophrenia: a review of the neuropathological evidence and its pathophysiological implications». Psychopharmacology (Berl.) 174: 151-162. PMID 15205886. doi:10.1007/s00213-003-1761-y.
- ↑ Goto Y, Grace AA (2008). «Limbic and cortical information processing in the nucleus accumbens». Trends Neurosci 31: 552-558. PMID 18786735. doi:10.1016/j.tins.2008.08.002.
- ↑ Boyer P, Phillips JL, Rousseau FL, Ilivitsky S (2007). «Hippocampal abnormalities and memory deficits: new evidence of a strong pathophysiological link in schizophrenia». Brain Res Rev 54: 92-112. PMID 17306884. doi:10.1016/j.brainresrev.2006.12.008.
- ↑ West, MJ (1990). «Stereological studies of the hippocampus: a comparison of the hippocampal subdivisions of diverse species including hedgehogs, laboratory rodents, wild mice and men.». Prog. Brain Res. 83: 13-36. PMID 2203095. doi:10.1016/S0079-6123(08)61238-8.
- ↑ Suzuki M, Hagino H, Nohara S, et ál. (2005). «Male-specific volume expansion of the human hippocampus during adolescence». Cereb Cortex 15: 187-193. PMID 15238436. doi:10.1093/cercor/bhh121.
- ↑ a b Jacobs, LF (2003). «The Evolution of the Cognitive Map». Brain Behav. Evol. 62: 128-139. PMID 12937351. doi:10.1159/000072443.
- ↑ Jacobs, LF; Gaulin SJ, Sherry DF, Hoffman GE (1990). «Evolution of spatial cognition: sex-specific patterns of spatial behavior predict hippocampal size». PNAS 87: 6349-6352. PMID 2201026. doi:10.1073/pnas.87.16.6349.
- ↑ Aboitiz, F; Morales D, Montiel J (2003). «The evolutionary origin of the mammalian isocortex: Towards an integrated developmental and functional approach». Behav. Brain Sciences 26: 535-552. PMID 15179935. doi:10.1017/S0140525X03000128.
- ↑ Rodríguez et ál., 2002
- ↑ Colombo and Broadbent, 2000
- ↑ Shettleworth, SJ (2003). «Memory and Hippocampal Specialization in Food-Storing Birds: Challenges for Research on Comparative Cognition». Brain Behav. Evol. 62: 108-116. PMID 12937349. doi:10.1159/000072441.
- ↑ Nieuwenhuys, R (1982). «An Overview of the Organization of the Brain of Actinopterygian Fishes». Am. Zool. 22: 287-310. doi:10.1093/icb/22.2.287.
- ↑ Portavella, M; Vargas JP, Torres B, Salas C (2002). «The effects of telencephalic pallial lesions on spatial, temporal, and emotional learning in goldfish». Brain Res. Bull. 57: 397-399. PMID 11922997. doi:10.1016/S0361-9230(01)00699-2.
- ↑ Vargas, JP; Bingman VP, Portavella M, López JC (2006). «Telencephalon and geometric space in goldfish». Eur. J. Neurosci. 24: 2870-2878. PMID 17156211. doi:10.1111/j.1460-9568.2006.05174.x.
- ↑ Broglio, C; Gómez A, Durán E, Ocaña FM, Jiménez-Moya F, Rodríguez F, Salas C (2002). «Hallmarks of a common forebrain vertebrate plan: Specialized pallial areas for spatial, temporal and emotional memory in actinopterygian fish». Brain Res. Bull. 57: 397-399. PMID 16144602.
- ↑ Mizunami M, Weibrecht JM, Strausfeld NJ (1998). «Mushroom bodies of the cockroach: their participation in place memory». J Comp Neurol 402: 520-537. PMID 9862324. doi:10.1002/(SICI)1096-9861(19981228)402:4<520::AID-CNE6>3.0.CO;2-K.
- ↑ [1]
- 1. The Human Hippocampus: Functional Anatomy, Vascularization and Serial Sections with MRI. Third Edition. Henri M. Duvernoy.
Enlaces externos
[editar] Wikimedia Commons alberga una galería multimedia sobre Hipocampo.
Wikimedia Commons alberga una galería multimedia sobre Hipocampo.
