Diferencia entre revisiones de «Aminoácido»
m Revertidos los cambios de 189.144.121.66 (disc.) a la última edición de Tirithel |
|||
| Línea 17: | Línea 17: | ||
[[Archivo:Zuiterrionball.svg|center|600px]] |
[[Archivo:Zuiterrionball.svg|center|600px]] |
||
Los aminoácidos a pH |
Los aminoácidos a pH bajo ([[ácido]]) se encuentran mayoritariamente en su forma [[catión]]ica (con carga positiva), y a pH alto ([[básico]]) se encuentran en su forma [[anión]]ica (con carga negativa). Sin embargo, existe un pH especifico para cada aminoácido, donde la carga positiva y la carga negativa son de la misma magnitud y el conjunto de la molécula es eléctricamente neutro. En este estado se dice que el aminoácido se encuentra en su forma de ion dipolar o [[zwitterión]]. |
||
== Clasificación == |
== Clasificación == |
||
Revisión del 20:26 25 oct 2009
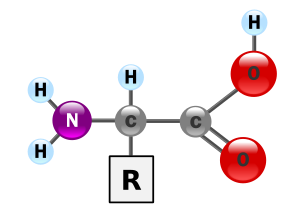
Un aminoácido, como su nombre indica, es una molécula orgánica con un grupo amino (-NH2) y un grupo carboxilo (-COOH; ácido). Los aminoácidos más frecuentes y de mayor interés son aquellos que forman parte de las proteínas. Dos aminoácidos se combinan en una reacción de condensación que libera agua formando un enlace peptídico. Estos dos "residuos" aminoacídicos forman un dipéptido. Si se une un tercer aminoácido se forma un tripéptido y así, sucesivamente, para formar un polipéptido. Esta reacción ocurre de manera natural en los ribosomas, tanto los que están libres en el citosol como los asociados al retículo endoplasmático.
Todos los aminoácidos componentes de las proteínas son alfa-aminoácidos, lo que indica que el grupo amino está unido al carbono alfa, es decir, al carbono contiguo al grupo carboxilo. Por lo tanto, están formados por un carbono alfa unido a un grupo carboxilo, a un grupo amino, a un hidrógeno y a una cadena (habitualmente denominada R) de estructura variable, que determina la identidad y las propiedades de los diferentes aminoácidos; existen cientos de cadenas R por lo que se conocen cientos de aminoácidos diferentes, pero sólo 20 forman parte de las proteínas y tienen codones específicos en el código genético.
La unión de varios aminoácidos da lugar a cadenas llamadas polipéptidos o simplemente péptidos, que se denominan proteínas cuando la cadena polipeptídica supera los 50 aminoácidos o la masa molecular total supera las 5.000 uma.
Estructura general de un aminoácido
La estructura general de un aminoácido se establece por la presencia de un carbono central alfa unido a: un grupo carboxilo (rojo en la figura), un grupo amino (verde), un hidrógeno (en negro) y la cadena lateral (azul):
"R" representa la cadena lateral, específica para cada aminoácido. Técnicamente hablando, se los denomina alfa-aminoácidos, debido a que el grupo amino (–NH2) se encuentra a un átomo de distancia del grupo carboxilo (–COOH). Como dichos grupos funcionales poseen H en sus estructuras químicas, son grupos susceptibles a los cambios de pH; por eso, al pH de la célula prácticamente ningún aminoácido se encuentra de esa forma, sino que se encuentra ionizado.

Los aminoácidos a pH bajo (ácido) se encuentran mayoritariamente en su forma catiónica (con carga positiva), y a pH alto (básico) se encuentran en su forma aniónica (con carga negativa). Sin embargo, existe un pH especifico para cada aminoácido, donde la carga positiva y la carga negativa son de la misma magnitud y el conjunto de la molécula es eléctricamente neutro. En este estado se dice que el aminoácido se encuentra en su forma de ion dipolar o zwitterión.
Clasificación
Existen muchas formas de clasificar los aminoácidos; las dos formas que se presentan a continuación son las más comunes.
Según las propiedades de su cadena

Los aminoácidos se clasifican habitualmente según las propiedades de su cadena lateral:
- Neutros polares, polares o hidrófilos : Serina (Ser, S), Treonina (Thr, T), Cisteína (Cys, C), Asparagina (Asn, N), Glutamina (Gln, Q) y Tirosina (Tyr, Y).
- Neutros no polares, apolares o hidrófobos: Glicina (Gly, G), Alanina (Ala, A), Valina (Val, V), Leucina (Leu, L), Isoleucina (Ile, I), Metionina (Met, M), Prolina (Pro, P), Fenilalanina (Phe, F) y Triptófano (Trp, W).
- Con carga negativa, o ácidos: Ácido aspártico (Asp, D) y Ácido glutámico (Glu, E).
- Con carga positiva, o básicos: Lisina (Lys, K), Arginina (Arg, R) e Histidina (His, H).
- Aromáticos: Fenilalanina (Phe, F), Tirosina (Tyr, Y) y Triptófano (Trp, W) (ya incluidos en los grupos neutros polares y neutros no polares).
Según su obtención
A los aminoácidos que necesitan ser ingeridos por el cuerpo para obtenerlos se los llama esenciales; la carencia de estos aminoácidos en la dieta limita el desarrollo del organismo, ya que no es posible reponer las células de los tejidos que mueren o crear tejidos nuevos, en el caso del crecimiento. Para el ser humano, los aminoácidos esenciales son:
- Valina (Val)
- Leucina (Leu)
- Treonina (Thr)
- Lisina (Lys)
- Triptófano (Trp)
- Histidina (His)
- Fenilalanina (Phe)
- Isoleucina (Ile)
- Tirosina (Tyr)
- Metionina (Met)
Según su capacidad de síntesis
aminoácidos esenciales o indispensables: los organismos superiores no los sintetizan, es necesario incluirlos en la dieta. Estos son:
- Valina (Val)
- Leucina (Leu)
- Metionina (Met)
- Triptófano (Trp)
- Histidina (His)
A los aminoácidos que pueden ser sintetizados por el cuerpo se los conoce como no esenciales y son:
- Alanina (Ala)
- Prolina (Pro)
- Glicina (Gly)
- Serina (Ser)
- Cisteína (Cys)
- Asparagina (Asn)
- Glutamina (Gln)
- Tirosina (Tyr)
- Ácido aspártico (Asp)
- Ácido glutámico (Glu)
Estas clasificaciones varían según la especie. Se han aislado cepas de bacterias con requerimientos diferenciales de cada tipo de aminoácido.
Los datos actuales en cuanto a número de aminoácidos y de enzimas ARNt sintetasas se contradicen hasta el momento, puesto que se ha comprobado que existen 22 aminoácidos distintos que intervienen en la composición de las cadenas polipeptídicas y que las enzimas ARNt sintetasas no son siempre exclusivas para cada aminoácido. El aminoácido número 21 es la Selenocisteína que aparece en eucariotas y procariotas y el número 22 la Pirrolisina, que aparece sólo en arqueas (o arqueobacterias).
Aminoácidos codificados en el genoma
Los aminoácidos proteicos, canónicos o naturales son aquellos que están codificados en el genoma; para la mayoría de los seres vivos son 20: alanina, arginina, asparagina, aspartato, cisteína, fenilalanina, glicina, glutamato, glutamina, histidina, isoleucina, leucina, lisina, metionina, prolina, serina, tirosina, treonina, triptófano y valina.
Sin embargo, hay unas pocas excepciones: en algunos seres vivos el código genético tiene pequeñas modificaciones y puede codificar otros aminoácidos. Por ejemplo: selenocisteína y pirrolisina.[1][2][3]
Aminoácidos no proteicos
Existen además de los 20 aminoácidos proteicos alrededor de 150 adicionales que no se consideran proteicos aunque aparecen en algunas proteínas. Son derivados de otros aminoácidos, es decir, se incorporan a la proteína como uno de los aminoácidos proteicos y, después de haber sido formada la proteína, se modifican químicamente; por ejemplo, la hidroxiprolina.
Algunos aminoácidos no proteicos actúan como neurotransmisores, vitaminas, etc. Por ejemplo, la beta-alanina, el ácido gamma-aminobutírico (GABA) o la biotina.
Propiedades
- Ácido-básicas.
- Comportamiento de cualquier aminoácido cuando se ioniza. Cualquier aminoácido puede comportarse como ácido y como base, se denominan sustancias anfóteras.
- Cuando una molécula presenta carga neta cero está en su punto isoeléctrico. Si un aminoácido tiene un punto isoeléctrico de 6,1 su carga neta será cero cuando el pH sea 6,1.
- Los aminoácidos y las proteínas se comportan como sustancias tampón.
- Ópticas.
- Todos los aminoácidos excepto la glicina tienen el carbono alfa asimétrico, lo que les confiere actividad óptica; esto es, sus disoluciones desvían el plano de polarización cuando un rayo de luz polarizada las atraviesa. Si el desvío del plano de polarización es hacia la derecha (en sentido horario), el compuesto se denomina dextrógiro, mientras que si se desvía a la izquierda (sentido antihorario)se denomina levógiro. Un aminoácido puede en principio existir en sus dos formas enantioméricas (una dextrógira y otra levógira), pero en la naturaleza lo habitual es encontrar sólo una de ellas.
- Estructuralmente, las dos posibles formas enantioméricas de cada aminoácido se denominan configuración D o L dependiendo de la orientación relativa en el espacio de los 4 grupos distintos unidos al carbono alfa. El hecho de que sea dextrógiro no quiere decir que tenga configuración D.
- Químicas.
- Las que afectan al grupo carboxilo, como la descarboxilación.
- Las que afectan al grupo amino, como la desaminación.
- Las que afectan al grupo R.
Reacciones de los aminoácidos
En los aminoácidos hay tres reacciones principales que se inician cuando un aminoácido se une con el piridoxal-P formando una base de Schiff o aldimina. De ahí en adelante la transformación depende de las enzimas, las cuales tienen en común el uso de la coenzima piridoxal-fosfato. Las reacciones que se desencadenan pueden ser:
- la transaminación (transaminasa): Necesita la participación de un α-cetoácido.
- la descarboxilación
- la racemización: Es la conversión de un compuesto L en D, o viceversa. Aunque en las proteínas de un ser vivo los aminoácidos están presentes únicamente en la forma estructural levógira (L), en las bacterias podemos encontrar D-aminoácidos.
Notas
- ↑ [http://web.utah.edu/unews/releases/02/may/amino.html 22nd Amino Acid Reflects Genetic Versatility University of Utah Geneticists Write Science Commentary on Discovery], Universidad de Utah
- ↑ Un nuevo aminoácido natural llamado pirrolisina, Ciencia15
- ↑ Síntesis Proteica, Facultad de Agroindustrias de la Universidad Nacional del Nordeste.
Véase también
Referencias bibliográficas
- Rodríguez-Sotres, Rogelio. La estructura de las proteínas. Consultado el 11/1/2002.
- Leninhger Principios de bioquímica, Omega, Barcelona, 2000.
- Pato Pino Bioquímica II, Alfa, Buenos Aires, 2008.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Aminoácido.
Wikimedia Commons alberga una galería multimedia sobre Aminoácido.- Estructura de las proteínas
