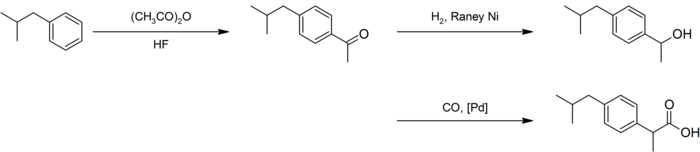Ibuprofeno
| Ibuprofeno | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
| ácido (RS)-2-(4-isobutilfenil)propanoico | ||
| Identificadores | ||
| Número CAS | 15687-27-1 | |
| Código ATC | M01AE01 | |
| PubChem | 3672 | |
| DrugBank | DB01050 | |
| ChemSpider | 3544 | |
| UNII | WK2XYI10QM | |
| KEGG | D00126 | |
| ChEBI | 5855 | |
| Datos químicos | ||
| Fórmula | C13H18O2 | |
| Peso mol. | 206,29 g/mol | |
|
CC(C)Cc1ccc(cc1)C(C)C(=O)O
| ||
|
InChI=1S/C13H18O2/c1-9(2)8-11-4-6-12(7-5-11)10(3)13(14)15/h4-7,9-10H,8H2,1-3H3,(H,14,15)
Key: HEFNNWSXXWATRW-UHFFFAOYSA-N | ||
| Datos físicos | ||
| P. de fusión | 76 °C (169 °F) | |
| Farmacocinética | ||
| Biodisponibilidad | 49–73% | |
| Unión proteica | 99% | |
| Metabolismo | Hepático (CYP2C9) | |
| Vida media | 1.8–2 horas | |
| Excreción | Renal | |
| Datos clínicos | ||
| Nombre comercial | Brufen, genéricos | |
| Inf. de Licencia | FDA:enlace | |
| Cat. embarazo | C (AU) Evidencia de riesgo para el feto, aunque el beneficio potencial de su uso en embarazadas puede ser aceptable a pesar del riesgo probable solo en algunas situaciones. Queda a criterio del médico tratante. (EUA) | |
| Estado legal | GSL (UK) OTC (EUA) | |
| Vías de adm. | Oral, rectal, tópica, intravenosa, inhalada | |
El ibuprofeno es un antiinflamatorio no esteroideo (AINE), utilizado frecuentemente como antipirético, analgésico y antiinflamatorio. Se utiliza para el alivio sintomático de la fiebre, dolor de cabeza (cefalea), dolor dental (odontalgia), dolor muscular o mialgia, molestias de la menstruación (dismenorrea), dolor neurológico de carácter leve o moderado y dolor postquirúrgico. También se usa para tratar cuadros inflamatorios, como los que se presentan en artritis, artritis reumatoide (AR), hinchazón muscular, dolor de garganta y artritis gotosa. Es usado en ocasiones para tratar el acné debido a sus propiedades antiinflamatorias[1] y ha sido expendido en Japón en forma tópica para acné de adultos.[2]
Indicaciones
[editar]El ibuprofeno se usa principalmente como antipirético para tratar cuadros febriles (incluida la fiebre post-vacunal) y como analgésico para tratar el dolor leve o moderado: dolor postquirúrgico, dolor de origen dental, cefalea, migraña, dismenorrea primaria,[3] artrosis y dolor por cálculos renales. Alrededor del 60 % de las personas responde a cualquier AINE; los que no responden bien a uno en particular pueden sí responder a otro.[4]
Se utiliza además para tratar enfermedades inflamatorias como la artritis idiopática juvenil, la artritis reumatoide,[5][6] espondilitis anquilopoyética, artrosis y otros procesos reumáticos agudos o crónicos, y cualquier alteración musculoesquelética y traumática que curse con dolor e inflamación.[3] También se utiliza para la pericarditis y ductus arterioso persistente.[7]
Posología
[editar]Generalmente la dosis recomendada para adultos es de unos 1200 mg diarios.[8] Sin embargo, bajo supervisión médica, la cantidad máxima de ibuprofeno para adultos es de 800 mg por dosis o 3200 mg por día.[9] En niños es de 5 a 10 mg por kg en un intervalo de tiempo de 6 a 8 horas, con una dosis diaria máxima de 30 mg/kg.[10]
Farmacocinética
[editar]Se absorbe de forma total, por vía oral. Los alimentos reducen la velocidad de absorción, pero no la cantidad absorbida. Su combinación con L-arginina acelera su velocidad de absorción.[11]
Historia
[editar]
En 1953, los químicos Stewart Adams y John Nicholson, empleados de Boots Group, comienzan a trabajar para identificar un análogo de la aspirina para tratar la artritis reumatoide.[12][13]
En 1961, Stewart Adams y John Nicholson descubrieron el ácido 2-(4-isobutilfenil) propiónico, y solicitan una patente en 1962, que luego fue concedida en 1966, con el numero: US3228831A.
En 1969, el fármaco fue lanzado como un tratamiento para la artritis reumatoidea en el Reino Unido , y en los Estados Unidos en 1974.[14] Es famoso el hecho de que el Dr. Adams inicialmente probó este medicamento durante una resaca.[14]
En 1974, Nueva patente del ibuprofeno con numero US3784705A, fue concedida a los químicos Stewart Adams, John Nicholson, Antonio Ribera Blancafort y Bernard J. Armitage.
En 2019, María África Madriaga, viuda de Antonio Ribera, apareció en varios medios de comunicación, afirmando que Ribera fue uno de los creadores del ibuprofeno.
El ibuprofeno forma parte del listado de la Organización Mundial de la Salud de medicamentos indispensables.[15]
Estereoquímica
[editar]El ibuprofeno, al igual que otros derivados de 2-arilpropionato (incluyendo ketoprofeno, flurbiprofeno, naproxeno, etc.), contiene un carbono quiral en la posición α (alfa-) del propionato.
 |
 |
 |
 |
 |
 |
Esto es determinante a la hora de estudiar el metabolismo de este profármaco, que se puede definir como fármacos unidos a un grupo modulador lábil, que requieren ser transformados dentro del organismo por un proceso hidrolítico, químico o enzimático, para que manifiesten su actividad biológica.
Síntesis
[editar]La síntesis de este compuesto es un popular caso estudiado en química verde (química sostenible).[16] La síntesis original del ibuprofeno consiste en seis pasos. Se inicia con la acilación del isobutilbenceno mediante Friedel-Crafts. La reacción con cloroacetato de etilo (condensación de Darzens) da el α,β-epoxiéster, que es descarboxilado e hidrolizado hacia el aldehído. La reacción con hidroxilamina da la oxima, convertida a continuación al nitrilo. Esta se hidroliza al ácido deseado:[17]
Una síntesis mejorada por BHC requiere de solo tres pasos. Esta síntesis mejorada ganó el premio "Presidential Green Chemistry Challenge Greener Synthetic Pathways" en 1997.[18] Después de una acilación similar a la de la síntesis anterior, la hidrogenación con el níquel Raney da como resultado el alcohol, que por carbonilación catalizada por paladio da la molécula final:
Solubilidad
[editar]El ibuprofeno es prácticamente insoluble en agua, se disuelve menos de 1 mg de ibuprofeno en 1 ml de agua (< 1 mg/ml). Es soluble en disolventes orgánicos como etanol o acetona. [19]
Acción
[editar]La acción principal de todos los AINE es la inhibición de la ciclooxigenasa. Esta enzima convierte el ácido araquidonico en endoperóxidos cíclicos, los cuales se transforman en prostaglandinas y en tromboxanos mediadores de la inflamación y factores biológicos locales, no circulantes llamados autacoides, incluyendo los eicosanoides.
La inhibición de la síntesis de prostaglandinas y tromboxanos por el ibuprofeno es responsable de su actividad terapéutica, esta es una inhibición competitiva.
Al inhibir a la ciclooxigenasa y la subsecuente síntesis de prostaglandinas, se reduce la liberación de sustancias y mediadores inflamatorios, previniéndose la activación de los receptores del dolor llamados nociceptores.[20]
Metabolismo
[editar]Se han observado inversiones metabólicas en los estereocentros de fármacos quirales como el ibuprofeno. El enantiómero (-)-R es enzimáticamente isomerizado al eutómero (+)-S, pudiendo considerarse como un profármaco de este último. El mecanismo de isomerización implica una conversión inicial del enantiómero (-)-R en su tioéster de la CoA, generando un intermedio con un metino en α altamente acídico y que puede ser rápidamente desprotonado y reprotonado, probablemente mediante una reacción enzimática a través del enol, con la consiguiente epimerización. La hidrólisis posterior conduce al eutómero del ibuprofeno.
El hecho de que el eutómero no parezca sufrir una epimerización similar puede explicarse atendiendo a la estereoselectividad de la CoA-sintetasa que actúa preferentemente sobre el enantiómero (-)-R. El eutómero (+)-S es excretado como un conjugado de glicina, mientras que el enantiómero (-)-R no es un sustrato para la glicina-N-acetiltransferasa. Como se ha indicado, debido a este mecanismo de isomerización, el enantiómero (-)-R puede considerarse un profármaco del eutómero (+)-S y contribuye al perfil farmacodinámico global del racemato. Esta forma de metabolizarse no es igual para todos los proféns, debido a que lo determinante es la rapidez de la inversión. En el caso del ibuprofeno es rápida, pero para inversiones lentas, hay que considerar el enantiómero (-)-R como impureza innecesaria.
Toxicidad en humanos
[editar]La sobredosis por ibuprofeno se ha convertido en algo común desde que se puede conseguir sin receta. Hay muchos casos de sobredosis en la historia de la medicina, aunque la cantidad de complicaciones que amenazan la vida por sobredosis de ibuprofeno es baja.[21] La respuesta humana en los casos de sobredosis se extiende desde la ausencia de síntomas, al resultado fatal a pesar de tratamientos en cuidados intensivos. La mayoría de los síntomas son un exceso de la acción del ibuprofeno e incluyen dolor abdominal, náuseas, vómitos, somnolencia, mareos, dolor de cabeza, zumbido de oídos y nistagmo. Rara vez los síntomas pueden ser más graves, se conocen de algunos como hemorragia gastrointestinal, convulsiones, acidosis metabólica, hiperpotasemia, hipotensión, bradicardia, taquicardia, fibrilación auricular, coma, insuficiencia hepática, insuficiencia renal aguda, cianosis, depresión respiratoria y paro cardíaco.[22] La gravedad de los síntomas varía según la dosis ingerida y el tiempo transcurrido, sin embargo, la tolerancia de cada persona a la dosis también juega un papel importante. Generalmente, los síntomas por sobredosis de ibuprofeno observados son similares a los síntomas causados por sobredosis de otros AINE.
Hay poca correlación entre la severidad de los síntomas y los niveles plasmáticos de ibuprofeno medidos. Los efectos tóxicos son poco probables en dosis inferiores a 100 mg/kg pero pueden ser graves por encima de los 400 mg/kg (alrededor de 150 comprimidos de 200 mg para un hombre normal).[23] Sin embargo, dosis altas no indican que el cuadro clínico vaya a ser letal.[24] No es posible determinar una dosis letal precisa, ya que puede variar con la edad, el peso y las enfermedades asociadas al paciente, siempre manteniendo fuera del alcance o de la vista de los niños.
La terapia está basada en los síntomas. En casos tempranos se recomienda la descontaminación gástrica. La descontaminación se hace con carbón activado, el cual absorbe el medicamento antes de que entre al sistema circulatorio. Actualmente el lavado gástrico apenas se realiza, en cambio, puede ser realizado si la cantidad ingerida es potencialmente mortal dentro de los 60 minutos tras la ingesta. El vómito no es recomendado.[25] La mayoría de las ingestiones de ibuprofeno producen efectos leves y el tratamiento para la sobredosis es sencillo. Las medidas básicas para mantener la producción normal de orina deben de ser entabladas y la función renal supervisada. Dado que el ibuprofeno contiene propiedades ácidas y es excretado por la orina, la diuresis forzada alcalina es teóricamente beneficiosa. Sin embargo, como el ibuprofeno se une fuertemente a las proteínas en la sangre, hay una excreción mínima renal del fármaco inalterado. La diuresis forzada alcalina tiene un beneficio limitado.[26] El tratamiento sintomático para la hipotensión, la hemorragia gastrointestinal, acidosis, y la toxicidad renal serán indicadas. Ocasionalmente, la supervisión en la UCI (Unidad de Cuidados Intensivos) durante varios días es necesaria. Si el paciente sobrevive a una intoxicación aguda, normalmente no experimentará secuelas.
Detección en fluidos corporales
[editar]El ibuprofeno puede ser cuantificado en la sangre, el plasma y el suero para demostrar la presencia del medicamento en una persona que ha experimentado una reacción anafiláctica, confirmar un diagnóstico de intoxicación en pacientes hospitalizados o colaborar en una investigación de una muerte. Hay un nomograma publicado donde se relaciona la concentración de ibuprofeno en el plasma, con el tiempo transcurrido desde la ingestión, y el riesgo de desarrollar toxicidad renal en pacientes con sobredosis.[27]
Efectos adversos
[editar]- Estreñimiento
- Diarrea
- Gases o distensión abdominal
- Mareo y vómito
- Nerviosismo
- Tinnitus
Efectos más graves
[editar]- Aumento de peso inexplicable
- Fiebre
- Ampollas
- Sarpullido
- Comezón
- Urticaria
- Hinchazón de ojos, cara, labios, lengua, garganta, brazos, manos, pies, tobillos y pantorrillas
- Dificultad para respirar o tragar
- Ronquera
- Cansancio excesivo
- Dolor en la parte superior derecha del abdomen[28]
- Náuseas
- Pérdida del apetito
- Coloración amarillenta en la piel o los ojos
- Síntomas parecidos a los de la gripe
- Palidez
- Latidos del corazón rápidos
- Orina turbia, descolorida o sanguinolenta
- Dolor de espalda
- Sinagesia
- Dificultad o dolor al orinar
- Visión borrosa, cambios en el color de la visión u otros problemas de la visión
- Ojos enrojecidos o doloridos
- Rigidez en el cuello
- Dolor de cabeza
- Confusión
- Agresividad[29]
Sobredosis
[editar]Los síntomas de sobredosis son, entre otros:
- Mareo
- Zumbido en los oídos
- Gigantismo
- Movimientos rápidos e incontrolables de los ojos (nistagmo)
- Respiración lenta o interrupción momentánea de la respiración (apnea)
- Coloración azul alrededor de los labios, la boca y la nariz (cianosis)[29]
- Deshidratación
- Alergia al Ibuprofeno
- Taquicardia
Incidencia ambiental
[editar]El organismo es capaz de metabolizar hasta un 90% del ibuprofeno ingerido, pero el restante 10% se excreta a las aguas junto con los otros metabolitos resultantes de la digestión del fármaco. Este hecho puede afectar más de lo que creemos al medio ambiente, debido al fenómeno de bioacumulación y toxicidad del fármaco. Dado que la principal vía por la que el fármaco puede llegar al medio ambiente es por medio de las aguas residuales, un mejor tratamiento de estas aguas incorporando más filtros o tratamientos físico-químicos adecuados podría disminuir la presencia de este fármaco en el entorno. Se ha logrado la eliminación de ibuprofeno de las aguas residuales por ultrasonidos,[30] y mediante la degradación fotocatalítica del ibuprofeno mediante dióxido de titanio.[31]
Características electroquímicas y consecuencias cardíacas
[editar]De un análisis superficial de la configuración bioelectroquímica del ibuprofeno se puede decir lo siguiente:[32]
- Se observan dos enlaces débiles de un solo electrón en ambos laterales que presumiblemente produce una ruptura del Ibuprofeno en cuatro submoléculas.
- La ruptura produce un cambio de la estructura de enlace electrónica relacionada con el anillo de carbonos central y subestructuras laterales.
- Se observa un enlace fuerte en el enlace carbono hidroxilo C-OH.
- El enlace de este hidroxilo actúa como un ácido graso con un enlace extraño, más fuerte e infrecuente.
- Algunos ácidos grasos son sintetizados en el músculo cardíaco.
- El enlace fuerte que une el átomo de carbono lateral con el hidroxilo OH, tiene una configuración de tres electrones. En un ácido graso normal, esta configuración es de dos electrones. Posiblemente ésta sea la causa de sobreesfuerzo cardíaco relacionado con el ibuprofeno.
Véase también
[editar]Referencias
[editar]- ↑ RC, Wong; Kang S; Heezen JL; Voorhees JJ; Ellis CN. (Dec de 1984). «Oral ibuprofen and tetracycline for the treatment of acne vulgaris». Journal of the American Academy of Dermatology.
- ↑ «In Japan, an OTC ibuprofen ointment (Fukidia) for alleviating adult acne has been launched», Inpharma 1 (1530), 25 de marzo de 2006: 18. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ a b «Ibuprofeno». Vidal Vademecum Spain. Consultado el 16 de julio de 2016.
- ↑ «10.1.1 Non-steroidal anti-inflammatory drugs». : British National Formulary. Archivado desde el original el 17 de noviembre de 2016. Consultado el 13 de abril de 2016.
- ↑ Joint Formulary Committee (2013). British National Formulary (BNF) (65 edición). London, UK: Pharmaceutical Press. pp. 665, 671. ISBN 978-0-85711-084-8.
- ↑ Rossi, S, ed. (2013). Australian Medicines Handbook (2013 edición). Adelaide: The Australian Medicines Handbook Unit Trust. ISBN 978-0-9805790-9-3.
- ↑ «Ibuprofen». The American Society of Health-System Pharmacists. Consultado el 3 de abril de 2011.
- ↑ /index.cfm?fuseaction=Search.SearchAction&SearchTerm=Ibuprofen&SearchType=BasicSearch «Ibuprofen». U.S. Food and Drug Administration (FDA).
- ↑ «Topical NSAIDs: plasma and tissue concentrations». Bandolier. Archivado desde el original el 17 de abril de 2016. Consultado el 4 de enero de 2010.
- ↑ Dosificación de ibuprofeno en niños. Pediamécum (AEP). Consultado el 22/abr/2013
- ↑ «L-arginina». MedlinePlus. 21 de marzo de 2013. Consultado el 11 de junio de 2013.
- ↑ International Ibuprofen Foundation, http://www.ibuprofen-foundation.com/what-ibuprofen/story.htm Archivado el 5 de diciembre de 2018 en Wayback Machine.
- ↑ Adams SS (abril de 1992). «The propionic acids: a personal perspective». J Clin Pharmacol 32 (4): 317-23. PMID 1569234. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ a b «Dr Stewart Adams: 'I tested ibuprofen on my hangover' - Telegraph». Consultado el 20 de enero de 2008.
- ↑ «WHO Model List of Essential Medicines» (PDF). World Health Organization. marzo de 2005. Consultado el 12 de marzo de 2006.
- ↑ González, ML.; Valea, A (2009). El compromiso de enseñar química con criterios de sostenibilidad: la química verde. Educación Química, nº2, p 48-52
- ↑ «Copia archivada». Archivado desde el original el 5 de junio de 2014. Consultado el 18 de septiembre de 2014.
- ↑ «Presidential Green Chemistry Challenge: 1997 Greener Synthetic Pathways Award». U.S. Environmental Protection Agency. Archivado desde el original el 1 de septiembre de 2009. Consultado el 18 de agosto de 2009.
- ↑ Motrin (Ibuprofeno) descripción de fármacos - El FDA aprobado para los medicamentos con receta y medicamentos a RxList Archivado el 12 de septiembre de 2008 en Wayback Machine.
- ↑ Hardman, Joel G.; Limbird, Lee E.; Goodman Gilman, Alfred. (1996.). «27: Analgésicos-antipiréticos, antiinflamatorios y fármacos que se utilizan en el tratamiento de la gota.». (9a. edición). México, D.F.: McGraw-Hill-Interamericana. ISBN 0-07-026266-7. Goodman & Gilman, las bases farmacológicas de la terapéutica.
- ↑ McElwee NE, Veltri JC, Bradford DC, Rollins DE. (1990). «A prospective, population-based study of acute ibuprofen overdose: complications are rare and routine serum levels not warranted.». Ann Emerg Med 19 (6): 657-62. PMID 2188537. doi:10.1016/S0196-0644(05)82471-0.
- ↑ Vale JA, Meredith TJ. (1986). «Acute poisoning due to non-steroidal anti-inflammatory drugs. Clinical features and management.». Med Toxicol 1 (1): 12-31. PMID 3537613.
- ↑ Volans G, Hartley V, McCrea S, Monaghan J. (2003). «Non-opioid analgesic poisoning». Clinical Medicine 3 (2): 119-23. PMID 12737366. doi:10.1007/s10238-003-0014-z.
- ↑ Seifert SA, Bronstein AC, McGuire T (2000). «Massive ibuprofen ingestion with survival». J. Toxicol. Clin. Toxicol. 38 (1): 55-7. PMID 10696926. doi:10.1081/CLT-100100917.
- ↑ American Academy Of Clinical Toxico; European Association Of Poisons Cen (2004). «Position paper: Ipecac syrup». J. Toxicol. Clin. Toxicol. 42 (2): 133-43. PMID 15214617. doi:10.1081/CLT-120037421.
- ↑ Hall AH, Smolinske SC, Conrad FL, et al. (1986). «Ibuprofen overdose: 126 cases». Ann Emerg Med 15 (11): 1308-13. PMID 3777588. doi:10.1016/S0196-0644(86)80617-5.
- ↑ R. Baselt, Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, CA, 2008, pp. 758-761.
- ↑ «Topical NSAIDs: plasma and tissue concentrations», Bandolier, archivado desde el original el 17 de abril de 2016, consultado el 4 de enero de 2010.
- ↑ a b Ibuprofeno en Medline Plus
- ↑ F. Méndez-Arriaga, R.A. Torres-Palma, C. Pétrier, S. Esplugas, J. Gimenez, C. Pulgarin. Ultrasonic treatment of water contaminated with ibuprofen. Water Research 42 (16): 4243-4248, 2008.
- ↑ Marcela Papamija, Víctor Sarriab (enero - junio de 2010). «Degradación fotocatalítica del ibuprofeno empleando dióxido de titanio». Revista de ingeniería. Universidad de los Andes (Bogotá D.C., Colombia.): 47-53. Archivado desde el original el 24 de mayo de 2013.
- ↑ «IBUPROFENO». © 2016 El León de El Español Publicaciones S.A.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Ibuprofeno.
Wikimedia Commons alberga una categoría multimedia sobre Ibuprofeno.- La AEMPS informa que ningún dato indica que el ibuprofeno agrave las infecciones por COVID-19
- Ibuprofeno y Lactancia | E-Lactancia
- Para qué sirve el Ibuprofeno
- Medicamentos comercializados con el principio activo Ibuprofeno
- En MedlinePlus hay más información sobre Ibuprofeno