Ácido isociánico
| Ácido isociánico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ácido isociánico | ||
| General | ||
| Otros nombres | Isocianato de hidrógeno | |
| Fórmula semidesarrollada | HNCO | |
| Fórmula estructural |
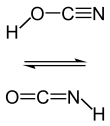 | |
| Fórmula molecular | HNCO | |
| Identificadores | ||
| Número CAS | 75-13-8[1] | |
| ChEBI | 29202 | |
| ChemSpider | 6107 | |
| PubChem | 6347 | |
| UNII | QKG6U31925 | |
| Propiedades físicas | ||
| Apariencia | Líquido incoloro o gas (cerca de temperatura ambiente) | |
| Densidad | 1140 kg/m³; 1,14 g/cm³ | |
| Masa molar | 43,03 g/mol | |
| Punto de fusión | 187,15 K (−86 °C) | |
| Punto de ebullición | 296,65 K (24 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | Soluble en agua, benceno, tolueno y éter | |
| Compuestos relacionados | ||
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Él ácido isociánico es un compuesto inorgánico con la fórmula HNCO, descubierto en 1830 por Liebig y Wöhler.[2] Esta sustancia incolora es volátil y venenosa, con un punto de ebullición de 23.5 °C. El ácido isociánico es el compuesto químico más sencillo formado por hidrógeno, nitrógeno carbono y oxígeno, los cuatro elementos más encontrados en la química orgánica y la biología.
Preparación y reacciones
[editar]El ácido isociánico puede ser sintetizado al añadir protones al anión isocianato, en sales como cianato de potasio con el cloruro de hidrógeno o el ácido oxálico.,[3] por ejemplo:
- H+ + NCO- → HNCO
El ácido isociánico también puede ser sintetizado en la descomposición a altas temperaturas del ácido cianúrico, un trímero.
El ácido isociánico hidroliza a dióxido de carbono y amoníaco:
- HNCO + H2O → CO2 + NH3
En concentraciones altas, el ácido isociánico oligomeriza para dar ácido cianúrico y ciamelida, un polímero. Estas especies químicas son normalmente fáciles de separar de los productos de la reacción. Las disoluciones diluidas del ácido isociánico son estables en disolventes inertes, por ejemplo éter.[4]
El ácido isociánico reacciona con grupos amino para dar ureas:
- HNCO + RNH2 → RNHC(O)NH2
Isómeros
[editar]La fotólisis de sólidos a baja temperatura de HNCO suele dar lugar a H-O-C≡N, conocido como ácido ciánico o cianato de hidrógeno; es un tautómero.[5] del ácido isociánico. El ácido ciánico en estado puro no ha sido aislado y el ácido isociánico es la forma predomninante en todos los disolventes.[4] Nótese que a veces cuando se cita el ácido ciánico se está refiriendo al ácido isociánico.
Los ácidos ciánico e isociánico son isómeros del ácido fulmínico (H-C=N-O), un compuesto inestable.[6]
Véase también
[editar]Referencias
[editar]- ↑ Número CAS
- ↑ Liebig, J.; Wöhler, F. (1830). «Untersuchungen über die Cyansäuren». Ann. Phys. 20: 394. doi:10.1002/andp.18300961102.
- ↑ Fischer, G.; Geith, J.; Klapötke, T. M.; Krumm B. (2002). «Synthesis, Properties and Dimerization Study of Isocyanic Acid». Z. Naturforschung. 57b (1): 19-25.
- ↑ a b A. S. Narula, K. Ramachandran “Isocyanic Acid” in Encyclopedia of Reagents for Organic Synthesis, 2001, John Wiley & Sons, New York. doi 10.1002/047084289X.ri072m Article Online Posting Date: April 15, 2001.
- ↑ Jacox, M.E.; Milligan, D.E. (1964). «Low-Temperature Infrared Study of Intermediates in the Photolysis of HNCO and DNCO». Journal of Chemical Physics 40: 2457-2460. doi:10.1063/1.1725546.
- ↑ Kurzer, Frederick (2000). «Fulminic Acid in the History of Organic Chemistry». Journal of Chemical Education 77: 851-857.
Más información
[editar]- Handbook of Chemistry and Physics, 65th. Edition, CRC Press (1984)
Enlaces externos
[editar]- Walter, Wolfgang (1997). Organic Chemistry: A Comprehensive Degree Text and Source Book. Chichester: Albion Publishing. p. 364. Consultado el 21 de junio de 2008.
- Cyanic acid from NIST Chemistry WebBook (accessed 2006-09-09)
