Sulfato de bario
| Sulfato de bario | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Fórmula estructural |
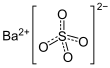 | |
| Fórmula molecular | BaSO4 | |
| Identificadores | ||
| Número CAS | 7727-43-7[1] | |
| Número RTECS | CR0600000 | |
| ChEBI | 133326 | |
| ChEMBL | CHEMBL2105897 | |
| ChemSpider | 22823 | |
| DrugBank | DB11150 | |
| PubChem | 517271, 139207729 24414, 517271, 139207729 | |
| UNII | 25BB7EKE2E | |
| Propiedades físicas | ||
| Masa molar | 233,857 g/mol | |
El sulfato de bario es el compuesto inorgánico con la fórmula química BaSO4. Es un sólido cristalino blanco inodoro e insoluble en agua. Se presenta como el mineral barita, que es la principal fuente comercial de bario y materiales preparados a partir de él. El aspecto blanco opaco y su alta densidad se aprovechan en sus principales aplicaciones.[2]
Usos
[editar]Lodo bentonítico
[editar]Alrededor del 80% de la producción mundial de sulfato de bario, en su mayoría mineral purificado, se consume como componente del fluido de perforación de pozos petrolíferos. Aumenta la densidad del fluido,[3] aumentando la presión hidrostática en el pozo y reduciendo la posibilidad de un explosión.
Agente de radiocontraste
[editar]El sulfato de bario en suspensión se utiliza a menudo en medicina como agente de radiocontraste en imagen de rayos X y otros procedimientos de diagnóstico. Se utiliza con mayor frecuencia en la obtención de imágenes del tracto GI. Se administra por vía oral, o por enema, como una suspensión de partículas finas en una solución espesa similar a la leche (a menudo con agentes edulcorantes y aromatizantes añadidos). Aunque el bario es un metal pesado, y sus compuestos solubles en agua suelen ser muy tóxicos, la baja solubilidad del sulfato de bario protege al paciente de la absorción de cantidades perjudiciales del metal. El sulfato de bario también se elimina fácilmente del organismo, a diferencia del torotrast, al que sustituyó. Debido al relativamente alto número atómico del bario (Z = 56), sus compuestos absorben los rayos X con más fuerza que los compuestos derivados de núcleos más ligeros.
Pigmento
[editar]La mayor parte del sulfato de bario sintético se utiliza como componente del pigmento blanco de las pinturas. En la pintura al óleo, el sulfato de bario es casi transparente[cita requerida], y se utiliza como relleno o para modificar la consistencia. Uno de los principales fabricantes de pintura al óleo para artistas vende un "blanco permanente" que contiene una mezcla de pigmento blanco de titanio (TiO2) y el sulfato de bario. La combinación de sulfato de bario y sulfuro de zinc (ZnS) es el pigmento inorgánico llamado litopona. En fotografía se utiliza como revestimiento de ciertos papeles fotográficos. También se utiliza como revestimiento para difundir la luz de manera uniforme.
Pintura reflectante del calor
[editar]En 2021, investigadores de la Universidad de Purdue anunciaron que habían formulado una pintura con sulfato de bario que refleja el 98,1% de toda la radiación solar, enfriando así las superficies a las que se ha aplicado.
Esto contrasta con las pinturas blancas disponibles en el mercado, que sólo pueden reflejar entre el 80 y el 90% de la luz solar que incide en esas superficies pintadas, lo que hace que se calienten. Los investigadores se han asociado con una empresa para ampliar la pintura y comercializarla, y ya se ha solicitado la patente de esta pintura.[4]
Blanqueador de papel
[editar]En la mayoría de los papeles fotográficos se recubre primero una fina capa de sulfato de bario llamada baritina para aumentar la reflectividad de la imagen; el primer papel de este tipo se introdujo en 1884 en Alemania.[5] A continuación, la emulsión de haluro de plata sensible a la luz se recubre sobre la capa baritada. La capa baritada limita la penetración de la emulsión en las fibras del papel y hace que la emulsión sea más uniforme, lo que da lugar a colores negros más uniformes.[6] A continuación, puede haber otros revestimientos para fijar y proteger la imagen. La barita también se ha utilizado para abrillantar papeles destinados a la impresión por chorro de tinta.[7]
Relleno de plástico
[editar]El sulfato de bario se utiliza comúnmente como relleno de plásticos para aumentar la densidad del polímero en aplicaciones de amortiguación de masas vibratorias. En los plásticos de polipropileno y poliestireno se utiliza como carga en proporciones de hasta el 70%. Tiene el efecto de aumentar la resistencia a los ácidos y álcalis y la opacidad. Estos compuestos también se utilizan como materiales de blindaje contra los rayos X debido a su mayor radioopacidad.[8] Para algunas aplicaciones particulares, los compuestos con una alta fracción de masa (70-80%) de sulfato de bario pueden ser preferibles a los escudos de acero más comúnmente utilizados.[cita requerida]
Usos especializados
[editar]El sulfato de bario se utiliza en las pruebas del suelo. Las pruebas de pH del suelo y otras cualidades del suelo utilizan indicadores de color, y las pequeñas partículas (normalmente arcilla) del suelo pueden enturbiar la mezcla de la prueba y hacer que sea difícil ver el color del indicador. El sulfato de bario que se añade a la mezcla se une a estas partículas, haciéndolas más pesadas para que caigan al fondo, dejando una solución más clara.
En colorimetría, el sulfato de bario se utiliza como un difusor casi perfecto cuando se miden fuentes de luz.
En la fundición de metales, los moldes utilizados suelen estar recubiertos de sulfato de bario para evitar que el metal fundido se adhiera al molde.
También se utiliza en revestimiento de frenos, espumas anacústicas, recubrimiento de polvo y relleno de conductos radiculares.
El sulfato de bario es un ingrediente de las "balas de goma" utilizadas por la policía chilena.[9] Esto, junto con la sílice, ayuda a que el gránulo alcance una dureza de 96,5 shore A.[9]
Apoyo a los catalizadores
[editar]El sulfato de bario se utiliza como soporte de catalizador cuando se trata de hidrogenar selectivamente grupos funcionales que son sensibles a la sobre-reducción. Con una superficie baja, el tiempo de contacto del sustrato con el catalizador es más corto y, por tanto, se consigue la selectividad. El paladio sobre sulfato de bario también se utiliza como catalizador en la reducción de Rosenmund.
Pirotecnia
[editar]Como los compuestos de bario emiten una luz verde característica cuando se calientan a alta temperatura, las sales de bario se utilizan a menudo en fórmulas pirotécnicas verdes, aunque las sales de nitrato y clorato son más comunes. El sulfato de bario se utiliza habitualmente como componente de composiciones pirotécnicas "estroboscópicas".
Industria del cobre
[editar]Como el sulfato de bario tiene un alto punto de fusión y es insoluble en agua, se utiliza como material de desmoldeo en la fundición de placas anódicas de cobre. Las placas de ánodo se funden en moldes de cobre, por lo que para evitar el contacto directo del cobre líquido con el molde de cobre sólido, se utiliza una suspensión de polvo fino de sulfato de bario en agua como recubrimiento de la superficie del molde. De este modo, cuando el cobre fundido se solidifica en forma de placa anódica, puede liberarse fácilmente de su molde.
Mediciones radiométricas
[editar]A veces se utiliza el sulfato de bario (o bien el PTFE) para recubrir el interior de las esferas integradoras debido a la alta reflectancia del material y a las características casi lambertianas.
Producción
[editar]Casi todo el bario que se consume comercialmente se obtiene de la barita, que a menudo es muy impura. La barita se procesa mediante reducción carbotérmica (calentamiento con coque) para dar sulfuro de bario:
- BaSO4 + 4 C → BaS + 4 CO
A diferencia del sulfato de bario, el sulfuro de bario es soluble en agua y se convierte fácilmente en óxido, carbonato y haluros. Para producir sulfato de bario de alta pureza, el sulfuro o cloruro se trata con ácido sulfúrico o sales de sulfato:
- BaS + H2SO4 → BaSO4 + H2S
El sulfato de bario producido de esta manera a menudo se llama blanc fixe, que en francés significa "blanco permanente". Blanc fixe es la forma de bario que se encuentra en los productos de consumo, como las pinturas.,[3]
En el laboratorio, el sulfato de bario se genera combinando soluciones de iones de bario y sales de sulfato. Debido a que el sulfato de bario es la sal menos tóxica del bario debido a su insolubilidad, los desechos que contienen sales de bario a veces se tratan con sulfato de sodio para inmovilizar (desintoxicar) el bario. El sulfato de bario es una de las sales de sulfato más insolubles. Su baja solubilidad se aprovecha en análisis inorgánicos cualitativos como prueba para iones Ba2+, así como para sulfato.
Historia
[editar]El sulfato de bario se reduce a sulfuro de bario por carbono. El descubrimiento accidental de esta conversión hace muchos siglos condujo al descubrimiento del primer fósforo sintético.[2] El sulfuro, a diferencia del sulfato, es soluble en agua.
Durante la primera parte del siglo XX, durante el período de colonización japonesa, se descubrió que la hokutolita existía naturalmente en el área de aguas termales de Beitou cerca de la ciudad de Taipéi, Taiwán. La hokutolita es un mineral radiactivo compuesto principalmente por PbSO4 y BaSO4, pero que también contiene trazas de uranio, torio y radio. Los japoneses recolectaron estos elementos para usos industriales y también desarrollaron decenas de "baños termales terapéuticos" en la zona.[10]
Aspectos de seguridad
[editar]Aunque las sales solubles de bario son moderadamente tóxicas para los humanos, el sulfato de bario no es tóxico debido a su insolubilidad. El medio más común de intoxicación por bario inadvertido surge del consumo de sales de bario solubles mal etiquetadas como BaSO4. En el incidente de Celobar (Brasil, 2003), nueve pacientes murieron a causa de un agente de radiocontraste preparado incorrectamente. Con respecto a las exposiciones ocupacionales, la Administración de Salud y Seguridad Ocupacional estableció un límite de exposición permisible en 15 mg/m3, mientras que el Instituto Nacional de Salud y Seguridad Ocupacional tiene un límite de exposición recomendado en 10 mg/m3. Para exposiciones respiratorias, ambas agencias han establecido un límite de exposición ocupacional de 5 mg/m3.[11]
Véase también
[editar]Referencias
[editar]- ↑ Número CAS
- ↑ a b Holleman, A. F. and Wiberg, E. (2001) Inorganic Chemistry, San Diego, CA : Academic Press, ISBN 0-12-352651-5.
- ↑ a b Robert Kresse, Ulrich Baudis, Paul Jäger, H. Hermann Riechers, Heinz Wagner, Jochen Winkler, Hans Uwe Wolf, "Barium and Barium Compounds" en Ullmann's Encyclopedia of Industrial Chemistry, 2007 Wiley-VCH, Weinheim. doi 10.1002/14356007.a03_325.pub2
- ↑ El récord de Purdue por la pintura más blanca aparece en la última edición de 'Guinness World Records', por Kayla Wiles, en Purdue University; publicado el 16 de septiembre de 2021; recuperado el 18 de octubre de 2021
- ↑ Instituto de Conservación Getty, Silver Gelatin. The Atlas of Analytical Signatures of Photographic Processes. J. Paul Getty Trust, 2013.
- ↑ Salvaggio, Nanette L. Basic Photographic Materials and Processes. Taylor & Francis US, 27 de octubre de 2008. p. 362.
- ↑ Nikitas, Theano. "Papeles para inyección de tinta que darán dinamismo a tus fotos: ¿tú y tus clientes estáis aburridos de vuestras impresiones fotográficas? echa un vistazo a nuestros papeles favoritos para inyección de tinta de alta calidad y especiales que seguro que harán que tus imágenes destaquen." Photo District News julio de 2012: 36+. Centro de referencia general ORO. Web. 3 nov. 2012.
- ↑ Lopresti, Mattia; Alberto, Gabriele; Cantamessa, Simone; Cantino, Giorgio; Conterosito, Eleonora; Palin, Luca; Milanesio, Marco (28 de enero de 2020). «Light Weight, Easy Formable and Non-Toxic Polymer-Based Composites for Hard X-ray Shielding: A Theoretical and Experimental Study». International Journal of Molecular Sciences 21 (3): 833. PMC 7037949. PMID 32012889. doi:10.3390/ijms21030833.
- ↑ a b «Investigación U. de Chile comprueba que perdigones usados por Carabineros contienen solo 20 por ciento de goma». Universidad de Chile. 18 de noviembre de 2019. Consultado el 29 de junio de 2020.
- ↑ Chu, Tieh-Chi; Wang, Jeng-Jong (2000). «Radioactive Disequilibrium of Uranium and Thorium Nuclide Series in Hot Spring and River Water from Peitou Hot Spring Basin in Taipei». Journal of Nuclear and Radiochemical Sciences 1 (1): 5-10. doi:10.14494/jnrs2000.1.5.
- ↑ «Barium Sulfate». NIOSH Pocket Guide to Chemical Hazards. Centers for Disease Control and Prevention. 4 de abril de 2011. Consultado el 18 de noviembre de 2013.
Enlaces externos
[editar] Wikimedia Commons alberga una galería multimedia sobre Sulfato de bario.
Wikimedia Commons alberga una galería multimedia sobre Sulfato de bario.
