P-nitroanilina
| p-Nitroanilina | ||
|---|---|---|
 | ||
| General | ||
| Otros nombres |
4-nitroanilina 1-amino-4-nitrobenzeno p-nitrofenilamina | |
| Fórmula estructural |
 | |
| Fórmula molecular | C6H6N2O2 | |
| Identificadores | ||
| Número CAS | 100-01-6[1] | |
| Número RTECS | BY7000000 | |
| ChEBI | 17064 | |
| ChEMBL | 14282 | |
| ChemSpider | 13846959 | |
| PubChem | 7475 | |
| UNII | 1MRQ0QZG7G | |
| KEGG | C02126 | |
|
c1cc(ccc1N)N(=O)=O
| ||
| Propiedades físicas | ||
| Apariencia | polvo de color amarillo o marrón | |
| Densidad | 1,437 kg/m³; 0,001437 g/cm³ | |
| Masa molar | 138,12 g/mol | |
| Punto de fusión | 147,5 °C (421 K) | |
| Punto de ebullición | 332 °C (605 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
4-Nitroanilina, p-nitroanilina o 1-amino-4-nitrobenzeno polvo de color amarillo o marrón C6H6N2O2. Es un compuesto químico orgánico, que consiste en un grupo fenilo unido a un grupo amino que es el camino a un grupo nitro. Este producto químico se usa comúnmente como un intermedio en la síntesis de colorantes, antioxidantes, productos farmacéuticos y gasolina, en peptizantes, medicamentos de aves de corral, y como un inhibidor de la corrosión.
Síntesis
[editar]Se produce industrialmente mediante la aminación de 4-nitroclorobenceno:[2]
- ClC6H4NO2 + 2 NH3 → H2NC6H4NO2 + NH4Cl
A continuación se muestra una síntesis de laboratorio de p-nitroanilina desde la anilina. El paso clave en esta secuencia de reacción es una sustitución electrófila aromática para instalar el grupo nitro para al grupo amino. Después de esta reacción, una separación se debe realizar para eliminar 2-nitroanilina, que también se formó en una pequeña cantidad durante la reacción.[3]
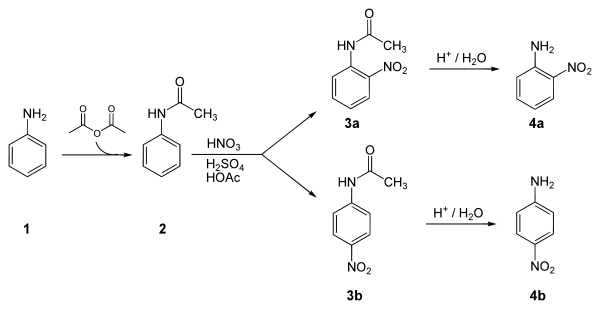
Aplicaciones
[editar]4-Nitroanilina se consume principalmente industrialmente como un precursor de la p-fenilendiamina, un colorante importante. La reducción se efectúa usando metal de hierro y por hidrogenación catalítica.[2]
Es un material de partida para la síntesis de Para Red, el primer azoderivado:[4]

Toxicidad
[editar]El compuesto es tóxico a través de la inhalación, ingestión y absorción, y debe ser manejado con cuidado. Su LD 50 en ratas es de 750 mg/kg cuando se administra por vía oral. p-nitroanilina es particularmente perjudicial para todos los organismos acuáticos y puede causar daños a largo plazo para el medio ambiente si es liberado como un contaminante.
Referencias
[editar]- ↑ Número CAS
- ↑ a b Gerald Booth "Nitro Compounds, Aromatic in Ullmann's Encyclopedia of Industrial Chemistry, 7th Ed.; Wiley-VCH: Weinheim, 2005. doi 10.1002/14356007.a17_411
- ↑ Mohrig, J.R.; Morrill, T.C.; Hammond, C.N.; Neckers, D.C. "Synthesis 5: Synthesis of the Dye Para Red from Aniline." Experimental Organic Chemistry. Freeman: New York, NY, 1997; pp 456-467 Archivado el 15 de septiembre de 2020 en Wayback Machine..
- ↑ Williamson, Kenneth L. (2002). Macroscale and Microscale Organic Experiments, Fourth Edition. Houghton-Mifflin. ISBN 0-618-19702-8.
Enlaces externos
[editar]- Safety (MSDS)data for p-nitroaniline
- MSDS Sheet for p-nitroaniline
- Sigma-Aldrich Catalog data
- CDC - NIOSH Pocket Guide to Chemical Hazards
- Esta obra contiene una traducción derivada de «4-nitroanilina» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
