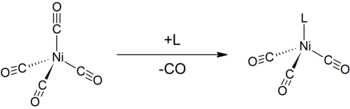Tetracarbonilo de níquel
| Tetracarbonilo de níquel | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Tetracarbonilníquel (0) | ||
| General | ||
| Otros nombres |
Carbonilo de níquel Níquel tetracarbonilo Níquel carbonilo | |
| Fórmula molecular | Ni(CO)4 | |
| Identificadores | ||
| Número CAS | 13463-39-3[1] | |
| Número RTECS | QR6300000 | |
| ChEBI | 30372 | |
| ChemSpider | 24253 | |
| PubChem | 26039 | |
| UNII | 1ZYL78UWZN | |
| Propiedades físicas | ||
| Apariencia | incoloro a amarillo muy débil | |
| Densidad | 1319 kg/m³; 1316 g/cm³ | |
| Masa molar | 170,73 g/mol g/mol | |
| Punto de fusión | 255,8 K (−17 °C) | |
| Punto de ebullición | 316 K (43 °C) | |
| Estructura cristalina | tetraédrico | |
| Viscosidad | 3,05 x 10-4 Pa s | |
| Propiedades químicas | ||
| Solubilidad en agua | 0,018 g/100 mL | |
| Solubilidad |
miscible en la mayoría de los disolventes orgánicos soluble en ácido nítrico, aqua regia | |
| Momento dipolar | 0 D | |
| Termoquímica | ||
| ΔfH0líquido | −632 kJ/mol kJ/mol | |
| S0líquido, 1 bar | 320 J K−1 mol−1 J·mol–1·K–1 | |
| Peligrosidad | ||
| SGA |
    | |
| Punto de inflamabilidad | 248 K (−25 °C) | |
| NFPA 704 |
4
4
4
| |
| Temperatura de autoignición | 323 K (50 °C) | |
| Frases R | R61, R11, R26, R40, R50/53 | |
| Frases S | S53, S45, S60, S61 | |
| Límites de explosividad | 2–34% | |
| Riesgos | ||
| Riesgos principales |
Inflamable ('F) Carcinóg. Cat. 3 Repr. Cat. 2 Muy tóxico (T+) Peligroso para el medio ambiente (N) | |
| Más información | Ficha de seguridad InChem 0064 | |
| Compuestos relacionados | ||
| Carbonilos metálicos |
pentacarbonilo de hierro hexacarbonilo molibdeno | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El níquel carbonilo o carbonilo de níquel (llamado por la IUPAC níquel tetracarbonilo o tetracarbonilo de níquel (0)) es el compuesto de organoníquel de fórmula química Ni(CO)4. Este carbonilo metálico de color amarillo pálido es muy volátil a temperatura ambiente y altamente tóxico. El carbonilo de níquel puede ser usado para fabricar acero al níquel y otros metales, y obtener níquel muy puro. Es un reactivo intermediario en el proceso de Mond para la purificación de la níquel[2] y es un reactivo en química organometálica.
Estructura y enlace
[editar]El carbonilo de níquel es una molécula tetraédrica con cuatro ligandos carbonilo (monóxido de carbono) unidos al níquel. Los ligandos CO (en los que el C y el O están conectados entre sí por triples enlaces aunque a menudo son representados como enlaces dobles), están covalentemente unidos al átomo de níquel a través del carbono terminal. Las estructuras del carbonilo de níquel y otros compuestos relacionados han desconcertado a los químicos durante muchos años, y la mayoría de las publicaciones anteriores a 1950 mostraban las cadenas de CO quelados al metal.
El carbonilo de níquel tiene 18 electrones de valencia, al igual que muchos otros carbonilos metálicos, tales como el pentacarbonilo de hierro y el hexacarbonilo molibdeno. Estos carbonilos metálicos tienen estructura simétrica y carga neutra, dando como resultado una alta volatilidad. En Ni(CO)4, el átomo de níquel tiene un número de oxidación formal igual a cero.
Preparación
[editar]El Ni(CO)4 fue sintetizado por primera vez en 1890 por Ludwig Mond mediante reacción directa del níquel metálico con el CO gaseoso[3] Este trabajo pionero anunciaba la existencia de muchos otros compuestos de metal-carbonilo, incluidos los de V, Cr, Mn, Fe y Co. Se empleó también en la industria para la purificación del níquel a finales del siglo XIX.[4]
A 323 K (50 °C), el monóxido de carbono se pasa sobre el níquel impuro. La tasa óptima de conversión se produce a 130 °C.[5]
El Ni(CO)4 no está fácilmente disponible comercialmente. Se genera fácilmente en el laboratorio por carbonilación del bis(ciclooctadien)níquel (0). disponible en el mercado.
Reacciones
[editar]Descarbonilación térmica
[editar]El calentamiento moderado del Ni(CO)4 lo descompone en monóxido de carbono y níquel metal. Dado la formación fácil de CO e incluso del níquel impuro, esta descomposición es la base del proceso Mond para la purificación de níquel. La descomposición térmica comienza aproximadamente a 180 °C y aumenta al subir la temperatura.[5]
Reacciones con nucleófilos y reductores
[editar]Al igual que otros carbonilos metálicos de bajo estado de oxidación o valencia, el Ni(CO)4 es susceptible al ataque de nucleófilos. El ataque puede ocurrir en el centro de la molécula ocupado por el níquel, lo que resulta en un desplazamiento de los ligandos CO. Así, los ligandos de especies químicas donantes de electrones, como la trifenilfosfina, reaccionan para dar Ni(CO)3(PPh3) y Ni(CO)2(PPh3)2. La bipiridina y ligandos relacionados poseen un comportamiento similar.[6] La monosustitución del niqueltetracarbonilo con otros ligandos se puede utilizar para determinar el parámetro electrónico de Tolman, una medida de la capacidad de donar o quitar electrones de un ligando dado.
El tratamiento con hidróxidos forma grupos como [Ni5(CO)12]2− y [Ni6(CO)12]2−. Estos compuestos también pueden ser obtenidos por reducción del carbonilo de níquel.
Por lo tanto, el tratamiento de Ni(CO)4 con compuestos orgánicos nucleófilos (Nu−) da como resultado la formación de derivados de acilo como [Ni(CO)3C(O)Nu)]−.[7]
Reacciones con electrófilos y oxidantes
[editar]El carbonilo de níquel puede ser oxidado. El cloro oxida al carbonilo de níquel para dar NiCl2, liberando CO gas. Otros halógenos se comportan de forma análoga. Esta reacción proporciona un método conveniente para la destrucción de las partes no deseadas de la sustancia tóxica inorgánica.
Las reacciones de Ni(CO)4 con halogenuros de alquilo y de arilo a menudo producen productos orgánicos carbonilados. Los haluros de vinilo, como PhCH = CHBr, se convierten en ésteres insaturados durante el tratamiento con Ni(CO)4 seguido de metóxido de sodio. Estas reacciones, probablemente, también tendrán lugar a través de adiciones oxidativas. Los haluros de alilo dan compuestos de pi-alilníquel, tales como (allyl)2Ni2Cl2:[8]
- 2 Ni(CO)4 + 2 ClCH2CH=CH2 → Ni2(μ-Cl)2(η3-C3H5)2 + 8 CO
Toxicología y consideraciones de seguridad
[editar]El carbonilo de níquel es muy peligroso, mucho más que por su contenido implícito de CO, lo que refleja los efectos del níquel, si se libera en el cuerpo. Carbonilo de níquel puede ser fatal si se absorbe por la piel o, más probablemente, si se inhala, debido a su alta volatilidad.[9] Su LC50 para una exposición de 30 minutos de duración se ha estimado en 3 ppm, y la concentración que es inmediatamente fatal para los humanos sería de 30 ppm. Algunos sujetos expuestos a inhalaciones hasta de 5 ppm describieron el olor como a humedad o de hollín, pero puesto que el compuesto es tan extremadamente tóxico su olor no proporciona ninguna advertencia confiable frente a una exposición potencialmente fatal.[10] Históricamente, los laboratorios que utilizaban Ni(CO)4 poseían canarios en el laboratorio actuando de animales centinela como indicador de la toxicidad del níquel carbonilo, debido a la mayor sensibilidad de las aves frente a este veneno.
Los efectos sistémicos humanos por inhalación son: somnolencia, fiebre, y alteraciones pulmonares entre otros. Los vapores pueden causar tos, disnea (dificultad para respirar), irritación, congestión y edema de los pulmones, taquicardia (pulso rápido), cianosis, dolor de cabeza, mareos y debilidad. La toxicidad por inhalación se cree que es causada tanto por el níquel como por el monóxido de carbono liberado en los pulmones. Una exposición crónica puede provocar cáncer de pulmón o de los senos nasales. La dermatitis de contacto es bastante común. Se considera el compuesto de níquel más peligroso en el lugar de trabajo. Es soluble en lípidos y puede atravesar las membranas biológicas (por ejemplo, los alvéolos pulmonares, la barrera hematoencefálica, y la placenta).
Los vapores de Ni(CO)4 pueden entrar en autoignición.
la intoxicación por níquel carbonilo se caracteriza por una enfermedad en dos etapas. La primera consiste en dolor de cabeza y dolor en el pecho durante unas horas, generalmente seguida de una remisión a corto plazo. La segunda fase es una neumonitis química, que generalmente se inicia después de 16 horas con síntomas de tos, disnea y fatiga extrema. Estos alcanzan mayor gravedad después de cuatro días, posiblemente resultando en muerte por parada cardiorrespiratoria o insuficiencia renal. La convalecencia es a menudo muy prolongada, frecuentemente complicada por el cansancio, la depresión y la disnea de esfuerzo. Daños respiratorios permanentes son poco usuales. El carcinogenicidad del Ni(CO)4 es un asunto de debate.
Los vapores de carbonilo de níquel se descomponen rápidamente en el aire, con una duración de sólo un minuto.[11]
Referencias
[editar]- ↑ Número CAS
- ↑ Principios de química: los caminos del descubrimiento. Peter William Atkins, Loretta Jones. Ed. Médica Panamericana, 2006. ISBN 9500600803. Pág. 616
- ↑ Mond, L.; Langer, C.; Quincke, F. (1890). «Action of Carbon Monoxide on Nickel». J. Chem. Soc., Trans. 57: 749-53. doi:10.1039/CT8905700749.
- ↑ «The Extraction of Nickel from its Ores by the Mond Process». Nature 59 (1516): 63-64. 1898. doi:10.1038/059063a0.
- ↑ a b Lascelles,Keith; Morgan, Lindsay G.; & Nicholls, David (1991). «Nickel Compounds». Ullmann's Encyclopedia of Industrial Chemistry. A17 (5): 235-249. doi:10.1002/14356007.a17_157.
- ↑ Elschenbroich, C.; Salzer, A. (1992). Organometallics : A Concise Introduction (2nd edición). Weinheim: Wiley-VCH. ISBN 3-527-28165-7.
- ↑ EROS Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2003.
- ↑ (1988) "Reaction of Aryl Halides with π-Allylnickel Halides: Methallylbenzene". Org. Synth.; Coll. Vol. 6: 722.
- ↑ Níquel tetracarbonilo. Química inórganica experimental: una guía de trabajo de laboratorio. R.E. Dodd. Editorial Reverté, 1965. ISBN 8429171401. Pág. 231
- ↑ Board on Environmental Studies and Toxicology (2008). «Nickel Carbonyl: Acute Exposure Guideline Levels». Acute Exposure Guideline Levels for Selected Airborne Chemicals: Volume 6. National Academies Press. pp. 213-259.
- ↑ Stedman, D. H.; Hikade, D. A.; Pearson, Jr., R.; Yalvac, E. D. (1980). «Nickel Carbonyl: Decomposition in Air and Related Kinetic Studies». Science 208 (4447): 1029-1031. PMID 17779026. doi:10.1126/science.208.4447.1029.
Lecturas adicionales
[editar]- Shi Z (1991). «Nickel carbonyl: toxicity and human health». The Science of the Total Environment 148 (2-3): 293-298. PMID 8029705. doi:10.1016/0048-9697(94)90406-5.
- Sunderman FW (1989). «A Pilgrimage into the Archive of Nickel Toxicology». Annals of Clinical and Lalboratory Science 19: 1-16.
- Armit HW (1908). «The toxicology of nickel carbonyl. Part II.». Journal of Hygiene 8: 565-610. PMID 20474374.
- Armit HW (1907). «The toxicology of nickel carbonyl». Journal of Hygiene 7 (4): 525-551. PMC 2236193. PMID 20474327. doi:10.1017/S0022172400033507.
- Barceloux DG; Barceloux, Donald (1999). «Nickel». Journal of Toxicology-Clinical Toxicology 37 (2): 239-258. PMID 10382559. doi:10.1081/CLT-100102423. DOI
Enlaces externos
[editar]- Níquel tetracarbonilo. Química inórganica experimental: una guía de trabajo de laboratorio. R.E. Dodd. Editorial Reverté, 1965. ISBN 8429171401. Pág. 231
- Ficha de seguridad sobre el compuesto de International Chemical. (en inglés)
- National Pollutant Inventory - Hoja de datos del carbonilo de níquel (en inglés)
- Guía de bolsillo NIOSH sobre riesgos químicos (en inglés)
- IARC Monografía "Nickel and Nickel compounds" (en inglés)