Nitrato de cerio y amonio
| Nitrato de cerio y amonio | ||
|---|---|---|
 | ||
| General | ||
| Fórmula molecular | (NH4)2[Ce(NO3)6] | |
| Identificadores | ||
| Número CAS | 16774-21-3[1] | |
| ChemSpider | 17339538 | |
| PubChem | 16211559 | |
| UNII | U99S55ED6B | |
| Propiedades físicas | ||
| Masa molar | 547,901094 g/mol | |
El nitrato de cerio y amonio (CAN, por sus siglas en inglés) es un compuesto inorgánico de fórmula (NH4)2[Ce(NO3)6]. Esta sal de cerio soluble en agua, de color rojo anaranjado, es un agente oxidante especializado en síntesis orgánica y un oxidante estándar en análisis cuantitativos.
Preparación, propiedades y estructura[editar]
El anión [Ce(NO3)6]2- se genera disolviendo Ce2O3 en ácido nítrico caliente y concentrado (HNO3).
La sal está formada por el anión hexanitratocerato(IV) [Ce(NO3)6]2- y un par de cationes de amonio NH+4. Los iones de amonio no intervienen en las reacciones de oxidación de esta sal. En el anión, cada grupo nitrato quela el átomo de cerio de forma bidentada, como se muestra a continuación:
El anión [Ce(NO3)6]2- tiene simetría molecular Th (Oh idealizado). El núcleo CeO12 define un icosaedro.[3]
El Ce4+ es un fuerte agente oxidante de un solo electrón. En términos de su potencial redox (E° ≈ 1,61 V vs. N.H.E.) es un agente oxidante aún más fuerte que el Cl2 (E° ≈ 1,36 V). Pocos reactivos estables son oxidantes más fuertes. En el proceso redox el Ce(IV) se convierte en Ce(III), un cambio de un electrón, señalado por el desvanecimiento del color de la solución de naranja a amarillo pálido (siempre que el sustrato y el producto no estén fuertemente coloreados).
Aplicaciones en química orgánica[editar]
En síntesis orgánica, el CAN es útil como oxidante para muchos grupos funcionales (alcoholes, fenoles y éteres), así como para enlaces C-H, especialmente los bencílicos. Los alquenos se someten a dinitroxilación, aunque el resultado depende del disolvente. Se producen quinonas a partir de catecoles e hidroquinonas e incluso se oxidan nitroalcanos.[4][5]
El CAN proporciona una alternativa a la reacción de Nef; por ejemplo, para la síntesis de ketomacrolida en la que se suelen encontrar reacciones secundarias complicadas utilizando otros reactivos. La halogenación oxidativa puede ser promovida por el CAN como oxidante in situ para la bromación bencílica, y la yodación de cetonas y derivados del uracilo.
Para la síntesis de heterociclos[editar]
Las cantidades catalíticas de CAN acuoso permiten la síntesis eficaz de derivados de quinoxalina. Las quinoxalinas son conocidas por sus aplicaciones como colorantes, semiconductores orgánicos y agentes de escisión del ADN. Estos derivados también son componentes de antibióticos como la equinomicina y la actinomicina. La reacción de tres componentes catalizada por el CAN entre anilinas y alquil vinil éteres proporciona una entrada eficiente en 2-metil-1,2,3,4-tetrahidroquinolinas y las correspondientes quinolinas obtenidas por su aromatización.
Como reactivo de desprotección
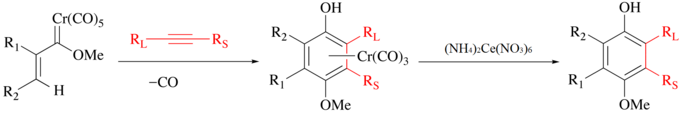
El CAN se utiliza tradicionalmente para liberar ligandos orgánicos de carbonilos metálicos. En el proceso, el metal se oxida, se desprende CO y se libera el ligando orgánico para su posterior manipulación.[6] Por ejemplo, con la reacción de Wulff-Dötz se combinan un alquino, monóxido de carbono y un carbeno de cromo para formar un complejo de medio sándwich de cromo[7][8]y el ligando fenol puede aislarse mediante una oxidación suave con el CAN.
El CAN se utiliza para escindir éteres para-metoxibencílicos y 3,4-dimetoxibencílicos, que son grupos protectores de los alcoholes.[9][10]Se necesitan dos equivalentes de CAN por cada equivalente de éter para-metoxibencílico. El alcohol se libera y el para-metoxibencil éter se convierte en para-metoxibenzaldehído. La ecuación equilibrada es la siguiente
2 [NH
4]
2[Ce(NO
3)
6] + H
3COC
6H
4CH
2OR + H
2O → 4 NH+
4 + 2 Ce3+ + 12 NO−
3 + 2 H+
+ H
3COC
6H
4CHO + HOR
Otras aplicaciones[editar]
El CAN también es un componente del grabador de cromo,[11]un material que se utiliza en la producción de fotomáscaras y pantallas de cristal líquido.
Referencias[editar]
- ↑ Número CAS
- ↑ «CSD Entry 1598999, ICSD Entry 22219, H8CeN8O18». Cambridge Structural Database: Access Structures (Cambridge Crystallographic Data Centre). Consultado el 5 de noviembre de 2021.
- ↑ a b Thomas A. Beineke; J. Delgaudio (1968). «Crystal structure of ceric ammonium nitrate». Inorg. Chem. 7 (4): 715-721. doi:10.1021/ic50062a020.
- ↑ Nair, Vijay; Deepthi, Ani (2007). «Cerium(IV) Ammonium NitrateA Versatile Single-Electron Oxidant». Chemical Reviews 107 (5): 1862-1891. PMID 17432919. doi:10.1021/cr068408n.
- ↑ Sridharan, Vellaisamy; Menéndez, J. Carlos (2010). «Cerium(IV) Ammonium Nitrate as a Catalyst in Organic Synthesis». Chemical Reviews 110 (6): 3805-3849. PMID 20359233. doi:10.1021/cr100004p.
- ↑ L. Brener, J. S. McKennis, and R. Pettit "Cyclobutadiene in Synthesis: endo-Tricyclo[4.4.0.02,5]deca-3,8-diene-7,10-dione" Org. Synth. 1976, 55, 43.doi 10.15227/orgsyn.055.0043
- ↑ Waters, M.; Wulff, W. D. (2008). «The Synthesis of Phenols and Quinones via Fischer Carbene Complexes». Organic Reactions 70 (2): 121-623. doi:10.1002/0471264180.or070.02.
- ↑ Dötz, K. H. (1983). «Carbon–Carbon Bond Formation via Carbonyl-Carbene Complexes». Pure and Applied Chemistry 55 (11): 1689-1706. S2CID 95165461. doi:10.1351/pac198355111689.
- ↑ Boons, Geert-Jan.; Hale, Karl J. (2000). Organic Synthesis with Carbohydrates (1st ed.) Sheffield, England: Sheffield Academic Press. pp.33
- ↑ Kocienski, Phillip J. (1994). Protecting Groups Stuttgart, New York Georg Thieme Verlag. pp 8–9, 52–54
- ↑ Walker, Perrin; William H. Tarn (1991). CRC Handbook of Metal Etchants. pp. 287–291. ISBN 0-8493-3623-6.
Enlaces externos[editar]
- Oxidizing Agents: Cerium Ammonium Nitrate
- Esta obra contiene una traducción derivada de «Ceric ammonium nitrate» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.