Glucólisis
| Reacción global de la glucólisis[1] |
|---|
  + + 
|
| α-D-glucosa + 2NAD+ + 2ADP + 2Pi ==> 2(piruvato) + 2NADH + 2ATP + 2H+ + 2H2O |
La glucólisis (del griego glycos, azúcar y lysis, ruptura, destrucción, transformación) es la ruta metabólica encargada de oxidar la glucosa con la finalidad de obtener energía para la célula. Consiste en 10 reacciones enzimáticas consecutivas que convierten a la glucosa en dos moléculas de piruvato, el cual es capaz de seguir otras vías metabólicas y así continuar entregando energía al organismo. Esta ruta se realiza tanto en ausencia como en presencia de oxígeno, definido como proceso anaeróbico en este caso.[1]
El tipo de glucólisis más común y más conocida es la vía de Embden-Meyerhof, explicada inicialmente por Gustav Embden y Otto Fritz Meyerhof. El término puede incluir vías alternativas, como la ruta de Entner-Doudoroff.[2] No obstante, el vocablo «glucólisis» se usa con frecuencia como sinónimo de la vía de Embden-Meyerhof. Se continúa con el ciclo de Krebs. Es la vía inicial del catabolismo de glúcido de carbohidratos.
Descubrimiento
[editar]Los primeros estudios informales de los procesos glucolíticos fueron iniciados en 1860, cuando Louis Pasteur descubrió que los microorganismos son los responsables de la fermentación,[3] y en 1897 cuando Eduard Buchner encontró que cierto extracto celular puede causar fermentación. La siguiente gran contribución fue de Arthur Harden y William Young en 1905, quienes determinaron que para que la fermentación tenga lugar son necesarias una fracción celular de masa molecular elevada y termosensible (enzimas) y una fracción citoplasmática de baja masa molecular y termorresistente (ATP, ADP, NAD+ y otras coenzimas). Los detalles de la vía en sí se determinaron en 1940, con un gran avance de Otto Meyerhoff y algunos años después por Luis Leloir. Las mayores dificultades en determinar lo intrincado de la vía fueron la corta vida y las bajas concentraciones de los intermediarios en las rápidas reacciones glicolíticas.
En eucariotas y procariotas, la glucólisis ocurre en el citosol de la célula. En células vegetales, algunas de las reacciones glucolíticas se encuentran también en el ciclo de Calvin, que ocurre dentro de los cloroplastos. La amplia conservación de esta vía incluye los organismos filogenéticamente más antiguos, y por esto se considera una de las vías metabólicas más antiguas.[4]
Visión general
[editar]
Durante la glucólisis se obtiene un rendimiento neto de dos moléculas de ATP; el ATP puede ser usado como fuente de energía para realizar trabajo metabólico, mientras que el NADH puede tener diferentes destinos. Puede usarse como fuente de poder reductor en reacciones anabólicas; si hay oxígeno, puede oxidarse en la cadena respiratoria, obteniéndose 5 ATP (2,5 por cada NADH); si no hay dioxígeno, se usa para reducir el piruvato a lactato (fermentación láctica), o a CO2 y etanol (fermentación alcohólica), sin obtención adicional de energía.
La glucólisis es la forma más rápida de conseguir energía para una célula y, en el metabolismo de carbohidratos, generalmente es la primera vía a la cual se recurre. Se encuentra estructurada en 10 reacciones enzimáticas que permiten la transformación de una molécula de glucosa a dos moléculas de piruvato mediante un proceso catabólico.
La glucólisis es una de las vías más estudiadas, y generalmente se encuentra dividida en dos fases: la primera, de gasto de energía y la segunda fase, de obtención de energía.
La primera fase consiste en transformar una molécula de glucosa en dos moléculas de gliceraldehído (una molécula de baja energía) mediante el uso de 2 ATP. Esto permite duplicar los resultados de la segunda fase de obtención energética.
En la segunda fase, el gliceraldehído se transforma en un compuesto de alta energía, cuya hidrólisis genera una molécula de ATP, y como se generaron 2 moléculas de gliceraldehído, se obtienen en realidad dos moléculas de ATP. Esta obtención de energía se logra mediante el acoplamiento de una reacción fuertemente exergónica después de una levemente endergónica. Este acoplamiento ocurre una vez más en esta fase, generando dos moléculas de piruvato. De esta manera, en la segunda fase se obtienen 4 moléculas de ATP.
Reacciones posteriores
[editar]Luego de que una molécula de glucosa se transforme en 2 moléculas de piruvato, las condiciones del medio en que se encuentre determinarán la vía metabólica a seguir.
En organismos aeróbicos, el piruvato seguirá oxidándose por la enzima piruvato deshidrogenasa y el ciclo de Krebs, creando intermediarios como NADH y FADH2. Estos intermediarios no pueden cruzar la membrana mitocondrial, y por lo tanto, utilizan sistemas de intercambio con otros compuestos llamados lanzaderas (en inglés, shuttles). Los más conocidos son la lanzadera malato-aspartato y la lanzadera glicerol-3-fosfato. Los intermediarios logran entregar sus equivalentes[5] al interior de la membrana mitocondrial, y que luego pasarán por la cadena de transporte de electrones, que los usará para sintetizar ATP.
De esta manera, se puede obtener hasta 30 moles de ATP a partir de 1 mol de glucosa como ganancia neta.
Sin embargo, cuando las células no posean mitocondrias (ej.: eritrocito) o cuando requieran de grandes cantidades de ATP (ej.: el músculo al ejercitarse), el piruvato sufre fermentación que permite obtener 2 moles de ATP por cada mol de glucosa, por lo que esta vía es poco eficiente respecto a la fase aeróbica de la glucólisis.
El tipo de fermentación varía respecto al tipo de organismos: en levaduras, se produce fermentación alcohólica, produciendo etanol y CO2 como productos finales, mientras que en músculo, eritrocitos y algunos microorganismos se produce fermentación láctica, que da como resultado ácido láctico o lactato.
Funciones
[editar]Las funciones de la glucólisis son:
- La generación de moléculas de alta energía (ATP y NADH) como fuente de energía celular en procesos de respiración aeróbica (presencia de oxígeno) y fermentación (ausencia de oxígeno).
- La generación de piruvato que pasará al ciclo de Krebs, como parte de la respiración aeróbica.
- La producción de intermediarios de 6 y 3 carbonos que pueden ser utilizados en otros procesos celulares.
Etapas de la glucólisis
[editar]La glucólisis se divide en dos partes principales y diez reacciones enzimáticas, que se describen a continuación.
Fase de gasto de energía (ATP)
[editar]Esta primera fase de la glucólisis consiste en transformar una molécula de glucosa en dos moléculas de gliceraldehído.
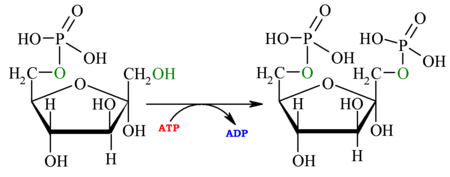
| 1.er paso: hexoquinasa Véase también: Hexoquinasa
| ||||
|---|---|---|---|---|
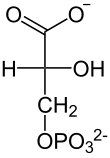
| La primera reacción de la glucólisis es la fosforilación de la glucosa, para activarla (aumentar su energía) y así poder utilizarla en otros procesos cuando sea necesario. Esta activación ocurre por la transferencia de un grupo fosfato del ATP, una reacción catalizada por la enzima hexoquinasa,[6] la cual puede fosforilar (añadir un grupo fosfato) a moléculas similares a la glucosa, como la fructosa y manosa. Las ventajas de fosforilar la glucosa son dos: la primera es hacer de la glucosa un metabolito más reactivo, mencionado anteriormente, y la segunda es que la glucosa-6-fosfato no puede cruzar la membrana celular —a diferencia de la glucosa—, ya que la carga negativa que le proporciona el grupo fosfato a la molécula hace que sea más difícil atravesarla. De esta forma se evita la pérdida de sustrato energético para la célula. Técnicamente hablando, la hexoquinasa solo fosforila las D-hexosas, y utiliza de sustrato MgATP2+, ya que este catión permite que el último fosfato del ATP (fosfato gamma, γ-P o Pγ) sea un blanco más fácil para el ataque nucleofílico que realiza el grupo hidroxilo (OH) del sexto carbono de la glucosa, lo que es posible debido al Mg2+ que apantalla las cargas de los otros dos fosfatos.[1][7]
Esta reacción posee un ΔG negativo, y por tanto se trata de una reacción en la que se pierde energía en forma de calor. En numerosas bacterias esta reacción está acoplada a la última reacción de la glucólisis (de fosfoenolpiruvato a piruvato) para poder aprovechar la energía sobrante de la reacción: el fosfato del fosfoenolpiruvato se transfiere de una a otra proteína de un sistema de transporte fosfotransferasa, y en última instancia, el fosfato pasará a una molécula de glucosa que es tomada del exterior de la célula y liberada en forma de G6P en el interior celular. Se trata por tanto de acoplar la primera y la última reacción de esta vía y usar el excedente de energía para realizar un tipo de transporte a través de membrana denominado translocación de grupo. |
| |||
| 2.º paso: glucosa-6-P isomerasa Véase también: Fosfohexosa isomerasa
| ||||
| Este es un paso importante, puesto que aquí se define la geometría molecular que afectará los dos pasos críticos en la glucólisis: El próximo paso, que agregará un grupo fosfato al producto de esta reacción, y el paso 4, cuando se creen dos moléculas de gliceraldehido que finalmente serán las precursoras del piruvato.[1] En esta reacción, la glucosa-6-fosfato se isomeriza a fructosa-6-fosfato, mediante la enzima glucosa-6-fosfato isomerasa. La isomerización ocurre en una reacción de 4 pasos, que implica la apertura del anillo y un traspaso de protones a través de un intermediario cis-enediol[9]
Puesto que la energía libre de esta reacción es igual a +1,7 kJ/mol la reacción es no espontánea y se debe acoplar. |
| |||
| 3.er paso: fosfofructoquinasa
Véase también: Fosfofructoquinasa-1
| ||||
| Fosforilación de la fructosa 6-fosfato en el carbono 1, con gasto de un ATP, a través de la enzima fosfofructoquinasa-1 (PFK1). También este fosfato tendrá una baja energía de hidrólisis. Por el mismo motivo que en la primera reacción, el proceso es irreversible. El nuevo producto se denominará fructosa-1,6-bisfosfato. La irreversibilidad es importante, ya que la hace ser el punto de control de la glucólisis. Como hay otros sustratos aparte de la glucosa que entran en la glucólisis, el punto de control no está colocado en la primera reacción, sino en esta. La fosfofructoquinasa tiene centros alostéricos, sensibles a las concentraciones de intermediarios como citrato y ácidos grasos. Liberando una enzima llamada fosfructocinasa-2 que fosforila en el carbono 2 y regula la reacción. |
| |||
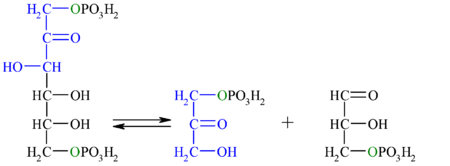
| 4.º paso: aldolasa
Véase también: Aldolasa
| ||||
| La enzima aldolasa (fructosa-1,6-bisfosfato aldolasa), mediante una condensación aldólica reversible, rompe la fructosa-1,6-bisfosfato en dos moléculas de tres carbonos (triosas): dihidroxiacetona fosfato y gliceraldehído-3-fosfato. Existen dos tipos de aldolasa, que difieren tanto en el tipo de organismos donde se expresan, como en los intermediarios de reacción.
Esta reacción tiene una energía libre (ΔG) entre 20 a 25 kJ/mol, por lo tanto, en condiciones estándar no ocurre de manera espontánea. Sin embargo, en condiciones intracelulares la energía libre es pequeña debido a la baja concentración de los sustratos, lo que permite que esta reacción sea reversible.[1] |
| |||
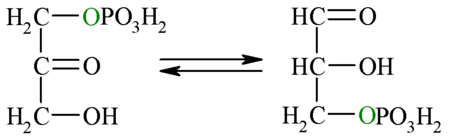
| 5.º paso: triosa fosfato isomerasa | ||||
| Puesto que solo el gliceraldehído-3-fosfato puede seguir los pasos restantes de la glucólisis, la otra molécula generada por la reacción anterior (dihidroxiacetona-fosfato) es isomerizada (convertida) en gliceraldehído-3-fosfato. Esta reacción posee una energía libre en condiciones estándar positiva, lo cual implicaría un proceso no favorecido, sin embargo, al igual que para la reacción 4, considerando las concentraciones intracelulares reales del reactivo y el producto, se encuentra que la energía libre total es negativa, por lo que la dirección favorecida es hacia la formación de G3P.
Este es el último paso de la "fase de gasto de energía". Solo se ha consumido ATP en el primer paso (hexoquinasa) y el tercer paso (fosfofructoquinasa-1). Cabe recordar que el 4.º paso (aldolasa) genera una molécula de gliceraldehído-3-fosfato, mientras que el 5.º paso genera una segunda molécula de este. De aquí en adelante, las reacciones a seguir ocurrirán dos veces, debido a las 2 moléculas de gliceraldehído generadas de esta fase. Hasta esta reacción hay intervención de energía (ATP). |
| |||
Fase de beneficio energético (ATP, NADH)
[editar]Hasta el momento solo se ha consumido energía (ATP), sin embargo, en la segunda etapa, el gliceraldehído es convertido a una molécula de mucha energía, donde finalmente se obtendrá el beneficio final de 4 moléculas de ATP.
| 6.º paso: gliceraldehído-3-fosfato deshidrogenasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Esta reacción consiste en oxidar el gliceraldehído-3-fosfato utilizando NAD+ para añadir un ion fosfato a la molécula, la cual es realizada por la enzima gliceraldehído-3-fosfato deshidrogenasa en 5 pasos, y de esta manera aumentar la energía del compuesto.
Técnicamente, el grupo aldehído se oxida a un grupo acil-fosfato, que es un derivado de un carboxilo fosfatado. Este compuesto posee una energía de hidrólisis sumamente alta (cercana a los 50 kJ/mol) por lo que se da inicio al proceso de reacciones que permitirán recuperar el ATP más adelante. Mientras el grupo aldehído se oxida, el NAD+ se reduce, lo que hace de esta reacción una reacción redox. El NAD+ se reduce por la incorporación de algún [H+] dando como resultado una molécula de NADH de carga neutra. |
| ||||||||
| 7.º paso: fosfoglicerato quinasa
Véase también: Fosfoglicerato quinasa
| |||||||||
| En este paso, la enzima fosfoglicerato quinasa transfiere el grupo fosfato de 1,3-bisfosfoglicerato a una molécula de ADP, generando así la primera molécula de ATP de la vía. Como la glucosa se transformó en 2 moléculas de gliceraldehído, en total se recuperan 2 ATP en esta etapa. Nótese que la enzima fue nombrada por la reacción inversa a la mostrada, y que esta opera en ambas direcciones.
Los pasos 6 y 7 de la glucólisis nos muestran un caso de acoplamiento de reacciones, donde una reacción energéticamente desfavorable (paso 6) es seguida por una reacción muy favorable energéticamente (paso 7) que induce la primera reacción. En otras palabras, como la célula se mantiene en equilibrio, el descenso en las reservas de 1,3-bisfosfoglicerato empuja a la enzima GAP deshidrogenasa a aumentar sus reservas. La cuantificación de la energía libre para el acople de ambas reacciones es de alrededor de -12 kJ/mol. Esta manera de obtener ATP sin la necesidad de O2 se denomina fosforilación a nivel de sustrato. |
| ||||||||
| 8.º paso: fosfoglicerato mutasa
Véase también: Fosfoglicerato mutasa
| |||||||||
| Se isomeriza el 3-fosfoglicerato procedente de la reacción anterior dando 2-fosfoglicerato, la enzima que cataliza esta reacción es la fosfoglicerato mutasa. Lo único que ocurre aquí es el cambio de posición del fosfato del C3 al C2. Son energías similares y por tanto reversibles, con una variación de energía libre cercana a cero. |
| ||||||||
| 9.º paso: enolasa
Véase también: Enolasa
| |||||||||
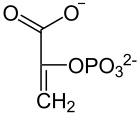
| La enzima enolasa propicia la formación de un doble enlace en el 2-fosfoglicerato, eliminando una molécula de agua formada por el hidrógeno del C2 y el OH del C3. El resultado es el fosfoenolpiruvato. |
| ||||||||
| 10.º paso: piruvato quinasa
Véase también: Piruvato quinasa
| |||||||||
| Desfosforilación del fosfoenolpiruvato, obteniéndose piruvato y ATP. Reacción irreversible mediada por la piruvato quinasa. El enzima piruvato quinasa es dependiente de magnesio y potasio. La energía libre es de -31,4 kJ/mol, por lo tanto la reacción es favorable e irreversible. |
| ||||||||
El rendimiento total de la glucólisis de una sola glucosa (6C) es de 2 ATP y no 4 (dos por cada gliceraldehído-3-fosfato (3C)), ya que se consumen 2 ATP en la primera fase, y 2 NADH (que dejarán los electrones Nc en la cadena de transporte de electrones para formar 3 ATP por cada electrón). Con la molécula de piruvato, mediante un paso de oxidación intermedio llamado descarboxilación oxidativa, mediante el cual el piruvato pasa al interior de la mitocondria, perdiendo CO2 y un electrón que oxida el NAD+, que pasa a ser NADH más H+ y ganando un CoA-SH (coenzima A), formándose en acetil-CoA gracias a la enzima piruvato deshidrogenasa, se puede entrar al ciclo de Krebs (que, junto con la cadena de transporte de electrones, se denomina respiración).
Regulación
[editar]El efecto Pasteur
[editar]El efecto Pasteur es la visualización del poder que posee el O2 en la fermentación mediada por levadura, que fue descubierto por Luis Pasteur al observar la relación entre la tasa de fermentación y la existencia de aire. Él determinó que estas tenían una relación inversa, y además observó que en condiciones aeróbicas, las células de levadura aumentaban y la fermentación disminuía.
De esta manera, el efecto Pasteur fue una de las primeras observaciones que alguien realizó al proceso de la glucólisis de manera indirecta, pero observando que el metabolismo primario de glucosa se podía realizar con presencia o ausencia de oxígeno, y que en este último ocurre la fermentación alcohólica.
Regulación del sustrato
[editar]La membrana plasmática de las células es permeable a la glucosa. Para llevarla dentro de ella utiliza transportadores especiales llamados GLUT, de los cuales no hay diferentes tipos y algunos especializados para cada célula.
Regulación de la actividad enzimática
[editar]
La glucólisis se regula enzimáticamente en los tres puntos irreversibles de esta ruta, esto es, en la primera reacción (G → G-6P), por medio de la hexoquinasa; en la tercera reacción (F-6P → F-1,6-BP) por medio de la PFK1 y en el último paso (PEP → Piruvato) por la piruvato quinasa.
- La hexoquinasa es un punto de regulación poco importante, ya que se inhibe cuando hay mucho G-6P en músculo. Es un punto poco importante ya que el G-6P se utiliza para otras vías.
- La fosfofructoquinasa-1 es la enzima principal de la regulación de la glucólisis, actúa como una llave de agua, si está activa cataliza muchas reacciones y se obtiene más fructosa-1,6-bisfosfato, lo que permitirá a las enzimas siguientes transformar mucho piruvato. Si está inhibida, se obtienen bajas concentraciones de producto y por lo tanto se obtiene poco piruvato. Esta enzima es controlada por regulación alostérica: por un lado se activa por concentraciones elevadas de ADP y AMP, inhibiéndose en abundancia de ATP y citrato, y por otro se activa en presencia de un regulador generado por la PFK2 que es la fructosa-2,6-bisfosfato (F-2,6-BP), que no es un metabolito ni de la glucólisis ni de la gluconeogénesis, sino un regulador de ambas vías que refleja el nivel de glucagón en sangre.
- La lógica de la inhibición y activación son las siguientes:
- ATP: inhibe esta enzima pues si hay una alta concentración de ATP entonces la célula no necesita generar más.
- Citrato: Si la concentración de citrato es alta el ciclo de Krebs va más despacio de lo que el sustrato (acetil-CoA) llega para degradarse, y la concentración de glucosa será más alta. En el ciclo de Krebs se produce mucho NADH y FADH2, para que funcionen se han de reoxidar en la cadena de transporte electrónico creando gradiente de protones, si el gradiente no se gasta los coenzimas no se reoxidan y el ciclo de Krebs se para.
- AMP, ADP: la alta concentración de estas moléculas implica que hay una carencia de ATP, por lo que es necesario realizar glucólisis, para generar piruvato y energía.
- La piruvatoquinasa se regula distintamente según el tejido en el que trabaje, pero en hígado se inhibe en presencia de ATP y Acetil Coenzima-A (Acetil-CoA), y se activa de nuevo ante la F-1,6-BP y la concentración de fosfoenolpiruvato.
Regulación hormonal
[editar]Al aumentar la glucosa en la sangre, después de una comida, las células beta del páncreas estimulan la producción de insulina, y esta a su vez aumenta la actividad de la glucoquinasa en los hepatocitos.
Las concentraciones altas de glucagón y las bajas de insulina disminuyen la concentración intracelular de fructosa-1,6-bisfosfato. Esto trae por consecuencia la disminución de la glucólisis y el aumento de la gluconeogenesis.
Patología
[editar]En la aciduria malónica y metilmalónica combinada (CMAMMA) debida a la deficiencia de ACSF3, la glucólisis se reduce en un 50 %, lo que está causado por una lipoylación reducida de enzimas mitocondriales como el complejo piruvato deshidrogenasa y el complejo α-cetoglutarato deshidrogenasa.[10]
Producción de glucosa
[editar]La gluconeogénesis es la ruta anabólica por la que tiene lugar la síntesis de nueva glucosa a partir de precursores no glucosídicos (lactato, piruvato, glicerol y algunos aminoácidos). Se lleva a cabo principalmente en el hígado, y en menor medida en la corteza renal. Es estimulada por la hormona glucagón, secretada por las células α (alfa) de los islotes de Langerhans del páncreas y es inhibida por su contrarreguladora, la hormona insulina, secretada por las células β (beta) de los islotes de Langerhans del páncreas, que estimula la ruta catabólica llamada glucogenólisis para degradar el glucógeno almacenado y transformarlo en glucosa y así aumentar la glucemia (azúcar en sangre).
Desde el punto de vista enzimático, producir glucosa desde láctico o piruvato cuesta más de lo que produjo su degradación fosfórica. La ecuación global es:
| 2 piruvato + 4 ATP + 2 GTP + 2 NADH + 2 H+ + 4 H 2O → glucosa + 4 ADP + 2 GDP + 6 Pi + 2 NAD+ |
Glucólisis en plantas
[editar]Las plantas tienen la capacidad de realizar la fotosíntesis, y entre los subproductos de este proceso está la glucosa. Esta es usada por las plantas, entre muchas cosas, como fuente de energía en el proceso de respiración, el cual a diferencia de la fotosíntesis es ejecutado independientemente de la luz. Al respirar las plantas absorben oxígeno del aire y expulsan dióxido de carbono y vapor de agua. El intercambio de sustancias lo realizan las estomas; aberturas que actúan como compuertas en las plantas que además tienen la característica de cerrarse ante un descenso excesivo del vapor atmosférico.[11]
Véase también
[editar]Referencias
[editar]- ↑ a b c d e David Nelson & Michael Cox (2004). «Glycolysis, Gluconeogenesis and the Pentose Phosphate Pathway». Lehningher's Principles of Biochemistry. W.H.Freeman. 0716743396.
- ↑ «glucólisis». Real Academia Nacional de Medicina de España.
- ↑ Papers de Pasteur
- ↑ Romano AH & Conway T. Evolution of carbohydrate metabolic pathways. Res Microbiol. 147(6-7):448-55 (1996) PMID 9084754
- ↑ No se usan los intermediarios generados, sino que por medio de las lanzaderas se vuelven a crear dentro de la mitocondria. Por esto se les llama sus equivalentes. Para una visión química, visitar equivalentes
- ↑ Meyerhof, O. Ueber die enzymatische Milch-säurebildung im Muskelextrakt; die Milch-säurebildung aus den gärfähigen Hexosen. Biochem Z. 183:176 (1927)
- ↑ Colowick, S. y Kalckar H.. The role of myokinase in trans-phosphorylations; the enzymatic phosphorylation of hexoses by adenyl pyrophosphate. J. Biol. Chem. 148: 117 (1943).
- ↑ a b c d e f g h i j Valores tomados de Lehningher's Principles of Biochemistry (ISBN 0-7167-4339-6) y del Volumen 3 de Biochemistry por J. Stenesh (ISBN 0-306-45733-4)
- ↑ Irwin A. Rose (2006). «Mechanism of the Aldose-Ketose Isomerase Reactions». Advances in Enzymology - and Related Areas of Molecular Biology, Volume 43. Wiley Interscience. ISBN 0471591788. - doi 10.1002/9780470122884.ch6
- ↑ Wehbe, Zeinab; Behringer, Sidney; Alatibi, Khaled; Watkins, David; Rosenblatt, David; Spiekerkoetter, Ute; Tucci, Sara (1 de noviembre de 2019). «The emerging role of the mitochondrial fatty-acid synthase (mtFASII) in the regulation of energy metabolism». Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids 1864 (11): 1629-1643. ISSN 1388-1981. doi:10.1016/j.bbalip.2019.07.012.
- ↑ «Funciones de las plantas». Consultado el 30 de agosto de 2011.
Enlaces externos
[editar]- www.pdb.org: The Glycolytic Enzymes, información en Protein Data Bank Archivado el 28 de enero de 2011 en Wayback Machine. (en inglés)
- Glucólisis - Artículo para Estudiantes de Medicina (en español)
- Glucólisis explicada en 10 sencillos pasos (en español)
 Wikimedia Commons alberga una categoría multimedia sobre Glucólisis.
Wikimedia Commons alberga una categoría multimedia sobre Glucólisis.