Antocianina

Las antocianinas (del griego ἀνθός (anthos): ‘flor’ + κυανός (kyáneos): ‘azul’) son pigmentos hidrosolubles que se hallan en las vacuolas de las células vegetales y que otorgan el color rojo, púrpura o azul a las hojas, flores y frutos.[1] Desde el punto de vista químico, las antocianinas pertenecen al grupo de los flavonoides y son glicósidos de las antocianidinas, es decir, están constituidas por una molécula de antocianidina, que es la aglicona, a la que se le une un azúcar por medio de un enlace glucosídico. Sus funciones en las plantas son múltiples, desde la de protección de la radiación ultravioleta hasta la de atracción de insectos polinizadores.[2]
El término antocianina fue propuesto en 1835 por el farmacéutico alemán Ludwig Clamor Marquart (1804-1881) para describir el pigmento azul de la col lombarda (Brassica oleracea). Actualmente las antocianinas no solo incluyen a los pigmentos azules de las plantas sino también a los rojos y violetas.[3][2]
El interés por los pigmentos antociánicos se ha intensificado recientemente debido a sus propiedades farmacológicas y terapéuticas. Por lo tanto, además de su papel funcional como colorantes alimenticios, las antocianinas son agentes potenciales en la obtención de productos con valor agregado para el consumo humano.[2]
Estructura

Químicamente las antocianinas son glicósidos de las antocianidinas, es decir, están constituidas por una molécula de antocianidina, que es la aglicona, a la que se le une un azúcar por medio de un enlace glucosídico. La estructura química básica de estas agliconas es el ion flavilio, también llamado 2-fenil-benzopirilio que consta de dos grupos aromáticos: un benzopirilio y un anillo fenólico; el flavilio normalmente funciona como un catión.[2][4][5]
Las agliconas libres raramente existen en los alimentos, excepto posiblemente como componentes traza de las reacciones de degradación.[6] De todas las antocianidinas que actualmente se conocen (aproximadamente 20), las más importantes son la pelargonidina, la delfinidina, la cianidina, la petunidina, la peonidina y la malvidina, nombres que derivan de la fuente vegetal de donde se aislaron por primera vez; la combinación de éstas con los diferentes azúcares genera aproximadamente 150 antocianinas. Los hidratos de carbono que comúnmente se encuentran son la glucosa y la ramnosa, seguidos de la galactosa, la xilosa y la arabinosa y, ocasionalmente, la gentiobiosa, la rutinosa y la soforosa.[4] Como se muestra en la siguiente tabla, el grupo fenilo en la posición 2 puede llevar diferentes sustituyentes.[5]
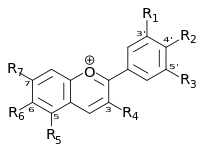
|
Antocianidina | R1 | R2 | R3 | R4 | R5 | R6 | R7 |
| Aurantinidina | -H | -OH | -H | -OH | -OH | -OH | -OH | |
| Capensinidina | -OCH3 | -OH | -OCH3 | -OH | -OCH3 | -H | -OH | |
| Cianidina | -OH | -OH | -H | -OH | -OH | -H | -OH | |
| Delfinidina | -OH | -OH | -OH | -OH | -OH | -H | -OH | |
| Europinidina | -OCH3 | -OH | -OH | -OH | -OCH3 | -H | -OH | |
| Luteolinidina | -OH | -OH | -H | -H | -OH | -H | -OH | |
| Pelargonidina | -H | -OH | -H | -OH | -OH | -H | -OH | |
| Malvidina | -OCH3 | -OH | -OCH3 | -OH | -OH | -H | -OH | |
| Peonidina | -OCH3 | -OH | -H | -OH | -OH | -H | -OH | |
| Petunidina | -OH | -OH | -OCH3 | -OH | -OH | -H | -OH | |
| Rosinidina | -OCH3 | -OH | -H | -OH | -OH | -H | -OCH3 |
Estabilidad
La estabilidad de las antocianinas está determinada por el grado de oxidación, la temperatura, la fuerza iónica, la acidez y la interacción con otros radicales y moléculas complejas.[7]
El científico alemán Richard Willstätter (1872-1942) fue el primero en describir el cambio de color de las antocianinas, moléculas en las que se produce el efecto batocrómico, que consiste en que al cambiar la acidez, es decir el pH, se pasa del rojo anaranjado en condiciones ácidas, como el de la pelargonidina, al rojo intenso-violeta de la cianidina en condiciones neutras, y al rojo púrpura-azul de la delfinidina, en condiciones alcalinas. El pH tiene efecto en la estructura y la estabilidad de las antocianinas. La acidez tiene un efecto protector sobre la molécula. En soluciones acuosas a valores de pH inferiores a 2, básicamente la totalidad del pigmento se encuentra en su forma más estable de ion oxonio o catión flavilio de color rojo intenso. A valores de pH más altos ocurre una pérdida del protón y adición de agua en la posición 2, dando lugar a un equilibrio entre la pseudobase carbinol o hemicetal y la forma chalcona, o de cadena abierta. Tanto el hemicetal como la chalcona, son formas incoloras y bastante inestables. A valores de pH superiores a 7 se presentan las formas quinoidales de color púrpura que se degradan rápidamente por oxidación con el aire.[8][7]
Los incrementos de la temperatura dan como resultado la pérdida del azúcar glicosilante en la posición 3 de la molécula y la apertura de anillo con la consecuente producción de chalconas incoloras.[9]
Los efectos degradativos del oxígeno y de la presencia de ácido ascórbico sobre la estabilidad de las antocianinas están relacionados entre sí. Las condiciones que favorecen la oxidación aeróbica del ácido ascórbico en el jugo de fresa y en sistemas modelo que contenían pelargonidina 3-glucósido proveniente de la fresa causaban grandes pérdidas de antocianinas, pero cuando el oxígeno era excluido del sistema no se observaba deterioro del color.[10] De igual manera, se ha informado que existe un efecto sinérgico entre el ácido ascórbico y el oxígeno sobre la degradación de la pelargonidina 3-glucósido en solución.[7][11][12]
Distribución
| Especie | Contenido de antocianinas |
|---|---|
| Euterpe oleracea | 320[13] |
| Ribes nigrum | 165-412[14][15] |
| Aronia melanocarpa | 1.480[16] |
| Solanum melongena | 750[16] |
| naranja | ~200[13] |
| Rubus fruticosus | 317[17] |
| Rubus occidentalis | 589[18] |
| Rubus idaeus | 365[16] |
| Vaccinium | 558[19] |
| Prunus cerassus | 350-400[13] |
| Ribes rubrum | 80-420[16] |
| uva roja | 888[20] |
| vino tinto | 24-35[13] |
| maíz morado | 1.642[21] |
En las plantas superiores las antocianinas se encuentran en todos los tejidos, incluyendo las hojas, los tallos, las raíces, las flores y los frutos. Las antocianinas pueden confundirse con los carotenoides, que también le dan color a las flores y hojas, aunque a diferencia de las antocianinas, éstos no son solubles en agua, sino que están adosados a las proteínas de los cloroplastos. Los carotenoides dan colores rojo-anaranjados o amarillos, mientras que las antocianinas dan un abanico inmenso de colores: la malvidina da color purpúreo, las flavonas dan marfil o amarillo, muy frecuente en las hojas de Agave, Erythrina indica, Pandanus y Sanseviera; la delfinidina, azul; la cianidina, violeta; la pelargonidina, rojo y salmón como en Pelargonium, Dahlia, o Papaver.[22] Un factor que contribuye a la variedad de colores en flores, hojas y frutas es la coexistencia de varias antocianinas en un mismo tejido, por ejemplo en las flores de la malva real (Althaea rosea) se puede encontrar malvidina y delfinidina.[23]
Las antocianinas se encuentran en muchas frutas oscuras (como la frambuesa azul y negra, zarzamora, cereza, mora azul, uva azul y negra) y muchas verduras. Según el pH su color está dado por los grupos hidroxilos de los anillos fenólicos y el benzopirilio, de modo tal que en medio ácido (con un pH menor a 5) toma coloraciones rojizas, mientras que en un medio alcalino (con pH mayor a 7) adquiere coloración púrpura.[2][7]
Funciones
Las antocianinas pueden encontrarse en las hojas, haciendo que las mismas muestren un color rojizo. Esta coloración puede deberse a un mecanismo de defensa, para proteger a las plantas, sus flores y sus frutas contra la luz ultravioleta (UV) y, por su propiedad antioxidante, evitar la producción de radicales libres. Las hojas de muchas especies muestran un color rojo bien diferenciado durante el otoño, tales como: Amherstia, Andira, Bombax, Brownea, Calophyllum, Cecropia, Ceiba, Cinnamomum, Coccoloba, Diospyrus, Eugenia, Gustavia, Lophira, Mangifera, Mesua, Pachira, Persea, Saraca, Triplaris. También se hallan altas concentraciones de antocianinas en Acalypha y en muchas especies de las familias Araceae, Bromeliaceae, Marantaceae, Liliaceae y Euphorbiaceae, que atraen a los polinizadores a sus flores mediante los brillantes colores provistos por estos compuestos. En algunos árboles, como el arce rojo Americano (Acer rubrum) o el roble escarlata (Quercus coccinea), los flavonoles (un tipo de flavonoide) incoloros se convierten en antocianinas rojas cuando la clorofila de sus hojas se degrada.[24] En otoño, cuando la clorofila se descompone, los flavonoides incoloros se ven privados del átomo de oxígeno unido a su anillo central, lo que los convierte en antocianinas, dando colores brillantes. Esta transformación química que consiste sólo en la pérdida de un átomo de oxígeno es la responsable de nuestra percepción de los colores del otoño. Las antocianinas que aparecen en el otoño probablemente son las que protegen a las hojas del efecto de los rayos UV del Sol. Se especula que esta protección de las hojas aumenta su efectividad para transportar nutrientes durante su senescencia.[25][26]
Las antocianinas en la alimentación



El interés por los pigmentos antociánicos se ha intensificado recientemente debido a sus propiedades farmacológicas y terapéuticas. Debido a que durante el paso desde el tracto digestivo al torrente sanguíneo de los mamíferos las antocianinas permanecen intactas, su consumo puede tener un impacto directo sobre la salud humana.[27]
Beneficios
Ejercen efectos terapéuticos conocidos que incluyen la reducción de la enfermedad coronaria, efectos antitumorales, antiinflamatorios y antidiabéticos, además del mejoramiento de la agudeza visual y del comportamiento cognitivo. Los efectos terapéuticos de las antocianinas están relacionados con su actividad antioxidante. Estudios con fracciones de antocianinas provenientes del vino han demostrado que estas son efectivas en atrapar especies reactivas del oxígeno, además de inhibir la oxidación de lipoproteínas y la agregación de plaquetas.[7][28]
- Obesidad
Un diverso grupo de compuestos fenólicos provenientes de los denominados frutos rojos, tales como flavonoles, elagitaninos y antocianidinas, inhiben las enzimas digestivas α-glucosidasa, α-amilasa, proteasa y lipasa, las cuales son dianas terapéuticas para controlar la diabetes mellitus tipo 2 y la obesidad. Las antocianinas restringen la actividad de la α-glucosidasa, lo que determina una disminución de los niveles de glucosa en sangre. Además, junto con los elagitaninos, actúan sinergísticamente para inhibir la actividad de la enzima α-amilasa. Las pro-antocianidinas contribuyen principalmente en la inhibición de la lipasa gastrointestinal y limitan la digestión de las grasas después de las comidas.[29] Las antocianinas de la uva, por otro lado, inhibirían el desarrollo de la obesidad ya que, al menos in vitro, producen una disminución de la acumulación de lípidos en los adipocitos maduros.[30]
- Funciones neurológicas
Una dieta de 2% de bayas de Vaccinium (arándanos) suministrada a ratas de la cepa F344 durante 8 semanas fue efectiva para mejorar las deficiencias relacionadas con la edad en el señalamiento neuronal y parámetros de comportamiento.[31] Se ha informado que varias antocianinas como el 3-galactósido de cianidina, el 3-glucósido de cianidina, el 3-arabinosa cianidina, 3-el galactósido de malvidina y el 3-galactósido de delfinidina, entre otros, pueden localizarse en varias regiones del cerebro de las ratas tratadas de este modo. En otro estudio, los mismos frutos, pero liofilizados, demostraron que mejoran la memoria a corto plazo de las ratas a una dosis de 3,2 mg/día por 30 días.[32][33]
- Sistema inmune
La ingestión de frutos rojos también mejora el sistema inmune. Los jugos ricos en antocianinas, como los de frutas de arándanos o de boysenberry (Rubus ursinus x idaeus), cuando son suministrados como suplemento de la dieta a gente sana, incrementan la proliferación de linfocitos, como así también la secreción de citocininas (interleucina 2) por los linfocitos activados.[34]
Colorantes alimenticios
El interés por los pigmentos antociánicos y su investigación científica se ha incrementado en los últimos años, debido no solamente al color que confieren a los productos que las contienen sino a su probable papel en la reducción de las enfermedades coronarias, cáncer y diabetes; a sus efectos antiinflamatorios y al mejoramiento de la agudeza visual y del comportamiento cognitivo. Por lo tanto, además de su papel funcional como colorantes, las antocianinas son agentes potenciales en la obtención de productos con valor agregado para el consumo humano.[7]
La demanda de antocinina a nivel mundial, obtenida a partir de fuentes naturales, se calcula entre 1.200 y 1.300 toneladas anuales. Los principales países consumidores son Japón y Estados Unidos y en menor escala Francia, Inglaterra, Alemania, España, Bélgica y Venezuela. La producción global de antocianinas está orientada a las empresas productoras de productos de bebidas, saborizantes de yogur y golosinas.[35]
Las políticas regulatorias en cuanto al uso de colorantes derivados de las antocianinas varían según el país considerado. Estados Unidos es el país más restrictivo en cuanto al empleo de las antocianinas como colorantes naturales. Allí, solo cuatro de los 26 colorantes que están exentos de certificación y aprobados para el uso en alimentos derivan de la cáscara de la uva, del extracto de la uva, del jugo de vegetales y del jugo de frutas. Las fuentes más comunes de jugo de vegetales son el repollo morado, los rábanos y diferentes variedades de bayas.[36] En contraste, en la Unión Europea, Chile, Colombia, Irán, Israel, Corea del Sur, Malta, Perú, Arabia Saudita y los Emiratos Árabes todos los colorantes derivados de las antocianinas son reconocidos como naturales y no presentan restricciones para su utilización.[37]
Antocianinas en vinos
Los vinos están compuestos por varias familias de compuestos químicos. Dentro de estas familias, las antocianinas son un importante parámetro de calidad de uvas rojas, debido a la importancia que estos compuestos tienen en el color de los respectivos vinos. Las antocianinas están en las plantas en una distribución específica, tanto cualitativa como cuantitativamente, lo que las hace un marcador bioquímico muy útil en quimiotaxonomia, al igual que un índice de control de calidad y aseguramiento de calidad en productos de origen vegetal. En las uvas y en los vinos realizados a partir de ellas, las antocianinas presentes están estructuralmente basadas en cinco agliconas, denominadas malvidina, petunidina, peonidina, delfinidina y cianidina. Las antocianidinas glicosiladas (antocianinas) existen como 3-O-glucósidos, 3-O-acetilglucósidos y 3-O-(6-O-p-cumaroil) glucósidos.[38][39][40]
En busca de la rosa azul: ingeniería genética de flavonoides

La leyenda de "Las rosas azules" apareció publicada en "Los días del Albaicín" de A.J. Afán de Ribera[41] y en ella concurren como personajes principales, Isabel, hija de un noble cristiano y Hamet, noble árabe granadino. Hamet, enamorado de Isabel, la rapta cuando va a asaltar el castillo de su padre; como consecuencia del rapto ella enloquece y en su locura busca una rosa azul en los jardines del musulmán. La curación y el desenlace feliz -Hamet e Isabel juntos- se opera a través del cambio de religión del noble musulmán. La rosa azul posibilitó la realización del milagro.[42] Otra de las leyendas que tienen como protagonista a la rosa azul está basada en el famoso poeta lírico Anacreonte de Grecia (siglo VI a. C.), que cantaba que el curativo bálsamo de rosas, en particular la azul, servía de alivio al corazón que latía agonizante por las penas.[43] Lo cierto, además de las leyendas, es que la rosa azul ha sido un producto de la imaginación del hombre por siglos.[42]
Frank Cowlishaw, un ingeniero retirado de Derbyshire, en Inglaterra, pasó 25 años de su vida cruzando entre sí diferentes tipos de rosas, tratando de sacarle a la naturaleza el viejísimo sueño de producir una rosa azul. El fruto de sus esfuerzos combinó seis variedades distintas y produjo, en 1999, la llamada "Rhapsody in Blue" (del inglés, Rapsodia en azul), una magnífica y aromática flor morada, que es lo más cercano al color azul que puede brindar una rosa.[44] La verdad es que si Cowlishaw continuara cruzando y entrecruzando rosas, jamás podría conseguir una rosa realmente azul. La razón es que los pétalos de las rosas no posee el gen necesario (y por ende, la enzima) para crear el pigmento azul indispensable: la delfinidina.[45]
Lo que no pudo lograr el mejoramiento genético aparentemente lo está logrando la ingeniería genética, particularmente la ingeniería genética de flavonoides. Los científicos de la compañía holandesa Florigene (controlada desde el 2003 por la empresa japonesa Suntory) han tenido éxito en crear el pigmento azul en los pétalos de las rosas mediante la inclusión de un gen proveniente de la petunia (Petunia × hybrida) en las células de esas plantas, que produce la enzima indispensable para lograr la síntesis de delfinidina.[46][47] Además de ese gen, se incluyó también mediante transformación un "gen silenciador", cuyo propósito exclusivo es ordenar a la rosa que deje de fabricar el pigmento rojo, la cianidina, mediante una estrategia conocida como ribointerferencia.[48]
En 1996, Yoshikazu Tanaka, a cargo del proyecto de la rosa azul, pudo fabricar a partir de una antigua variedad llamada «Cardenal» una primera rosa transgénica que tenía en sus pétalos moléculas de delfinidina, el pigmento azul. Pero el análisis indicó que en los pétalos había también moléculas de cianidina, el pigmento responsable del color rojo. A simple vista, la flor tenía un color borgoña oscuro. Todavía no era azul. Fue en el año 2002 cuando Tanaka tuvo en sus manos la primera rosa que sólo tenía pigmento azul en sus pétalos. No era todavía una rosa visiblemente azul, sino más bien una rosa entre malva y lila, como otras variedades ya existentes en el mercado («Blue Moon», «Vol de Nuit»). Pero a diferencia de ellas, la rosa de Florigene tenía en sus pétalos el pigmento azul. Aparentemente, resta modificar la acidez (el pH) de las células de estas rosas para que sus pétalos sean definidamente azules.[49][50]
Véase también
Referencias
- ↑ Wagner GJ. 1982. Cellular and Subcellular Location in Plant Metabolism. In: Creazy L, Hrazdina G. (ed) Recent advances in Phytochemistry. New York, Plenum Press; . p. 1-45.
- ↑ a b c d e Wong, D. 1995. Química de los Alimentos: Mecanismos y Teoría. Ed. Acribia, S. A. España. 476 p.
- ↑ Raphael Ikan. 1991. Natural products: a laboratory guide . Academic Press, California. ISBN 0-12-370551-7, pág. 19.
- ↑ a b Badui, S. 1999. Química de los Alimentos. Longman de México Editores. México. 648 p.
- ↑ a b International Union of Pure and Applied Chemistry IUPAC Goldbook. Interdivisional Commitée on Nomenclature and Symbols. Consultado el 1 de octubre de 2009.
- ↑ Fennema, O. 1993. Química de los Alimentos. Ed. Acribia, S. A. Zaragoza, España. 1095 p.
- ↑ a b c d e f Garzon, G. 2008. Anthocyanins As Natural Colorants And Bioactive Compounds: A Review. Acta Biol.Colomb. 13, no.3, p.27-36. ISSN 0120-548X.
- ↑ Hutcings JH. 1999. Food Color and Appearance. 2nd ed. Gaithersburg, Md.:Aspen Publishers, Inc.
- ↑ Timberlake CF. 1980. Anthocyanins. Occurrence, Extraction and Chemistry. Food Chem. 5(1)69-80.
- ↑ Sondheimer E, Kertesz ZI. 1953. Participation of Ascorbic Acid in the Destruction of Anthocyanin in Strawberry Juice and Model Systems. Food Res.18:475.
- ↑ Markakis P., Liningston GE, Fellers, RC. 1957. Quantitative Aspects of Strawberry Pigment Degradation. Food Res. 22:117-130.
- ↑ Garzón GA, Wrolstad RE. 2002. Comparison of the Stability of Pelargonidin-based Anthocyanins in Strawberry Juice and Concentrate. J Food Sci. 67(4):1288-1299.
- ↑ a b c d Wu, X., Beecher, G. R., Holden, J. M., Haytowitz, D. B., Gebhardt, S. E., and Prior, R. L. (2006). Concentrations of Anthocyanins in Common Foods in the United States and Estimation of Normal Consumption. J Agric Food Chem.
- ↑ Kampuse, S., Kampuss, K., and Pizika, L. (2002). Stability of anthocyanins and ascorbic acid in raspberry and blackcurrant cultivars during frozen storage. Acta Horticulturae 2, 507-510.
- ↑ Kähkönen, M. P., Heinamaki, J., Ollilainen, V., and Heinonen, M. (2003). Berry anthocyanins: isolation, identification and antioxidant properties. Journal of the Science of Food and Agriculture 83, 1403-1411.
- ↑ a b c d Wu X, Gu L, Prior RL, McKay S (diciembre de 2004). «Characterization of anthocyanins and proanthocyanidins in some cultivars of Ribes, Aronia, and Sambucus and their antioxidant capacity». J. Agric. Food Chem. 52 (26): 7846-56. PMID 15612766. doi:10.1021/jf0486850.
- ↑ Siriwoharn T, Wrolstad RE, Finn CE, Pereira CB (diciembre de 2004). «Influence of cultivar, maturity, and sampling on blackberry (Rubus L. Hybrids) anthocyanins, polyphenolics, and antioxidant properties». J. Agric. Food Chem. 52 (26): 8021-30. PMID 15612791. doi:10.1021/jf048619y.
- ↑ Wada L, Ou B (junio de 2002). «Antioxidant activity and phenolic content of Oregon caneberries». J. Agric. Food Chem. 50 (12): 3495-500. PMID 12033817. doi:10.1021/jf011405l.
- ↑ Hosseinian FS, Beta T (diciembre de 2007). «Saskatoon and wild blueberries have higher anthocyanin contents than other Manitoba berries». J. Agric. Food Chem. 55 (26): 10832-8. PMID 18052240. doi:10.1021/jf072529m.
- ↑ Muñoz-Espada AC, Wood KV, Bordelon B, Watkins BA (noviembre de 2004). «Anthocyanin quantification and radical scavenging capacity of Concord, Norton, and Marechal Foch grapes and wines». J. Agric. Food Chem. 52 (22): 6779-86. PMID 15506816. doi:10.1021/jf040087y.
- ↑ Lieberman S (2007). «The antioxidant power of purple corn: a research review». Alternative & Complementary Therapies 13 (2): 107-110. doi:10.1089/act.2007.13210.
- ↑ Jaakola L, K Määtä, AM Pirttila, R Törrönen, S Kärenlampi y A Hohtola. 2002. "Expression of Genes Involved in Anthocyanin Biosynthesis in Relation to Anthocyanin, Proanthocyanidin, and Flavonol Levels during Bilberry Fruit Development." Plant Physiology 130: 729–739.
- ↑ Lawrence,W.J.C. James Robert Price, Gertrude Maud Robinson y Robert Robinson. 1939. The Distribution of Anthocyanins in Flowers, Fruits and Leaves. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, Vol. 230, No. 567 (Jul. 24, 1939), pp. 149-178
- ↑ M. N. Clifford (2000): Anthocyanins – nature, occurrence and dietary burden. In: Journal of the Science of Food and Agriculture. Bd. 80, Nr. 7, S. 1063–1072. doi <1063::AID-JSFA605>3.0.CO;2-Q 10.1002/(SICI)1097-0010(20000515)80:7<1063::AID-JSFA605>3.0.CO;2-Q
- ↑ Feild T. S., D. W. Lee, N. M. Holbrook (2001). «Why leaves turn red in autumn. The role of anthocyanins in senescing leaves of red-osier dogwood» (PDF). Plant Physiol 127 (2): 566-574.
- ↑ G. Mazza, E. Miniati: Anthocyanins in fruits, vegetables, and grains. CRC Press, Boca Raton 1993. ISBN 0-8493-0172-6
- ↑ MIYAZAWA T, NAKAGAWA K, KUDO M, MURAISHI K, SOMEYA K. Direct Intestinal Absorption of Red Fruit Anthocyanins, Cyanidin-3-Glucoside and Cyanidin-3,5-Diglucoside, Into Rats and Humans. J Agric Food Chem. 1999;47:1083-1091.
- ↑ Ghiselli A, Nardini M, Baldi A, Scaccini C. Antioxidant Activity of Different Phenolic Fractions Separated From an Italian Red Wine. J Agric Food Chem. 1998;46 (2),361-367.
- ↑ McDougall, G. J., and Stewart, D. (2005). The inhibitory effects of berry polyphenols on digestive enzymes. Biofactors 23, 189-195.
- ↑ Lefevre, M., Lee, B., Byun, D. and Kim, H. Anthocyanins inhibit lipogenesis of 3T3-L1 preadipocytes. IFT 2006, presentation number: 003E-16
- ↑ Andres-Lacueva, C., Shukitt-Hale, B., Galli, R. L., Jauregui, O., Lamuela-Raventos, R. M., and Joseph, J. A. (2005). Anthocyanins in aged blueberry-fed rats are found centrally and may enhance memory. Nutr Neurosci 8, 111-120.
- ↑ Ramirez, M. R., Izquierdo, I., do Carmo Bassols Raseira, M., Zuanazzi, J. A., Barros, D., and Henriques, A. T. (2005). Effect of lyophilised Vaccinium berries on memory, anxiety and locomotion in adult rats. Pharmacol Res 52, 457-462.
- ↑ Cantuti-Castelvetri, I., Shukitt-Hale, B., and Joseph, J. A. (2000). Neurobehavioral aspects of antioxidants in aging. Int J Dev Neurosci 18, 367-381.
- ↑ Bub, A., Watzl, B., Blockhaus, M., Briviba, K., Liegibel, U., Muller, H., Pool-Zobel, B. L., and Rechkemmer, G. (2003). Fruit juice consumption modulates antioxidative status, immune status and DNA damage. J Nutr Biochem 14, 90-98.
- ↑ Situación del Perú como productor de colorantes [Producción de antocianinas http://www.monografias.com/trabajos58/produccion-antocianina/produccion-antocianina2.shtml] Consultado el 1 de octubre de 2009.
- ↑ Wrolstad, R E. 2004. Anthocyanin Pigments-bioactivity and Coloring Properties. J Food Sci. 69(5):C419-C425.
- ↑ Ottersäater, G. Coloring of Food, Drugs and Cosmetics. New York, N.Y.: Marcel Dekker, Inc.; 1999.
- ↑ Catharino, R.R.; Cunha, I.; Fogaça, A.; Facco, E.; Godoy, H.; Daudt, C.; Eberlin, M.; Sawaya, A. Characterization of must and wine of six varieties of grapes by direct infusion electrospray ionization mass spectrometry. J.Mass Spectrom. 2006, 41, 185-190.
- ↑ Gonzalez-Neves, G; Barreiro, L.; Gil, G.; Franco, J.; Ferrer, M.; Moutounet, M.; Carbonneau, A. Anthocyanic composition of Tannat grapes from the south region of Uruguay. Analytica Chimica Acta 513, 2004, 197-202
- ↑ Revilla, E.; García-Beneytez, E.; Cabello, F.; Martin-Ortega, G.; Ryan J.M. Value of high-performance liquid chromatographic analysis of anthocyanins in the differentiation of red grape cultivars and red wines made from them. Journal of Chromatography A. 2001, 915, 53-60.
- ↑ A.J. Afán de Ribera. 1891. Los días del Albaicín. Tradiciones, leyendas y cuentos granadinos. Granada, Tip. Sta. Ana.
- ↑ a b Iteresa. La leyenda de la rosa azul Consultado el 20 de abril de 2009.
- ↑ La leyenda puede leerse en este sitio. Consultado el 15 de abril de 2009.
- ↑ Royal Horticultural Society. The Garden. 2002. Blue rose success for amateur Consultado el 14 de abril de 2009.
- ↑ Florigene. News. The World's First Biotechnology-driven "Blue Roses" -synonym for the impossible - have been successfully developed Consultado el 19 de abril de 2009.
- ↑ Brugliera, F., Barri-Rewell, G., Holton, T. and Mason, J. (1999). «Isolation and characterization of a flavonoid 3’-hydroxylase cDNA clone corresponding to the Ht1 locus of Petunia hybrida.» (PDF). The Plant Journal 19 (4): 441-451. doi:10.1046/j.1365-313X.1999.00539.x.
- ↑ Brugliera, F., Holton, T.A., Stevenson, T.W., Farcy, E., Lu, C-Y. y Cornish, E.C. (1994). «Isolation and characterization of a cDNA clone corresponding to the Rt locus of Petunia hybrida» (PDF). The Plant Journal 5 (1): 81-92. doi:10.1046/j.1365-313X.1994.5010081.x.
- ↑ Tanaka, Y. and Mason J. (2003) Manipulation of flower colour by genetic engineering. In: Singh RP and Jaiwal PK (eds) Plant Genetic Engineering (pp 361-385). SCI Tech Publishing, Houston
- ↑ Notas de Ciencia. La rosa azul, México. Consultado el 21 de abril de 2009.
- ↑ CSIRO Plant Industries. 2005. World's First Blue Rose. Consultado el 15 de junio de 2009.
