Nitrato de potasio
| Nitrato de potasio | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Trioxonitrato (V) de potasio | ||
| General | ||
| Otros nombres |
Nitrato de potasio Nitrato potásico Nitrato de potasa Salitre | |
| Fórmula estructural |
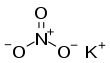 | |
| Fórmula molecular | KNO3 | |
| Identificadores | ||
| Número CAS | 7757-79-1[1] | |
| Número RTECS | TT3700000 | |
| ChEBI | 63043 | |
| ChEMBL | CHEMBL1644029 | |
| ChemSpider | 22843 | |
| DrugBank | DB11090 | |
| PubChem | 139063997, 516903 24434, 139063997, 516903 | |
| UNII | RU45X2JN0Z | |
| KEGG | D02051 | |
| Propiedades físicas | ||
| Apariencia | Blanco o gris sucio | |
| Densidad | 2100 kg/m³; 2,1 g/cm³ | |
| Masa molar | 101,103 g/mol g/mol | |
| Punto de fusión | 607 K (334 °C) | |
| Punto de ebullición | 673 K (400 °C) | |
| Estructura cristalina | Ortorrómbico, Aragonita | |
| Propiedades químicas | ||
| Solubilidad en agua | 36 g en 100g de agua | |
| Peligrosidad | ||
| NFPA 704 |
0
1
0
OX
| |
| Riesgos | ||
| Ingestión | Puede causar irritación, náusea, vómitos, mareos y diarrea. | |
| Inhalación | Irritación; la exposición a largo plazo puede resultar fatal. | |
| Piel | Bajo riesgo. | |
| Ojos | Bajo riesgo. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El compuesto químico nitrato de potasio, componente del salitre, o nitrato potásico es un nitrato cuya fórmula es KNO3. Actualmente, la mayoría del nitrato de potasio viene de los vastos depósitos de nitrato de sodio. El nitrato de sodio es purificado y posteriormente se le hace reaccionar en una solución con cloruro de potasio (KCl), en la cual el nitrato de potasio, menos soluble, cristaliza.
Etimología
[editar]La potasa, o nitrato de potasio, debido a su uso y producción tempranos y globales, tiene muchos nombres. El químico potasio fue aislado por primera vez por el químico Sir Humphry Davy, a partir de la potasa. Esto se refiere a un método primitivo de extraer varias sales de potasio: colocando en una olla de hierro la ceniza de madera quemada u hojas de árboles, agregando agua, calentando y evaporando la solución.[2] En cuanto al nitrato, las palabras hebreas y egipcias tenían las consonantes n-t-r, lo que indicaba una probable cognación en el griego nitron, que se latinizó como nitrum o nitrium. De allí que el francés antiguo tuviera nitro y el inglés medio nitro. En el siglo XV, los europeos se refirieron a él como salitre,[3] específicamente salitre indio (el nitrato de sodio es salitre de chile) y más tarde como nitrato de potasa, ya que la química del compuesto se entendía mejor.
Producción histórica
[editar]A partir de fuentes minerales
[editar]En la antigua India, los fabricantes de salitre formaban la casta Nuniya.[4] El salitre se menciona en el Arthashastra de Kautilya (compilado entre el 300 a. C. y el 300 d. C.), que menciona el uso de su humo venenoso como arma de guerra,[5] aunque su uso para la propulsión no apareció hasta la época medieval.
El químico e ingeniero Hasan al-Rammah de Siria describió en 1270 un proceso de purificación del nitrato de potasio en su libro al-Furusiyya wa al-Manasib al-Harbiyya (Libro de la equitación militar y de los ingenios de guerra). En este libro, al-Rammah describe, en primer lugar, la purificación del barud (mineral de salitre en bruto) hirviéndolo con un mínimo de agua y utilizando sólo la solución caliente, y luego el uso de carbonato de potasio (en forma de cenizas de madera) para eliminar el calcio y el magnesio mediante la precipitación de sus carbonatos de esta solución, dejando una solución de nitrato de potasio purificado, que luego podía secarse.[6] La terminología utilizada por al-Rammah indicaba que la pólvora de la que escribía procedía de China[7]
Ya en 1845 se explotaban depósitos de nitratita en Chile y California.
A partir de cuevas
[editar]Las principales fuentes naturales de nitrato de potasio eran los depósitos que cristalizaban de las paredes de las cuevas y las acumulaciones de guano de murciélago en las cuevas.[8] La extracción se realiza sumergiendo el guano en agua durante un día, filtrándolo y recogiendo los cristales en el agua filtrada. Tradicionalmente, el guano era la fuente utilizada en Laos para la fabricación de la pólvora de los cohetes Bang Fai.
Salitrería
[editar]El nitrato de potasio se produce en una salitrería.[9] El proceso consistía en enterrar los excrementos (humanos o animales) en un campo junto a los nitrarios, regarlos y esperar hasta que la lixiviación permitiera que el salitre saliera a la superficie del suelo por eflorescencia. A continuación, los operarios recogían el polvo resultante y lo transportaban para concentrarlo por ebullición en la planta de calderas.[10][11]
Además de "Montepellusanus" (Montpellier), durante el siglo XIII (y más allá) el único suministro de salitre en toda la Europa cristiana (según De Alchimiaen 3 manuscritos de Michael Scot, 1180-1236) se "encontró en España en Aragón en cierta montaña cerca del mar".[12]: 89, 311 [13]
En 1561, Isabel I de Inglaterra, en guerra con Felipe II de España, no pudo importar el salitre (del que el Reino de Inglaterra no tenía producción propia), y tuvo que pagar "300 libras de oro" al capitán alemán Gerrard Honrik por el manual "Instructions for making salpeter to growe" (el secreto del "Feuerwerkbuch" - las salitrerías-).[14]
Lecho de salitre
[editar]El lecho de nitrato es un proceso similar utilizado para producir nitrato a partir de excrementos. Sin embargo, a diferencia del proceso basado en la lixiviación del nitrario, se mezclan los excrementos con la tierra y se espera a que los microbios del suelo conviertan el amino-nitrógeno en nitratos mediante la nitrificación. Los nitratos se extraen del suelo con agua y luego se purifican en salitre añadiendo ceniza de madera. El proceso se descubrió a principios del siglo XV y fue muy utilizado hasta que se encontraron los yacimientos chilenos.[15]
El bando confederado de la Guerra de Secesión estadounidense tenía una importante escasez de salitre. En consecuencia, se creó la Oficina del Nitre y la Minería para fomentar la producción local, incluso mediante lechos de nitrato y proporcionando excrementos a los nitrarios del gobierno. El 13 de noviembre de 1862, el gobierno publicó un anuncio en el Charleston Daily Courier solicitando 20 o 30 "hombres negros aptos" para trabajar en los nuevos lechos de salitre de Ashley Ferry, S.C. Los lechos de salitre eran grandes rectángulos de estiércol y paja descompuestos, humedecidos semanalmente con orina, "agua de estiércol" y líquido procedente de retretes, pozos negros y desagües, y volteados regularmente. Los Archivos Nacionales publicaron registros de nóminas que dan cuenta de más de 29 000 personas obligadas a este tipo de trabajo en el estado de Virginia. El Sur estaba tan desesperado por conseguir salitre para la pólvora que, según se informa, un funcionario de Alabama puso un anuncio en el periódico pidiendo que se guardara el contenido de los orinales para recogerlo. En Carolina del Sur, en abril de 1864, el gobierno confederado obligó a 31 personas esclavizadas a trabajar en la Ashley Ferry Nitre Works, en las afueras de Charleston.[16]
Método francés
[editar]Anne Robert Jacques Turgot y Lavoisier crearon la Régie des Poudres et Salpêtres unos años antes de la Revolución Francesa. Los lechos de salitre se preparaban mezclando estiércol con mortero o cenizas de madera, tierra común y materiales orgánicos como la paja para dar porosidad a una pila de abono que solía tener 1,2 m de altura, 1,8 m de ancho y 4,6 m de largo.[17] La pila solía estar a cubierto de la lluvia, se mantenía húmeda con orina, se volteaba con frecuencia para acelerar la descomposición, y finalmente se lixiviaba con agua después de aproximadamente un año, para eliminar el nitrato de calcio soluble que luego se convertía en nitrato de potasio por filtración a través de la potasa.
Tal vez el análisis más exhaustivo de la producción de salitre sea el texto de LeConte de 1862,.[17] que escribía con el propósito expreso de aumentar la producción en los Estados Confederados para satisfacer sus necesidades durante la guerra civil estadounidense. Dado que pedía ayuda a las comunidades agrícolas rurales, las descripciones e instrucciones son sencillas y explícitas. Detalla el "método francés", junto con varias variaciones, así como un "método suizo". N.B. Se han hecho muchas referencias a un método que utiliza sólo paja y orina, pero no existe tal método en esta obra.
Método suizo
[editar]LeConte describe un proceso en el que sólo se utiliza la orina y no el estiércol, denominándolo método suizo. La orina se recoge directamente, en un foso de arena bajo un establo. La propia arena se extrae y se lixivia en busca de nitratos, que luego se convierten en nitrato potásico mediante el uso de potasa, como en el caso anterior.
A partir del ácido nítrico
[editar]Desde 1903 hasta la época de la Primera Guerra Mundial, el nitrato de potasio para la pólvora negra y los fertilizantes se producía a escala industrial a partir del ácido nítrico producido mediante el proceso Birkeland-Eyde, que utilizaba un arco eléctrico para oxidar el nitrógeno del aire. Durante la Primera Guerra Mundial, el proceso Haber (1913), recientemente industrializado, se combinó con el proceso Ostwald a partir de 1915, lo que permitió a Alemania producir ácido nítrico para la guerra tras quedarse sin sus suministros de nitratos de sodio minerales procedentes de Chile.
Producción Moderna
[editar]El nitrato de potasio se puede obtener combinando nitrato de amonio e hidróxido de potasio.
Una forma alternativa de producir nitrato de potasio sin un subproducto de amoníaco es combinar nitrato de amonio, que se encuentra en bolsas de hielo instantáneas , [18] y cloruro de potasio, que se obtiene fácilmente como sustituto de la sal sin sodio.
El nitrato de potasio también se puede producir neutralizando el ácido nítrico con hidróxido de potasio. Esta reacción es altamente exotérmica.
A escala industrial se prepara mediante la reacción de doble desplazamiento entre nitrato de sodio y cloruro de potasio.
Síntesis
[editar]El nitrato de potasio se obtiene por neutralización de compuestos básicos (e.g. hidróxido potásico KOH) con ácido nítrico HNO3.
Se une el átomo de hidrógeno (H) del HNO3 con los átomos de hidrógeno (H) y oxígeno(O) del KOH, formando agua (H2O); y el de potasio (K) sobrante del KOH con los de nitrato (NO3) sobrantes del HNO3 :
KOH + HNO3 → H2O + KNO3
Además existe de forma natural, mineral denominado nitro, que suele estar combinado con nitratina (nitrato de sodio) formando salitre.
Propiedades
[editar]El nitrato de potasio tiene una estructura cristalina ortorrómbica a temperatura ambiente,[19] que se transforma en un sistema trigonal a 129 °C.[20][21]
El nitrato de potasio es moderadamente soluble en agua, pero su solubilidad aumenta con la temperatura. La solución acuosa es casi neutra, exhibe un pH 6.2 a 14 °C para una solución al 10 % de polvo comercial. No es muy higroscópico, absorbe aproximadamente 0.03 % de agua en 80 % de humedad relativa durante 50 días. Es insoluble en alcohol y no es venenoso; puede reaccionar explosivamente con agentes reductores, pero no es explosivo por sí mismo.[22]
Usos
[editar]Como fertilizante
[editar]El nitrato potásico se utiliza en fertilizantes como fuente de nitrógeno y potasio, dos de los macronutrientes de las plantas. Cuando se utiliza solo, tiene un índice NPK de 13-0-44.[23][24] El nitrato potásico es la fuente más usada de potasio en fertirrigación, estando su consumo muy generalizado en todo tipo de cultivos, tanto anuales como permanentes. El producto al ser aplicado no deja ningún residuo, aportando solo elementos útiles, pues es soluble en su totalidad. Al aportar el nitrógeno en forma nítrica, no retenida por el suelo, su reparto es muy homogéneo. Su forma de aplicación consiste en preparar una solución madre, a partir de la cual se incorpora en el agua de riego. Aproximadamente el 75 % del nitrato de potasio se manufactura con una pureza del 90 % para su uso como fertilizante. La ausencia de cloro es una ventaja para las plantaciones de frutas cítricas y tabaco, también se usa en la producción de fertilizantes líquidos y es un importante constituyente de los fertilizantes multinutrientes.
Producción de ácido nítrico
[editar]Una de las aplicaciones más útiles del nitrato de potasio es la producción de ácido nítrico, añadiendo ácido sulfúrico concentrado a una solución acuosa de nitrato de potasio. Además es una reacción endotérmica.
Como conservante de alimentos
[editar]El nitrato potásico ha sido un ingrediente común añadido a la carne salada desde la antigüedad[25] o la Edad Media.[26] La adopción generalizada del uso de nitrato es más reciente y está vinculada al desarrollo del procesamiento de carne a gran escala.[27] El uso de nitrato potásico se ha abandonado en su mayor parte debido a los resultados lentos e inconsistentes en comparación con los compuestos de nitrito sódico como el "polvo de Praga" o la "sal de curado" rosa. Aun así, el nitrato potásico se sigue utilizando en algunas aplicaciones alimentarias, como el salami, el jamón curado en seco, la charcutería y (en algunos países) en la salmuera utilizada para elaborar la carne en conserva (a veces junto con el nitrito sódico).[28] Cuando se utiliza como aditivo alimentario en la Unión Europea,https://ec.europa.eu/food/food-feed-portal/screen/food-additives/search/details/POL-FAD-IMPORT-3061[29] este compuesto se puede denominar en la etiqueta como E252. También está aprobado su uso como aditivo alimentario en Estados Unidos,[30] Australia y Nueva Zelanda[31] (donde figura con el número INS 252).[22]
Otros usos
[editar]El 25 % de la producción de nitrato potásico es de grado técnico, de una pureza mínima del 99 %, del cual prácticamente el 50 % se emplea en la metalurgia, principalmente en los baños de transferencia de calor, entre el 10 y 20 % se consume por la industria del vidrio y la cerámica.
También es un componente principal en compuestos usados para descomponer con más rapidez restos orgánicos, como los tocones de los árboles, porque acelera el proceso de descomposición.
La creencia popular dice que el nitrato de potasio es un anafrodisíaco, pero en realidad no tiene esa clase de efectos en los humanos.
Finalmente, el nitrato de potasio es el agente oxidante (aporte de oxígeno). Aunque el nitrato de potasio se usa para producir pólvora, mezclado con azufre y carbón, por sí mismo no es combustible ni inflamable.
Es bastante utilizado también para el tratamiento de la hipersensibilidad de la pulpa dental.
Referencias
[editar]- ↑ Número CAS
- ↑ Soanes, Catherine; Stevenson, Angus, eds. (2003) [1999]. Oxford Dictionary of English (second edición). Oxford University Press. p. 1377. ISBN 0-19-8613474.
- ↑ Spencer, Dan (2013). Saltpeter:The Mother of Gunpowder. Oxford, UK: Oxford University Press. p. 256. ISBN 9780199695751.
- ↑ Sen, Sudipta (2019). Ganges: The Many Pasts of an Indian River. New Haven: Yale University Press. p. 318. ISBN 978-0-300-11916-9.
- ↑ Roy, Kaushik (2014). Military Transition in Early Modern Asia, 1400-1750. London: Bloomsbury Academic. p. 19. ISBN 978-1-7809-3765-6.
- ↑ Ahmad Y. Hassan, Potassium Nitrate in Arabic and Latin Sources Archivado el 26 de febrero de 2008 en Wayback Machine., History of Science and Technology in Islam.
- ↑ Jack Kelly (2005). Gunpowder: Alchemy, Bombards, and Pyrotechnics: The History of the Explosive that Changed the World. Basic Books. p. 22. ISBN 978-0-465-03722-3. Archivado desde el original el 11 de mayo de 2016.
- ↑ Major George Rains (1861). Notes on Making Saltpetre from the Earth of the Caves. New Orleans, LA: Daily Delta Job Office. p. 14. Archivado desde el original el 29 de julio de 2013. Consultado el 13 de septiembre de 2012.
- ↑ John Spencer Bassett; Edwin Mims; William Henry Glasson et al. (1904). The South Atlantic Quarterly. Duke University Press. Consultado el 22 de febrero de 2013.
- ↑ Paul-Antoine Cap (1857). Etudes biographiques pour servir à l'histoire des sciences ...: sér. Chimistes. V. Masson. pp. 294-. Consultado el 23 de febrero de 2013.
- ↑ Oscar Gutman (1906). Monumenta pulveris pyrii. Repr. Artists Press Balham. pp. 50-.
- ↑ James Riddick Partington (1999). A history of Greek fire and gunpowder. JHU Press. ISBN 978-0-8018-5954-0.
- ↑ Alexander Adam (1805). A compendious dictionary of the Latin tongue: for the use of public Seminar and private March 2012. Printed for T. Cachorro and W. Davies, by C. Stewart, London, Bell and Bradfute, W. Creech.
- ↑ SP Dom Elizabeth vol.xvi 29-30 (1589)
- ↑ Narihiro, Takashi; Tamaki, Hideyuki; Akiba, Aya et al. (11 de agosto de 2014). «Microbial Community Structure of Relict Niter-Beds Previously Used for Saltpeter Production». PLOS ONE 9 (8): e104752. Bibcode:2014PLoSO...9j4752N. PMC 4128746. PMID 25111392. doi:10.1371/journal.pone.0104752.
- ↑ Ruane, Michael. «During the Civil War, the enslaved were given an especially odious job. The pay went to their owners». Washington Post. Consultado el 10 de julio de 2020.
- ↑ a b Joseph LeConte (1862). Instructions for the Manufacture of Saltpeter. Columbia, S.C.: South Carolina Military Department. p. 14. Archivado desde el original el 13 de octubre de 2007. Consultado el 19 de octubre de 2007.
- ↑ «How Refrigerators Work». HowStuffWorks (en inglés). 29 de noviembre de 2006. Consultado el 2 de noviembre de 2018.
- ↑ Adiwidjaja, G.; Pohl, D. (2003). «Superstructure of α-phase potassium nitrate». Acta Crystallogr. C 59 (12): i139-i140. PMID 14671340. doi:10.1107/S0108270103025277.
- ↑ Nimmo, J. K.; Lucas, B. W. (1976). «The crystal strutures of γ- and β-KNO3 and the α ← γ ← β phase transformations». Acta Crystallogr. B 32 (7): 1968-1971. doi:10.1107/S0567740876006894.
- ↑ Freney, E. J.; Garvie, L. A. J.; Groy, T. L.; Buseck, P. R. (2009). «Growth and single-crystal refinement of phase-III potassium nitrate, KNO3». Acta Crystallogr. B 65 (6): 659-663. PMID 19923693. doi:10.1107/S0108768109041019.
- ↑ a b B. J. Kosanke; B. Sturman; K. Kosanke et al. (2004). «2». Pyrotechnic Chemistry (en inglés). Journal of Pyrotechnics. pp. 5-6. ISBN 978-1-889526-15-7. Archivado desde el original el 5 de mayo de 2016. Consultado el 4 de marzo de 2023.
- ↑ «Field Crops». Field Crops (en inglés estadounidense). Consultado el 19 de febrero de 2023.
- ↑ Hall, William L; Robarge, Wayne P; Meeting, American Chemical Society (2004). Environmental Impact of Fertilizer on Soil and Water (en inglés). p. 40. ISBN 9780841238114. Archivado desde el original el 27 de enero de 2018.
- ↑ Binkerd, E. F; Kolari, O. E (1 de enero de 1975). «The history and use of nitrate and nitrite in the curing of meat». Food and Cosmetics Toxicology 13 (6): 655-661. ISSN 0015-6264. PMID 1107192. doi:10.1016/0015-6264(75)90157-1.
- ↑ «Meat Science». 23 de diciembre de 2003. Archivado desde el original el 23 de diciembre de 2003. Consultado el 19 de febrero de 2023.
- ↑ Lauer, Klaus (1991). «The history of nitrite in human nutrition: A contribution from German cookery books». Journal of Clinical Epidemiology 44 (3): 261-264. ISSN 0895-4356. PMID 1999685. doi:10.1016/0895-4356(91)90037-a.
- ↑ Corned Beef Archivado el 2 de diciembre de 2008 en Wayback Machine., Food Network
- ↑ Union Europea. «REGLAMENTO (CE) No 1333/2008 DEL Parlamento Europeo y del Consejo sobre aditivos alimentarios. Texto consolidado de 31.102022». Consultado el 4 de marzo de 2023.
- ↑ «Listing of Food Additives Status Part II». Food and Drug Administration (en inglés). Archivado desde el original el 8 de noviembre de 2011. Consultado el 27 de octubre de 2011.
- ↑ Health. «Australia New Zealand Food Standards Code - Standard 1.2.4 - Labelling of Ingredients». www.legislation.gov.au (en inglés). Consultado el 19 de febrero de 2023.





