Célula beta
| Célula beta del islote pancreático | ||
|---|---|---|
 Célula beta (falso color). | ||
| Nombre y clasificación | ||
| Sinónimos |
célula β; insulinocito; célula secretora de Insulina | |
| Latín |
endocrinocytus B; insulinocytus | |
| TH | H3.04.02.0.00026 | |
| TH | H3.04.02.0.00026 | |
| Información anatómica | ||
| Sistema | Endócrino | |
| Parte de | Islotes pancreáticos | |
| Información fisiológica | ||
| Función |
Detección de glucemia Secreción de hormona Insulina | |
| Estructuras principales | ||
| Páncreas | ||
|
| ||
Las células beta o células secretoras de insulina[1] son uno de los tipos de célula endócrina localizadas en los islotes de Langerhans del páncreas. Las células beta son las únicas que sintetizan, almacenan y secretan la hormona insulina que reduce los niveles de glucosa en la sangre (glucemia).[2]
La insulina es secretada en reacción a la hiperglucemia y además en respuesta a algunas hormonas peptídicas.
La patología propia de las células secretoras de hormona insulina, se conoce como insuficiencia de las células β, con producción insuficiente de insulina que es característica de la diabetes tipo2.
Características[editar]
Las células beta son células endócrinas ubicadas en los islotes pancreáticos. Muestran los elementos moleculares y ultraestructurales específicos, que permiten caracterizar su capacidad de secreción de insulina.[3][4]
Microaquitectura[editar]
Para identificar las células beta (β) secretoras de insulina se necesitan métodos de tinción especial como el de Gomori o tinción mediante inmunohistoquímica o inmunofluorescencia.[5]
Con tinción H&E y tinción de Gomori se ven relativamente pequeñas y de color azul.[6][7]
Las denominadas células β representan la mayoría de las células endócrinas del islote.
En el Islote pancreático la proporción de las células β varía según la especie.
La localización tridimensional de las células β dentro del islote también difiere entre especies.[8]

La arquitectura espacial de los tipos de células endócrinas dentro del islote es importante para su función, ya que el contacto intercelular y la señalización parácrina entre células optimizan la secreción de hormonas.
El 70 % de las células beta (β) humanas están en contigüidad directa con los otros tipos de células dentro del islote. La comunicación intercelular entre los diferentes tipos de células es necesaria para la homeostasis de la glucemia.[9]
Los islotes de ratón/rata muestran una arquitectura típica de dos sectores: núcleo y manto con las células β ubicadas en el centro (núcleo).
En los islotes pancreáticos humanos las células β están entremezcladas con las células α, δ, G, γ y ε.[8][10][11][12]
Las células beta (β) muestran forma de pirámides truncadas que se agrupan alrededor de los vasos sanguíneos de los islotes. Las células β tienen un diámetro promedio de 10 micrómetros (μm).[4] El núcleo de la célula β está ubicado cerca de su base. Los gránulos de insulina se encuentran enriquecidos en el vértice.[13]
Las β son el tipo de célula predominante en los islotes. Un islote de Langerhans promedio contiene un total de 1000 a 3000 células, de las cuales el 50 % al 80 % son células β. Estimaciones realizadas plantean que un páncreas de ratón podría contener 1 × 106 células beta (1 miligramo mg de células beta) y un páncreas humano promedio contiene 1 × 109 células beta (1 gramo g de células beta).[14]
Ultraestructura[editar]

Con el microscopio electrónico (ME) las células secretoras de insulina (células β) muestran diámetros promedio de 10 micrómetros (μm) con una longitud de ~17 μm.
La superficie total de membrana de una célula β, se estimó en ≈973 micrómetros cuadrados (µm2).
El volumen calculado de la célula β sería de ≈1430 micrómetros cúbicos (µm3) en promedio.[15][16]
Gránulos de insulina[editar]

IG= inmaduros; MG= maduros.
Los gránulos insulinógenos de las células β se caracterizan por ser esferoides densos a los electrones (electro-denso)
- gránulos “grises” inmaduros (IG): son de aspecto homogéneo sin núcleo, contienen proinsulina que aún no está completamente procesada.
- gránulos maduros (MG) centro denso oscuro de forma irregular y un halo periférico de aspecto claro (el contenido se separa de la membrana limitante después de la fijación utilizada para el ME), aparentando una periferia blanca (electro-lúcido) debido al espacio vacío que se genera.
- El tamaño de los gránulos insulinógenos maduros (MG) es de alrededor de 300 nanómetros (nm) y su número promedio se ha estimado en ~10 000 en cada célula beta.[5][4]
- gránulos acoplados: es una fracción de gránulos MG, que se encuentra muy cerca de la membrana celular, representan una población definida y lista para la exocitosis.
Los gránulos de las células β contienen alrededor de 20 picogramos (pg) de insulina por célula.[4]
Núcleo[editar]
El núcleo de la célula β se muestra claro porque predomina el ADN menos compacto (eucromatina) que contiene los genes que se están transcribiendo de forma activa y permanente (expresión génica) por la célula.
El volumen calculado del núcleo de la célula de ratón, está entre 110-168 micrómetros cúbicos (µm3), que representa 14-16 % del volumen celular total.[15][16]
Golgi[editar]

El aparato de Golgi de la célula β se encarga de la modificación y distribución de las proteínas (proinsulina) que han sido sintetizadas en el retículo endoplasmático y las rodean de membrana creando vesículas (llamados gránulos de insulina) para secretarlas fuera de la célula. El volumen del Golgi de la célula β está entre 18-22 µm3 que es un 0,90-2,20 % del volumen celular.[16]
Dominios de la membrana plasmática[editar]
- Polaridad de células β
La polaridad de las células secretoras de insulina ha sido planteada desde que se especuló su origen embriológico.
Las células beta humanas entran en contacto con los capilares del islote y están estructural y funcionalmente polarizadas.
Se han propuesto dos y hasta tres polos para las células β.[17][18][19]
Las especializaciones de membrana plasmática entre las células endócrinas aparecen como (gap-junctions) o (tight-junctions).[20][21]
Las células beta son conocidas por poseer microvellosidades abundantes las cuales determinan la apariencia de terciopelo de su superficie.[22][13]
Cilio primario[editar]
El cilio primario de la célula beta es largo y único, su longitud es de 5–10 micrómetros (μm) y 0,2-0,3 μm (200-230 nanómetros (nm)) de diámetro. Aparece desde las superficies celulares apoyadas en otras células y opuestas a las que contactan con los vasos sanguíneos. Se proyecta en un «canalículo» del espacio intercelular, formado por tres o cuatro células adyacentes, que se encuentra recubierto con microvellosidades.[23][24] Este espacio ha sido planteado como formado por la región apical de las células β, ubicada dentro de un dominio espacial definido por uniones estrechas.[19][18]
Síntesis, procesamiento y empaquetamiento de insulina[editar]
Síntesis de Insulina[editar]
La insulina es sintetizada en el retículo endoplásmico rugoso de la célula β en forma de un polipéptido llamado pre-pro-insulina que es transformado en pro-insulina, que posee escasa actividad hormonal. La proinsulina se modifica en el aparato de Golgi y las vesículas secretoras que salen del complejo contienen la hormona insulina.
Las células β fabrican insulina en etapas. La primera etapa es la producción de la proinsulina. La proinsulina es una molécula formada por una cadena proteínica de 81 aminoácidos, que es precursora de la insulina. Las células Beta del páncreas procesan la proinsulina convirtiéndola en insulina por la sustracción enzimática del péptido C, que es una estructura de 30 aminoácidos que conecta las cadenas A y B (de 21 y 30 aminoácidos, respectivamente).[25]
La insulina es secretada en reacción a la hiperglucemia y también por algunas hormonas péptidas como glucagón, colecistocinina-pancreocimina y secretina. Sus acciones principales son estimular la captación de glucosa en varios tipos de células disminuyendo concomitantemente el nivel de glucosa sanguínea, al estimular la conversión de glucosa en glucógeno en los hepatocitos y miocitos, siempre que dicho nivel aumente.
Proteoma[editar]
El 20 % de la masa total de ARNm en las células beta es ARNm de insulina, y el contenido total estimado de insulina en el páncreas humano es de aproximadamente 10 mg (1 % del peso de las células beta), lo que corresponde a ~10 días de secreción por personas sanas.[14]
Liberación de insulina[editar]
Cada célula beta (β) secretora de insulina, contiene entre 5000-13 000 gránulos secretores (SG) de insulina. De acuerdo con la respuesta fisiológica al estímulo, estos SG se han clasificado tradicionalmente como: el grupo liberable rápidamente (readily releasable pool RRP) y el grupo de reserva (reserve pool RP).[26]
El grupo RRP es responsable de la primera fase de secreción, mientras que la secreción sostenida depende del reclutamiento de gránulos del grupo de reserva RP.
La estimulación aguda para la secreción de insulina, implica la liberación de gránulos presentes en la membrana plasmática. La estimulación prolongada necesita de la movilización de gránulos de la reserva (RP) mediante un mecanismo que depende de una maquinaria de transporte de gránulos.[25]
En las β existe una población de gránulos que se encuentran en contacto con la membrana plasmática. Estos gránulos acoplados (docking) se unen mediante fusión de la bicapa de los gránulos con la membrana plasmática, liberando su contenido de insulina mediante exocitosis.
Arriba= Proceso de las vesículas (gránulos secretores SG) de insulina. Pasos: docking= acople; printing= cebado; fusion
Abajo= moléculas que intervienen en la exocitosis.
La insulina liberada por las vesículas secretoras de las células β, se vuelca directamente en el espacio intersticial, de donde pasa a los capilares fenestrados del islote y de allí a la vena porta.[27]
En un ser humano adulto, las células beta liberan entre 30 y 70 Unidades de insulina por día, dependiendo del peso corporal.[4]
Fisiología de la célula beta[editar]

Las células beta (β) logran un control preciso de la secreción de insulina mediante una extensa interconexión (comunicación celular), con el resto de los tipos de células del islote, en particular las células alfa productoras de glucagón y las células delta productoras de somatostatina.[28]
En la célula β el aumento de los niveles de glucosa en sangre (glucemia) luego de ingerir alimentos (pos-ingesta o posprandial), está directamente vinculado con la liberación de insulina. La secreción de insulina es dependiente de la glucosa, y por analogía con el acoplamiento de excitación-contracción en el músculo, se denomina mecanismo de acoplamiento de estímulo-secreción.
Electrofisiología[editar]
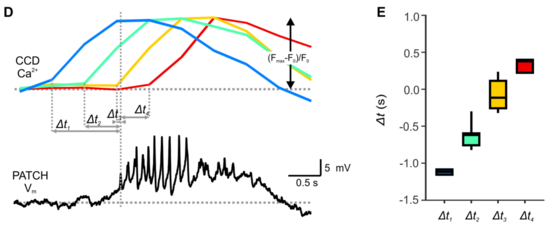
El flujo de iones cargados eléctricamente a través de la membrana plasmática de la célula β, da lugar en determinadas condiciones a cambios bruscos de voltaje, despolarizaciones que son llamadas potenciales de acción. La estimulación con glucosa provoca la despolarización de la membrana y la consiguiente actividad eléctrica en las células β secretoras de insulina.[29]
Una onda lenta (meseta) 2 por minuto, con ráfagas superpuestas (espigas).
Concentración de glucosa G (arriba) baja 3 mM y alta 15 mM. mM= milimoles.
Vm= voltaje de membrana; mV= milivoltios; s= segundos.
Barra de escala de tiempo= 0,5 segundo.
Barra de escala de voltaje= 5mV.
En ausencia de glucosa estimuladora (menos de 5 mM), las células β de roedores son eléctricamente silenciosas (polarizadas en su potencial de reposo).
En estas concentraciones, el potencial de reposo de las células β se registra entre -60 y -70 milivoltios (mV).
Un minuto después del aumento de la concentración local de glucosa a 10 milimoles (mM), la membrana de la célula β se despolariza lentamente hacia un potencial umbral.
Cuando alcanza este potencial umbral, la membrana rápidamente despolariza hacia una meseta de potencial sobre la cual aparecen las espigas de los potenciales de acción. Una onda lenta (o meseta) 2 por minuto, con ráfagas superpuestas (espigas).[30]

La glucosa es transportada hasta la célula beta donde ingresa y se metaboliza para producir piruvato, que luego eleva los niveles de Adenosín trifosfato (ATP). El aumento en la relación entre ATP/ADP dentro de la célula, cierra los canales de potasio (K+) dependientes de ATP (KATP) en la membrana plasmática. El cierre de los canales de K+ despolariza la membrana celular. La despolarización eléctrica provoca la apertura de los canales de calcio (Ca2+) dependientes de voltaje (VDCC). Cuando estos canales se abren, el ion Ca2+ entra rápidamente, igualando las concentraciones a ambos lados de la membrana.
La entrada del ion Ca2+ a la célula beta provoca la liberación de insulina desde los gránulos (vesículas) que la contienen.[31][32][33][34]
En islotes humanos y de ratón como respuesta a un estímulo de glucosa, la actividad eléctrica de las células β dentro de un islote, experimenta oscilaciones rápidas (períodos de decenas de segundos) seguidas por oscilaciones lentas (períodos de varios minutos).[35]
Heterogeneidad beta[editar]
Las células β individuales son heterogéneas en su nivel de liberación de insulina, y presentan propiedades funcionales diferentes dentro del mismo islote. Se han encontrado marcadores que subdividen las células β según diferentes niveles de expresión génica de insulina, de gránulos y de secreción.[36]
Las sub-poblaciones de células β que se diferencian por sus propiedades funcionales, se encuentran conectadas en redes.
Las redes de conectividad dentro de los islotes pancreáticos, se interpretaron como en un esquema de concentrador-seguidor. Las células (hub) o «centrales» estaban altamente conectadas en lo funcional y su presencia era esencial para mantener las oscilaciones en el islote.[35]
Regulación de la célula beta[editar]
La célula secretora de insulina (células β) además de la glucosa, es regulada por varios niveles de aportes paracrinos, endócrinos, neuronales y nutricionales que colectivamente determinan su actividad.[7]
La liberación de insulina está regulada por una red de muchas señales diferentes, que activan, potencian o inhiben a la células β.[4]
La principal señal que provoca la secreción de insulina en la células β es la glucosa, y tiene una transmisión intracelular, que se transforma desde las señales químicas iniciales, hacia señales eléctricas y señales mecánicas.[27]
Regulación autocrina[editar]
La función autocrina de la insulina sobre las células β, regula negativamente su propia secreción (retroalimentación negativa). La eliminación del receptor de insulina de la superficie de las células β, provoca una hipersecreción de insulina.[37]
Regulación paracrina[editar]
La somatostatina secretada por las células delta del islote, tiene efecto paracrino sobre las células beta, ya que inhibe la liberación de insulina.
El glucagón secretado por las células alfa estimula, en lugar de inhibir, la secreción de insulina posprandial. Las células beta expresan los receptores tanto del receptor del péptido similar al glucagón tipo 1 (GLP1-R) como de receptor de glucagón (GCG-R) y el glucagón puede activar cualquiera de estos receptores.[38]
La hormona liberadora de corticotropina (CRH), secretada por las células alfa estimula localmente la secreción de insulina. Las células beta expresan el receptor de tipo 1 de la CRH (CRH-R1).[38][39]
Regulación endócrina[editar]
La hormona del crecimiento y la prolactina estimulan la secreción de insulina. La prolactina promueve la hipertrofia y la hiperplasia de los islotes durante el embarazo.
El cortisol inhibe la secreción de insulina.[40]
Las señales simpáticas, como la epinefrina, inhiben la secreción de insulina.
Las señales parasimpáticas, como la acetilcolina, potencian la secreción de insulina.
Las incretinas comprenden varias hormonas gastrointestinales, que interactúan con GIP y GLP-1, durante las comidas que contienen proteínas, grasas y carbohidratos complejos, todas tienen efecto de secreción de insulina (insulinogénicas).[41]
Recambio celular de células beta[editar]
Los niveles de replicación de células beta y la apoptosis de las mismas se equilibran. El equilibrio permite el reemplazo gradual de la población de células beta que deben considerarse un tejido que se renueva lentamente.[42]
La masa de células beta está controlada por varios mecanismos, que incluyen la replicación de células beta, la neogénesis, la hipertrofia y la supervivencia.[43]
Patología de la célula beta[editar]
La patología propia de las células secretoras de hormona insulina, se conoce como insuficiencia de las células β .[44]
El fracaso de las células β para responder a la demanda aumentada de insulina, debida a la resistencia progresiva de los tejidos periféricos a la hormona, es la característica de la diabetes tipo2.[45]
Está en discusión si la disfunción de las células β es una anomalía temprana de la diabetes tipo2, o si ocurre tarde en la historia natural. Parece que la función de las células beta disminuye al principio del proceso de la enfermedad y disminuye progresivamente a medida que se deteriora la tolerancia a la glucosa.[46]
Al inicio de la diabetes tipo 2, hay una reducción de ~50 % en la masa total de las células β.
En los pacientes con diabetes tipo 1 recién diagnosticados, se encuentra una pérdida aguda de ~90 % de las células β.[47]
En la diabetes tipo 1, el sistema inmunológico destruye las células Beta debido a una reacción autoinmune que puede implicar tanto a su transportador de Zinc, ZnT8; a la glutamato descarboxilasa (GAD); a la misma insulina o a otras moléculas. Sin las células beta, el páncreas no puede producir insulina lo cual causa un incremento en los niveles de glucosa con las consecuencias a corto y largo plazo que ocasiona la diabetes.
Trasplante de células beta[editar]
El reemplazo de las células secretoras de insulina, tiene el potencial de curar la diabetes tipo 1 y es posible que también la diabetes tipo 2.
El trasplante puede ser autólogo o heterólogo ya sea de islotes multicelulares o de células aisladas.
- Islotes
La terapia con islotes pancreáticos se utiliza en algunos pacientes con diabetes tipo 1, son obtenidos de donantes (heterólogos).[48][49]
- Células aisladas
- Las células madre embrionarias (ESC) son obtenidas de donante (heterólogos).
- Las células madre adultas o bien las adultas inducidas hasta pluripotentes (iPSC), son autólogas.[50]
El rechazo del trasplante puede detectarse por la hiperglucemia y un aumento en la hemoglobina glucosilada (HbA1C); el tratamiento del rechazo no se ha establecido.
El paciente receptor debe seguir un régimen inmunosupresor postrasplante de por vida, que puede consistir en anticuerpos basiliximab, tacrolimus y sirolimus.[51]
Véase también[editar]
Referencias[editar]
- ↑ OMS,OPS,BIREME (ed.). «Células beta». Descriptores en Ciencias de la Salud. Biblioteca Virtual en Salud.
- ↑ Dee Unglaub Silverthorn (2008). Fisiología Humana. Un enfoque integrado (4.ª edición). Médica Panamericana. ISBN 9789500619820. Consultado el 8 de agosto de 2017.
- ↑ Michael H. Ross; Wojciech Pawlina (2007). «Aparato Digestivo III: Hígado, Vesícula biliar y Páncreas». Histologia: Texto y Atlas color con Biología Celular y Molecular (5.ª edición). Médica Panamericana. pp. 649-650.
- ↑ a b c d e f Marchetti P.; Bugliani M.; De Tata V.; Suleiman M.; Marselli L. (2017). «Pancreatic Beta Cell Identity in Humans and the Role of Type 2 Diabetes». Frontiers in Cell and Developmental Biology (Front. Cell Dev. Biol.) (REVISIÓN). Epigenomics and Epigenetics (Frontiers (editorial)) 5 (55). Consultado el 4 de febrero de 2023.

- ↑ a b Leslie P. Gartner (2021). «cap.18: Aparato Digestivo: glándulas». Texto de histología: Atlas a color. Elsevier Health Sciences. p. 440. Consultado el 4 de febrero de 2023.
- ↑ Lima-Martínez M.; Betancourt L.; Bermúdez A. (2011). «Glucagón: ¿un simple espectador o un jugador clave en la fisiopatología de la diabetes?». Avances en Diabetología (Elsevier) 27 (5): 160-167. Consultado el 4 de febrero de 2023.
- ↑ a b Noguchi G.M.; Huising M.O (2019). [https://escholarship.org › con...PDF Integrating the inputs that shape pancreatic islet hormone release - eScholarship «Integrating the inputs that shape pancreatic islet hormone release»] (formato PDF). Nature Metabolism (en inglés) 1. eScholarship.org University of California. pp. 1189-1201.
- ↑ a b Hoang D-T.; Matsunari H.; Nagaya M.; Nagashima H.; Millis JM.; Witkowski P.; Periwal V.; Hara M.;Jo J. (2014). «A Conserved Rule for Pancreatic Islet Organization.». PLoS ONE (en inglés) (Public Library of Science) 9 (10): e110384. doi:10.1371/journal.pone.0110384. Consultado el 1 de octubre de 2022.

- ↑ Levetan C. (2021). «Frederick Banting's observations leading to the potential for islet neogenesis without transplantation». Journal of Diabetes (REVISIÓN) (en inglés) 14 (2): 104-110. PMC 9060105. PMID 34967992. Consultado el 18 de marzo de 2023.

- ↑ Cabrera O.; Bergman D.M; Kenyon N.S.; Ricordi C.; Berggren P-O.; Caicedo A. (2006). «The unique cytoarchitecture of human pancreatic islets has implications for islet cell function». Proc Natl Acad Sci USA. Medical Sciences (en inglés) 103 (7): 2334-2339. PMC 1413730. PMID 16461897. doi:10.1073/pnas.0510790103. Consultado el 12 de setiembre de 2022.

- ↑ Brissova M.; Fowler M.J.; Nicholson W.E; Chu A.; Hirshberg B.; Harlan D.M.; Powers A.C. (2005). «Assessment of Human Pancreatic Islet Architecture and Composition by Laser Scanning Confocal Microscopy». Journal of Histochemistry & Cytochemistry (en inglés) 53 (9): 1087-1097. Consultado el 12 de setiembre de 2022.

- ↑ Wang X.; Zielinski MC.; Misawa R.; Wen P.; Wang T-Y.; Wang C-Z.; Witkowski P.; Hara M. (2013). «Quantitative Analysis of Pancreatic Polypeptide Cell Distribution in the Human Pancreas». PLoS ONE (en inglés) (Public Library of Science) 8 (1): e55501. Consultado el 16 de enero de 2018.

- ↑ a b Geron E.; Boura-Halfon S.; Schejter E.D.; Shilo B-Z. (2015). «The Edges of Pancreatic Islet β Cells Constitute Adhesive and Signaling Microdomains». Cell Reports (en inglés) 10 (3): P317-325. doi:10.1016/j.celrep.2014.12.031. Consultado el 28 de febrero de 2023.

- ↑ a b Scharfmann R.; Rachdi L.; Ravassard P. (2013). «Concise Review: In Search of Unlimited Sources of Functional Human Pancreatic Beta Cells». Stem Cells Translational Medicine (REVISIÓN) (en inglés) (Academic.oup.) 2 (1): 61-67. doi:10.5966/sctm.2012-0120. Consultado el 4 de febrero de 2023.

- ↑ a b Dean P.M. (1973). «Ultrastructural Morphometry of the Pancreatic β Cell» (PDF). Diabetologia (en inglés) (Springer-Verlag) 9: 115-119. Consultado el Febrero de 2023.

- ↑ a b c Müller A.; Schmidt D.; C. Shan Xu; Song Pang; Joyson Verner D’Costa; Kretschmar S.; Münster C.; Kurth T. ; Jug F. ; Weigert M. ; Hess H.F. ; Solimena M. (2021). «3D FIB-SEM reconstruction of microtubule–organelle interaction in whole primary mouse β cells». Journal of Cell Biology. Structural Biology 2021 (en inglés) 220 (2): e202010039. Consultado el 24 de febrero de 2023.

- ↑ Bonner-Weir S. (1988). «Morphological Evidence for Pancreatic Polarity of B-Cell Within Islets of Langerhans» (PDF). DIABETES 37 (5): 616-621. doi:10.2337/diab.37.5.616.

- ↑ a b Cottle L.; Gan W.J.; Gilroy I.; Samra J.S.; Gill A.J.; Loudovaris T.; Thomas H.E.; Hawthorne W.J.; Kebede M.A.; Thorn P. (2021). «Structural and functional polarisation of human pancreatic beta cells in islets from organ donors with and without type 2 diabetes.». Diabetologia 64: 618-629. doi:10.1007/s00125-020-05345-8. Consultado el 13 de abril de 2023.

- ↑ a b Gan W.J.; Zavortink M.; Ludick C.; Templin R.; Webb R.; Webb R.; Poronnik W.; Parton R.G..; Gaisano H.Y.; Shewan A.M. ; Thorn P. (2017). «Cell polarity defines three distinct domains in pancreatic β-cells». J Cell Sci. (en inglés) 130 (1): 143-151. PMC 5394774. PMID 26919978. doi:10.1242/jcs.185116. Consultado el 8 de marzo de 2023.

- ↑ Orci L.; Unger R.H.; Renold A.E. (1973). «Structural coupling between pancreatic islet cells». Experientia (en francés) 29: 1015-1018. (requiere suscripción).
- ↑ Paolo MEDA; Alain PERRELET; Lelio ORCI (1979). «Increase of GAP junctions between pancreatic B-cells during stimulation of insulin secretion» (PDF). J. CELL BIOLOGY (The Rockefeller University Press) 82: 441-448.

- ↑ Polino A.J.; Sviben S.; Melena I.; Piston D.W.; Hughes J. (2023). Scanning electron microscopy of human islet cilia (PDF) (en inglés). bioRxiv. Consultado el 28 de febrero de 2023.

- ↑ Yamamoto M.; Kataoka K. (1986). «Electron microscopic observation of the primary cilium in the pancreatic islets». Arch Histol Jpn (PDF) (en inglés) (J-STAGE) 49 (4): 449-457. doi:10.1679/aohc.49.449.

- ↑ Iwanaga T.; Miki T.; Takahashi-Iwanaga H. (2011). «Restricted expression of somatostatin receptor 3 to primary cilia in the pancreatic islets and adenohypophysis of mice» (PDF). Biomed Res (en inglés) (J-STAGE) 32 (1): 73-81. PMID 21383513. doi:10.2220/biomedres.32.73. Consultado el 21 de marzo de 2023.
- ↑ a b Omar-Hmeadi M.; Idevall-Hagren O. (2021). «Insulin granule biogenesis and exocytosis». Cellular and Molecular Life Sciences (REVISIÓN) 78: 1957-1970. PMC 7966131. PMID 33146746. doi:10.1007/s00018-020-03688-4. Consultado el 16 de mayo de 2023.

- ↑ Hu R.; Zhu X.; Yuan M.; Ho K-H.; Kaverina I.; Gu G. (2021). «Microtubules and Gαo-signaling modulate the preferential secretion of young insulin secretory granules in islet β cells via independent pathways». PLoS One (Public Library of Science) 16 (7): e0241939. PMC 8297875. PMID 34292976. doi:10.1371/journal.pone.0241939. Consultado el 15 de mayo de 2023.

- ↑ a b Tokarz V.L.; MacDonald P.E.; Klip A. (2018). «The cell biology of systemic insulin function». J Cell Biol. (REVISIÓN) (en inglés) 217 (7): 2273-2289. PMC 6028526. doi:10.1083/jcb.201802095. Consultado el 6 de febrero de 2023.

- ↑ Huising M.O. (2020). «Paracrine regulation of insulin secretion». Diabetologia (REVISIÓN) (en inglés) (Springer) 63 (10): 2057-2063. PMC 7968070. PMID 32894316. doi:10.1007/s00125-020-05213-5. Consultado el 8 de abril de 2023.

- ↑ MacDonald P.E.; Rorsman P. (2006). «Oscillations, Intercellular Coupling, and Insulin Secretion in Pancreatic β Cells.». PLoS Biology (Public Library of Science) 4 (2): e49. doi:10.1371/journal.pbio.0040049. Consultado el 3 de abril de 2023.

- ↑ Gilon P.; Henquin J-C. (1992). «Influence of Membrane Potential Changes on Cytoplasmic Ca2+ Concentration in an Electrically Excitable Cell, the Insulin-secreting Pancreatic B-cell» (PDF). THE JOURNAL OF BIOLOGICAL CHEMISTRY (en inglés) (The American Society for Biochemistry and Molecular Biology) 267 (29): 20713-20720.

- ↑ Leyva Montero M.A.; Rodríguez Moldón Y.; Rodríguez Duque R.; Niño Escofet S. (2020). «Mecanismos moleculares de la secreción de insulina». Correo Científico Médico (ccm) (REVISIÓN) (Holguín, Cuba) 24 (2). Consultado el 16 de abril de 2023.

- ↑ Palti Y.; Ben David G.; Lachov E.; Mika Y.H.; Omri G.; Schatzberger R. (1996). «Islets of Langerhans Generate Wavelike Electric Activity Modulated by Glucose Concentration» (PDF). DIABETES (en inglés) 45: 595-601. Consultado el 6 de abril de 2023.

- ↑ Andersson L.E.; Valtat B.; Bagge A.; Sharoyko V.V.; Nicholls D.G.; Ravassard P.; Scharfmann R.; Spégel P. ; Mulder H. (2015). «Characterization of Stimulus-Secretion Coupling in the Human Pancreatic EndoC-βH1 Beta Cell Line.». PLoS ONE (en inglés) (Public Library of Science) 10 (3): e0120879. doi:10.1371/journal.pone.0120879. Consultado el 2 de abril de 2023.

- ↑ Rorsman P.; Ashcroft F.M. (2018). «Pancreatic β-Cell Electrical Activity and Insulin Secretion: Of Mice and Men». Physiol Rev. (REVISIÓN) (en inglés) 98 (1): 117-214. PMC 5866358. PMID 29212789. doi:10.1152/physrev.00008.2017. Consultado el 22 de abril de 2023.

- ↑ a b Hogan J.P.; Peercy B.E. (2021). «Flipping the switch on the hub cell: Islet desynchronization through cell silencing». PLoS ONE (en inglés) (Public Library of Science) 16 (4): e0248974. doi:10.1371/journal.pone.0248974. Consultado el 28 de abril de 2023.

- ↑ Kravets V.; Dwulet J.M.; Schleicher W.E.; Hodson D.J.; Davis A.M.; Pyle L.; Piscopio R.A.; Sticco-Ivins M.; Benninger R. (2022). «Functional architecture of pancreatic islets identifies a population of first responder cells that drive the first-phase calcium response.». PLoS Biology (REVISIÓN) (en inglés) (Public Library of Science) 20 (9): e3001761. doi:10.1371/journal.pbio.3001761. Consultado el 26 de abril de 2023.

- ↑ Basu L.; Bhagat V.; Ching M.E.A.; Di Giandomenico A.; Dostie S.; Greenberg D.; Greenberg M.; Hahm J.; Screaton R.A. (2023). «Recent Developments in Islet Biology: A Review With Patient Perspectives». Can J Diabetes (REVISIÓN) (en inglés) 47 (2): 207-221. doi:10.1016/j.jcjd.2022.11.003. Consultado el 2 de mayo de 2023.

- ↑ a b Hartig S.M.; Cox A.R. (2020). «Paracrine signaling in islet function and survival». J Mol Med (Berl) 98 (4): 451-467. PMC 7899133. PMID 32067063. doi:10.1007/s00109-020-01887-x. Consultado el 3 de mayo de 2023.
- ↑ Hernández de la Red S. Estudio de las células pancreáticas productoras de Somatostatina en Diabetes mellitus tipo 2 (Tesis Master). Departamento de Bioquímica y Biología Molecular y Fisiología. Universidad de Valladolid. pp. 6-7.
- ↑ Boland B.B.; Rhodes C.J.; Grimsby J.S. (2017). «The dynamic plasticity of insulin production in β-cells». Mol Metab. (REVISIÓN) (en inglés) 6 (9): 958-973. PMC 5605729. PMID 28951821. doi:10.1016/j.molmet.2017.04.010. Consultado el 15 de marzo de 2023.

- ↑ Rehfeld J.F. (2018). «The Origin and Understanding of the Incretin Concept». Frontiers in Endocrinology (Lausana) (REVISIÓN) 9 (387). PMC 6054964. PMID 30061863. doi:10.3389/fendo.2018.00387. Consultado el 28 de abril de 2023.

- ↑ Bonner-Weir S. (2001). «beta-cell turnover: its assessment and implications». Diabetes (REVISIÓN). 50 Suplemento 1: S20-24. PMID 11272192. doi:10.2337/diabetes.50.2007.s20. Consultado el 13 de febrero de 2023. (requiere suscripción).
- ↑ Rodas C.J. (2005). «Type 2 diabetes-a matter of beta-cell life and death?». Science. 307 (5708): 380-384. PMID 15662003. doi:10.1126/ciencia.1104345. Consultado el 13 de febrero de 2023. (requiere suscripción).
- ↑ Contreras Zambrano M.A. (2008). «Disfunción beta pancreática». Rev. Venez. Endocrinol. Metab. (Mérida) 6 (3). Consultado el 10 de marzo de 2023.

- ↑ «Tratamiento combinado inicial en la diabetes tipo 2» (PDF). Medicina para y por Residentes (Resumen) (Sociedad Iberoamericana de Información Científica (SIIC)) 7 (3): 23-27. 2021. Consultado el 10 de febrero de 2023.

- ↑ Paldánius P.D. (2020). «Evaluating the Evidence behind the Novel Strategy of Early Combination from Vision to Implementation». Diabetes Metab J. (REVISIÓN) (en inglés) 44 (6): 785-801. PMC 7801764. PMID 33081426. doi:10.4093/dmj.2020.0179. Consultado el 11 de febrero de 2023.

- ↑ Levetan, Claresa (2010). «Distinctions between islet neogenesis and β-cell replication: Implications for reversal of Type 1 and 2 diabetes». Journal of Diabetes (REVISIÓN) 2 (2): 76-84. doi:10.1111/j.1753-0407.2010.00074.x. Consultado el 13 de febrero de 2023.

- ↑ Hertl M. (2022). «Trasplante de células de los islotes pancreáticos (trasplante de células de los islotes de Langerhans)». Versión para público general (Manual MSD).
- ↑ Vantyghem M.C.; Chetboun M.; Gmyr V.; Jannin A.; Espiard S.; Le Mapihan K.; Raverdy V.; Delalleau N..; Machuron F. ; Hubert T. ; Frimat M. ; Van Belle E. ; Hazzan M. ; Pigny P. ; Noel C. ; Caiazzo R. ; Kerr-Conte J. ; Pattou F. (2019). «Ten-Year Outcome of Islet Alone or Islet After Kidney Transplantation in Type 1 Diabetes: A Prospective Parallel-Arm Cohort Study». Diabetes Care (en inglés) (American Diabetes Association) 42 (11): 2042-2049. PMC 7171950. doi:10.2337/dc19-0401. Consultado el 9 de febrero de 2023.
- ↑ Bourgeois S.; Sawatani T.; Van Mulders A.; De Leu N.; Heremans H.; Heimberg H.; Cnop M.; Staels W. (2021). «Towards a Functional Cure for Diabetes Using Stem Cell-Derived Beta Cells: Are We There Yet?». Cells (REVISIÓN) (en inglés) (MDPI) 10 (1): 191. PMC 7835995. PMID 33477961. doi:10.3390/cells10010191. Consultado el 8 de febrero de 2023.

- ↑ Hertl M. (2022). «Trasplante de células de los islotes pancreáticos». Versión para Profesionales (Manual MSD).
Enlaces externos[editar]
- MeSH: Pancreatic+beta+cells (en inglés)