Amigdalina
| Amigdalina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| [(6-O-β-D-glucopyranosyl-β-D-glucopyranosyl)oxy](phenyl)acetonitrile | ||
| General | ||
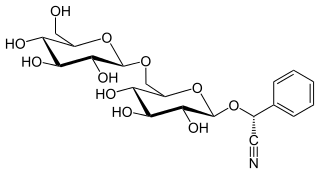
| Fórmula estructural |
 | |
| Fórmula molecular | C20H27NO11 | |
| Identificadores | ||
| Número CAS | 29883-15-6[1] | |
| ChEBI | 17019 | |
| ChEMBL | 461727 | |
| ChemSpider | 570897 | |
| PubChem | 34751 | |
| UNII | 214UUQ9N0H | |
| KEGG | C08325 | |
|
O[C@@H]3[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]3OC[C@H]2O[C@@H](OC(C#N)c1ccccc1)[C@H](O)[C@@H](O)[C@@H]2O
| ||
| Propiedades físicas | ||
| Masa molar | 457,429 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La amigdalina —del griego clásico ἀμυγδαλή (amygdálē): "almendra"—, también llamada amigdalósido, es un glucósido cianogénico presente en las semillas de varias plantas de la subfamilia Amygdaloideae, en la familia Rosaceae. La contienen, entre otras, las almendras amargas, las semillas de los albaricoqueros,[2] de los melocotoneros y de los manzanos.
Tanto la amigdalina como un derivado de su molécula registrado con la marca Laetrile,[3] —escrito también «Laetrilo» y «Laetril»— son anunciados por falsos terapeutas como un tratamiento contra el cáncer, a menudo bajo el nombre incorrecto de «vitamina B17».[4]
Historia
[editar]La amigdalina fue aislada e hidrolizada por primera vez en 1830 por Pierre-Jean Robiquet y Antoine Boutron-Charlard, a partir de un extracto de semillas de almendro amargo, Prunus dulcis var. amara.[5][6] En 1837 Justus von Liebig y Friedrich Wöhler identificaron sus tres productos de hidrólisis: glucosa, benzaldehído y cianuro de hidrógeno, y nombraron emulsina a la enzima que la hidroliza.[7]
Química
[editar]Estructuralmente, la amigdalina consta de un disacárido, la gentiobiosa, unido a una molécula de mandelonitrilo. La prunasina, que sólo tiene una molécula de glucosa, es su precursor, y esta a su vez es sintetizada por los vegetales a partir del aminoácido aromático fenilalanina. Ambos compuestos son productos comunes en las plantas de la familia Rosaceae, particularmente el género Prunus, pero también en plantas, algunas de ellas alimenticias, de las familias Poaceae —gramíneas—, Fabaceae —leguminosas—, y Euphorbiaceae, como la mandioca, junto con glucósidos de estructura parecida, como la linamarina o la sambunigrina. En los órganos que la contienen, la amigdalina y las enzimas necesarias para hidrolizarla se almacenan en lugares separados, y sólo se mezclan si se produce un daño tisular. Esto sirve como un medio de defensa pasiva contra los fitófagos.[8][9]
El contenido de amigdalina en las semillas de los frutales es variable, entre 33 y 54 gramos por cada kg en caso de almendras amargas, 14 gramos por kilo en las de albaricoquero, 6,8 g/Kg en melocotonero, y de 4 a 17,5 g/Kg en las de ciruelo. Las semillas de la manzana contienen una proporción menor, de 3 g/Kg.[10]
Las almendras dulces también contienen amigdalina, pero en una cantidad muy baja, 0.06 g/Kg de promedio. variable según la variedad y la zona de cultivo.[11] Esto se debe a un gen recesivo llamado Sweet kernal [Sk].
Si se ingiere, la amigdalina es hidrolizada en la boca por las glucosidasas presentes en la saliva, y en el intestino por la β-glucosidasa intestinal (emulsina),[12] escindiéndose en el disacárido gentiobiosa y en L-mandelonitrilo. La gentiobiosa se hidroliza a su vez en glucosa, mientras que el mandelonitrilo se descompone para dar benzaldehído y cianuro de hidrógeno. El benzaldehído es el causante del sabor amargo. El cianuro de hidrógeno en cantidad suficiente —su dosis oral letal está entre 0,6 y 1,5 mg/kg de peso corporal— causa intoxicación por cianuro.[13]
En Europa (y también en otros países) está limitado el nivel de glucósidos cianogénicos en los huesos de albaricoque desde 2017.[14] Esta medida está basada en la opinión de la Autoridad Europea de Seguridad Alimentaria de abril de 2016[15]
Uso como anticancerígeno
[editar]En 1892 se probó en Alemania como fármaco contra el cáncer, pero su uso fue abandonado por inefectivo y por ser demasiado tóxico.[5] En la década de 1920, un médico de cabecera estadounidense llamado Ernst Krebs anunció que un extracto de semillas de albaricoque reducía los tumores en roedores, pero avisó que sus resultados eran impredecibles y su uso peligroso en humanos.[16] Su hijo Ernst T. Krebs rescató la idea en 1950, y hacia los fines de la década de los años 60 y los comienzos de los 70 del siglo XX hubo una gran agitación político-legal, principalmente en el estado de California (Estados Unidos), a causa de la prescripción médica de la vitamina B-17, también conocida como Laetril, para el tratamiento del cáncer.[17]
La ortomedicina lo relacionó inicialmente con la cura del cáncer, con el nombre vitamina B17, pero los estudios han demostrado que carece de efectividad alguna para ello.[18][19][20]
Laetrile
[editar]

El levomandelonitrilo es un análogo semisintético de la amigdalina.[21] Fue patentado en Estados Unidos bajo la marca Laetrile.[22]
El neocuranderismo lo promueve como un tratamiento eficaz para los tumores cancerígenos, despreciando toda la evidencia que refuta su supuesta efectividad.
La Colaboración Cochrane determinó en el 2006 lo siguiente:
La tesis que defiende que la Laetrile tiene efectos beneficiosos sobre el cáncer no tiene soporte alguno, con base en los ensayos clínicos. Esta revisión bibliográfica sistemática concluye que para intentar demostrar tal efectividad necesita que estudios aleatorizados o controlados clínicamente.[23]
Referencias
[editar]- ↑ Número CAS
- ↑ «Apricot kernels pose risk of cyanide poisoning». European Food Safety Authority (en inglés). 27 de abril de 2016. Consultado el 21 de septiembre de 2020.
- ↑ «Laetrile/Amygdalin (PDQ®)–Health Professional Version - National Cancer Institute». www.cancer.gov (en inglés). 11 de mayo de 2020. Consultado el 8 de octubre de 2020.
- ↑ Lerner, Irving J. (1981). «Laetrile: A lesson in cancer quackery». CA: A Cancer Journal for Clinicians (en inglés) 31 (2): 91-95. ISSN 1542-4863. doi:10.3322/canjclin.31.2.91. Consultado el 5 de octubre de 2020.
- ↑ a b Wilson, Dr Benjamin. «Verificiencia - El ascenso y la caída del Laetril». verificiencia.com. Archivado desde el original el 30 de octubre de 2020. Consultado el 5 de octubre de 2020.
- ↑ «Botany online: MIRROR SITE: Chronology - Historical Developments - Biological Sciences». web.archive.org. 20 de agosto de 2007. Archivado desde el original el 20 de agosto de 2007. Consultado el 5 de octubre de 2020.
- ↑ Wöhler, F.; Liebig, J. (1 de enero de 1838). Ueber die Bildung des Bittermandelöls. doi:10.1002/ardp.18380630105. Consultado el 5 de octubre de 2020.
- ↑ Mora, Carlos A.; Halter, Jonas G.; Adler, Cornel; Hund, Andreas; Anders, Heidrun; Yu, Kang; Stark, Wendelin J. (11 de mayo de 2016). «Application of the Prunus spp. Cyanide Seed Defense System onto Wheat: Reduced Insect Feeding and Field Growth Tests». Journal of Agricultural and Food Chemistry 64 (18): 3501-3507. ISSN 0021-8561. doi:10.1021/acs.jafc.6b00438. Consultado el 5 de octubre de 2020.
- ↑ Villalba Cadavid, Marcela; Arrázola Paternina, Guillermo; Pardo Perez, Enrique (5 de junio de 2017). «Determinación de capsaicina mediante cromatografía liquida de alta resolución (HPLC-PDA) en la especie Capsicum frutescens». BISTUA REVISTA DE LA FACULTAD DE CIENCIAS BASICAS 15 (1). ISSN 0120-4211. doi:10.24054/01204211.v1.n1.2017.2553. Consultado el 7 de octubre de 2020.
- ↑ Bolarinwa, I. F.; Orfila, C.; Morgan, M. R. A. (1 de junio de 2014). «Amygdalin content of seeds, kernels and food products commercially- available in the UK». Food Chemistry (en inglés) 152: 133-139. ISSN 0308-8146. Consultado el 7 de octubre de 2020.
- ↑ Sánchez-Pérez, Raquel; Jørgensen, Kirsten; Olsen, Carl Erik; Dicenta, Federico; Møller, Birger Lindberg (2008-3). «Bitterness in Almonds». Plant Physiology 146 (3): 1040-1052. ISSN 0032-0889. PMC 2259050. PMID 18192442. doi:10.1104/pp.107.112979. Consultado el 7 de octubre de 2020.
- ↑ George Mann, Frederick; Charles Saunders, Bernard (1975). Practical Organic Chemistry. pp. 509-517. ISBN 9788125013808. Consultado el 5 de octubre de 2020.
- ↑ «Apricot kernels pose risk of cyanide poisoning». European Food Safety Authority (en inglés). 27 de abril de 2016. Consultado el 5 de octubre de 2020.
- ↑ Comisión Europea (8 de junio de 2017). «Reglamento (UE) 2017/1237 de la Comisión sobre el contenido máximo de ácido cianhídrico en los huesos de albaricoque enteros, triturados, molidos, machacados o picados sin transformar comercializados al consumidor final». Consultado el 1 de junio de 2021.
- ↑ European Food Safety Authority (27 de abril de 2016). «Acute health risks related to the presence of cyanogenic glycosides in raw apricot kernels and products derived from raw apricot kernels» (en inglés). Consultado el 1 de junio de 2021.
- ↑ «Wayback Machine». web.archive.org. 27 de marzo de 2010. Archivado desde el original el 27 de marzo de 2010. Consultado el 5 de octubre de 2020.
- ↑ Lerner IJ (1981). «Laetrile: a lesson in cancer quackery». CA Cancer J Clin 31 (2): 91-5. PMID 6781723. doi:10.3322/canjclin.31.2.91. Archivado desde el original el 27 de marzo de 2010.
- ↑ Ellison NM, Byar DP, Newell GR (septiembre de 1978). «Special report on Laetrile: the NCI Laetrile Review. Results of the National Cancer Institute's retrospective Laetrile analysis». N. Engl. J. Med. 299 (10): 549-52. PMID 683212.
- ↑ Moertel CG, Ames MM, Kovach JS, Moyer TP, Rubin JR, Tinker JH (febrero de 1981). «A pharmacologic and toxicological study of amygdalin». JAMA 245 (6): 591-4. PMID 7005480. doi:10.1001/jama.245.6.591.
- ↑ Moertel CG, Fleming TR, Rubin J et al. (enero de 1982). «A clinical trial of amygdalin (Laetrile) in the treatment of human cancer». N. Engl. J. Med. 306 (4): 201-6. PMID 7033783. doi:10.1007/s00520-006-0168-9.
- ↑ Fenselau C, Pallante S, Batzinger RP (noviembre de 1977). «Mandelonitrile beta-glucuronide: synthesis and characterization». Science 198 (4317): 625-7. PMID 335509. doi:10.1126/science.335509.
- ↑ What is laetrile?, National Cancer Institute, (en inglés) consultado el 14 de enero del 2007.
- ↑ Milazzo S, Ernst E, Lejeune S, Schmidt K (2006). «Laetrile treatment for cancer». Cochrane Database Syst Rev (2): CD005476. PMID 16625640. doi:10.1002/14651858.CD005476.pub2.
