Beta-carbolina
| Beta-carbolina | ||
|---|---|---|
 | ||
 Prototipo de clase de compuestos llamados β-carbolinas | ||
| Nombre IUPAC | ||
| 9H-β-carbolina | ||
| General | ||
| Fórmula molecular | C11H8N2 | |
| Identificadores | ||
| Número CAS | 244-63-3[1] | |
| ChEBI | 109895 | |
| ChEMBL | CHEMBL275224 | |
| ChemSpider | 58486 | |
| PubChem | 64961 | |
| UNII | 94HMA1I78O | |
| KEGG | C20157 | |
|
c2cncc3nc1ccccc1c23
| ||
| Propiedades físicas | ||
| Masa molar | 168,2 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La β-carbolina (9H-pirido[3,4-b]indol) es una amina orgánica, prototipo de un grupo de compuestos conocidos como β-carbolinas.
Síntesis
[editar]La Reacción de Pictet-Spengler es una reacción de cierre de un anillo piperidínico fusionado a un sistema aromático a partir de una β-indoletilamina, la cual experimenta el cierre de anillo después de que condensa con un aldehído o cetona. Normalmente procede con catálisis ácida y se calienta a reflujo la mezcla de reacción , aunque algunos compuestos reactivos dan buenos rendimientos incluso bajo condiciones fisiológicas.[2][3][4] La reacción de Pictect-Spengler consiste en dos reacciones consecutivas: una reacción de Schiff entre el compuesto carbonílico y la amina, y una reacción de Mannich, combinada con una sustitución electrofílica aromática. El producto de la reacción de Pictect-Spengler de la triptamina es una 1-alquil-β-carbolina.

Abundancia en la naturaleza
[editar]La β-carbolina es un alcaloide encontrado en diversas plantas,[5] tales como Chrysophyllum lacourtianum, Catharanthus roseus, Lolium perenne, Strychnos johnsonii, Strychnos potatorum, y Lolium arundinaceum. También lo producen bacterias de los géneros Nocardia y Streptomyces así como la ascidia neozelandesa Ritterella sigillinoides y el dinoflagelado Noctiluca miliaris.[6] Es asimismo un componente traza del tabaco. Por otro lado, en tunicados se han aislado β-carbolinas simples y sustituidas en 1, tales como las eudistominas.
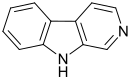
- β-carbolínas simples: Se forman por condensación con formaldehído, piruvato, acetaldehído, etc. Ejemplos:β--Carbolina, Harmano, eleagnina, harmina, harmalina, Pseudofrinaminas A, 5-Bromo-6-hidroxi-β-carbolina, pseudofrinaminol, perlolirina, borrerina, eudistominas, cantin-6-ona, infractinas, flazina, cantinonas.

- Eudistominas: Grupo de alcaloides que condensan con cisteína aislados de tunicados:
- Carbolinas fusionadas con antranilato: Evodiamina
 |
 |
 |
 |
| β-Carbolina | Harmina | Eudistomina C | Evodiamina |
- Infractopicrinas: Alcaloides pentacíclicos aislados de Cortinarius infracta.
 |
| Infractopicrina: |
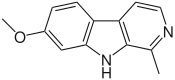
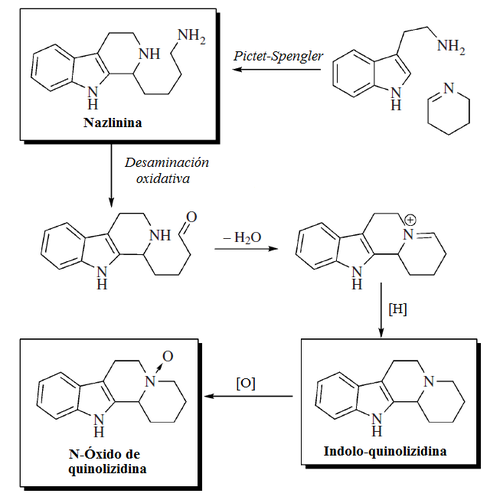
- Alcaloides indólicos de Nitraria: Se forman por la condensación de un anillo hidrolizado de piperideina proveniente de la lisina (Alcaloides β-carbolinmonopiperideínicos) o con dos unidades de piperideina (Alcaloides β-carbolindipiperideínicos). Ejemplos de estos alcaloides son la nazlinina, schobericina, komaroidina, las komavinas, nitrarina, nitramidina, nitraricina, nitrarizina, tangutorina, nitraraína, komarovina, komarovicina, komaroína, komarovidina, isokomarovina, nitramarina
- Alcaloides estrictosidínicos: Estrictosidina

Y sus derivados, muchos de los cuales conservan la estructura beta-carbolínica:

- Alcaloides indoloquinolizidínicos: Angustina, Deplancheína
 |
| Angustina(alcaloide) |
Farmacología
[editar]Los alcaloides β-carbolinas están extendidos en plantas y animales, y frecuentemente actúan como inhibidores de la monoaminooxidasa (IMAO). Como componentes de las lianas Banisteriopsis caapi, las β-carbolinas harmina, harmalina, y tetrahidroharmina juegan un papel fundamental en la farmacología bebida sacramental indígena Ayahuasca al inhibir la monoaminooxidasa (MAO), lo que impide la degradación de dimetiltriptamina en el intestino; de este modo, la Ayahuasca resulta psicoactiva en la administración oral. Algunas β-carbolinas, notablemente triptolina y pinolina, se forman naturalmente en el cuerpo humano. La segunda está implicada, junto con la melatonina, en la función reguladora de la glándula pineal sobre el ciclo de sueño y vigilia.[cita requerida] Las β-carbolinas pueden unirse a los receptores cerebrales de benzodiazepinas e inducir efectos agonistas inversos (ansiógenos).[cita requerida]
Derivados
[editar]Las β-carbolinas pueden ser sintetizadas por el método de Bischler-Napieralski.
La normelinonina F es la sal cuaternaria de amonio (N2-metil-β-carbolina). CAS: 17994-14-8. C12H11N21+. PM: 183.232. Se aisló de Strychnos usambarensis (Strychnaceae).[7]
La 9-acetil-3,4-dihidro-β-carbolina se aisló de las raíces de Adhatoda vasica (Acanthaceae). CAS: 76528-83-1. C13H12N2O. PM: 212.251. PM = 165 - 166 °C.
Reacciones
[editar]La síntesis de triptamina de Abramovitch-Shapiro es una reacción orgánica para la síntesis de triptaminas a partir de β-Carbolina[8]

Véase también
[editar]Referencias
[editar]- ↑ Número CAS
- ↑ Pictet, A.; Spengler, T. (1911). «Über die Bildung von Isochinolin-derivaten durch Einwirkung von Methylal auf Phenyl-äthylamin, Phenyl-alanin und Tyrosin». Berichte der deutschen chemischen Gesellschaft 44 (3): 2030-2036. doi:10.1002/cber.19110440309.
- ↑ «The Pictet-Spengler synthesis of tetrahydroisoquinolines and related compounds». Org. React. 6: 74. 1951.
- ↑ Hahn G., Ludewig H. (1934). «Synthese von Tetrahydro-harman-Derivaten unter physiologischen Bedingungen». Chemische Berichte 67 (12): 2033. doi:10.1002/cber.19340671221.
- ↑ Rommelspacher, H. et al., Prog. Drug Res., 1985, 29, 415- 459
- ↑ Inoue, S. et al., Chem. Lett., 1980, 297- 298
- ↑ Caprasse, M. et al., J. Pharm. Belg., 1983, 38, 135- 139
- ↑ 880. Triptaminas, carbolines, and related compounds. Part II. A convenient synthesis of triptaminas and -carbolines R. A. Abramovitch and D. Shapiro J. Chem. Soc., 1956, 4589 - 4592, doi 10.1039/JR9560004589
Enlaces externos
[editar]- TiHKAL #44
- TiHKAL in general
- MeSH: Beta-Carbolines (en inglés)
- Beta-carbolines in Coffee
- Farzin D, Mansouri N (julio de 2006). «Antidepressant-like effect of harmane and other beta-carbolines in the mouse forced swim test». Eur Neuropsychopharmacol 16 (5): 324-8. PMID 16183262. doi:10.1016/j.euroneuro.2005.08.005.
