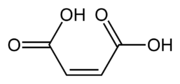
Ácido cis-butenodioico
| Ácido cis-butenodioico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ácido cis-butenodioico, (Z)-ácido butenodioico | ||
| General | ||
| Fórmula molecular | C4H4O4 | |
| Identificadores | ||
| Número CAS | 110-16-7[1] | |
| Número RTECS | OM9625000 | |
| ChEBI | 18300 | |
| ChEMBL | CHEMBL539648 | |
| ChemSpider | 392248 | |
| DrugBank | 04299 | |
| PubChem | 444266 | |
| UNII | 91XW058U2C | |
| KEGG | C01384 | |
| Propiedades físicas | ||
| Apariencia | Blanco | |
| Densidad | 1590 kg/m³; 1,59 g/cm³ | |
| Masa molar | 116,07 g/mol | |
| Punto de fusión | 404 K (131 °C) | |
| Punto de ebullición | 408 K (135 °C) | |
| Propiedades químicas | ||
| Acidez | 1=1,910; 2=6,332 pKa | |
| Solubilidad en agua | 78 g/100 ml (25 °C) | |
| Peligrosidad | ||
| NFPA 704 |
0
3
0
| |
| Compuestos relacionados | ||
| Ácido carboxílico |
Ácido fumárico Ácido succínico | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido cis-butenodioico o (Z)-ácido butenodioico o ácido maleico es un compuesto orgánico que es un dicarboxílico (molécula con dos grupos carboxilo). Otros nombres con el que se le conoce a este ácido son el ácido malénico, el ácido maleinico y ácido toxilico.
El ácido maleico es el isómero cis del ácido butenodioico, mientras que el ácido fumárico es el isómero trans. En este sentido cabe destacar que el anhídrido del ácido maleico, el anhídrido maleico, se puede formar debido a la proximidad estructural de los dos grupos carboxílicos. En cambio, en el caso del ácido fumárico, este no es posible debido a la lejanía estructural de los dos grupos carboxílicos. En este sentido, el anhídrido del ácido fumárico no se puede formar y en consecuencia el anhídrido fumárico no existe.
Propiedades físicas[editar]
Las propiedades físicas de ácido butenodioico son muy diferentes a las del ácido fumárico. El ácido maleico es una molécula menos estable que el ácido fumárico. La diferencia en el calor de combustión es de 22,7 kJ/mol.
El ácido maleico es soluble en agua, mientras que el ácido fumárico no lo es. El punto de fusión del ácido maleico está entre 131-139 °C, también es mucho menor que la del ácido fumárico que es de 287 °C. Ambas propiedades del ácido maleico puede explicarse en razón de la vinculación del hidrógeno intramolecular que tiene lugar a expensas de las interacciones moleculares.
Obtención[editar]
En la industria, el ácido maleico se deriva del anhídrido maleico por hidrólisis. El anhídrido maleico se produce a partir de benceno o de butano en un proceso de oxidación.
Reacciones de síntesis[editar]
- Isomerización. El ácido maleico y el ácido fumárico normalmente no se pueden interconvertir porque la rotación alrededor de un doble enlace carbono-carbono no es energéticamente favorable. En el laboratorio, la conversión del isómero cis en el isómero trans es posible mediante la aplicación de la luz y una pequeña cantidad de bromo. Convierte la luz bromo elemental en un bromo radical, que ataca al alqueno en una reacción de adición de radicales a un bromo-alcano radical, y ahora la rotación de enlace simple es posible. Los radicales se recombinan y el ácido fumárico se forma. En otro método (utilizado como una demostración de clase), el ácido maleico se transforma en ácido fumárico, a través del proceso de calentamiento de la solución de ácido maleico en 12 M de ácido clorhídrico. Además la reacción es reversible (H+) lleva a la rotación libre alrededor del enlace (C-C) central y la formación de ácido fumárico, el más estable y menos soluble. En la industria, el ácido fumárico se produce también a partir del ácido maleico por isomerización catalítica con ácidos minerales, bromatos, o tiourea. Una vez más la gran diferencia en la solubilidad en agua hace que la purificación del ácido fumárico sea fácil.
- El ácido maleico es una materia prima industrial para la producción de ácido glioxílico por ozonólisis.
- El ácido maleico se convierte en anhídrido maleico por deshidratación, al ácido málico por la hidratación, y el ácido succínico por hidrogenación (etanol/paladio sobre carbono). Reacciona con el cloruro de tionilo o pentacloruro de fósforo para dar el cloruro de ácido maleico (que no es posible aislar el cloruro de ácido mono).
- El ácido maleico es un reactivo que se utiliza mucho en síntesis química de Diels-Alder.
Maleatos[editar]
El ion maleato es la forma ionizada del ácido maleico. El ion maleato es útil en la bioquímica como un inhibidor de las reacciones de las transaminasas. los ésteres del ácido maleico también se le llaman maleatos, por ejemplo, maleato de dimetilo.

