Sulfato de sodio
| Sulfato de sodio | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Sulfato de sodio o tetraoxidosulfato de disodio | ||
| General | ||
| Fórmula estructural |
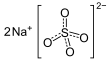 | |
| Fórmula molecular | Na2SO4 | |
| Identificadores | ||
| Número CAS |
7757-82-6 7727-73-3 (decahidratado)[1] | |
| Número RTECS | WE1650000 | |
| ChEBI | 32149 | |
| ChEMBL | CHEMBL233406 | |
| ChemSpider | 22844 | |
| DrugBank | 09472 | |
| PubChem | 24436 | |
| UNII | 36KCS0R750 | |
| KEGG | D01732 C13199, D01732 | |
| Propiedades físicas | ||
| Apariencia | Sólido cristalino blanco | |
| Densidad | 2.664 g/cm³ (anhidro) kg/m³; 1.464 g/cm³ (decahidrato) g/cm³ | |
| Masa molar |
142.04 g/mol (anhidro) 322.20 g/mol (decahidro) g/mol | |
| Punto de fusión | 1157,15 K (884 °C) | |
| Punto de ebullición | 1702,15 K (1429 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 4.76 g/100 mL (0 °C) 42.7 g/100 mL (100 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El sulfato de disodio, tetraoxosulfato de disodio, sulfato de sodio o antiguamente sulfato sódico (Na2SO4) es una sustancia incolora, cristalina, con buena solubilidad en el agua y mala solubilidad en la mayoría de los disolventes orgánicos con excepción de la glicerina.
El sulfato de sodio se disuelve en agua bajo enfriamiento de la disolución por efecto entrópico. La sal deshidratada, libera energía (reacción exotérmica) al hidratarse y disolverse. Al enfriarse una disolución saturada, a menudo se observa sobresaturación.
Formas[editar]
- Sulfato sódico anhidro, conocido como el raro mineral thenardita, utilizado como agente desecante en síntesis orgánica.
- Sulfato de sodio heptahidratado, una forma muy rara.
- Sulfato de sodio decahidratado, conocido como el mineral mirabilita, muy utilizado por la industria química. También se conoce como sal de Glauber.
Propiedades químicas[editar]
El sulfato de sodio es un típico sulfato iónico con enlace electrostático. La existencia de iones sulfato libres en la solución está indicada por la fácil formación de sulfatos insolubles cuando estas soluciones se tratan con sales de Ba2+ o Pb2+:
- Na2SO4 + BaCl2 → 2 NaCl + BaSO4
El sulfato de sodio es poco reactivo hacia la mayoría de los agentes oxidantes o reductores. A altas temperaturas, puede convertirse en sulfuro de sodio por reducción carbotérmica (también conocida como reducción termoquímica del sulfato (TSR), calentamiento a alta temperatura con carbón vegetal, etc.):[2]
- Na2SO4 + 2 C → Na2S + 2 CO2
Esta reacción se empleaba en el proceso Leblanc, una ruta industrial desaparecida para obtener carbonato de sodio.
El sulfato de sodio reacciona con el ácido sulfúrico para dar la sal ácida bisulfato de sodio:[3][4]
- Na2SO4 + H2SO4 ⇌ 2 NaHSO4
El sulfato de sodio muestra una tendencia moderada a formar sales dobles. Los únicos alumbres formados con metales trivalentes comunes son NaAl(SO4)2 (inestable por encima de 39 °C) y NaCr(SO4)2, en contraste con el sulfato de potasio y el sulfato de amonio que forman muchos alumbres estables.[5] Se conocen sales dobles con algunos otros sulfatos de metales alcalinos, incluyendo el Na2SO4-3K2SO4 que ocurre naturalmente como el mineral afitalita. La formación de glaserita por reacción de sulfato de sodio con cloruro de potasio se ha utilizado como base de un método para producir sulfato de potasio, un fertilizante.[6] Otras sales dobles incluyen 3Na2SO4·CaSO4, 3Na2SO4·MgSO4 (vanthoffita) y NaF·Na2SO4.[7]
Propiedades físicas[editar]
El sulfato de sodio tiene unas características de solubilidad inusuales en el agua.[8] Su solubilidad en el agua se multiplica por más de diez entre 0 °C y 32,384 °C, donde alcanza un máximo de 49,7 g/100 mL. En este punto, la curva de solubilidad cambia de pendiente y la solubilidad se vuelve casi independiente de la temperatura. Esta temperatura de 32,384 °C, que corresponde a la liberación del agua cristalina y a la fusión de la sal hidratada, sirve como referencia de temperatura precisa para la calibración de un termómetro.
Estructura[editar]
Los cristales del decahidrato están formados por iones [Na(OH2)6]+ con geometría molecular octaédrica. Estos octaedros comparten aristas de tal forma que 8 de las 10 moléculas de agua están unidas al sodio y otras 2 son intersticiales, estando unidas por hidrógeno al sulfato. Estos cationes están unidos a los aniones sulfato por enlace de hidrógeno. Las distancias Na-O son de unos 240 pm.[9] El sulfato de sodio cristalino decahidratado también es inusual entre las sales hidratadas por tener una entropía residual medible (entropía a cero absoluto) de 6,32 J/(K-mol). Esto se atribuye a su capacidad para distribuir el agua mucho más rápidamente en comparación con la mayoría de los hidratos.[10]
Producción[editar]
La producción mundial de sulfato de sodio, casi exclusivamente en forma de decahidrato, asciende a unos 5,5 a 6 millones de toneladas anuales (Mt/a). En 1985, la producción era de 4,5 Mt/a, la mitad procedente de fuentes naturales y la otra mitad de la producción química. Después de 2000, en un nivel estable hasta 2006, la producción natural había aumentado a 4 Mt/a, y la producción química disminuyó a 1,5 a 2 Mt/a, con un total de 5,5 a 6 Mt/a.[11][12][13][14] Para todas las aplicaciones, el sulfato de sodio producido naturalmente y el producido químicamente son prácticamente intercambiables.
Fuentes naturales[editar]
Dos tercios de la producción mundial de decahidrato (sal de Glauber) proceden de la forma mineral natural mirabilita, por ejemplo, tal y como se encuentra en los lechos lacustres del sur de Saskatchewan. En 1990, México y España eran los principales productores mundiales de sulfato sódico natural (alrededor de 500.000 toneladas cada uno), mientras que Rusia, Estados Unidos y Canadá producían unas 350.000 toneladas cada uno.[12] Se calcula que los recursos naturales superan los 1.000 millones de toneladas.[11][12]
Entre los principales productores de 200 000 a 1500 000 toneladas/año en 2006 se encontraban Searles Valley Minerals (California, EE.UU.), Airborne Industrial Minerals (Saskatchewan, Canadá), Química del Rey (Coahuila, México), Minera de Santa Marta y Criaderos Minerales Y Derivados, también conocido como Grupo Crimidesa (Burgos, España), Minera de Santa Marta (Toledo, España), Sulquisa (Madrid, España), Chengdu Sanlian Tianquan Chemical (Condado de Tianquan, Sichuan, China), Hongze Yinzhu Chemical Group (Distrito de Hongze, Jiangsu, China), Nafine Chemical Industry ; 南风化工}} (Shanxi, China), Mirabilita Chuanmei de la provincia de Sichuan (万胜镇; 万胜镇}}, Distrito de Dongpo, Meishan, Sichuan, China), y Kuchuksulphat JSC (Altai Krai, Siberia, Rusia).[11][13]
El sulfato de sodio anhidro se presenta en ambientes áridos como el mineral thenardita. Se convierte lentamente en mirabilita en aire húmedo. El sulfato sódico también se encuentra como glauberita, un mineral de sulfato sódico cálcico. Ambos minerales son menos comunes que la mirabilita.
Aplicaciones[editar]
El sulfato de sodio anhidro tiene propiedades higroscópicas y, por lo tanto, se utiliza como desecante en el laboratorio o la industria química.
Industrias de materias primas[editar]
Con un precio en EE. UU. de 30 dólares por tonelada en 1970, hasta 90 dólares por tonelada para la calidad de torta de sal, y 130 dólares para las mejores calidades, el sulfato sódico es un material muy barato. El mayor uso es como relleno en detergente para ropa doméstico en polvo, consumiendo aproximadamente el 50% de la producción mundial. Este uso está disminuyendo a medida que los consumidores domésticos se decantan cada vez más por detergentes compactos o líquidos que no incluyen sulfato sódico.[11] Se emplea en la fabricación de la celulosa y como aditivo en la fabricación del vidrio y plástico.
También se añade a los detergentes en polvo para mejorar su comportamiento mecánico, donde puede representar una parte importante del peso total. Se usa como desinfectante, pero causa irritación después de un pequeño periodo de tiempo.
Tiene utilidad en toxicología como acelerador del tránsito intestinal (catártico), junto con la administración de carbón activado, para disminuir la absorción intestinal de tóxicos ingeridos. También se utiliza en alimentos como acidulantes.
Fabricación de papel[editar]
Otro de los usos más importantes del sulfato sódico, sobre todo en Estados Unidos y Canadá, es el proceso Kraft para la fabricación de pulpa de celulosa. Los orgánicos presentes en el "licor negro" de este proceso se queman para producir calor, necesario para impulsar la reducción del sulfato sódico a sulfuro sódico. Sin embargo, debido a los avances en la eficiencia térmica del proceso de recuperación Kraft a principios de la década de 1960, se logró una recuperación de azufre más eficiente y la necesidad de maquillaje de sulfato de sodio se redujo drásticamente.[15] Por lo tanto, el uso de sulfato de sodio en la industria de la pulpa de EE. UU. y Canadá se redujo de 1.400.000 toneladas por año en 1970 a sólo aprox. 150.000 toneladas en 2006.[11]
Fabricación de vidrio[editar]
La industria del vidrio proporciona otra aplicación significativa para el sulfato sódico, como segunda aplicación más importante en Europa. El sulfato sódico se utiliza como agente clarificante, para ayudar a eliminar las pequeñas burbujas de aire del vidrio fundido. Fundente el vidrio y evita la formación de escoria en el vidrio fundido durante el refinado. La industria del vidrio en Europa ha consumido entre 1970 y 2006 un volumen estable de 110 000 toneladas anuales.
Textiles[editar]
El sulfato de sodio es importante en la fabricación de textiles, sobre todo en Japón, donde es la mayor aplicación. El sulfato de sodio se añade para aumentar la fuerza iónica de la solución y así ayuda a "nivelar", es decir, a reducir las cargas eléctricas negativas de las fibras textiles, para que los tintes puedan penetrar uniformemente (véase la teoría de la doble capa difusa (DDL) elaborada por Gouy y Chapman). A diferencia de la alternativa cloruro sódico, no corroe los recipientes de acero inoxidable utilizados en la tintura. Esta aplicación en Japón y EE. UU. consumió en 2006 aproximadamente 100 000 toneladas.[11]
Industria alimentaria[editar]
El sulfato de sodio se utiliza como diluyente para colorantes alimentarios.[16] Se conoce como aditivo número E E514'.
Almacenamiento de calor[editar]
La alta capacidad de almacenamiento de calor en el cambio de fase de sólido a líquido, y la ventajosa temperatura de cambio de fase de 32 °C (90 °F) hacen que este material sea especialmente apropiado para almacenar calor solar de bajo grado para su posterior liberación en aplicaciones de calefacción de espacios. En algunas aplicaciones, el material se incorpora a baldosas térmicas que se colocan en un espacio abuhardillado, mientras que en otras, la sal se incorpora a celdas rodeadas de agua calentada por energía solar. El cambio de fase permite una reducción sustancial de la masa del material necesaria para el almacenamiento efectivo de calor (el calor de fusión del sulfato de sodio decahidratado es de 82 kJ/mol o 252 kJ/kg[17]), con la ventaja adicional de una consistencia de temperatura siempre que se disponga de suficiente material en la fase adecuada.
Para aplicaciones de refrigeración, una mezcla con sal común de cloruro sódico (NaCl) reduce el punto de fusión a 18 °C (64 °F). El calor de fusión del NaCl-Na2SO4-10H2O, en realidad aumenta ligeramente a 286 kJ/kg.[18]
Síntesis[editar]
Actualmente la mayor parte del sulfato de sodio se obtiene de minas de glauberita y de la explotación de lagos salados, siendo los principales productores las provincias de Jiangsu y Sichuan en China, seguidas de España, en donde se encuentra el mayor yacimiento de glauberita del mundo (en Cerezo de Río Tirón, Burgos). También se obtiene como subproducto en muchos procesos industriales donde se neutraliza el ácido sulfúrico con bases de sodio.
Historia[editar]
El sulfato de sodio es parte esencial de los minerales encontrados en muchas aguas minerales y tiene propiedades astringentes. Johann Rudolph Glauber (1604-1670), químico y boticario neerlando/alemán, lo descubrió en 1625 en las aguas de manantiales austríacos. Lo llamó sal mirabilis (sal milagrosa), debido a sus propiedades medicinales: los cristales se usaron como un laxante de uso general, hasta que surgieron alternativas más sofisticadas en la década de 1900.[19][20] Comenzó con su fabricación a partir de sal (NaCl) y ácido sulfúrico concentrado entre 1650 y 1660. Este proceso es considerado como el inicio de la industria química. Por este comienzo, en alemán, aparte de por su nombre sistemático, se conoce como "Glaubersalz" y en inglés como "Glauber's salt" (sal de Glauber).
En el siglo XVIII, la sal de Glauber comenzó a usarse como materia prima para la producción industrial de cenizas de sosa (carbonato de sodio), por reacción con la potasa (carbonato de potasio). La demanda de carbonato de sodio aumentó y el suministro de sulfato de sodio tuvo que aumentar en línea. Por ello, en el siglo XIX, el proceso Leblanc a gran escala, que produce sulfato de sodio sintético como un intermediario clave, se convirtió en el método principal de producción de cenizas de sosa.[21]
Analítica[editar]
El sodio se determina comúnmente por su emisión de luz amarilla en la llama. El sulfato se suele determinar precipitándolo como sulfato de bario.
Referencias[editar]
- ↑
7727-73-3
(decahidratado) Número CAS - ↑ Handbook of Chemistry and Physics (71st edición). Ann Arbor, Michigan: CRC Press. 1990. ISBN 9780849304712. (requiere registro).
- ↑ The Merck Index (7th edición). Rahway, New Jersey, US: Merck & Co. 1960.
- ↑ Nechamkin, Howard (1968). The Chemistry of the Elements. New York: McGraw-Hill. (requiere registro).
- ↑ Lipson, Henry; Beevers, C. A. (1935). «The Crystal Structure of the Alums». Proceedings of the Royal Society A 148 (865): 664-80. Bibcode:1935RSPSA.148..664L. doi:10.1098/rspa.1935.0040.
- ↑ Garrett, Donald E. (2001). Sodium sulfate : handbook of deposits, processing, properties, and use. San Diego: Academic Press. ISBN 978-0-12-276151-5.
- ↑ Mellor, Joseph William (1961). Mellor's Comprehensive Treatise on Inorganic and Theoretical Chemistry II (new impression edición). London: Longmans. pp. 656-673. ISBN 978-0-582-46277-9.
- ↑ Linke, W. F.; A. Seidell (1965). Solubilities of Inorganic and Metal Organic Compounds (4th edición). Van Nostrand. ISBN 978-0-8412-0097-5.
- ↑ Helena W. Ruben, David H. Templeton, Robert D. Rosenstein, Ivar Olovsson, "Crystal Structure and Entropy of Sodium Sulfate Decahydrate", J. Am. Chem. Soc. 1961, volumen 83, pp. 820-824. doi 10.1021/ja01465a019.
- ↑ Brodale, G.; W. F. Giauque (1958). «El Calor de Hidratación del Sulfato de Sodio. Capacidad calorífica a baja temperatura y entropía del decahidrato de sulfato sódico». Journal of the American Chemical Society 80 (9): 2042-2044. doi:10.1021/ja01542a003.
- ↑ a b c d e f Suresh, Bala; Kazuteru Yokose (Mayo 2006). «Sulfato de sodio». Informe de Investigación de Marketing de CEH (Zúrich: Manual de Economía Química SRI Consulting). pp. 771.1000A-771.1002J. Archivado desde html el original el 14 de marzo de 2007.
- ↑ a b c gov/minerals/pubs/commodity/sodium_sulfate/stat «Compendio estadístico del sulfato de sodio». Reston, Virginia: US Geological Survey, Información sobre minerales. 1997. Archivado desde el original el 7 de marzo de 2007. Consultado el 22 de abril de 2007.
- ↑ a b La economía del sulfato sódico (Octava edición). Roskill Information Services. 1999.}
- ↑ El negocio del sulfato sódico. Chem Systems International. Noviembre 1984.
- ↑ Smook, Gary (2002). Handbook for Pulp and Paper Technologists. p. 143. Archivado desde aspx el original el 7 de agosto de 2016.
- ↑ Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasWHO2000 - ↑ «Materiales con cambio de fase para aplicaciones térmicas solares de baja temperatura». Archivado desde pdf el original el 24 de septiembre de 2015. Consultado el 19 de junio de 2014.
- ↑ «Materiales de cambio de fase para aplicaciones térmicas solares de baja temperatura». p. 8. Archivado desde eng.mie-u.ac.jp/research/activities/29/29_31.pdf el original el 24 de septiembre de 2015. Consultado el 19 de junio de 2014.
- ↑ Szydlo, Zbigniew (1994). Water which does not wet hands: The Alchemy of Michael Sendivogius. London–Warsaw: Polish Academy of Sciences.
- ↑ Westfall, Richard S. (1995). «Glauber, Johann Rudolf». The Galileo Project. Archivado desde el original el 18 de noviembre de 2011.
- ↑ Aftalion, Fred (1991). A History of the International Chemical Industry. Philadelphia: University of Pennsylvania Press. pp. 11-16. ISBN 978-0-8122-1297-6.
Enlaces externos[editar]
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del sulfato de sodio.
