Ácido fluorhídrico
| Ácido fluorhídrico | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Ácido fluorhídrico | ||
| General | ||
| Otros nombres | Fluoruro de hidrógeno | |
| Fórmula molecular | HF (ac) | |
| Identificadores | ||
| Número CAS | 7664-39-3[1] | |
| Número RTECS | MW7875000 | |
| DrugBank | 11072 | |
| PubChem | 14917 | |
| UNII | RGL5YE86CZ | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1160 kg/m³; 1,16 g/cm³ | |
| Masa molar | 20,0063 g/mol | |
| Punto de fusión | 238,15 K (−35 °C) | |
| Punto de ebullición | 379,15 K (106 °C) | |
| Propiedades químicas | ||
| Acidez | 3,17 pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido fluorhídrico es una solución de fluoruro de hidrógeno (HF) en agua. Es un hidrácido que no debe ponerse en contacto con elementos de vidrio ya que puede corroerlo, por esto se manipula bajo fríos extremos utilizando material de plástico. Se utiliza para fabricar la mayoría de los compuestos que contienen flúor; algunos ejemplos son el medicamento antidepresivo de uso común fluoxetina (Prozac) y el material PTFE (Teflón). El flúor elemental se produce a partir de él. Se utiliza habitualmente para grabar obleas de vidrio y silicio.
Descripción[editar]
El fluoruro de hidrógeno puro a menudo se denomina “ácido fluorhídrico anhidro”. El ácido fluorhídrico es un ácido débil en solución acuosa diluida. De hecho, aunque el ácido se disocia completamente en solución acuosa, es decir, se forman iones H3O+ y F−, los iones flúor son tan electronegativos que se unirán muy fuertemente al ion hidronio (H3O+) formados, haciéndolos inactivos porque son muy estables,
- HF + H2O H3O+•••F−
donde las dos especies resultantes (productos) están fuertemente unidas por un enlace iónico entre el ion fluoruro altamente electronegativo y el ion hidronio.
El ácido fluorhídrico es uno de los pocos líquidos conocidos capaces de disolver vidrio, que como se sabe consiste principalmente en sílice:
- SiO2(s) + 6 HF(aq) → H2[SiF6] (aq) + 2 H2O (l).
El ácido fluorhídrico tiene la propiedad única de poder disolver casi todos los óxidos minerales, así como la mayoría de los metales (solo platino, oro, plata y mercurio no son atacados[2]).
Usos[editar]
Producción de compuestos organofluorados[editar]
El principal uso del ácido fluorhídrico es la química de los organofluorados. Muchos compuestos organofluorados se preparan utilizando el HF como fuente de flúor, incluyendo el teflón, los fluoropolímeros, los fluorocarbonos y los refrigerantes como el freón. Muchos productos farmacéuticos contienen flúor.[3]
Producción de fluoruros inorgánicos[editar]
La mayoría de los compuestos fluorados inorgánicos de gran volumen se preparan a partir del ácido fluorhídrico. Los más importantes son Na3AlF6, criolita, y AlF3, trifluoruro de aluminio. Una mezcla fundida de estos sólidos sirve como disolvente a alta temperatura para la producción de aluminio metálico. Otros fluoruros inorgánicos preparados a partir del ácido fluorhídrico son el fluoruro de sodio y el hexafluoruro de uranio.[3]
Producción[editar]
El ácido fluorhídrico fue preparado por primera vez en 1771, por Carl Wilhelm Scheele.[4] En la actualidad se lo produce principalmente mediante el tratamiento del mineral fluorita, CaF2, con ácido sulfúrico concentrado a unos 265 °C.
- CaF2 + H2SO4 → 2 HF + CaSO4
El ácido también es un subproducto de la producción de ácido fosfórico a partir de apatita y fluorapatita. La digestión del mineral con ácido sulfúrico a temperaturas elevadas libera una mezcla de gases, incluido el fluoruro de hidrógeno, que puede recuperarse.[3]
Debido a su alta reactividad con el vidrio, el ácido fluorhídrico se almacena en recipientes de plástico fluorado (a menudo PTFE),[3][5] fluoropolímeros (politetrafluoroetileno. El polietileno y poliestireno solo son resistentes a soluciones acuosas diluidas. El ácido fluorhídrico puede encontrarse en la naturaleza; se libera en las erupciones volcánicas.
Acidez[editar]
A diferencia de otros ácidos halhídricos, como el ácido clorhídrico, el fluoruro de hidrógeno sólo es un ácido débil en solución acuosa diluida.[6] Esto es en parte resultado de la fuerza del enlace hidrógeno-flúor, pero también de otros factores como la tendencia del HF, y aniones H
2O, y F−
de formar agrupamientos.[7] En concentraciones altas, las moléculas de HF sufren homoasociación formando iones poliatómicos (tales como bifluoruro, HF−
2) y protones, incrementando sobremanera la acidez.[8] Ello conduce a la protonación de ácidos muy fuertes como el clorhídrico, sulfúrico, o nítrico al utilizar soluciones de ácido fluorhídrico concentradas.[9] Si bien el ácido fluorhídrico es un ácido débil, es muy corrosivo, llegando a atacar el vidrio si se lo hidrata.[8]
La acidez de las soluciones de ácido fluorhídrico varia con la concentración a causa de las interacciones de puente hidrógeno del ion fluoruro. Las soluciones diluidas son débilmente ácidas con una constante de ionización ácida Ka = 6.6x10-4 (o pKa = 3.18),[10] contrastando con las soluciones correspondientes de otros haluros de hidrógeno, que son ácidos fuertes (pKa < 0). Las soluciones concentradas de ácido fluorhídrico son mucho más fuertemente ácidas que lo que implica este valor, tal como muestran las mediciones de la función de acidez de Hammett H0[11] (o "pH efectivo"). El H0 para 100% HF se estima es entre −10.2 y −11, comparable con el valor de −12 del ácido sulfúrico.[12][13]
En términos termodinámicos, las soluciones de HF son altamente no ideales, con la actividad del HF aumentando mucho más rápidamente que su concentración. La débil acidez en solución diluida se atribuye a veces a la elevada fuerza de enlace del H-F, que se combina con la elevada entalpía de disolución del HF para compensar la entalpía más negativa de hidratación del ion fluoruro.[14] Paul Giguère y Sylvia Turrell[15][16] han demostrado mediante espectroscopía infrarroja que las especies de soluto predominantes en soluciones diluidas es el par iónico de puente hidrógeno H3O+·F−.[17]
- H2O + HF
 H3O+⋅F−
H3O+⋅F−
A mayores concentraciones de HF la concentración del ion difluoruro de hidrógeno también aumenta.[15] La reacción
- 3 HF
 HF−
HF−
2 + H2F+
es un ejemplo de homoconjugación, también llamada homoasociación[18]
Aplicaciones[editar]
El ácido fluorhídrico se utiliza en química orgánica en la obtención de compuestos orgánicos fluorados, como catalizador en petroquímica, para obtener criolita (Na3AlF6) artificial que se emplea en la obtención del aluminio, fluoruros inorgánicos como el hexafluoruro de uranio (UF6) y a veces como disolvente. También es utilizado en la industria y preparación de vidrio o cristal en el tallado y grabado del mismo. En estudios petrográficos de rocas graníticas es utilizado en estado puro para atacar con sus vapores los silicatos que componen la roca, para luego de un suave lavado con agua destilada ser cubierto con cobalto-nitrito de sodio el cual pintara selectivamente de un color amarillo intenso los feldespatos de potasio, que luego podrán ser distinguidos de los feldespatos plagioclasa sobre la base de su color y de esta manera se podrá clasificar la roca ígnea.
Producción de compuestos organofluorados[editar]
El uso principal del ácido fluorhídrico está en química organofluorada. Muchos compuestos organofluorados se preparan utilizando HF como fuente de flúor, que incluyen teflón, fluoropolímeros, fluorocarbonos y fluidos refrigerantes como el Freón. Muchos productos farmacéuticos contienen flúor.[3]
Producción de fluoruros inorgánicos[editar]
La mayoría de los compuestos de fluoruro inorgánico de alto volumen se preparan a partir de ácido hidrofluorico. Los más grandes son Na3 ALF6, criolita y Alf3, aluminio trifluoruro. Una mezcla fundida de estos sólidos sirve como un disolvente de alta temperatura para la producción de aluminio metálico. Otros fluoruros inorgánicos preparados a partir de ácido fluorhídrico incluyen fluoruro de sodio y hexafluoruro de uranio.[3]
Agente de grabado, agente de limpieza[editar]

Se usa en la industria de semiconductores como componente importante del grabador Wright y del grabador de óxido tamponado, que se utilizan para limpiar obleas de silicio. De manera similar, también se usa para grabado de vidrio por tratamiento con dióxido de silicio para formar fluoruros de silicio gaseosos o solubles en agua. También se puede usar para pulir vidrio.[5]
Se usa un gel de ácido fluorhídrico del 5% al 9% también comúnmente para grabar las restauraciones dentales de cerámica para mejorar la unión.[19] Por razones similares, el ácido fluorhídrico diluido es un componente de los quitamanchas de óxido domésticos, en lavado de autos en agentes limpiadores de ruedas, y en inhibidores de la oxidación en cerámica y telas.[5][20] por su capacidad para disolver los óxidos de hierro, así como los contaminantes a base de sílice, el ácido fluorhídrico se usa en calderas previas al compromiso que producen vapor de alta presión. El ácido fluorhídrico también es útil para disolver muestras de roca (generalmente en polvo) antes del análisis. De manera similar, este ácido se usa en maceración ácida para extraer fósiles orgánicos de rocas de silicato. La roca fosilífera se puede sumergir directamente en el ácido, o se puede aplicar una película nitrato de celulosa (disuelto en amiloacetato), que se adhiere al componente orgánico y permite que la roca se disuelva a su alrededor.[21]
Refinado de petróleo[editar]
En un proceso estándar de refinería de petróleo conocido como alquilación, isobutano está alquilado con bajo peso molecular alqueno s (principalmente una mezcla de propileno y butileno) en presencia de un ácido catalizador derivado del ácido fluorhídrico. El catalizador protona los alquenos (propileno, butileno) para producir reactivos arbocationales, que alquilan isobutano. La reacción se lleva a cabo a temperaturas suaves (0 y 30 °C) en una reacción en dos fases.
Toxicología[editar]
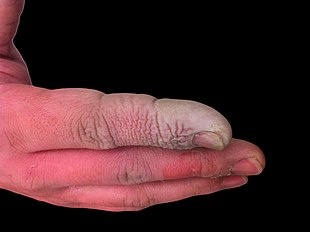
Se trata de una sustancia irritante, corrosiva y tóxica. En la piel produce quemaduras muy dolorosas de difícil curación. Esto se debe a que el calcio necesario en el proceso de curación precipita con los fluoruros como fluoruro de calcio (CaF2). En caso de haberse producido una quemadura con ácido fluorhídrico se recomienda lavar con abundante agua de "Kit de laboratorio", no agua corriente, y tratar como primera medida con un gel de gluconato de calcio (que debe estar disponible en todos los lugares donde haya o se maneje esta sustancia), en su defecto, utilizar una disolución de lactato cálcico o citrato cálcico o, en su defecto, con leche. En caso de aspiración de vapores, se trata de una emergencia médica. Se trata aplicando oxígeno por máscara (se desaconseja otros materiales por irritantes) si el afectado respira, controlando su nivel de consciencia. Llegado el caso, se debe aplicar técnicas de resucitación de la persona afectada, si fuera necesario. En caso de salpicaduras en los ojos, solamente tratar con solución fisiológica estéril en muy abundante cantidad; al igual que la respiración, se desaconseja por irritante sustancias basadas en compuestos cálcicos.
Un elemento que ha resultado muy útil para evitar los efectos adversos de la quemadura química y contrarrestar el efecto de precipitación del calcio, es la solución Hexafluorine, la cual se aconseja tener a mano en laboratorios, junto con los elementos de primeros auxilios y duchas de emergencia.[22]
En absolutamente todos los casos, se debe tratar en forma médica avanzada después de prestar los primeros auxilios.
Datos sobre seguridad[editar]
- DL50: 18 mg/kg.
- Concentración máxima permitida en lugares de trabajo: 2 ppm.
Etiquetado internacional como sustancia peligrosa[editar]
Clase : 8
Número ONU : UN 1790[23]
Tres denominaciones en función de la concentración :
- ácido fluorhídrico con contenido de más de 85 % de fluoruro de hidrógeno;
- ácido fluorhídrico con contenido entre 60 % y 85 % de fluoruro de hidrógeno;
- ácido fluorhídrico con contenido como máximo 60 % de fluoruro de hidrógeno.
Cuando se transporta licuado (anhidro), el código ONU es 1052.
Etiquetado CE 231-634-8.
Referencias[editar]
- ↑ Número CAS
- ↑ INRS, /TI-ND-2122/nd2122. Hoja pdf — PDF.
- ↑ a b c d e f Aigueperse, Jean; Mollard, Paul; Devilliers, Didier; Chemla, Marius; Faron, Robert; Romano, René; Cuer, Jean Pierre (2000). Fluorine Compounds, Inorganic. ISBN 3527306730. doi:10.1002/14356007.a11_307.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. 921. ISBN 978-0-08-022057-4.
- ↑ a b c «CDC – The Emergency Response Safety and Health Database: Systemic Agent: HYDROGEN FLUORIDE/ HYDROFLUORIC ACID – NIOSH». www.cdc.gov. Consultado el 4 de diciembre de 2015.
- ↑ Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. San Diego: Academic Press. p. 425. ISBN 978-0-12-352651-9.
- ↑ Clark, Jim (2002). «The acidity of the hydrogen halides». Consultado el 4 de septiembre de 2011.
- ↑ a b Chambers, C.; Holliday, A. K. (1975). Modern inorganic chemistry (An intermediate text). The Butterworth Group. pp. 328-329. Archivado desde el original el 23 de marzo de 2013.
- ↑ Hannan, Henry J. (2010). Course in chemistry for IIT-JEE 2011. Tata McGraw Hill Education Private Limited. pp. 15-22. ISBN 9780070703360.
- ↑ Ralph H. Petrucci; William S. Harwood; Jeffry D. Madura (2007). General chemistry: principles and modern applications. Pearson/Prentice Hall. p. 691. ISBN 978-0-13-149330-8
- ↑ Hyman, Herbert H.; Kilpatrick, Martin; Katz, Joseph J. (1957). "The Hammett Acidity Function H0 for Hydrofluoric Acid Solutions". Journal of the American Chemical Society. American Chemical Society (ACS). 79 (14): 3668–3671.
- ↑ Jolly, William L. (1991). Modern Inorganic Chemistry. McGraw-Hill. p. 203. ISBN 0-07-032768-8.
- ↑ Cotton, F. A.; Wilkinson, G. (1988). Advanced Inorganic Chemistry (5th ed.). New York: Wiley. p. 109. ISBN 0-471-84997-9.
- ↑ C. E. Housecroft and A. G. Sharpe "Inorganic Chemistry" (Pearson Prentice Hall, 2nd ed. 2005), p. 170.
- ↑ a b Giguère, Paul A.; Turrell, Sylvia (1980). «The nature of hydrofluoric acid. A spectroscopic study of the proton-transfer complex H3O+...F−». J. Am. Chem. Soc. 102 (17): 5473. doi:10.1021/ja00537a008.
- ↑ Radu Iftimie; Vibin Thomas; Sylvain Plessis; Patrick Marchand; Patrick Ayotte (2008). «Spectral Signatures and Molecular Origin of Acid Dissociation Intermediates». J. Am. Chem. Soc. 130 (18): 5901-7. PMID 18386892. doi:10.1021/ja077846o.
- ↑ (Cotton y Wilkinson, 1988, p. 104)
- ↑ Unión Internacional de Química Pura y Aplicada. «Homoassociation». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Craig, Robert (2006). Craig's Restorative Dental Materials. st. Louis, MO: Mosby Elsevier. ISBN 0-323-03606-6. OCLC 68207297. <!- Powers, John M. y Sakaguchi, Ronald L. (2006) Craig's Restorative Dental Materials, 12ª ed., Mosby, ISBN 0323036066 p. 10.5.3->
- ↑ Strachan, John (Enero de 1999). «A deadly rinse: The dangers of hydrofluoric acid (un enjuague mortal: los peligros del ácido fluorhídrico)». Professional Carwashing & Detailing 23 (1). Archivado desde el original el 25 de abril de 2012.
- ↑ Edwards, D. (1982). «Fragmentary non-vascular plant microfossils from the late Silurian of Wales (microfósiles fragmentarios de plantas no vasculares del Silúrico tardío de Gales)». Botanical Journal of the Linnean Society 84 (3): 223-256. doi:10.1111/j.1095-8339.1982.tb00536.x.
- ↑ «Solución HEXAFLUORINE® - PREVOR». Prevor ES. Consultado el 12 de agosto de 2022.
- ↑ https://www.un.org/ecosoc/en/events/2020/committee-experts-transport-dangerous-goods-and-globally-harmonized-system
Enlaces externos[editar]
 Wikcionario tiene definiciones y otra información sobre ácido fluorhídrico.
Wikcionario tiene definiciones y otra información sobre ácido fluorhídrico.- ATSDR en Español - ToxFAQs: flúor, fluoruro de hidrógeno y fluoruros
- Hoja de datos de Seguridad (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Sigma Aldrich: Hydrofluoric acid
- International Chemical Safety Card 0283
- NIOSH Pocket Guide to Chemical Hazards
- "Hydrofluoric Acid Burn", The New England Journal of Medicine—Acid burn case study

