Diferencia entre revisiones de «Serpina»
m Bot: 8 - Estandarizaciones y otras mejoras automatizadas |
Sin resumen de edición |
||
| Línea 1: | Línea 1: | ||
{{featured article}} |
|||
{{Familia de proteínas |
|||
{{Use dmy dates|date=March 2016}} |
|||
{{Pfam_box |
|||
| Symbol = Serpin, SERPIN ([http://www.genenames.org/cgi-bin/genefamilies/ root symbol] of family) |
| Symbol = Serpin, SERPIN ([http://www.genenames.org/cgi-bin/genefamilies/ root symbol] of family) |
||
| Name = |
| Name = Serpin (serine protease inhibitor) |
||
| |
| image = serpin_(stressed).png |
||
| width = |
|||
| caption = A serpin (white) with its 'reactive centre loop' (blue) bound to a [[protease]] (grey). Once the protease attempts [[enzyme catalysis|catalysis]] it will be [[irreversible inhibition|irreversibly inhibited]]. ({{PDB|1K9O}}) |
| caption = A serpin (white) with its 'reactive centre loop' (blue) bound to a [[protease]] (grey). Once the protease attempts [[enzyme catalysis|catalysis]] it will be [[irreversible inhibition|irreversibly inhibited]]. ({{PDB|1K9O}}) |
||
| Pfam= PF00079 |
| Pfam= PF00079 |
||
| InterPro= IPR000215 |
| InterPro= IPR000215 |
||
| SMART= |
|||
| Prosite = PDOC00256 |
| Prosite = PDOC00256 |
||
| SCOP = 1hle |
| SCOP = 1hle |
||
| TCDB = |
|||
| OPM family= |
|||
| OPM protein= |
|||
| CDD = cd00172 |
| CDD = cd00172 |
||
| PDB= |
|||
| PDB= {{PDB3|1m37}}A:1-378 {{PDB3|1hle}}B:349-379 {{PDB3|1jrr}}A:1-415 {{PDB3|1by7}}A:1-415 {{PDB3|1ova}}A:1-385 {{PDB3|1uhg}}A:1-385 {{PDB3|1jti}}B:1-385 {{PDB3|1att}}B:77-433 {{PDB3|1nq9}}L:76-461 {{PDB3|1oyh}}I:76-461 {{PDB3|1e03}}L:76-461 {{PDB3|1e05}}I:76-461 {{PDB3|1br8}}L:76-461 {{PDB3|1r1l}}L:76-461 {{PDB3|1lk6}}L:76-461 {{PDB3|1ant}}L:76-461 {{PDB3|2beh}}L:76-461 {{PDB3|1dzh}}L:76-461 {{PDB3|1ath}}A:78-461 {{PDB3|1tb6}}I:76-461 {{PDB3|2ant}}I:76-461p {{PDB3|1dzg}}I:76-461 {{PDB3|1azx}}L:76-461 {{PDB3|1jvq}}I:76-461 {{PDB3|1sr5}}A:76-461 {{PDB3|1e04}}I:76-461 {{PDB3|1xqg}}A:1-375 {{PDB3|1xu8}}B:1-375 {{PDB3|1wz9}}B:1-375 {{PDB3|1xqj}}A:1-375 {{PDB3|1c8o}}A:1-300 {{PDB3|1m93}}A:1-55 {{PDB3|1f0c}}A:1-305 {{PDB3|1k9o}}I:18-392 {{PDB3|1sek}} :18-369 {{PDB3|1atu}} :45-415 {{PDB3|1ezx}}B:383-415 {{PDB3|8api}}A:43-382 {{PDB3|1qmb}}A:49-376 {{PDB3|1iz2}}A:43-415 {{PDB3|1oo8}}A:43-415 {{PDB3|1d5s}}B:378-415 {{PDB3|7api}}A:44-382 {{PDB3|1qlp}}A:43-415 {{PDB3|1oph}}A:43-415 {{PDB3|1kct}} :44-415 {{PDB3|2d26}}A:43-382 {{PDB3|9api}}B:383-415 {{PDB3|1psi}} :47-415 {{PDB3|1hp7}}A:43-415 {{PDB3|3caa}}A:50-383 {{PDB3|1qmn}}A:43-420 {{PDB3|4caa}}B:390-420 {{PDB3|2ach}}A:47-383 {{PDB3|1as4}}A:48-383 {{PDB3|1yxa}}B:42-417 {{PDB3|1lq8}}F:376-406 {{PDB3|2pai}}B:374-406 {{PDB3|1pai}}B:374-406 {{PDB3|1jmo}}A:119-496 {{PDB3|1jmj}}A:119-496 {{PDB3|1oc0}}A:25-402 {{PDB3|1dvn}}A:25-402 {{PDB3|1b3k}}D:25-402 {{PDB3|1dvm}}D:25-402 {{PDB3|1a7c}}A:25-402 {{PDB3|1c5g}}A:25-402 {{PDB3|1db2}}B:26-402 {{PDB3|9pai}}A:25-402 {{PDB3|1lj5}}A:25-402 {{PDB3|1m6q}}A:138-498 {{PDB3|1jjo}}D:101-361 {{PDB3|1imv}}A:49-415|enlace=no |
|||
{{PDB3|1m37}}A:1-378 {{PDB3|1hle}}B:349-379 {{PDB3|1jrr}}A:1-415 |
|||
{{PDB3|1by7}}A:1-415 {{PDB3|1ova}}A:1-385 {{PDB3|1uhg}}A:1-385 |
|||
{{PDB3|1jti}}B:1-385 {{PDB3|1att}}B:77-433 {{PDB3|1nq9}}L:76-461 |
|||
{{PDB3|1oyh}}I:76-461 {{PDB3|1e03}}L:76-461 {{PDB3|1e05}}I:76-461 |
|||
{{PDB3|1br8}}L:76-461 {{PDB3|1r1l}}L:76-461 {{PDB3|1lk6}}L:76-461 |
|||
{{PDB3|1ant}}L:76-461 {{PDB3|2beh}}L:76-461 {{PDB3|1dzh}}L:76-461 |
|||
{{PDB3|1ath}}A:78-461 {{PDB3|1tb6}}I:76-461 {{PDB3|2ant}}I:76-461p |
|||
{{PDB3|1dzg}}I:76-461 {{PDB3|1azx}}L:76-461 {{PDB3|1jvq}}I:76-461 |
|||
{{PDB3|1sr5}}A:76-461 {{PDB3|1e04}}I:76-461 {{PDB3|1xqg}}A:1-375 |
|||
{{PDB3|1xu8}}B:1-375 {{PDB3|1wz9}}B:1-375 {{PDB3|1xqj}}A:1-375 |
|||
{{PDB3|1c8o}}A:1-300 {{PDB3|1m93}}A:1-55 {{PDB3|1f0c}}A:1-305 |
|||
{{PDB3|1k9o}}I:18-392 {{PDB3|1sek}} :18-369 {{PDB3|1atu}} :45-415 |
|||
{{PDB3|1ezx}}B:383-415 {{PDB3|8api}}A:43-382 {{PDB3|1qmb}}A:49-376 |
|||
{{PDB3|1iz2}}A:43-415 {{PDB3|1oo8}}A:43-415 {{PDB3|1d5s}}B:378-415 |
|||
{{PDB3|7api}}A:44-382 {{PDB3|1qlp}}A:43-415 {{PDB3|1oph}}A:43-415 |
|||
{{PDB3|1kct}} :44-415 {{PDB3|2d26}}A:43-382 {{PDB3|9api}}B:383-415 |
|||
{{PDB3|1psi}} :47-415 {{PDB3|1hp7}}A:43-415 {{PDB3|3caa}}A:50-383 |
|||
{{PDB3|1qmn}}A:43-420 {{PDB3|4caa}}B:390-420 {{PDB3|2ach}}A:47-383 |
|||
{{PDB3|1as4}}A:48-383 {{PDB3|1yxa}}B:42-417 {{PDB3|1lq8}}F:376-406 |
|||
{{PDB3|2pai}}B:374-406 {{PDB3|1pai}}B:374-406 {{PDB3|1jmo}}A:119-496 |
|||
{{PDB3|1jmj}}A:119-496 {{PDB3|1oc0}}A:25-402 {{PDB3|1dvn}}A:25-402 |
|||
{{PDB3|1b3k}}D:25-402 {{PDB3|1dvm}}D:25-402 {{PDB3|1a7c}}A:25-402 |
|||
{{PDB3|1c5g}}A:25-402 {{PDB3|1db2}}B:26-402 {{PDB3|9pai}}A:25-402 |
|||
{{PDB3|1lj5}}A:25-402 {{PDB3|1m6q}}A:138-498 {{PDB3|1jjo}}D:101-361 |
|||
{{PDB3|1imv}}A:49-415 |
|||
}} |
}} |
||
Las '''serpinas''' son un grupo numeroso de [[proteína]]s con estructuras similares identificados inicialmente como capaces de inhibir otras [[enzima]]s del grupo de las [[proteasa]]s. El nombre ''serpina'' deriva de la combinación de '''ser'''ina '''p'''roteasa '''in'''hibidora—en virtud de sus propiedades funcionales.<ref>{{cita publicación|autor=R. Carrell and J. Travis. |año=1985 |título=α1-Antitrypsin and the serpins: Variation and countervariation |revista=Trends Biochem. Sci. |volumen=10 |página=20-24 |doi=10.1016/0968-0004(85)90011-8}}</ref> |
|||
Las '''serpinas''' son una [[Superfamilia (biología)|superfamilia]] de proteínas con estructuras similares quer fueron identificadas primero por su inhibición de [[Peptidasa|proteasa]] y están encontradas en todos los [[Reino (biología)|reinos]].<ref name="Silverman_2001" /> El acrónimo serpina fue establecido porque las primeras serpinas en ser identificadas actuaban como quimotripsina serina proteasa ('''ser'''ina '''p'''roteasa '''in'''hibidora).<ref name="Silverman_2010">{{cite journal | vauthors = Silverman GA, Whisstock JC, Bottomley SP, Huntington JA, Kaiserman D, Luke CJ, Pak SC, Reichhart JM, Bird PI | title = Serpins flex their muscle: I. Putting the clamps on proteolysis in diverse biological systems | journal = The Journal of Biological Chemistry | volume = 285 | issue = 32 | pages = 24299–305 | date = August 2010 | pmid = 20498369 | pmc = 2915665 | doi = 10.1074/jbc.R110.112771 }}</ref><ref name="Whisstock_2010">{{cite journal | vauthors = Whisstock JC, Silverman GA, Bird PI, Bottomley SP, Kaiserman D, Luke CJ, Pak SC, Reichhart JM, Huntington JA | title = Serpins flex their muscle: II. Structural insights into target peptidase recognition, polymerization, and transport functions | journal = The Journal of Biological Chemistry | volume = 285 | issue = 32 | pages = 24307–12 | date = August 2010 | pmid = 20498368 | pmc = 2915666 | doi = 10.1074/jbc.R110.141408 }}</ref> Son notables por su inusual mecanismo de acción, en el cual inhiben de manera irreversible su objetivo, la proteasa al someterse a un gran [[cambio conformacional]] para alterar su [[sitio activo]].<ref name="Gettins_2002">{{cite journal | vauthors = Gettins PG | title = Serpin structure, mechanism, and function | journal = Chemical Reviews | volume = 102 | issue = 12 | pages = 4751–804 | date = December 2002 | pmid = 12475206 | doi = 10.1021/cr010170 }}</ref><ref name="Whisstock_2006" /> Esto contrasta con el mecanismo más común de los inhibidores de proteasa que ses unen y bloqeuan el acceso de la proteasa al sitio activo.<ref name="Whisstock_2006" /><ref name="Law_2006"/> |
|||
La inhibición de proteasa por serpinas controla el arreglo de los procesos biológicos, incluyendo la [[coagulación]] la [[inflamación]] y consecuentemente estas proteínas son el objetivo de [[investigación médica]]..<ref name="Stein_1995">{{cite journal | vauthors = Stein PE, Carrell RW | title = What do dysfunctional serpins tell us about molecular mobility and disease? | journal = Nature Structural Biology | volume = 2 | issue = 2 | pages = 96–113 | date = February 1995 | pmid = 7749926 | doi = 10.1038/nsb0295-96 }}</ref> Su cambio conformacional único también las vuelve de interés a la biología estructural y a la investigación de doblaje de proteínas <ref name="Gettins_2002"/><ref name="Whisstock_2006" /> El mecanismo del cambio conformacional contiene ciertas ventajas, pero también algunas desventajas; las serpinas son vulnerables a [[Mutación|mutaciones]] que pueden resultar en serpinopatías como el doblaje erróneo de las proteínas y la formación de [[Polímero|polímeros]] inactivos de cadenas largas.<ref name="Janciauskiene_2011">{{cite journal | vauthors = Janciauskiene SM, Bals R, Koczulla R, Vogelmeier C, Köhnlein T, Welte T | title = The discovery of α1-antitrypsin and its role in health and disease | journal = Respiratory Medicine | volume = 105 | issue = 8 | pages = 1129–39 | date = August 2011 | pmid = 21367592 | doi = 10.1016/j.rmed.2011.02.002 }}</ref><ref name="Carrell_1997" /> La [[polimerización]] de serpinas no sólo reduce la cantidad de inhibidores activos, pero también conlleva a la acumulación de los polímeros, causando [[muerte celular]] y falla de órganos .<ref name="Stein_1995"/> |
|||
Aunque la mayoría de las serpinas controlan las cascadas proteolíticas, algunas proteínas con estrcutura de serpina no son inhibidores de enzimas, pero realizan diversas funciones como [[almacenamiento]](como en el huevo blanco—ovalbúlima), transporte como en las [[Proteínas de transporte sodio-glucosa|proteínas de transporte]] de hormonas ([[Globulina fijadora de tiroxina]], [[Transcortina|globulina fijadora de cortisol]]) y de proteína chaperona([[HSP47]]).<ref name="Law_2006"/> El término ''serpina'' se usa para decribir a estos miembro también, a pesar de su función no inhibitoria ya que están relacionados evolutivamente.<ref name="Silverman_2001" /> |
|||
== Historia == |
== Historia == |
||
La actividad inihibidora de la preoteasa en el plasma de la sangre fue reportada por primera vez a finales de los 1800,<ref>{{cite journal | last1 = Fermi | first1 = C | last2 = Personsi | first2 = L | name-list-format = vanc | title = Untersuchungen uber die enzyme, Vergleichende Studie | trans-title = Studies on the enzyme, Comparative study | language = German | journal = Z Hyg Infektionskr | date = 1984 | issue = 18 | pages = 83–89 }}</ref> pero no fue hasta los 50 que las serpinas [[antitrombina]] y [[alfa 1-antitripsina]] fueron aisladas.<ref>{{cite journal | last1 = Schultz | first1 = H | last2 = Guilder | first2 = I | last3 = Heide | first3 =K | last4 = Schoenenberger | first4 = M | last5 = Schwick | first5 = G | name-list-format = vanc | title = Zur Kenntnis der alpha-globulin des menschlichen normal serums | trans-title = For knowledge of the alpha - globulin of human normal serums | language = German | journal = Naturforsch | date = 1955 | issue = 10 | page = 463 }}</ref> la investigación inicial se concentraba en su papel en la enfermedad humana: [[Deficiencia de alfa-1 antitripsina|deficiencia de alfa 1-antitripsina]] es uno de los desórdenes genéticos más comunes causando enfisema,<ref name="Janciauskiene_2011"/><ref name="Laurell_2013">{{cite journal | vauthors = Laurell CB, Eriksson S | title = The electrophoretic α1-globulin pattern of serum in α1-antitrypsin deficiency. 1963 | journal = Copd | volume = 10 Suppl 1 | issue = | pages = 3–8 | year = 2013 | pmid = 23527532 | doi = 10.3109/15412555.2013.771956 }}</ref><ref name="de_Serres_2002">{{cite journal | last1 = de Serres | first1 = Frederick J. | name-list-format = vanc | title = Worldwide Racial and Ethnic Distribution of α-Antitrypsin Deficiency | journal = CHEST Journal | date = 1 November 2002 | volume = 122 | issue = 5 | pages = 1818–1829 | doi = 10.1378/chest.122.5.1818 }}</ref> y la deficiencia de antitrombina resulta en [[trombosis]].<ref>{{cite journal | vauthors = Egeberg O | title = Inherited antithrombin deficiency causing thrombophilia | journal = Thrombosis Et Diathesis Haemorrhagica | volume = 13 | pages = 516–30 | date = June 1965 | pmid = 14347873 }}</ref><ref name="Patnaik MM 2516">{{cite journal | vauthors = Patnaik MM, Moll S | title = Inherited antithrombin deficiency: a review | journal = Haemophilia | volume = 14 | issue = 6 | pages = 1229–39 | date = November 2008 | pmid = 19141163 | doi = 10.1111/j.1365-2516.2008.01830.x }}</ref> |
|||
Los primeros miembros de la superfamilia de proteínas serpinas estudiados extensamente fueron las proteínas [[sangre|sanguíneas]] humanas [[antitrombina]] y [[antitripsina]], cuyas funciones inhiben la [[coagulación]] sanguínea y la [[inflamación]], respectivamente. En un principio, las investigaciones relacionadas a estas enzimas se enfocaban en el papel específico que tenían en las enfermedades humanas: la deficiencia de antitrombina resulta en episodios frecuentes de [[trombosis]] y la deficiencia de antitripsina tiende a causar [[enfisema]]. En 1980, los invstigadores Hunt y Dayhoff descubrieron para su sorpresa que ambas [[molécula]]s compartían un número importante de secuencias de [[aminoácido]]s similares a la proteína [[ovoalbúmina]] la principal proteína en la [[clara de huevo]] de [[gallina]]s. De allí su propuesta de que se trataba de una nueva superfamilia de proteínas.<ref>{{cita publicación|autor=Hunt LT, Dayhoff MO |título=A surprising new protein superfamily containing ovalbumin, antithrombin-III, and α1-proteinase inhibitor. |revista=Biochem Biophys Res Commun. |año=1980 |volumen=95 |número=2 |página=864-71 |pmid=6968211}}</ref> |
|||
En los 80, se volvió claro que estos inhibidores eran parte de una superfamilia de proteínas relacionadas entre sí que incluían inhibidores de proteasa ( alfa 1-antitrpsina) y no inhibidores (ovalbúlima).<ref name="Hunt_1980">{{cite journal | vauthors = Hunt LT, Dayhoff MO | title = A surprising new protein superfamily containing ovalbumin, antithrombin-III, and alpha 1-proteinase inhibitor | journal = Biochemical and Biophysical Research Communications | volume = 95 | issue = 2 | pages = 864–71 | date = July 1980 | pmid = 6968211 | doi = 10.1016/0006-291X(80)90867-0 }}</ref> Durante el mismo periodo de tiempo, las primeras estructuras de la serpina fueron estudiadas (primero en su conformación relajada, después en la estresada).<ref name="Huber_1984">{{cite journal | vauthors = Loebermann H, Tokuoka R, Deisenhofer J, Huber R | title = Human alpha 1-proteinase inhibitor. Crystal structure analysis of two crystal modifications, molecular model and preliminary analysis of the implications for function | journal = Journal of Molecular Biology | volume = 177 | issue = 3 | pages = 531–57 | date = August 1984 | pmid = 6332197 | doi = 10.1016/0022-2836(84)90298-5 }}</ref><ref name="Stein_1990">{{cite journal | vauthors = Stein PE, Leslie AG, Finch JT, Turnell WG, McLaughlin PJ, Carrell RW | title = Crystal structure of ovalbumin as a model for the reactive centre of serpins | journal = Nature | volume = 347 | issue = 6288 | pages = 99–102 | date = September 1990 | pmid = 2395463 | doi = 10.1038/347099a0 }}</ref>La estructuras indicaban que el mecanismo inhibidor involucraba un cambio conformacional inusual y promovía el siguiente punto de enfoque estructural en los estudios de la serpina.<ref name="Whisstock_2006">{{cite journal | vauthors = Whisstock JC, Bottomley SP | title = Molecular gymnastics: serpin structure, folding and misfolding | journal = Current Opinion in Structural Biology | volume = 16 | issue = 6 | pages = 761–8 | date = December 2006 | pmid = 17079131 | doi = 10.1016/j.sbi.2006.10.005 }}</ref><ref name="Stein_1990"/> |
|||
Más de 1000 serpinas han sido ahora identificadas incluyendo, 36 proteínas humanas, además de moléculas en todos los reinos.<ref name="Irving_2000"/><ref name="Irving_2002"/><ref name="Steenbakkers_2008">{{cite journal | vauthors = Steenbakkers PJ, Irving JA, Harhangi HR, Swinkels WJ, Akhmanova A, Dijkerman R, Jetten MS, van der Drift C, Whisstock JC, Op den Camp HJ | title = A serpin in the cellulosome of the anaerobic fungus Piromyces sp. strain E2 | journal = Mycological Research | volume = 112 | issue = Pt 8 | pages = 999–1006 | date = August 2008 | pmid = 18539447 | doi = 10.1016/j.mycres.2008.01.021 }}</ref> En los 2000, una nomenclatura sistemática fue introducida para categorizar miembros de la superfamilia de serpinas basado en sus relaciones evolutivas.<ref name="Silverman_2001">{{cite journal | vauthors = Silverman GA, Bird PI, Carrell RW, Church FC, Coughlin PB, Gettins PG, Irving JA, Lomas DA, Luke CJ, Moyer RW, Pemberton PA, Remold-O'Donnell E, Salvesen GS, Travis J, Whisstock JC | title = The serpins are an expanding superfamily of structurally similar but functionally diverse proteins. Evolution, mechanism of inhibition, novel functions, and a revised nomenclature | journal = The Journal of Biological Chemistry | volume = 276 | issue = 36 | pages = 33293–6 | date = September 2001 | pmid = 11435447 | doi = 10.1074/jbc.R100016200 }}</ref> Las serpinas son, por lo tanto, la superfamilia más frande y deviersa de inhibidores de proteasa.<ref name="Rawlings_2004">{{cite journal | vauthors = Rawlings ND, Tolle DP, Barrett AJ | title = Evolutionary families of peptidase inhibitors | journal = The Biochemical Journal | volume = 378 | issue = Pt 3 | pages = 705–16 | date = March 2004 | pmid = 14705960 | pmc = 1224039 | doi = 10.1042/BJ20031825 }}</ref> |
|||
== Bioquímica == |
== Bioquímica == |
||
Se han identificado más de 1000 serpinas, incluyendo 36 proteínas humanas, así como moléculas de [[planta]]s (como la ''[[Arabidopsis thaliana]]''), [[bacteria]]s (entre ellos los [[Clostridium]]), [[parásito]]s (como la [[nematoda]] ''[[Caenorhabditis elegans]]''), [[archaea]] y ciertos [[Poxviridae|virus]].<ref name="irving2000">{{cita publicación| autor=Irving JA, Pike RN, Lesk AM, Whisstock. |título=Phylogeny of the Serpin Superfamily: Implications of Patterns of Amino Acid Conservation for Structure and Function.|revista=Genome Res. |volumen=10 |páginas=1845-64 |año=2000 |pmid=11116082}}</ref><ref name="irving2002" /> Las serpinas constituyen la familia de inhibidores de proteasas más numera y diversa.<ref name="rawlings">{{cita publicación|autor=Rawlings ND, Tolle DP, Barrett AJ. |título=Evolutionary families of peptidase inhibitors. |revista=Biochem J. |año=2004 |volumen=378 |página=705-16. |pmid=14705960}}</ref> |
Se han identificado más de 1000 serpinas, incluyendo 36 proteínas humanas, así como moléculas de [[planta]]s (como la ''[[Arabidopsis thaliana]]''), [[bacteria]]s (entre ellos los [[Clostridium]]), [[parásito]]s (como la [[nematoda]] ''[[Caenorhabditis elegans]]''), [[archaea]] y ciertos [[Poxviridae|virus]].<ref name="irving2000">{{cita publicación| autor=Irving JA, Pike RN, Lesk AM, Whisstock. |título=Phylogeny of the Serpin Superfamily: Implications of Patterns of Amino Acid Conservation for Structure and Function.|revista=Genome Res. |volumen=10 |páginas=1845-64 |año=2000 |pmid=11116082}}</ref><ref name="irving2002" /> Las serpinas constituyen la familia de inhibidores de proteasas más numera y diversa.<ref name="rawlings">{{cita publicación|autor=Rawlings ND, Tolle DP, Barrett AJ. |título=Evolutionary families of peptidase inhibitors. |revista=Biochem J. |año=2004 |volumen=378 |página=705-16. |pmid=14705960}}</ref> |
||
== |
== Actividad == |
||
[[File:Serpin and protease.png|thumb|Una [[proteasa]] (gris) se une a un loop de centro reactivo de una serpina (RCL, azul). Cuando la tríada catalítica de la proteasa (roja) separa el RCL, se queda atrapada en una conformación inactiva.. ({{PDB|1K9O}})|alt=Diagram of a serpin and protease]] |
|||
La mayoría de las serpinas son inhibidores de proteasa, siendo su objetivo las proteasas de serina como quimotripsina. Estas proteasas poseen un reisduo de una [[serina]] [[Nucleófilo|nucleofílica]]Men una [[tríada catalítica]]. Algunos ejemplos, incluyen [[trombina]], [[tripsina]] y las elastas de nuetrófilos humanos.<ref>{{cite journal | vauthors = Barrett AJ, Rawlings ND | title = Families and clans of serine peptidases | journal = Archives of Biochemistry and Biophysics | volume = 318 | issue = 2 | pages = 247–50 | date = April 1995 | pmid = 7733651 | doi = 10.1006/abbi.1995.1227 }}</ref> Las serpinas actúan como inhibidores irreversibles y suicidas al atrapar un intermediario del mecanismo catalítico de la proteasa.<ref name="Huntington_2000">{{cite journal | vauthors = Huntington JA, Read RJ, Carrell RW | title = Structure of a serpin-protease complex shows inhibition by deformation | journal = Nature | volume = 407 | issue = 6806 | pages = 923–6 | date = October 2000 | pmid = 11057674 | doi = 10.1038/35038119 }}</ref> |
|||
Algunas serpinas inhiben otra clase de proteasas, normalmente proteasas de cisteína y se le conoce como inhibidores de clase cruzada. Estas enzimas difieren de la serinaproteasas en que una cisteína nucleofílica en lugar de una serina en su sitio activo.<ref>{{cite journal | vauthors = Barrett AJ, Rawlings ND | title = Evolutionary lines of cysteine peptidases | journal = Biological Chemistry | volume = 382 | issue = 5 | pages = 727–33 | date = May 2001 | pmid = 11517925 | doi = 10.1515/BC.2001.088 }}</ref> No obastante, la química enzimática es el mismo para las dos clases de proteasa.<ref>{{cite journal | vauthors = Irving JA, Pike RN, Dai W, Brömme D, Worrall DM, Silverman GA, Coetzer TH, Dennison C, Bottomley SP, Whisstock JC | title = Evidence that serpin architecture intrinsically supports papain-like cysteine protease inhibition: engineering alpha(1)-antitrypsin to inhibit cathepsin proteases | journal = Biochemistry | volume = 41 | issue = 15 | pages = 4998–5004 | date = April 2002 | pmid = 11939796 | doi = 10.1021/bi0159985 }}</ref> Ejemplos de serpinas inhibidoras de clase cruzada incluyen la serpina B4, un antigen 1 de carcinomas de células escamosas(SCCA-1) y la serpina aviar, una proteína de etapa específica, mieloide y eritoride de terminación nuclear.<ref name="Schick_1998">{{cite journal | vauthors = Schick C, Brömme D, Bartuski AJ, Uemura Y, Schechter NM, Silverman GA | title = The reactive site loop of the serpin SCCA1 is essential for cysteine proteinase inhibition | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 95 | issue = 23 | pages = 13465–70 | date = November 1998 | pmid = 9811823 | pmc = 24842 | doi = 10.1073/pnas.95.23.13465 }}</ref><ref name="McGowan_2006">{{cite journal | vauthors = McGowan S, Buckle AM, Irving JA, Ong PC, Bashtannyk-Puhalovich TA, Kan WT, Henderson KN, Bulynko YA, Popova EY, Smith AI, Bottomley SP, Rossjohn J, Grigoryev SA, Pike RN, Whisstock JC | title = X-ray crystal structure of MENT: evidence for functional loop-sheet polymers in chromatin condensation | journal = The EMBO Journal | volume = 25 | issue = 13 | pages = 3144–55 | date = July 2006 | pmid = 16810322 | pmc = 1500978 | doi = 10.1038/sj.emboj.7601201 }}</ref><ref>{{cite journal | vauthors = Ong PC, McGowan S, Pearce MC, Irving JA, Kan WT, Grigoryev SA, Turk B, Silverman GA, Brix K, Bottomley SP, Whisstock JC, Pike RN | title = DNA accelerates the inhibition of human cathepsin V by serpins | journal = The Journal of Biological Chemistry | volume = 282 | issue = 51 | pages = 36980–6 | date = December 2007 | pmid = 17923478 | doi = 10.1074/jbc.M706991200 }}</ref> |
|||
==Función biológica y ubicación == |
|||
=== Funciones === |
|||
La mayoría de las serpinas controlan por inhibición cascadas [[proteólisis|proteolíticas]] catalizadas por enzimas proteasas de la familia de las [[quimotripsina]]s, mientras que otras no son inhibitorias de otras enzimas sino que realizan funciones variadas, tales como almacenamiento (es el caso de la ovoalbumina), proteínas de transporte [[hormona]]l ([[globulina fijadora de tiroxina]], [[globulina fijadora de cortisol]]), [[Gen supresor tumoral|genes supresores tumorales]] (como la [[maspina]]), regulación de la [[tensión arterial]] y desarrollo de [[linfocito B|linfocitos B]], entre muchas otras.<ref>KORIN, Jorge. Antithrombin: 25 years later: A tribute to a long lasting source of knowledge in Hemostasis. Acta Bioquím. Clín. Latinoam. [online]. Jul./Sept. 2006, vol.40, no.3 [cited 19 March 2008], p.299-305. Available from World Wide Web: [http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-29572006000300004&lng=en&nrm=iso]. ISSN 0325-2957.</ref> Se emplea el término serpina para estas enzimas no inhibitorias, a pesar de su contradictoria función.<ref name="silverman">{{cita publicación|autor=Silverman GA, Bird PI, Carrell RW, Church FC, Coughlin PB, Gettins PG, Irving JA, Lomas DA, Luke CJ, Moyer RW, Pemberton PA, Remold-O'Donnell E, Salvesen GS, Travis J, Whisstock JC. |título='The serpins are an expanding superfamily of structurally similar but functionally diverse proteins. Evolution, mechanism of inhibition, novel functions, and a revised nomenclature. |revista= J Biol Chem |volumen=276 |página=33293-6 |año=2001 |pmid=11435447}}</ref> |
La mayoría de las serpinas controlan por inhibición cascadas [[proteólisis|proteolíticas]] catalizadas por enzimas proteasas de la familia de las [[quimotripsina]]s, mientras que otras no son inhibitorias de otras enzimas sino que realizan funciones variadas, tales como almacenamiento (es el caso de la ovoalbumina), proteínas de transporte [[hormona]]l ([[globulina fijadora de tiroxina]], [[globulina fijadora de cortisol]]), [[Gen supresor tumoral|genes supresores tumorales]] (como la [[maspina]]), regulación de la [[tensión arterial]] y desarrollo de [[linfocito B|linfocitos B]], entre muchas otras.<ref>KORIN, Jorge. Antithrombin: 25 years later: A tribute to a long lasting source of knowledge in Hemostasis. Acta Bioquím. Clín. Latinoam. [online]. Jul./Sept. 2006, vol.40, no.3 [cited 19 March 2008], p.299-305. Available from World Wide Web: [http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-29572006000300004&lng=en&nrm=iso]. ISSN 0325-2957.</ref> Se emplea el término serpina para estas enzimas no inhibitorias, a pesar de su contradictoria función.<ref name="silverman">{{cita publicación|autor=Silverman GA, Bird PI, Carrell RW, Church FC, Coughlin PB, Gettins PG, Irving JA, Lomas DA, Luke CJ, Moyer RW, Pemberton PA, Remold-O'Donnell E, Salvesen GS, Travis J, Whisstock JC. |título='The serpins are an expanding superfamily of structurally similar but functionally diverse proteins. Evolution, mechanism of inhibition, novel functions, and a revised nomenclature. |revista= J Biol Chem |volumen=276 |página=33293-6 |año=2001 |pmid=11435447}}</ref> |
||
== Evolución == |
|||
=== Inhibición de la proteasa === |
|||
Se cree que las serpinas esran moléculas inicialmente restringidas a organismos [[Eukaryota|eucariota]]s, pero se han descubierto un número de ellas entre las bacterias y archaea.<ref name="irving2000" /><ref name="irving2002">{{cita publicación|autor=Irving J, Steenbakkers P, Lesk A, Op den Camp H, Pike R, Whisstock J |título=Serpins in prokaryotes |revista=Mol Biol Evol |volumen=19 |número=11 |páginas=1881-90 |año=2002 |pmid=12411597}}</ref><ref>{{cita publicación|autor=Cabrita LD, Irving JA, Pearce MC, Whisstock JC, Bottomley SP. |título=Aeropin from the extremophile Pyrobaculum aerophilum bypasses the serpin misfolding trap. |revista=J Biol Chem. |año=2007 |pmid= 17635906}}</ref> Permanece aún no esclarecido si los genes respectivos de los [[procariota]]s son descendientes de serpinas ancestrales de entre los mismos procariotas o si son producto del cambio genético lateral entre diversos organismos sin descendencia evolutiva.<ref name="rawlings" /> |
|||
Aproximadamente dos tercios de las serpinas humanas realizan roles extracelulares, inhibiendo proteaseas en el flujo sanguíneo para modular sus actividades. Por ejemplo las serpinas extracelulares regulan las cascadas proteícas esenciales para la coagulación de la sangre (antitrombina), las respuestas [[Respuesta inmune|inmune]] e [[Inflamación|inflamatoria]] (antitripsina, antiquimotripsina y el inhibidor C1) y remodelación de tejido [[Plasminogen activator inhibitor-1|(PAI-1)]].<ref name="Law_2006"/> Al inhibir las proteasas de señalización de cascada, sólo pueden afectar el desarrollo. La tabla de serpinas humanas (abajo) proporciona ejemplos del rango de funciones realizadas por las serpinas humanas al igual que algunas de las enfermedades que resultan de la deficiencia de serpinas.<ref name="Acosta 1146–1158">{{cite journal | vauthors = Acosta H, Iliev D, Grahn TH, Gouignard N, Maccarana M, Griesbach J, Herzmann S, Sagha M, Climent M, Pera EM | title = The serpin PN1 is a feedback regulator of FGF signaling in germ layer and primary axis formation | journal = Development | volume = 142 | issue = 6 | pages = 1146–58 | date = March 2015 | pmid = 25758225 | doi = 10.1242/dev.113886 }}</ref><ref name="Hashimoto 945–950">{{cite journal | vauthors = Hashimoto C, Kim DR, Weiss LA, Miller JW, Morisato D | title = Spatial regulation of developmental signaling by a serpin | journal = Developmental Cell | volume = 5 | issue = 6 | pages = 945–50 | date = December 2003 | pmid = 14667416 | doi = 10.1016/S1534-5807(03)00338-1 }}</ref> . |
|||
Las proteasas objetivo, de las serpinas inhibiidoras intracelulares han sido díficles de identificar ya que varias de estas moléculas parecen realizar tareas que se superponen. Además muchas serpinas humanas carecen de los equivalentes funcionales precisos en organismos modelos como el ratón. Sin embargo, una función importante de las sperinas intracelulares puede ser proteger de la actividad inapropiada de las proteasas dentro de la célula.<ref>{{cite journal | vauthors = Bird PI | title = Regulation of pro-apoptotic leucocyte granule serine proteinases by intracellular serpins | journal = Immunology and Cell Biology | volume = 77 | issue = 1 | pages = 47–57 | date = February 1999 | pmid = 10101686 | doi = 10.1046/j.1440-1711.1999.00787.x }}</ref> Por ejemplo, uno de las serpinas mejor caracterizadas es la serpina B9, que inhibe la proteasa de gránulo citotóxico, granzima B. Al hacerlo, la serpina B9 puede proteger contra la liberación inadvertida de granzima B y la actiación premtaura o no deseada de los mecanismos de [[muerte celular]].<ref>{{cite journal | vauthors = Bird CH, Sutton VR, Sun J, Hirst CE, Novak A, Kumar S, Trapani JA, Bird PI | title = Selective regulation of apoptosis: the cytotoxic lymphocyte serpin proteinase inhibitor 9 protects against granzyme B-mediated apoptosis without perturbing the Fas cell death pathway | journal = Molecular and Cellular Biology | volume = 18 | issue = 11 | pages = 6387–98 | date = November 1998 | pmid = 9774654 | doi = 10.1128/mcb.18.11.6387 }}</ref> |
|||
Algunos [[virus]] usan serpinas para interrumpir las funciones de las proteasas en su huésped.La serpina viral de la viruela de las vacas CrmA se usa para evitar respuestas inflamatorias y apoptoticas de las células huéspedes infectadas.La CrmA aumenta la infección al suprimir la respuesta inflamatoria del huésped a través de la inhibicónde [[Interleukin 1 family|IL-1]] y el procesamiento de [[Interleukin 18|L-18]] por la proteasa de cisteína [[caspasa]]-1 .<ref>{{cite journal | vauthors = Ray CA, Black RA, Kronheim SR, Greenstreet TA, Sleath PR, Salvesen GS, Pickup DJ | title = Viral inhibition of inflammation: cowpox virus encodes an inhibitor of the interleukin-1 beta converting enzyme | journal = Cell | volume = 69 | issue = 4 | pages = 597–604 | date = May 1992 | pmid = 1339309 | doi = 10.1016/0092-8674(92)90223-Y }}</ref> En eucariontes una serpina de planta inhibe metacaspasas y una proteasa de cisteína como papaína<ref name="Vercammen_2006">{{cite journal | vauthors = Vercammen D, Belenghi B, van de Cotte B, Beunens T, Gavigan JA, De Rycke R, Brackenier A, Inzé D, Harris JL, Van Breusegem F | title = Serpin1 of Arabidopsis thaliana is a suicide inhibitor for metacaspase 9 | journal = Journal of Molecular Biology | volume = 364 | issue = 4 | pages = 625–36 | date = December 2006 | pmid = 17028019 | doi = 10.1016/j.jmb.2006.09.010 }}</ref><ref name="Lampl_2010">{{cite journal | vauthors = Lampl N, Budai-Hadrian O, Davydov O, Joss TV, Harrop SJ, Curmi PM, Roberts TH, Fluhr R | title = Arabidopsis AtSerpin1, crystal structure and in vivo interaction with its target protease responsive to desiccation (RD21) | journal = The Journal of Biological Chemistry | volume = 285 | issue = 18 | pages = 13550–60 | date = April 2010 | pmid = 20181955 | pmc = 2859516 | doi = 10.1074/jbc.M109.095075 }}</ref> |
|||
=== Roles no-inhibitorios === |
|||
Las serpinas extracelulares no inhibitorias también realizan un gran conjunto de roles importantes La [[globulina fijadora de tiroxina]] y la [[transcortina]] transportan las hormonas [[tiroxina]] y [[cortisol]] respectivamente.<ref name="cbg">{{cite journal | vauthors = Klieber MA, Underhill C, Hammond GL, Muller YA | title = Corticosteroid-binding globulin, a structural basis for steroid transport and proteinase-triggered release | journal = The Journal of Biological Chemistry | volume = 282 | issue = 40 | pages = 29594–603 | date = October 2007 | pmid = 17644521 | doi = 10.1074/jbc.M705014200 }}</ref><ref name="Zhou_2006"/> La serpina de ovalbúlmina, no inhibitoria es la proteína más abundante de el huevo blanco. Su función exacta no se conoce, pero se cree que es una proteína de almacenamiento para fetos en desarrollo.<ref>{{cite journal | vauthors = Huntington JA, Stein PE | title = Structure and properties of ovalbumin | journal = Journal of Chromatography. B, Biomedical Sciences and Applications | volume = 756 | issue = 1-2 | pages = 189–98 | date = May 2001 | pmid = 11419711 | doi = 10.1016/S0378-4347(01)00108-6 }}</ref> La serpina de choque térmico 47 es una chaperona, esencial para del doblaje apropiado del [[colágeno]].Actúa estabilizando la triple hélice del colágeno mientras está siendo procesada en el [[retículo endoplasmático]].<ref name="Mala_2010">{{cite journal | vauthors = Mala JG, Rose C | title = Interactions of heat shock protein 47 with collagen and the stress response: an unconventional chaperone model? | journal = Life Sciences | volume = 87 | issue = 19-22 | pages = 579–86 | date = November 2010 | pmid = 20888348 | doi = 10.1016/j.lfs.2010.09.024 }}</ref> |
|||
Algunas serpinas son tanto inhibidoras de proteasas y realizan otras tareas. Por ejemplo, el inhibidor nuclear de proteasas de cisteina [[myeloid and erythroid nuclear termination stage specific protein|MENT]], en pájaros también actúa como una molécula remodeladora de cromatina en las células rojas de un ave.<ref name="McGowan_2006"/><ref>{{cite journal | vauthors = Grigoryev SA, Bednar J, Woodcock CL | title = MENT, a heterochromatin protein that mediates higher order chromatin folding, is a new serpin family member | journal = The Journal of Biological Chemistry | volume = 274 | issue = 9 | pages = 5626–36 | date = February 1999 | pmid = 10026180 | doi = 10.1074/jbc.274.9.5626 }}</ref> |
|||
==Structure== |
|||
[[Image:Serpin_equilibrium.png|thumb|450px|El estado nativo de las serpinas es un equlibrio entre un estado completamente estresado (izquierda) y un estado parcialmente relajado (derecho). Las cinco hebras de plegadas-A (azul claro) contienen dos regiones funcionalmente importante para el mecanismo de la serpina, la brecha y el shutter. El loop de centro reactivo (RCL, azul) existe en un equilibrio dinámico entre la conformación completamente expuesta (izquierda) y una conformación donde está parcialmente insertado en la brecha de la plegada-A (derecha).({{PDB|1QLP|1YXA}})<ref>{{cite journal | vauthors = Elliott PR, Lomas DA, Carrell RW, Abrahams JP | title = Inhibitory conformation of the reactive loop of alpha 1-antitrypsin | journal = Nature Structural Biology | volume = 3 | issue = 8 | pages = 676–81 | date = August 1996 | pmid = 8756325 | doi = 10.1038/nsb0896-676 }}</ref><ref name="Horvath_2005">{{cite journal | vauthors = Horvath AJ, Irving JA, Rossjohn J, Law RH, Bottomley SP, Quinsey NS, Pike RN, Coughlin PB, Whisstock JC | title = The murine orthologue of human antichymotrypsin: a structural paradigm for clade A3 serpins | journal = The Journal of Biological Chemistry | volume = 280 | issue = 52 | pages = 43168–78 | date = December 2005 | pmid = 16141197 | doi = 10.1074/jbc.M505598200 }}</ref>|alt=Diagram of serpin states]] |
|||
Todas las serpinas comparten una estructura en común, a pesar de sus variadas funciones. Todas tienen típicamente 3 β-plegadas (llamada A, B y C) y ocho o nueve α-helices (llamada hA–hI).<ref name="Huber_1984" /><ref name="Stein_1990"/> Las regiones más significantes para la función de la serpina son la plegada-A y su loop de centro reactivo(RCL). La plegada-a incluye dos hebras-β que están en orientación paralela con una aregión entre ellas llamada 'shutter', y una región arriba llamada 'brecha'. El RCL forma la interacción inicial con la proteasa como objetivo en moléculas inhibidoras. Se han descifrado estructuras mostrando el RCL ya sea totalmente expuesto o parcialmente insertado en la plegada-A, y se piensa que las serpinas están en equilibrio dinámico entre estos dos estados.<ref name="Whisstock_2006" /> El RCL también hace interacciones temporales con el resto de la estructura y es por lo tanto sumamente flexible y es expuesto al solvente.<ref name="Whisstock_2006" /> |
|||
Las estructuras de serpinas que han sido determinadas, cubren varios tipos diferentes de conformaciones, que han sido necesarias para el entendimiento de su mecanismo de acción de múltiples pasos.La [[biología estructural]] ha jugado un papel centrar en el entendimiento de la función y biología de las serpinas.<ref name="Whisstock_2006"/> |
|||
==Cambio conformacional y mecanismo inhibitorio== |
|||
Las serpinas inhibitorias no inhiben a su objetivo, las proteasas por el típico mecanismo competitivo (candado y llave) usado por la mayoría de los inhibidores de proteasa pequeños ( [[Kunitz-type protease inhibitor|Kunitz-type inhibitor]]s). En lugar de eso, las serpinas usan un cambio conformacional inusual, el cual altera la estructura de la proteasa y previene que complete la catálisis. El cambio conformacional incluye que el RCL se mueva al extremo contrario de la proteína e insertando una β-plegada A, formando una hebra-β extra antiparalela. Esto convierte a la serpinas de un estado estresado a un estado relajado de baja energía(transición de S a R).<ref name="Gettins_2002"/><ref name="Whisstock_2006"/><ref>{{cite journal | vauthors = Whisstock JC, Skinner R, Carrell RW, Lesk AM | title = Conformational changes in serpins: I. The native and cleaved conformations of alpha(1)-antitrypsin | journal = Journal of Molecular Biology | volume = 296 | issue = 2 | pages = 685–99 | date = February 2000 | pmid = 10669617 | doi = 10.1006/jmbi.1999.3520 }}</ref> |
|||
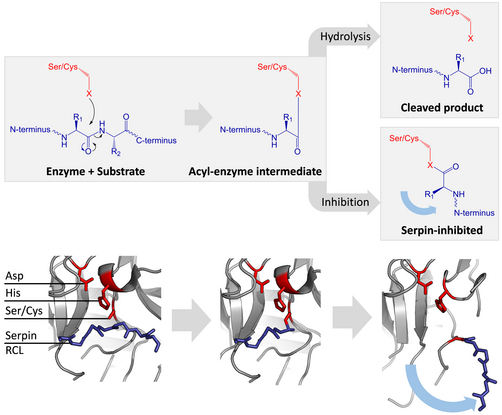
La serina y las proteasas de cisteína catalizan el rompimiento de un enlace peptídico por un proceso de dos pasos. Inicialmente, los residuos catalíticos de la sitio activo de lla tríada realiza un ataque nucleofílico en el enlace peptídico del sustrato. Esto libera las nuevas terminales-N y forma un enlace de éster covalente entre la enzima y el sustrato.<ref name="Gettins_2002"/> Este complejo covalente entre la enzima y el sustrato se llama un intermediario acil-enzima. Para sustratos estándares, el puente de éster es hidrolizado y una nueva terminal-C se libera para completar la catálisis. Sin embargo, cuando una serpina es separada por una proteasa, rápidamente atraviesa una transición de S a R antes de que el intermediario acil-enzima sea hidrolizado.<ref name="Gettins_2002"/> La eficiencia de la inhibición depende del hecho que la velocidad cinética relativa del cambio conformacional sea varios ordénes de magnitud más rápida que la hidrólisis de la proteasa. |
|||
Ya que el RCL está atado todavia covalentemente a la proteasa por el enlace de éster, la transición de S a R, toma a la proteasa de la cima al fondo de la serpina y distorsiona la tríada catalítica.La proteasa distorsionada solo puede hidrolizar el intermediarios acil-anzima extremadamente despacio, y entonces la proteasa permanece covalentemente unida desde días hasta semanas.<ref name="Huntington_2000" /> Las serpinas se clasifican como inhibidores irreversibles y como inhibidores suicidas ya que cada proteína de serpina inactiva permanentemente una sola proteasa y sólo puede funcionar una vez..<ref name="Gettins_2002" /> |
|||
{{multiple image |
|||
| align = center |
|||
| width1 = 400 |
|||
| image1 = Serpin mechanism (S to R).png |
|||
| caption1 = El mecanismo inhibitorio de las serpinas requiere un gran [[cambio conformacional]] (transición de S a R). La serpina (blanca) primero se une a la proteasa (gris) con el loop de centro reactivo expuesto (azul). Cuando este loop es separado por la proteasa, rápidamente se inserta en la plegada- A (azul claro), deformando e inhibiendo la proteasa.({{PDB|1K9O|1EZX}}) |
|||
| alt1 = Conformational change diagram |
|||
| width2 = 502 |
|||
| image2 = Serpin mechanism.png |
|||
| caption2 = [[Proteasa de Serina|Serina]] y [[proteasas de cisteína]] operan con un mecanismo catalítico de dos pasos.Primero, el sutrato (azul) es atacado nucelofílicamente por la cisteína o la serina de la tríada catalítica (roja) para formar el intermediario acil-enzima. Para sustratos típicos, el intermediario hidrolizado con agua. Sin embargo, cuando el loop ce centro reactivo (RCL) de una serpina es atacado, el cambio conformacional (flecha azul) quita la tríada catalítica de su posición previniendo que complete la catálisis. (Based on {{PDB|1K9O|1EZX}}) |
|||
| alt2 = Serpin mechanism diagram |
|||
}} |
|||
===Activación alostérica=== |
|||
[[File:Serpin activation by heparin (unannotated).png|thumb|600px|Algunas serpinas se activan por cofactores. La serpina antitrombina tiene un RCL (azul) donde la arginina P1 (líneas azules) apuntan hacia adentro, previniendo la unión de las proteasas. La unión de la heparina (lineas verdes) causan que el residuo de la arginina P1 se voltee a una posición expuesta. La proteasa objetivo (gris) entonces se une tanto a la arginina P1 como a la heparina. La serpina entonces se activa y la herparina es liberada. ({{PDB|2ANT|1TB6|1EZX}})|alt= Diagram of serpin activation by heparin]] |
|||
La movilidad conformacional de las serpinas proporciona una ventaja clave sobre los inhibidores de proteasa de candado y llave.<ref name="Huntington_2006"/> En particular, la función de serpinas inhibitorias puede ser regulada por interacciones alostéricas con los factores específicos. Las estructuras cristalinas en rayos X de la [[Antitrombina|antitrombina,]] el cofacto herapina II, MENT y la antiquimotripsina revelan que estas serpinas adopatan una conformación cuando en los primeros dos aminoácidos del RCL, están insertadas las β-plegadas A. La conformación parcialmente insertada es importante porque los cofactores pueden cambiar conformacionalmente ciertas serpinas inseertadas parcialmente en una forma comletamente expulsada.<ref>{{cite journal | vauthors = Jin L, Abrahams JP, Skinner R, Petitou M, Pike RN, Carrell RW | title = The anticoagulant activation of antithrombin by heparin | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 94 | issue = 26 | pages = 14683–8 | date = December 1997 | pmid = 9405673 | pmc = 25092 | doi = 10.1073/pnas.94.26.14683 }}</ref><ref>{{cite journal | vauthors = Whisstock JC, Pike RN, Jin L, Skinner R, Pei XY, Carrell RW, Lesk AM | title = Conformational changes in serpins: II. The mechanism of activation of antithrombin by heparin | journal = Journal of Molecular Biology | volume = 301 | issue = 5 | pages = 1287–305 | date = September 2000 | pmid = 10966821 | doi = 10.1006/jmbi.2000.3982 }}</ref> Este arreglo confromacional hace a la serpina un inhibidor más eficiente. |
|||
El ejemplo arquetípico de esta situación es la antitrombina, que circula en el plasma en un estado relativamente inactivo al estar parcialmente insertado. xample of this situation is antithrombin, which circulates in plasma in a partially inserted relatively inactive state. Lo primero que se determina es que el residuo (de arginina P1) apunta hacia el cuerpo de la serpina y no está disponible para la proteasa. Después de unirse, una secuencia de pentasacáridos de gran afinidad en una cadena larga de heparina, la antitrombina sufre un cambio conformacional, la expulsión del RCL, y la exposición de la arginina P1. La heparina de pentasacáridos de antitrombina es, entonces un inhibidor más eficiente de la trombina y factor Xa.<ref>{{cite journal | vauthors = Li W, Johnson DJ, Esmon CT, Huntington JA | title = Structure of the antithrombin-thrombin-heparin ternary complex reveals the antithrombotic mechanism of heparin | journal = Nature Structural & Molecular Biology | volume = 11 | issue = 9 | pages = 857–62 | date = September 2004 | pmid = 15311269 | doi = 10.1038/nsmb811 }}</ref><ref>{{cite journal | vauthors = Johnson DJ, Li W, Adams TE, Huntington JA | title = Antithrombin-S195A factor Xa-heparin structure reveals the allosteric mechanism of antithrombin activation | journal = The EMBO Journal | volume = 25 | issue = 9 | pages = 2029–37 | date = May 2006 | pmid = 16619025 | pmc = 1456925 | doi = 10.1038/sj.emboj.7601089 }}</ref> Además, las proteasas de coagulación también contienen sitio de unión (llamados exositios) para la heparina. La heparina, por lo tanto, también actúa como un templados para la unión de ambas, la proteasa y la serpina, acelerando dramáticamente la interacción entre las dos entidades. Ddespués de la interacción inicial, el complejo final de la serpina se forma y la mitad de la heparina se libera. Esta interacción es fisiológicamente importante. Por ejemplo después de una herida a la pared de los vasos sanguíneos, la heparina es expuesta y la antitrombina se activa para controlar la respuesta de coagulación. Entender la base molecular de esta interacción permite el desarrollo de [[Fondaparinux]], una forma sintética de heparina pentasacárida usada como un fármaco anticoagulante..<ref>{{cite journal | vauthors = Walenga JM, Jeske WP, Samama MM, Frapaise FX, Bick RL, Fareed J | title = Fondaparinux: a synthetic heparin pentasaccharide as a new antithrombotic agent | journal = Expert Opinion on Investigational Drugs | volume = 11 | issue = 3 | pages = 397–407 | date = March 2002 | pmid = 11866668 | doi = 10.1517/13543784.11.3.397 }}</ref><ref>{{cite journal | vauthors = Petitou M, van Boeckel CA | title = A synthetic antithrombin III binding pentasaccharide is now a drug! What comes next? | journal = Angewandte Chemie | volume = 43 | issue = 24 | pages = 3118–33 | date = June 2004 | pmid = 15199558 | doi = 10.1002/anie.200300640 }}</ref> |
|||
=== Conformación latente === |
|||
[[File:Serpin latent state (unannotated).png|thumb|450x450px|Algunas serpinas puedes convertirse espontáneamente a su estado latente inactivo. La serpina [[PAI-1]]<nowiki/>rpermanece en su conformación activa cuando se une a la [[vitronectin|vitronectina]] (verde). Sin embargo, en la ausencia de vitronectina, PAI-1 puede cambiar al estado latente inactivo. El RCL no cortado (azul; regiones desordenadas como líneas punteadas) se inserta en la plegada-A, quitando una hebra-β de la plegada-C (amarillo). ({{PDB|1OC0|1DVM|1LJ5}})| alt=Serpin latent state diagram]] |
|||
Ciertas serpinas son sometidas espontáneamente a la transición de S a R sin haber sido cortadas por una proteasa, para formar una conformación denominada como el estado latente.Las serpinas latentes son incapeces de interacturar con preoteasas y por lo tanto ya no son inhibidores de proteasa. El cambio conformacional a estado latente no es exactamente lo mismo que la transición de S a R de una serpina cortada. Ya que el RCL, sigue intacto, la primer hebra de la plegada-C tiene que despegarse para permitir la inserción completa del RCL.<ref name="Lindahl_1989">{{cite journal | vauthors = Lindahl TL, Sigurdardottir O, Wiman B | title = Stability of plasminogen activator inhibitor 1 (PAI-1) | journal = Thrombosis and Haemostasis | volume = 62 | issue = 2 | pages = 748–51 | date = September 1989 | pmid = 2479113 }}</ref> |
|||
La regulación de la transición a estado latente puede actuar como un mecanismo de control en algunas serpinas como en [[PAI-1]]. Aunque PAI-1 se produce en la confromación inhibitoria S, se auto.inactiva aal cambiar a estado latente, a menos que se una al cofactor [[vitronectina]].<ref name="Lindahl_1989"/> De manera similar, la antitrombina puede convertirse espontáneamente a su estado latente, como un mecanismo de modulación adicional a su activación alostérica con heparina.<ref>{{cite journal | vauthors = Mushunje A, Evans G, Brennan SO, Carrell RW, Zhou A | title = Latent antithrombin and its detection, formation and turnover in the circulation | journal = Journal of Thrombosis and Haemostasis | volume = 2 | issue = 12 | pages = 2170–7 | date = December 2004 | pmid = 15613023 | doi = 10.1111/j.1538-7836.2004.01047.x }}</ref> Finalmente, la terminal-N, una serpina de ''[[Thermoanaerobacter|Thermoanaerobacter tengcongensis]]'', se necesita para asegurar la molécula en su estado nativo inhibitorio. La ruptura de las interacciones hechas por la región de la terminal N resultan es cambios conformacionales espontáneos de la serpina a su conformación latente. .<ref>{{cite journal | vauthors = Zhang Q, Buckle AM, Law RH, Pearce MC, Cabrita LD, Lloyd GJ, Irving JA, Smith AI, Ruzyla K, Rossjohn J, Bottomley SP, Whisstock JC | title = The N terminus of the serpin, tengpin, functions to trap the metastable native state | journal = EMBO Reports | volume = 8 | issue = 7 | pages = 658–63 | date = July 2007 | pmid = 17557112 | pmc = 1905895 | doi = 10.1038/sj.embor.7400986 }}</ref><ref name="Zhang_2008">{{cite journal | vauthors = Zhang Q, Law RH, Bottomley SP, Whisstock JC, Buckle AM | title = A structural basis for loop C-sheet polymerization in serpins | journal = Journal of Molecular Biology | volume = 376 | issue = 5 | pages = 1348–59 | date = March 2008 | pmid = 18234218 | doi = 10.1016/j.jmb.2007.12.050 }}</ref> |
|||
=== Cambio conformacional en funciones no inhibitorias === |
|||
Algunas serpinas no inhibitorias también usan el cambio conformacional de la serpina como parte de su función. Por ejemplo, la forma nativa (S) de la globulina fijadora de tiroxina tiene una gran afinidad por la tiroxina, mientras que la forma cortada (R) tiene poca afinidad . De manera similar, la transcortina tiene mayor afinidad por el cortisol cuando está en su estado nativo (S) que cuando está en su estado cortado (R). Entonces, en estas serpinas, el RCL cortado y la transición de S a R se requiere para permitir la liberación de ligandos en lugar de la inhibición de proteasas..<ref name="cbg"/><ref name="Zhou_2006">{{cite journal | vauthors = Zhou A, Wei Z, Read RJ, Carrell RW | title = Structural mechanism for the carriage and release of thyroxine in the blood | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 103 | issue = 36 | pages = 13321–6 | date = September 2006 | pmid = 16938877 | pmc = 1557382 | doi = 10.1073/pnas.0604080103 }}</ref><ref>{{cite journal | vauthors = Pemberton PA, Stein PE, Pepys MB, Potter JM, Carrell RW | title = Hormone binding globulins undergo serpin conformational change in inflammation | journal = Nature | volume = 336 | issue = 6196 | pages = 257–8 | date = November 1988 | pmid = 3143075 | doi = 10.1038/336257a0 }}</ref> |
|||
En algunas serpinas, la transición de S a R puede activar eventos de señalización celular. En estos caso, una serpina que ha formado un complejo con su proteasa ojetivo, es reconocida por un receptor. El evento de unión entonces conduce a una dsminución de señalización por el receptor..<ref name="Cao_2006">{{cite journal | vauthors = Cao C, Lawrence DA, Li Y, Von Arnim CA, Herz J, Su EJ, Makarova A, Hyman BT, Strickland DK, Zhang L | title = Endocytic receptor LRP together with tPA and PAI-1 coordinates Mac-1-dependent macrophage migration | journal = The EMBO Journal | volume = 25 | issue = 9 | pages = 1860–70 | date = May 2006 | pmid = 16601674 | pmc = 1456942 | doi = 10.1038/sj.emboj.7601082 }}</ref> La transición de S a R es usada para alertar células de la presencia de activida de proteasa.<ref name="Cao_2006"/> Esto difiere de su mecanismo usual donde, las serpinas afectan la señalización simplemente al inhibir proteasas implicadas en una cascada de señalización.<ref name="Acosta 1146–1158"/><ref name="Hashimoto 945–950"/> |
|||
==Degradación == |
|||
Cuando una serpina inhibe una proteasa, forma un complejo permanente que necesita ser eliminado. Para las serpinas extracelulares, los complejos finales de serpina-enzima son rápidamente limpiados de la circulación. Un mecanismo por el que esto ocurre en mamíferos es a través de la proteína relacionada con el receptor de lipoproteínas de baja densidad (LRP) que se une a complejos inhibitorios hechos por la antitrombina, PA1-1, y la neuroserpina, provocando captación celular.<ref name="Cao_2006" /><ref name="Jensen_2009">{{cite journal | vauthors = Jensen JK, Dolmer K, Gettins PG | title = Specificity of binding of the low density lipoprotein receptor-related protein to different conformational states of the clade E serpins plasminogen activator inhibitor-1 and proteinase nexin-1 | journal = The Journal of Biological Chemistry | volume = 284 | issue = 27 | pages = 17989–97 | date = July 2009 | pmid = 19439404 | pmc = 2709341 | doi = 10.1074/jbc.M109.009530 }}</ref> De manera similar,la serpina de ''[[Drosophila]]'' se degrada en el lisosoma después de haber sido llevada dentro de la célula por el recpeto Lipoforina 1 (homólogo al recepeto LDL de la familía de mamíferos.<ref name="Soukup_2009">{{cite journal | vauthors = Soukup SF, Culi J, Gubb D | title = Uptake of the n<!--Shouldn't this "n" be capitalized?-->ecrotic serpin in Drosophila melanogaster via the lipophorin receptor-1 | journal = PLoS Genetics | volume = 5 | issue = 6 | pages = e1000532 | date = June 2009 | pmid = 19557185 | pmc = 2694266 | doi = 10.1371/journal.pgen.1000532 | editor1-last = Rulifson | editor1-first = Eric | name-list-format = vanc }}</ref> |
|||
==Enfermedad y serpinopatías== |
|||
Las serpinas son parte de un gran arreglo de funciones fisiológicas, y por lo tanto, las mutaciones en los genes codificándolas pueden causar una serie de enfermedades.Mutaciones que cambian la actividad, la especificidad o propiedades agregadas de las serpinas pueden afectar la manera en que funcionan. La mayoría de las enfermedades relacionadas a las serpinas son el resultado de una polimerización de serpinas en conjuntos, aunque otro tipo de mutaciones ligadas a enfermedades pueden ocurrir.<ref name="Whisstock_2006" /><ref>{{cite journal | vauthors = Kaiserman D, Whisstock JC, Bird PI | title = Mechanisms of serpin dysfunction in disease | journal = Expert Reviews in Molecular Medicine | volume = 8 | issue = 31 | pages = 1–19 | date = 1 January 2006 | pmid = 17156576 | doi = 10.1017/S1462399406000184 }}</ref> El desorden de la deficiencia de α-Antitripsina es una de las enfermedades hereditarias más comunes.<ref name="Janciauskiene_2011"/><ref name="de_Serres_2002"/> |
|||
=== Inactividad o ausencia === |
|||
[[File:Serpin delta conformation.png|thumb|La conformación- δ inactiva de la antiquimotripsina mutante enferma (L55P). Cuatro residuos del RCL (azul;región desordenada como línea punteada) están insertado en la parte superior de la plegada-A. Parte de la α-hélce F (amarillo) se desenrolla y llena la mitad del fondo de la plegada-A. ({{PDB|1QMN}})|alt=Serpin delta-conformation diagram]] |
|||
Ya que el doblaje de la serpina estresada es de energía alta, las mutaciones pueden causar que se cambien incorrectamente a conformaciones de baja energía(relajadas o latentes) antes de que realicen correctamente su función inhibitoria.<ref name="Stein_1995"/> |
|||
Las mutaciones que afectan la velocidad o que tanto se inserta el RCL en la plegada-A puede causar que la serpina sufra su cambio conformacional de S a R antes de haber interactuado con una proteasa. Como una serpina sólo puede hacer este cambio conformacional una sola vez, la serpina ahora es inactiva e incapaz de controlar apropiadamente a la proteasa.<ref name="Stein_1995"/><ref>{{cite journal | vauthors = Hopkins PC, Carrell RW, Stone SR | title = Effects of mutations in the hinge region of serpins | journal = Biochemistry | volume = 32 | issue = 30 | pages = 7650–7 | date = August 1993 | pmid = 8347575 | doi = 10.1021/bi00081a008 }}</ref> De igual manera, las mutaciones que promueven la transición inapropiada hacia el monomérico estado latente causan enfermedades al reducir la cantidad de serpina inhibitoria.Por ejemplo, ambas variantes enfermas de antitrombina ''wibble'' y ''wobble'',<ref>{{cite journal | vauthors = Beauchamp NJ, Pike RN, Daly M, Butler L, Makris M, Dafforn TR, Zhou A, Fitton HL, Preston FE, Peake IR, Carrell RW | title = Antithrombins Wibble and Wobble (T85M/K): archetypal conformational diseases with in vivo latent-transition, thrombosis, and heparin activation | journal = Blood | volume = 92 | issue = 8 | pages = 2696–706 | date = October 1998 | pmid = 9763552 }}</ref> promueven la formación del estado latente. |
|||
La estructura de la antiquimotripsina enferma (L55P) reveló otra, "la conformación- δ" inactiva. En la conformación- δ, se insertan cuatro residuos del RCL en la parte superior de la β-plegada A. La mitad del fondo de la plegada se llena como resultado de una de las α-helices (hélice F) cambiando parcialmente a una conformación de hebra-β, completando la unión de hidrógeno de la β-plegada.<ref name="Gooptu_2000">{{cite journal | vauthors = Gooptu B, Hazes B, Chang WS, Dafforn TR, Carrell RW, Read RJ, Lomas DA | title = Inactive conformation of the serpin alpha(1)-antichymotrypsin indicates two-stage insertion of the reactive loop: implications for inhibitory function and conformational disease | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 97 | issue = 1 | pages = 67–72 | date = January 2000 | pmid = 10618372 | pmc = 26617 | doi = 10.1073/pnas.97.1.67 }}</ref> No es claro si otras serpinas pueden adoptar este confórmero y si esta conformación tiene un tarea funcional, pero se especula que la conformación-δ puede ser adoptada por la globunlina fijadora de tiroxina durante la liberación de tiroxinas.<ref name="Zhou_2006"/> Las proteínas no inhibitorias relacionadas con las serpinas también pueden causar enfermedades cuando mutan. Por ejemplo la mutaciones en SERPINF1 causan [[osteogenesis imperfecta]] tipo VI en humanos.<ref name="Homan_2011"/> |
|||
En la ausencia de la serpina requerida, la proteasa que normalmente regularía está hiperactiva, conduciendo a patologías.<ref name="Stein_1995"/> Consecuentemente, una simple deficiencia de serpinas ( una mutación nula) puede resultar en enfermedad.<ref>{{cite journal | vauthors = Fay WP, Parker AC, Condrey LR, Shapiro AD | title = Human plasminogen activator inhibitor-1 (PAI-1) deficiency: characterization of a large kindred with a null mutation in the PAI-1 gene | journal = Blood | volume = 90 | issue = 1 | pages = 204–8 | date = July 1997 | pmid = 9207454 }}</ref>.<ref name="Heit_2013"/> |
|||
=== Cambio de especificidad === |
|||
En algunos casos raros, un solo cambio en los aminoácidos del RCL de la serpina altera su especificidad y ataca a la proteasa incorrecta. Por ejemplo la mutación de Antitripsina-Pittsburgh (M358R) causa que la serpina [[α1-antitrypsin]] inhiba a la trombina causando un desorden de hemorragia.<ref>{{cite journal | vauthors = Owen MC, Brennan SO, Lewis JH, Carrell RW | title = Mutation of antitrypsin to antithrombin. alpha 1-antitrypsin Pittsburgh (358 Met leads to Arg), a fatal bleeding disorder | journal = The New England Journal of Medicine | volume = 309 | issue = 12 | pages = 694–8 | date = September 1983 | pmid = 6604220 | doi = 10.1056/NEJM198309223091203 }}</ref> |
|||
=== Polimerización y acumulación === |
|||
{{multiple image |
|||
| header = Serpin polymerisation by domain swapping |
|||
| direction = vertical |
|||
| width = 280 |
|||
| image1 = Domainswappeddimer.png |
|||
| caption1 = Un dominio cambiado de un dímero de serpina. ({{PDB|2ZNH}}) |
|||
| alt1 = Diagram of a domain-swapped serpin dimer |
|||
| image2 = Antitrypsindomswap.png |
|||
| caption2 = Un dominio cambiado de un trímero de serpina. Cada RCL del monomero es insertado en su propia estructura (mostrado en rojo del monómero verde). ({{PDB|3T1P}}) |
|||
| alt2 = Diagram of a domain-swapped serpin trimer |
|||
}} |
|||
La mayoría de las enfermedades de serpinas se deben a la acumulación de proteínas y se denominan como "serpinopatías".<ref name="Carrell_1997" /><ref name="Gooptu_2000"/> Las serpinas son vulnerables a mutaciones que causen enfermedades que promueven la formación de polimeros mal doblados debido a sus estructuras inestables.<ref name="Gooptu_2000"/> Serpinpatías bien caracterizadas incluyen la deficiencia de α1-antitropsina, que puede causar enfisema familiial y en algunos casos [[Cirrosis hepática|cirrosis]], ciertas formas familiales de trombosis relacionadas con la deficiencia de antritrombina, <ref name="Janciauskiene_2011"/><ref name="Carrell_1997"/><ref name="lomas_1992">{{cite journal | vauthors = Lomas DA, Evans DL, Finch JT, Carrell RW | title = The mechanism of Z alpha 1-antitrypsin accumulation in the liver | journal = Nature | volume = 357 | issue = 6379 | pages = 605–7 | date = June 1992 | pmid = 1608473 | doi = 10.1038/357605a0 }}</ref> |
|||
Cada monomero del acumulado de serpinas existe es su conformación inactiva, relajada (con el RCL insertado en la plegada-A). Los polimeros son, por lo tanto, hiperestables a temperatura e incapaces de inhibir proteasas. Las serpinopatías , entonces causan patologías similares a otra protepatías ( enfermedades de [[prion]]) a través de dos mecanismos.<ref name="Janciauskiene_2011"/><ref name="Carrell_1997">{{cite journal | vauthors = Carrell RW, Lomas DA | title = Conformational disease | journal = Lancet | volume = 350 | issue = 9071 | pages = 134–8 | date = July 1997 | pmid = 9228977 | doi = 10.1016/S0140-6736(97)02073-4 }}</ref> Primero, la ausencia de serpinas activas resulta en la actividad incontrolable de las proteasas y la destrucción de tejidos. Segundo, los polimeros hiperestables obstruyen el retículo endoplasmático de las células que sintetizan las serpinas, eventualmente resultando en muerte celular y daño de tejidos. En el caso de la deficiencia de antitripsina, los polimeros de antitripsina provocan la muerte de células hepaticas y cirrosis. Dentro de la célula, los polimeros de serpina se remueven lentamente por degradación en el retículo endoplasmático.<ref name="Kroeger_2009">{{cite journal | vauthors = Kroeger H, Miranda E, MacLeod I, Pérez J, Crowther DC, Marciniak SJ, Lomas DA | title = Endoplasmic reticulum-associated degradation (ERAD) and autophagy cooperate to degrade polymerogenic mutant serpins | journal = The Journal of Biological Chemistry | volume = 284 | issue = 34 | pages = 22793–802 | date = August 2009 | pmid = 19549782 | pmc = 2755687 | doi = 10.1074/jbc.M109.027102 }}</ref> Sin embargo, los detalles de como los polimeros de serpina causan la muerte celular todavía no se entiende completamente.<ref name="Janciauskiene_2011"/> |
|||
Se cree que los polimeros fisiológicos de serpina se forman a través de un cambio de dominio, donde un segmento de una proteína de serpina se inserta en otro.<ref name="Yamasaki_2008">{{cite journal | vauthors = Yamasaki M, Li W, Johnson DJ, Huntington JA | title = Crystal structure of a stable dimer reveals the molecular basis of serpin polymerization | journal = Nature | volume = 455 | issue = 7217 | pages = 1255–8 | date = October 2008 | pmid = 18923394 | doi = 10.1038/nature07394 }}</ref> Los cambios de dominio ocurren cuando las mutaciones o los factores ambientales interfieren con las etapas finales del doblaje de la serpina. causando que los intermediarios de alta energía se doblen mal.<ref name="Bottomley_2011">{{cite journal | vauthors = Bottomley SP | title = The structural diversity in α1-antitrypsin misfolding | journal = EMBO Reports | volume = 12 | issue = 10 | pages = 983–4 | date = October 2011 | pmid = 21921939 | pmc = 3185355 | doi = 10.1038/embor.2011.187 }}</ref> Tanto las estructuras de los dímeros como de los trímeros que sufrieron cambio de dominio han sido resueltas. En el dímero (de antitrombina), el RCL y parte de la plegada-A se incorporan en la plegada-A de otra molécula de serpina.<ref name="Yamasaki_2008"/> el trímero de dominio cambiado (de antitripsina) forma, a través del intercambio de una región completamente diferente de la estructura, la beta-plegada (con el RCL de cada molécula insertado en su propia plegada-A).<ref name="Yamasaki_2011">{{cite journal | vauthors = Yamasaki M, Sendall TJ, Pearce MC, Whisstock JC, Huntington JA | title = Molecular basis of α1-antitrypsin deficiency revealed by the structure of a domain-swapped trimer | journal = EMBO Reports | volume = 12 | issue = 10 | pages = 1011–7 | date = October 2011 | pmid = 21909074 | pmc = 3185345 | doi = 10.1038/embor.2011.171 }}</ref> También se ha propuesto que las serpinas puedan formar cambios de dominio al insertar el RCL de una proteína en la plegada-A de otra (polimerización de plegada-A).<ref name="lomas_1992"/><ref>{{cite journal | vauthors = Chang WS, Whisstock J, Hopkins PC, Lesk AM, Carrell RW, Wardell MR | title = Importance of the release of strand 1C to the polymerization mechanism of inhibitory serpins | journal = Protein Science | volume = 6 | issue = 1 | pages = 89–98 | date = January 1997 | pmid = 9007980 | pmc = 2143506 | doi = 10.1002/pro.5560060110 }}</ref> Estas estructuras de dímeros y trímeros con cambio de dominio son suficientemente fuertes para ser los componentes de los acumulados de polimeros causantes de enfermedades, pero el mecanismo todavía no es claro.<ref name="Yamasaki_2008"/><ref name="Bottomley_2011"/><ref name="Yamasaki_2011"/><ref name="Miranda_2010">{{cite journal | vauthors = Miranda E, Pérez J, Ekeowa UI, Hadzic N, Kalsheker N, Gooptu B, Portmann B, Belorgey D, Hill M, Chambers S, Teckman J, Alexander GJ, Marciniak SJ, Lomas DA | title = A novel monoclonal antibody to characterize pathogenic polymers in liver disease associated with alpha1-antitrypsin deficiency | journal = Hepatology | volume = 52 | issue = 3 | pages = 1078–88 | date = September 2010 | pmid = 20583215 | doi = 10.1002/hep.23760 }}</ref> |
|||
====Estrategias terapeúticas ==== |
|||
Varios acercamientos terapeúticos están siendo investigados para tratar la serinpatía más común, la deficiencia de antitripsina.<ref name="Janciauskiene_2011"/> La terapia de aumento de antitripsina es aprobada para la deficiencia severa de antitripsina, relacionada con [[enfisema pulmonar]].<ref name="Sandhaus_2004">{{cite journal | vauthors = Sandhaus RA | title = alpha1-Antitrypsin deficiency . 6: new and emerging treatments for alpha1-antitrypsin deficiency | journal = Thorax | volume = 59 | issue = 10 | pages = 904–9 | date = October 2004 | pmid = 15454659 | pmc = 1746849 | doi = 10.1136/thx.2003.006551 }}</ref> En esta terpia, la antitripsina es pruificada del plasma de donadores de sangre y administrada por intravenosa ([[Prolastin]]).<ref name="Janciauskiene_2011"/><ref>{{cite journal | vauthors = Lewis EC | title = Expanding the clinical indications for α(1)-antitrypsin therapy | journal = Molecular Medicine | volume = 18 | issue = 6 | pages = 957–70 | pmid = 22634722 | pmc = 3459478 | doi = 10.2119/molmed.2011.00196 | url = http://www.molmed.org/content/pdfstore/11_196_Lewis.pdf }}</ref> Para tratar la deficiencia severa de antitripsina, el trasplante de pulmones e higado ha sido efectivo.<ref name="Janciauskiene_2011"/><ref name="Fregonese_2008">{{cite journal | vauthors = Fregonese L, Stolk J | title = Hereditary alpha-1-antitrypsin deficiency and its clinical consequences | journal = Orphanet Journal of Rare Diseases | volume = 3 | issue = | pages = 16 | year = 2008 | pmid = 18565211 | pmc = 2441617 | doi = 10.1186/1750-1172-3-16 }}</ref> En modelos animales el direccionamiento de genes en células madre pluripotentes inducidas ha sido exitosamente usado para correcgir el defecto de polimerización de antitripsina y para restaurar la habilidad del hígado mamífero de secretar antitripsina activa.<ref name="Yusa_2011">{{cite journal | vauthors = Yusa K, Rashid ST, Strick-Marchand H, Varela I, Liu PQ, Paschon DE, Miranda E, Ordóñez A, Hannan NR, Rouhani FJ, Darche S, Alexander G, Marciniak SJ, Fusaki N, Hasegawa M, Holmes MC, Di Santo JP, Lomas DA, Bradley A, Vallier L | title = Targeted gene correction of α1-antitrypsin deficiency in induced pluripotent stem cells | journal = Nature | volume = 478 | issue = 7369 | pages = 391–4 | date = October 2011 | pmid = 21993621 | pmc = 3198846 | doi = 10.1038/nature10424 }}</ref> Pequeñas moléculas tambíen han sido diseñadas que bloquean la polimerización de antitripsina in vitro.<ref name="Mallya_2007">{{cite journal | vauthors = Mallya M, Phillips RL, Saldanha SA, Gooptu B, Brown SC, Termine DJ, Shirvani AM, Wu Y, Sifers RN, Abagyan R, Lomas DA | title = Small molecules block the polymerization of Z alpha1-antitrypsin and increase the clearance of intracellular aggregates | journal = Journal of Medicinal Chemistry | volume = 50 | issue = 22 | pages = 5357–63 | date = November 2007 | pmid = 17918823 | pmc = 2631427 | doi = 10.1021/jm070687z }}</ref><ref name="Gosai_2010">{{cite journal | vauthors = Gosai SJ, Kwak JH, Luke CJ, Long OS, King DE, Kovatch KJ, Johnston PA, Shun TY, Lazo JS, Perlmutter DH, Silverman GA, Pak SC | title = Automated high-content live animal drug screening using C. elegans expressing the aggregation prone serpin α1-antitrypsin Z | journal = PloS One | volume = 5 | issue = 11 | pages = e15460 | year = 2010 | pmid = 21103396 | pmc = 2980495 | doi = 10.1371/journal.pone.0015460 }}</ref> |
|||
==Evolución== |
|||
Las serpinas son las superfamilia de proteinas inhibidoras más grande y más distribuida.<ref name="Silverman_2001" /><ref name="Rawlings_2004"/> Se pensaba que estaban restringidas a organismos eucariotes. pero desde entonces, han sido encontradas en bacteria, arquea y algunos virus..<ref name="Irving_2000"/><ref name="Irving_2002">{{cite journal | vauthors = Irving JA, Steenbakkers PJ, Lesk AM, Op den Camp HJ, Pike RN, Whisstock JC | title = Serpins in prokaryotes | journal = Molecular Biology and Evolution | volume = 19 | issue = 11 | pages = 1881–90 | date = November 2002 | pmid = 12411597 | doi = 10.1093/oxfordjournals.molbev.a004012 }}</ref><ref>{{cite journal | vauthors = Cabrita LD, Irving JA, Pearce MC, Whisstock JC, Bottomley SP | title = Aeropin from the extremophile Pyrobaculum aerophilum bypasses the serpin misfolding trap | journal = The Journal of Biological Chemistry | volume = 282 | issue = 37 | pages = 26802–9 | date = September 2007 | pmid = 17635906 | doi = 10.1074/jbc.M705020200 }}</ref> Permanece incierto si los genes procariotes son descendientes de una serpina procariótica ancestral o el producto de una [[transferencia genética horizontal]] de eucariontes. La mayoría de las serpinas permancen a un clado filogenético, si vienen de plantas o animales, indicando que las serpinas intracelulares y extracelulares pueden haberse separado antes de las plantas y los animales.<ref>{{cite journal | vauthors = Fluhr R, Lampl N, Roberts TH | title = Serpin protease inhibitors in plant biology | journal = Physiologia Plantarum | volume = 145 | issue = 1 | pages = 95–102 | date = May 2012 | pmid = 22085334 | doi = 10.1111/j.1399-3054.2011.01540.x }}</ref> Excepciones incluyen la serpina de choque intracelular de calor HSP47, que es una chaperon esencial para el doblaje apropiado del colágeno y ciclos entre [[Golgi apparatus|cis-Golgi]] y el retículo endoplasmático.<ref name="Mala_2010" /> |
|||
La inhibición de proteasa es considerada la función ancestral, con miembros no inhibidores resultado de neofuncionamiento evolucionario de la estructura. El cambio conformacional de S a R también ha sido aaptado por algunas serpinas que se unen para regular la afinidad por sus objetivos.<ref name="Zhou_2006"/> |
|||
== Investigaciones == |
== Investigaciones == |
||
Por razón de que las serpinas controlan procesos celulares tales como la coagulación y la inflamación, éstas son proteínas blanco para investigaciones científicas. Las serpinas también tienen importancia para la [[genómica estructural]] y el estudio del [[plegamiento de proteínas]] debido a que son capaces de dramáticos y muy únicos [[Cambio estructural|cambios en sus estructuras]] en el proceso de la inhibición enzimática.<ref name="huntington2000">{{cita publicación|autor=Huntington J, Read R, Carrell R |título=Structure of a serpin-protease complex shows inhibition by deformation |revista=Nature |volumen=407 |número=6806 |páginas=923-6 |año=2000 |pmid=11057674}}</ref> Esa característica es poco usual, ya que los inhibidores de las proteasas tienden a fusionarse con la sencilléz de una llave y su cerradura, con formas moleculares prescisas en el sitio activo de la enzima. La desventaja de los mecanismos conformacionales de las serpinas es que las hace susceptibles a [[mutación|mutaciones]] que causan [[polímero]]s de larga cadena que son inactivas.<ref name="carrelllancet">{{cita publicación|autor=Carrell RW, Lomas DA. |título=Conformational disease. |revista=Lancet. |año=1997 |volumen=350 |número=9071 |página=134-8 |pmid=9228977}}</ref><ref name="lomas1992">{{cita publicación|autor=Lomas DA, Evans DL, Finch JT & Carrell RW |título=The mechanism of Z alpha 1-antitrypsin accumulation in the liver |revista=Nature |volumen=357 |páginas=605–607 |año=1992 |pmid=1608473}}</ref> |
Por razón de que las serpinas controlan procesos celulares tales como la coagulación y la inflamación, éstas son proteínas blanco para investigaciones científicas. Las serpinas también tienen importancia para la [[genómica estructural]] y el estudio del [[plegamiento de proteínas]] debido a que son capaces de dramáticos y muy únicos [[Cambio estructural|cambios en sus estructuras]] en el proceso de la inhibición enzimática.<ref name="huntington2000">{{cita publicación|autor=Huntington J, Read R, Carrell R |título=Structure of a serpin-protease complex shows inhibition by deformation |revista=Nature |volumen=407 |número=6806 |páginas=923-6 |año=2000 |pmid=11057674}}</ref> Esa característica es poco usual, ya que los inhibidores de las proteasas tienden a fusionarse con la sencilléz de una llave y su cerradura, con formas moleculares prescisas en el sitio activo de la enzima. La desventaja de los mecanismos conformacionales de las serpinas es que las hace susceptibles a [[mutación|mutaciones]] que causan [[polímero]]s de larga cadena que son inactivas.<ref name="carrelllancet">{{cita publicación|autor=Carrell RW, Lomas DA. |título=Conformational disease. |revista=Lancet. |año=1997 |volumen=350 |número=9071 |página=134-8 |pmid=9228977}}</ref><ref name="lomas1992">{{cita publicación|autor=Lomas DA, Evans DL, Finch JT & Carrell RW |título=The mechanism of Z alpha 1-antitrypsin accumulation in the liver |revista=Nature |volumen=357 |páginas=605–607 |año=1992 |pmid=1608473}}</ref> |
||
==Distribución== |
|||
===Animal=== |
|||
====Humanos==== |
|||
El genoma humano codifica 16 clados de serpinas, que van desde serpinaA hasta serpinaP, incluyendo 29 proteínas de serpina inhibitorias y 7 no inhibitoria.<ref name="Law_2006" /><ref name="Heit_2013" /> El sistema usado para nombrar las serpinas humanas está basado en un análisis filogenético de aproximadamente 500 serpinas del 2001, con proteínas llamada serpin XY, donde X es el clado de proteína y Y el número de proteinas dentro de ese clado..<ref name="Silverman_2001" /><ref name="Irving_2000">{{cite journal | vauthors = Irving JA, Pike RN, Lesk AM, Whisstock JC | title = Phylogeny of the serpin superfamily: implications of patterns of amino acid conservation for structure and function | journal = Genome Research | volume = 10 | issue = 12 | pages = 1845–64 | date = December 2000 | pmid = 11116082 | doi = 10.1101/gr.GR-1478R }}</ref><ref name="Heit_2013" /> Las funciones de las serpinas humanas han sido determinaas por una combinación de estudios bioquímicos, desórdenes humanos genéticos, y modelos de [[Ratón knockout|ratones knockout]] T.<ref name="Heit_2013" /> |
|||
<!-------------------------------------------- |
|||
When adding to the 'Human disease' column of |
|||
this table, please cite secondary / tertiary |
|||
medical sources. (See WP:MEDRS for details) |
|||
---------------------------------------------> |
|||
{| class="navbox collapsible collapsed" style="border:0; margin-top:0.2em;" |
|||
|- |
|||
! style="text-align: center"| Tabla de serpinas humanas |
|||
|- |
|||
| |
|||
{| class="wikitable sortable" |
|||
! Nombre del gen |
|||
! Nombre común |
|||
! Ubicación |
|||
! class="unsortable" | Función / Actividad<ref name="Law_2006">{{cite journal | vauthors = Law RH, Zhang Q, McGowan S, Buckle AM, Silverman GA, Wong W, Rosado CJ, Langendorf CG, Pike RN, Bird PI, Whisstock JC | title = An overview of the serpin superfamily | journal = Genome Biology | volume = 7 | issue = 5 | pages = 216 | year = 2006 | pmid = 16737556 | pmc = 1779521 | doi = 10.1186/gb-2006-7-5-216 }}</ref><ref name="Heit_2013">{{cite journal | vauthors = Heit C, Jackson BC, McAndrews M, Wright MW, Thompson DC, Silverman GA, Nebert DW, Vasiliou V | title = Update of the human and mouse SERPIN gene superfamily | journal = Human Genomics | volume = 7 | pages = 22 | date = 30 October 2013 | pmid = 24172014 | pmc = 3880077 | doi = 10.1186/1479-7364-7-22 }}</ref> |
|||
! class="unsortable" | Efecto de la deficiencia<ref name="Law_2006"/><ref name="Heit_2013"/> |
|||
! class="unsortable" | Enfermedad Humana |
|||
! Localización cromosomal |
|||
! scope="col" style="width: 70px;" | Estructura de la proteína |
|||
|- |
|||
| [[SERPINA1]] |
|||
| [[Alpha-1 antitrypsin|α1-antitripsina]] |
|||
|Extracelular |
|||
|Inhibidor de la elastasa de los neutrófiloa.<ref name="Stoller_2005">{{cite journal | vauthors = Stoller JK, Aboussouan LS | title = Alpha1-antitrypsin deficiency | journal = Lancet | volume = 365 | issue = 9478 | pages = 2225–36 | year = 2005 | pmid = 15978931 | doi = 10.1016/S0140-6736(05)66781-5 }}</ref> El fragmento de terminal-C de la serpina separada puede inhibir la infección de VIH-1.<ref>{{cite journal | vauthors = Münch J, Ständker L, Adermann K, Schulz A, Schindler M, Chinnadurai R, Pöhlmann S, Chaipan C, Biet T, Peters T, Meyer B, Wilhelm D, Lu H, Jing W, Jiang S, Forssmann WG, Kirchhoff F | title = Discovery and optimization of a natural HIV-1 entry inhibitor targeting the gp41 fusion peptide | journal = Cell | volume = 129 | issue = 2 | pages = 263–75 | date = April 2007 | pmid = 17448989 | doi = 10.1016/j.cell.2007.02.042 }}</ref> |
|||
| |
|||
|Deficiencia, resulta en enfisema, polimerizacion resulta en cirrosis (serpinopatía).<ref name="Janciauskiene_2011"/><ref>{{cite journal | vauthors = Gooptu B, Dickens JA, Lomas DA | title = The molecular and cellular pathology of α₁-antitrypsin deficiency | journal = Trends in Molecular Medicine | volume = 20 | issue = 2 | pages = 116–27 | date = February 2014 | pmid = 24374162 | doi = 10.1016/j.molmed.2013.10.007 }}</ref> |
|||
| 14q32.1 |
|||
|{{PDB2|1QLP}}, {{PDB2|7API}}, {{PDB2|1D5S}} |
|||
|- |
|||
| [[SERPINA2]] |
|||
| [[Antitrypsin-related protein|Proteína relacionada con antitripsina]] |
|||
|Extracelular |
|||
|Posible pseudogen.<ref>{{cite journal | vauthors = Seixas S, Suriano G, Carvalho F, Seruca R, Rocha J, Di Rienzo A | title = Sequence diversity at the proximal 14q32.1 SERPIN subcluster: evidence for natural selection favoring the pseudogenization of SERPINA2 | journal = Molecular Biology and Evolution | volume = 24 | issue = 2 | pages = 587–98 | date = February 2007 | pmid = 17135331 | doi = 10.1093/molbev/msl187 }}</ref> |
|||
| |
|||
| |
|||
| 14q32.1 |
|||
| |
|||
|- |
|||
| [[SERPINA3]] |
|||
| [[Alpha 1-antichymotrypsin|α1-antiquimotripsina]] |
|||
|Extracelular |
|||
|Inhibidor de cathepsin G.<ref name="Kalsheker_1996">{{cite journal | vauthors = Kalsheker NA | title = Alpha 1-antichymotrypsin | journal = The International Journal of Biochemistry & Cell Biology | volume = 28 | issue = 9 | pages = 961–4 | date = September 1996 | pmid = 8930118 | doi = 10.1016/1357-2725(96)00032-5 }}</ref> Otros roles en la condensación de cromatina en células hepaticas.<ref name="Santamaria_2013">{{cite journal | vauthors = Santamaria M, Pardo-Saganta A, Alvarez-Asiain L, Di Scala M, Qian C, Prieto J, Avila MA | title = Nuclear α1-antichymotrypsin promotes chromatin condensation and inhibits proliferation of human hepatocellular carcinoma cells | journal = Gastroenterology | volume = 144 | issue = 4 | pages = 818–828.e4 | date = April 2013 | pmid = 23295442 | pmc = | doi = 10.1053/j.gastro.2012.12.029 }}</ref> |
|||
| |
|||
|Mala regulación, resulta en [[Enfermedad de Alzheimer|Alzheimer]] (serpinopatía).<ref>{{cite journal | vauthors = Zhang S, Janciauskiene S | title = Multi-functional capability of proteins: alpha1-antichymotrypsin and the correlation with Alzheimer's disease | journal = Journal of Alzheimer's Disease | volume = 4 | issue = 2 | pages = 115–22 | date = April 2002 | pmid = 12214135 }}</ref> <!--can only find primary sources on [[emphysema]]--> |
|||
| 14q32.1 |
|||
|{{PDB2|1YXA}}, {{PDB2|2ACH}} |
|||
|- |
|||
| [[SERPINA4]] |
|||
| [[Kallistatin]] |
|||
|Extracelular |
|||
|Inhibidor de kallikrein, regulador de función vascular.<ref name="Chao_1997">{{cite journal | vauthors = Chao J, Stallone JN, Liang YM, Chen LM, Wang DZ, Chao L | title = Kallistatin is a potent new vasodilator | journal = The Journal of Clinical Investigation | volume = 100 | issue = 1 | pages = 11–7 | date = July 1997 | pmid = 9202051 | pmc = 508159 | doi = 10.1172/JCI119502 }}</ref><ref>{{cite journal | vauthors = Miao RQ, Agata J, Chao L, Chao J | title = Kallistatin is a new inhibitor of angiogenesis and tumor growth | journal = Blood | volume = 100 | issue = 9 | pages = 3245–52 | date = November 2002 | pmid = 12384424 | doi = 10.1182/blood-2002-01-0185 }}</ref> |
|||
|Agotamiento en ratas hipertensas exacerba heridas renales y cardiovasculaers.<ref name="Liu_2012">{{cite journal | vauthors = Liu Y, Bledsoe G, Hagiwara M, Shen B, Chao L, Chao J | title = Depletion of endogenous kallistatin exacerbates renal and cardiovascular oxidative stress, inflammation, and organ remodeling | journal = American Journal of Physiology. Renal Physiology | volume = 303 | issue = 8 | pages = F1230-8 | date = October 2012 | pmid = 22811485 | doi = 10.1152/ajprenal.00257.2012 }}</ref> |
|||
| |
|||
| 14q32.1 |
|||
| |
|||
|- |
|||
| [[SERPINA5]] |
|||
| [[Protein C inhibitor]] |
|||
|Extracelular |
|||
| Inhibidor de la proteína C activa.<ref name="Geiger_2007">{{cite journal | vauthors = Geiger M | title = Protein C inhibitor, a serpin with functions in- and outside vascular biology | journal = Thrombosis and Haemostasis | volume = 97 | issue = 3 | pages = 343–7 | date = March 2007 | pmid = 17334499 | doi = 10.1160/th06-09-0488 }}</ref> Rol intracelular en prevenir la fagocitosis de las bacterias.<ref name="Baumgärtner_2007">{{cite journal | vauthors = Baumgärtner P, Geiger M, Zieseniss S, Malleier J, Huntington JA, Hochrainer K, Bielek E, Stoeckelhuber M, Lauber K, Scherfeld D, Schwille P, Wäldele K, Beyer K, Engelmann B | title = Phosphatidylethanolamine critically supports internalization of cell-penetrating protein C inhibitor | journal = The Journal of Cell Biology | volume = 179 | issue = 4 | pages = 793–804 | date = November 2007 | pmid = 18025309 | pmc = 2080921 | doi = 10.1083/jcb.200707165 }}</ref> |
|||
|En ratones Knockout causa infertilidad<ref>{{cite journal | vauthors = Uhrin P, Dewerchin M, Hilpert M, Chrenek P, Schöfer C, Zechmeister-Machhart M, Krönke G, Vales A, Carmeliet P, Binder BR, Geiger M | title = Disruption of the protein C inhibitor gene results in impaired spermatogenesis and male infertility | journal = The Journal of Clinical Investigation | volume = 106 | issue = 12 | pages = 1531–9 | date = December 2000 | pmid = 11120760 | pmc = 381472 | doi = 10.1172/JCI10768 }}</ref> La Acumulación ocure en placas cronicas activas en escleroris múltiple.<ref name="Han_2008">{{cite journal | vauthors = Han MH, Hwang SI, Roy DB, Lundgren DH, Price JV, Ousman SS, Fernald GH, Gerlitz B, Robinson WH, Baranzini SE, Grinnell BW, Raine CS, Sobel RA, Han DK, Steinman L | title = Proteomic analysis of active multiple sclerosis lesions reveals therapeutic targets | journal = Nature | volume = 451 | issue = 7182 | pages = 1076–81 | date = February 2008 | pmid = 18278032 | doi = 10.1038/nature06559 }}</ref> |
|||
| |
|||
| 14q32.1 |
|||
|{{PDB2|2OL2}}, {{PDB2|3B9F}} |
|||
|- |
|||
| [[SERPINA6]] |
|||
| [[Transcortina]] |
|||
|Extracelular |
|||
| No-inhibidor. fijante de Cortisol.<ref name="cbg"/> |
|||
| |
|||
|Deficiencia, associada con fatifa crónica.<ref>{{cite journal | vauthors = Torpy DJ, Ho JT | title = Corticosteroid-binding globulin gene polymorphisms: clinical implications and links to idiopathic chronic fatigue disorders | journal = Clinical Endocrinology | volume = 67 | issue = 2 | pages = 161–7 | date = August 2007 | pmid = 17547679 | doi = 10.1111/j.1365-2265.2007.02890.x }}</ref> |
|||
| 14q32.1 |
|||
|{{PDB2|2V6D}}, {{PDB2|2VDX}}, {{PDB2|2VDY}} |
|||
|- |
|||
| [[SERPINA7]] |
|||
| [[Globulina fijadora de tiroxina]] |
|||
|Extracelular |
|||
|No-inhibidor fijador de. Thiroxina .<ref name="Zhou_2006"/> |
|||
| |
|||
|Deficiencia causa hipotiroidismo.<ref>{{cite journal | vauthors = Bartalena L, Robbins J | title = Variations in thyroid hormone transport proteins and their clinical implications | journal = Thyroid | volume = 2 | issue = 3 | pages = 237–45 | year = 1992 | pmid = 1422238 | doi = 10.1089/thy.1992.2.237 }}</ref><ref>{{cite journal | vauthors = Persani L | title = Clinical review: Central hypothyroidism: pathogenic, diagnostic, and therapeutic challenges | journal = The Journal of Clinical Endocrinology and Metabolism | volume = 97 | issue = 9 | pages = 3068–78 | date = September 2012 | pmid = 22851492 | doi = 10.1210/jc.2012-1616 }}</ref> |
|||
| Xq22.2 |
|||
|{{PDB2|2CEO}}, {{PDB2|2RIV}}, {{PDB2|2RIW}} |
|||
|- |
|||
| [[SERPINA8]] |
|||
| [[Angiotensinogen]] |
|||
|Extracelular |
|||
| No-inhibidor, separado por renina, resulta en la liberación de angiotensina I.<ref name="Kumar_2007">{{cite journal | vauthors = Kumar R, Singh VP, Baker KM | title = The intracellular renin-angiotensin system: a new paradigm | journal = Trends in Endocrinology and Metabolism | volume = 18 | issue = 5 | pages = 208–14 | date = July 2007 | pmid = 17509892 | doi = 10.1016/j.tem.2007.05.001 }}</ref> |
|||
|Hipotensión en ratones Knockout.<ref name="Tanimoto_1994">{{cite journal | vauthors = Tanimoto K, Sugiyama F, Goto Y, Ishida J, Takimoto E, Yagami K, Fukamizu A, Murakami K | title = Angiotensinogen-deficient mice with hypotension | journal = The Journal of Biological Chemistry | volume = 269 | issue = 50 | pages = 31334–7 | date = December 1994 | pmid = 7989296 | doi = }}</ref> |
|||
|Variantes ligadas a hipertension.<ref>{{cite journal | vauthors = Jeunemaitre X, Gimenez-Roqueplo AP, Célérier J, Corvol P | title = Angiotensinogen variants and human hypertension | journal = Current Hypertension Reports | volume = 1 | issue = 1 | pages = 31–41 | year = 1999 | pmid = 10981040 | doi = 10.1007/s11906-999-0071-0 }}</ref><ref>{{cite journal | vauthors = Sethi AA, Nordestgaard BG, Tybjaerg-Hansen A | title = Angiotensinogen gene polymorphism, plasma angiotensinogen, and risk of hypertension and ischemic heart disease: a meta-analysis | journal = Arteriosclerosis, Thrombosis, and Vascular Biology | volume = 23 | issue = 7 | pages = 1269–75 | date = July 2003 | pmid = 12805070 | doi = 10.1161/01.ATV.0000079007.40884.5C }}</ref><ref>{{cite journal | vauthors = Dickson ME, Sigmund CD | title = Genetic basis of hypertension: revisiting angiotensinogen | journal = Hypertension | volume = 48 | issue = 1 | pages = 14–20 | date = July 2006 | pmid = 16754793 | doi = 10.1161/01.HYP.0000227932.13687.60 }}</ref> |
|||
| 1q42-q43 |
|||
|{{PDB2|2X0B}}, {{PDB2|2WXW}}, {{PDB2|2WXX}}, {{PDB2|2WXY}}, {{PDB2|2WXZ}}, {{PDB2|2WY0}}, {{PDB2|2WY1}} |
|||
|- |
|||
| [[SERPINA9]] |
|||
| [[Centerin]] / GCET1 |
|||
|Extracelular |
|||
| Inhibidor, mantenimiento de las células B .<ref>{{cite journal | vauthors = Frazer JK, Jackson DG, Gaillard JP, Lutter M, Liu YJ, Banchereau J, Capra JD, Pascual V | title = Identification of centerin: a novel human germinal center B cell-restricted serpin | journal = European Journal of Immunology | volume = 30 | issue = 10 | pages = 3039–48 | date = October 2000 | pmid = 11069088 | doi = 10.1002/1521-4141(200010)30:10<3039::AID-IMMU3039>3.0.CO;2-H }}</ref><ref>{{cite journal | vauthors = Paterson MA, Horvath AJ, Pike RN, Coughlin PB | title = Molecular characterization of centerin, a germinal centre cell serpin | journal = The Biochemical Journal | volume = 405 | issue = 3 | pages = 489–94 | date = August 2007 | pmid = 17447896 | pmc = 2267310 | doi = 10.1042/BJ20070174 }}</ref> |
|||
| |
|||
|Fuertemente expresada en la mayoría de los linfomas de células-B.<ref name="Paterson_2008">{{cite journal | vauthors = Paterson MA, Hosking PS, Coughlin PB | title = Expression of the serpin centerin defines a germinal center phenotype in B-cell lymphomas | journal = American Journal of Clinical Pathology | volume = 130 | issue = 1 | pages = 117–26 | date = July 2008 | pmid = 18550480 | doi = 10.1309/9QKE68QU7B825A3U }}</ref><ref>{{cite journal | vauthors = Ashton-Rickardt PG | title = An emerging role for Serine Protease Inhibitors in T lymphocyte immunity and beyond | journal = Immunology Letters | volume = 152 | issue = 1 | pages = 65–76 | date = April 2013 | pmid = 23624075 | doi = 10.1016/j.imlet.2013.04.004 }}</ref> |
|||
| 14q32.1 |
|||
| |
|||
|- |
|||
| [[SERPINA10]] |
|||
| Inhibidor de proteasa relacionada a Proteina Z |
|||
|Extracelular |
|||
| Une [[protein Z|proteina Z]]<nowiki/>ae inactiva [[factor Xa|actor Xa]] y [[factor XI]]a.<ref name="Han_2000">{{cite journal | vauthors = Han X, Fiehler R, Broze GJ | title = Characterization of the protein Z-dependent protease inhibitor | journal = Blood | volume = 96 | issue = 9 | pages = 3049–55 | date = November 2000 | pmid = 11049983 | doi = }}</ref> |
|||
| |
|||
| |
|||
| 14q32.1 |
|||
|{{PDB2|3F1S}}, {{PDB2|3H5C}} |
|||
|- |
|||
| [[SERPINA11]] |
|||
| – |
|||
|Probablemente Extracelular |
|||
| Desconocida |
|||
| |
|||
| |
|||
| 14q32.13 |
|||
| |
|||
|- |
|||
| [[SERPINA12]] |
|||
| [[Vaspin|Vaspina]] |
|||
|Extracelular |
|||
| Inhibidor de Kallikrein-7. Insulin-sensitizing adipocytokine.<ref>{{cite journal | vauthors = Hida K, Wada J, Eguchi J, Zhang H, Baba M, Seida A, Hashimoto I, Okada T, Yasuhara A, Nakatsuka A, Shikata K, Hourai S, Futami J, Watanabe E, Matsuki Y, Hiramatsu R, Akagi S, Makino H, Kanwar YS | title = Visceral adipose tissue-derived serine protease inhibitor: a unique insulin-sensitizing adipocytokine in obesity | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 102 | issue = 30 | pages = 10610–5 | date = July 2005 | pmid = 16030142 | pmc = 1180799 | doi = 10.1073/pnas.0504703102 }}</ref> |
|||
| |
|||
|Altos niveles de plasma, asocidado con diabetes tipo II.<ref>{{cite journal | vauthors = Feng R, Li Y, Wang C, Luo C, Liu L, Chuo F, Li Q, Sun C | title = Higher vaspin levels in subjects with obesity and type 2 diabetes mellitus: a meta-analysis | journal = Diabetes Research and Clinical Practice | volume = 106 | issue = 1 | pages = 88–94 | date = October 2014 | pmid = 25151227 | doi = 10.1016/j.diabres.2014.07.026 }}</ref> |
|||
| 14q32.1 |
|||
|{{PDB2|4IF8}} |
|||
|- |
|||
| [[SERPINA13]] |
|||
| – |
|||
|Probablemente Extracelular |
|||
| Desconocida |
|||
| |
|||
| |
|||
| 14q32 |
|||
| |
|||
|- |
|||
| [[SERPINB1]] |
|||
| [[SERPINB1|Monocyte neutrophil elastase inhibitor]] |
|||
|Intracelular |
|||
| Inhibidor de neutrophil elastase.<ref>{{cite journal | vauthors = Remold-O'Donnell E, Chin J, Alberts M | title = Sequence and molecular characterization of human monocyte/neutrophil elastase inhibitor | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 89 | issue = 12 | pages = 5635–9 | date = June 1992 | pmid = 1376927 | pmc = 49347 | doi = 10.1073/pnas.89.12.5635 }}</ref> |
|||
|En ratones Knockout causa el defecto de la supervivencia neutrofílica y deficiencia inmune.<ref>{{cite journal | vauthors = Benarafa C, Priebe GP, Remold-O'Donnell E | title = The neutrophil serine protease inhibitor serpinb1 preserves lung defense functions in Pseudomonas aeruginosa infection | journal = The Journal of Experimental Medicine | volume = 204 | issue = 8 | pages = 1901–9 | date = August 2007 | pmid = 17664292 | pmc = 2118684 | doi = 10.1084/jem.20070494 }}</ref> |
|||
| |
|||
| 6p25 |
|||
|{{PDB2|1HLE}} |
|||
|- |
|||
| [[SERPINB2]] |
|||
| [[Plasminogen activator inhibitor-2]] |
|||
|Intracelular/Extracelular |
|||
| Inhibidor de Extracelular uPA. Intracelular function unclear, but may protect against viral infection.<ref name="Antalis_1998">{{cite journal | vauthors = Antalis TM, La Linn M, Donnan K, Mateo L, Gardner J, Dickinson JL, Buttigieg K, Suhrbier A | title = The serine proteinase inhibitor (serpin) plasminogen activation inhibitor type 2 protects against viral cytopathic effects by constitutive interferon alpha/beta priming | journal = The Journal of Experimental Medicine | volume = 187 | issue = 11 | pages = 1799–811 | date = June 1998 | pmid = 9607921 | pmc = 2212304 | doi = 10.1084/jem.187.11.1799 }}</ref> |
|||
|Deficiencia en ratones reduce respuestaa inmune a infección de nematodos.<ref name="Zhao_2013">{{cite journal | vauthors = Zhao A, Yang Z, Sun R, Grinchuk V, Netzel-Arnett S, Anglin IE, Driesbaugh KH, Notari L, Bohl JA, Madden KB, Urban JF, Antalis TM, Shea-Donohue T | title = SerpinB2 is critical to Th2 immunity against enteric nematode infection | journal = Journal of Immunology | volume = 190 | issue = 11 | pages = 5779–87 | date = June 2013 | pmid = 23630350 | pmc = | doi = 10.4049/jimmunol.1200293 }}</ref> En ratones Knockout no causa ningún fenotipo obvio.<ref>{{cite journal | vauthors = Dougherty KM, Pearson JM, Yang AY, Westrick RJ, Baker MS, Ginsburg D | title = The plasminogen activator inhibitor-2 gene is not required for normal murine development or survival | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 96 | issue = 2 | pages = 686–91 | date = January 1999 | pmid = 9892694 | pmc = 15197 | doi = 10.1073/pnas.96.2.686 }}</ref> |
|||
| |
|||
| 18q21.3 |
|||
|{{PDB2|1BY7}} |
|||
|- |
|||
| [[SERPINB3]] |
|||
| [[Squamous cell carcinoma antigen-1]] (SCCA-1) |
|||
|Intracelular |
|||
| Inhibidor de proteasa de cisteína como papaína<ref name="Schick_1998"/> y catepsinas K, L y S.<ref>{{cite journal | vauthors = Takeda A, Yamamoto T, Nakamura Y, Takahashi T, Hibino T | title = Squamous cell carcinoma antigen is a potent inhibitor of cysteine proteinase cathepsin L | journal = FEBS Letters | volume = 359 | issue = 1 | pages = 78–80 | date = February 1995 | pmid = 7851535 | doi=10.1016/0014-5793(94)01456-b}}</ref><ref name="CT">{{cite journal | vauthors = Turato C, Pontisso P | title = SERPINB3 (serpin peptidase inhibitor, clade B (ovalbumin), member 3) | journal = Atlas of Genetics and Cytogenetics in Oncology and Haematology | volume = 19 | issue = 3 | pages = 202–209 | date = March 2015 | pmid = 25984243 | doi = 10.4267/2042/56413 | pmc=4430857}}</ref> |
|||
|En ratones Knockout de Serpinb3a (el homólogo de murino de SERPINB3 and SERPINB4) se reduce producción mucosa en un modelo murino del [[asma]] .<ref name="Sivaprasad_2011" /> |
|||
| |
|||
| 18q21.3 |
|||
|{{PDB2|2ZV6}} |
|||
|- |
|||
| [[SERPINB4]] |
|||
| [[Squamous cell carcinoma antigen-2]] (SCCA-2) |
|||
|Intracelular |
|||
| Inhibidor de proteasas de serina como quimotripsina, [[Catepsina|catepsina G]] and [[Quinasa dependiente de ciclina|quimasa]].<ref name="CT" /><ref>{{cite journal | vauthors = Schick C, Kamachi Y, Bartuski AJ, Cataltepe S, Schechter NM, Pemberton PA, Silverman GA | title = Squamous cell carcinoma antigen 2 is a novel serpin that inhibits the chymotrypsin-like proteinases cathepsin G and mast cell chymase | journal = The Journal of Biological Chemistry | volume = 272 | issue = 3 | pages = 1849–55 | date = January 1997 | pmid = 8999871 | doi = 10.1074/jbc.272.3.1849 }}</ref> |
|||
|En ratones Knockout de Serpinb3a (el homólogo de murino de SERPINB3 y SERPINB4) se reduce producción de mucosa en un modelo murino del asma.<ref name="Sivaprasad_2011">{{cite journal | vauthors = Sivaprasad U, Askew DJ, Ericksen MB, Gibson AM, Stier MT, Brandt EB, Bass SA, Daines MO, Chakir J, Stringer KF, Wert SE, Whitsett JA, Le Cras TD, Wills-Karp M, Silverman GA, Khurana Hershey GK | title = A nonredundant role for mouse Serpinb3a in the induction of mucus production in asthma | journal = The Journal of Allergy and Clinical Immunology | volume = 127 | issue = 1 | pages = 254–61, 261.e1-6 | date = January 2011 | pmid = 21126757 | pmc = 3058372 | doi = 10.1016/j.jaci.2010.10.009 }}</ref> |
|||
| |
|||
| 18q21.3 |
|||
| |
|||
|- |
|||
| [[SERPINB5]] |
|||
| [[Maspin|Maspina]] |
|||
|Intracelular |
|||
| No-inhibidor, función no clara<ref name="Teoh_2010">{{cite journal | vauthors = Teoh SS, Whisstock JC, Bird PI | title = Maspin (SERPINB5) is an obligate intracellular serpin | journal = The Journal of Biological Chemistry | volume = 285 | issue = 14 | pages = 10862–9 | date = April 2010 | pmid = 20123984 | pmc = 2856292 | doi = 10.1074/jbc.M109.073171 }}</ref><ref name="maspin">{{cite journal | vauthors = Zou Z, Anisowicz A, Hendrix MJ, Thor A, Neveu M, Sheng S, Rafidi K, Seftor E, Sager R | title = Maspin, a serpin with tumor-suppressing activity in human mammary epithelial cells | journal = Science | volume = 263 | issue = 5146 | pages = 526–9 | date = January 1994 | pmid = 8290962 | doi = 10.1126/science.8290962 }}</ref><ref name="Teoh_2014">{{cite journal | vauthors = Teoh SS, Vieusseux J, Prakash M, Berkowicz S, Luu J, Bird CH, Law RH, Rosado C, Price JT, Whisstock JC, Bird PI | title = Maspin is not required for embryonic development or tumour suppression | journal = Nature Communications | volume = 5 | pages = 3164 | year = 2014 | pmid = 24445777 | pmc = 3905777 | doi = 10.1038/ncomms4164 }}</ref> |
|||
| En ratones Knockout originalmente se reportó letal, pero después mostró no tener un fenotipo obvio<ref name="Gao_2004">{{cite journal | vauthors = Gao F, Shi HY, Daughty C, Cella N, Zhang M | title = Maspin plays an essential role in early embryonic development | journal = Development | volume = 131 | issue = 7 | pages = 1479–89 | date = April 2004 | pmid = 14985257 | doi = 10.1242/dev.01048 }}</ref> <ref name="Teoh_2014"/> |
|||
| |
|||
| 18q21.3 |
|||
|{{PDB2|1WZ9}} |
|||
|- |
|||
| [[SERPINB6]] |
|||
| [[SERPINB6|PI-6]] |
|||
|Intracelular |
|||
| Inhibidor de catepsina G.<ref name="Scott_1999">{{cite journal | vauthors = Scott FL, Hirst CE, Sun J, Bird CH, Bottomley SP, Bird PI | title = The intracellular serpin proteinase inhibitor 6 is expressed in monocytes and granulocytes and is a potent inhibitor of the azurophilic granule protease, cathepsin G | journal = Blood | volume = 93 | issue = 6 | pages = 2089–97 | date = March 1999 | pmid = 10068683 | doi = }}</ref> |
|||
|En ratones Knockout se presenta pérdida de audición<ref>{{cite journal | vauthors = Tan J, Prakash MD, Kaiserman D, Bird PI | title = Absence of SERPINB6A causes sensorineural hearing loss with multiple histopathologies in the mouse inner ear | journal = The American Journal of Pathology | volume = 183 | issue = 1 | pages = 49–59 | date = July 2013 | pmid = 23669344 | doi = 10.1016/j.ajpath.2013.03.009 }}</ref> y [[neutropenia]].<ref>{{cite journal | vauthors = Scarff KL, Ung KS, Nandurkar H, Crack PJ, Bird CH, Bird PI | title = Targeted disruption of SPI3/Serpinb6 does not result in developmental or growth defects, leukocyte dysfunction, or susceptibility to stroke | journal = Molecular and Cellular Biology | volume = 24 | issue = 9 | pages = 4075–82 | date = May 2004 | pmid = 15082799 | pmc = 387772 | doi = 10.1128/MCB.24.9.4075-4082.2004 }}</ref> |
|||
|Deficiencia asociada con pérdida del oído.<ref>{{cite book | title = Genetics of Nonsyndromic Recessively Inherited Moderate to Severe and Progressive Deafness in Humans | last = Naz | first = Sadaf | name-list-format = vanc | publisher = InTech | year = 2012 | isbn = 978-953-51-0366-0 | location = | pages = 260 | url = http://cdn.intechopen.com/pdfs/33872/InTech-Genetics_of_nonsyndromic_recessively_inherited_moderate_to_severe_and_progressive_deafness_in_humans.pdf | doi = 10.5772/31808 }}</ref> |
|||
| 6p25 |
|||
| |
|||
|- |
|||
| [[SERPINB7]] |
|||
| [[Megsin|Megsina]] |
|||
|Intracelular |
|||
| Relacionado con la maduración de megacariocitos |
|||
|Sobre expresión en ratones causa enfermedad del riñon.<ref name="Miyata_2007" /> En ratones Knockout no causa anormalidades histológicas.<ref name="Miyata_2007">{{cite journal | vauthors = Miyata T, Li M, Yu X, Hirayama N | title = Megsin gene: its genomic analysis, pathobiological functions, and therapeutic perspectives | journal = Current Genomics | volume = 8 | issue = 3 | pages = 203–8 | date = May 2007 | pmid = 18645605 | pmc = 2435355 | doi = 10.2174/138920207780833856 }}</ref> |
|||
|Mutatciones asociadas con [[Palmoplantar keratoderma|Nagashima-type Palmoplantar Keratosis]].<ref>{{cite journal | vauthors = Kubo A | title = Nagashima-type palmoplantar keratosis: a common Asian type caused by SERPINB7 protease inhibitor deficiency | journal = The Journal of Investigative Dermatology | volume = 134 | issue = 8 | pages = 2076–9 | date = August 2014 | pmid = 25029323 | doi = 10.1038/jid.2014.156 }}</ref> |
|||
| 18q21.3 |
|||
| |
|||
|- |
|||
| [[SERPINB8]] |
|||
| [[SERPINB8|PI-8]] |
|||
|Intracelular |
|||
| Possible Inhibidor de furina.<ref>{{cite journal | vauthors = Dahlen JR, Jean F, Thomas G, Foster DC, Kisiel W | title = Inhibition of soluble recombinant furin by human proteinase inhibitor 8 | journal = The Journal of Biological Chemistry | volume = 273 | issue = 4 | pages = 1851–4 | date = January 1998 | pmid = 9442015 | doi = 10.1074/jbc.273.4.1851 }}</ref> |
|||
| |
|||
| |
|||
| 18q21.3 |
|||
| |
|||
|- |
|||
| [[SERPINB9]] |
|||
| [[SERPINB9|PI-9]] |
|||
|Intracelular |
|||
| Inhibidor de the cytotoxic granule protease granzyme B.<ref name="Sun_1996">{{cite journal | vauthors = Sun J, Bird CH, Sutton V, McDonald L, Coughlin PB, De Jong TA, Trapani JA, Bird PI | title = A cytosolic granzyme B inhibitor related to the viral apoptotic regulator cytokine response modifier A is present in cytotoxic lymphocytes | journal = The Journal of Biological Chemistry | volume = 271 | issue = 44 | pages = 27802–9 | date = November 1996 | pmid = 8910377 | doi = 10.1074/jbc.271.44.27802 }}</ref> |
|||
|Disfunción inmune en ratones Knockout.<ref>{{cite journal | vauthors = Zhang M, Park SM, Wang Y, Shah R, Liu N, Murmann AE, Wang CR, Peter ME, Ashton-Rickardt PG | title = Serine protease inhibitor 6 protects cytotoxic T cells from self-inflicted injury by ensuring the integrity of cytotoxic granules | journal = Immunity | volume = 24 | issue = 4 | pages = 451–61 | date = April 2006 | pmid = 16618603 | doi = 10.1016/j.immuni.2006.02.002 }}</ref><ref name="Rizzitelli_2012">{{cite journal | vauthors = Rizzitelli A, Meuter S, Vega Ramos J, Bird CH, Mintern JD, Mangan MS, Villadangos J, Bird PI | title = Serpinb9 (Spi6)-deficient mice are impaired in dendritic cell-mediated antigen cross-presentation | journal = Immunology and Cell Biology | volume = 90 | issue = 9 | pages = 841–51 | date = October 2012 | pmid = 22801574 | doi = 10.1038/icb.2012.29 }}</ref> |
|||
| |
|||
| 6p25 |
|||
| |
|||
|- |
|||
| [[SERPINB10]] |
|||
| [[SERPINB10|Bomapina]] |
|||
|Intracelular |
|||
| Desconocida<ref>{{cite journal | vauthors = Riewald M, Chuang T, Neubauer A, Riess H, Schleef RR | title = Expression of bomapin, a novel human serpin, in normal/malignant hematopoiesis and in the monocytic cell lines THP-1 and AML-193 | journal = Blood | volume = 91 | issue = 4 | pages = 1256–62 | date = February 1998 | pmid = 9454755 | url = http://bloodjournal.hematologylibrary.org/content/91/4/1256.full }}</ref> |
|||
|No fenotipo obvio en ratones KO (C57/BL6; lab strain [http://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?db=nuccore&id=47125085 BC069938]). |
|||
| |
|||
| 18q21.3 |
|||
| |
|||
|- |
|||
| [[SERPINB11]] |
|||
| |
|||
|Intracelular |
|||
| Desconocidan<ref name="serpinb112">{{cite journal | vauthors = Askew DJ, Cataltepe S, Kumar V, Edwards C, Pace SM, Howarth RN, Pak SC, Askew YS, Brömme D, Luke CJ, Whisstock JC, Silverman GA | title = SERPINB11 is a new noninhibitory intracellular serpin. Common single nucleotide polymorphisms in the scaffold impair conformational change | journal = The Journal of Biological Chemistry | volume = 282 | issue = 34 | pages = 24948–60 | date = August 2007 | pmid = 17562709 | doi = 10.1074/jbc.M703182200 }}</ref> |
|||
|Deficiencia en ponis, asociada con la enfermedad de la separación de la pared del caso.<ref name="serpinb112"/> <ref name="Finno_2015">{{cite journal | vauthors = Finno CJ, Stevens C, Young A, Affolter V, Joshi NA, Ramsay S, Bannasch DL | title = SERPINB11 frameshift variant associated with novel hoof specific phenotype in Connemara ponies | journal = PLoS Genetics | volume = 11 | issue = 4 | pages = e1005122 | date = April 2015 | pmid = 25875171 | doi = 10.1371/journal.pgen.1005122 }}</ref> |
|||
| |
|||
| 18q21.3 |
|||
| |
|||
|- |
|||
| [[SERPINB12]] |
|||
| [[Yukopin|Yukopina]] |
|||
|Intracelular |
|||
| Desconocida<ref>{{cite journal | vauthors = Askew YS, Pak SC, Luke CJ, Askew DJ, Cataltepe S, Mills DR, Kato H, Lehoczky J, Dewar K, Birren B, Silverman GA | title = SERPINB12 is a novel member of the human ov-serpin family that is widely expressed and inhibits trypsin-like serine proteinases | journal = The Journal of Biological Chemistry | volume = 276 | issue = 52 | pages = 49320–30 | date = December 2001 | pmid = 11604408 | doi = 10.1074/jbc.M108879200 }}</ref> |
|||
| |
|||
| |
|||
| 18q21.3 |
|||
| |
|||
|- |
|||
| [[SERPINB13]] |
|||
| [[SERPINB13|Hurpina]] |
|||
|Intracelular |
|||
| Inhibidor de papain-like cysteine proteases.<ref>{{cite journal | vauthors = Welss T, Sun J, Irving JA, Blum R, Smith AI, Whisstock JC, Pike RN, von Mikecz A, Ruzicka T, Bird PI, Abts HF | title = Hurpin is a selective inhibitor of lysosomal cathepsin L and protects keratinocytes from ultraviolet-induced apoptosis | journal = Biochemistry | volume = 42 | issue = 24 | pages = 7381–9 | date = June 2003 | pmid = 12809493 | doi = 10.1021/bi027307q }}</ref> |
|||
| |
|||
| |
|||
| 18q21.3 |
|||
| |
|||
|- |
|||
| [[SERPINC1]] |
|||
| [[Antitrombina|Antithrombina]] |
|||
|Extracelular |
|||
| Inhibidor de [[coagulación]], especificamente [[factor X]], [[factor IX]] y [[trombina]].<ref name="Huntington_2006">{{cite journal | vauthors = Huntington JA | title = Shape-shifting serpins--advantages of a mobile mechanism | journal = Trends in Biochemical Sciences | volume = 31 | issue = 8 | pages = 427–35 | date = August 2006 | pmid = 16820297 | doi = 10.1016/j.tibs.2006.06.005 }}</ref> |
|||
|En ratones KO letal.<ref>{{cite journal | vauthors = Ishiguro K, Kojima T, Kadomatsu K, Nakayama Y, Takagi A, Suzuki M, Takeda N, Ito M, Yamamoto K, Matsushita T, Kusugami K, Muramatsu T, Saito H | title = Complete antithrombin deficiency in mice results in embryonic lethality | journal = The Journal of Clinical Investigation | volume = 106 | issue = 7 | pages = 873–8 | date = October 2000 | pmid = 11018075 | pmc = 517819 | doi = 10.1172/JCI10489 }}</ref> |
|||
|Deficiencia resulta en trombosis y otros desórdenes de coagulación(serpinopatía).<ref name="Patnaik MM 2516"/><ref>{{cite journal | vauthors = Huntington JA | title = Serpin structure, function and dysfunction | journal = Journal of Thrombosis and Haemostasis | volume = 9 Suppl 1 | pages = 26–34 | date = July 2011 | pmid = 21781239 | doi = 10.1111/j.1538-7836.2011.04360.x }}</ref> |
|||
| 1q23-q21 |
|||
|{{PDB2|2ANT}}, {{PDB2|2ZNH}}, {{PDB2|1AZX}}, {{PDB2|1TB6}}, {{PDB2|2GD4}}, {{PDB2|1T1F}} |
|||
|- |
|||
| [[SERPIND1]] |
|||
| [[Heparin cofactor II|Cofactor de heparina II]] |
|||
|Extracelular |
|||
| Inhibidor de trombina.<ref>{{cite journal | vauthors = Vicente CP, He L, Pavão MS, Tollefsen DM | title = Antithrombotic activity of dermatan sulfate in heparin cofactor II-deficient mice | journal = Blood | volume = 104 | issue = 13 | pages = 3965–70 | date = December 2004 | pmid = 15315969 | doi = 10.1182/blood-2004-02-0598 }}</ref> |
|||
|En ratones KO letal.<ref>{{cite journal | vauthors = Aihara K, Azuma H, Akaike M, Ikeda Y, Sata M, Takamori N, Yagi S, Iwase T, Sumitomo Y, Kawano H, Yamada T, Fukuda T, Matsumoto T, Sekine K, Sato T, Nakamichi Y, Yamamoto Y, Yoshimura K, Watanabe T, Nakamura T, Oomizu A, Tsukada M, Hayashi H, Sudo T, Kato S, Matsumoto T | title = Strain-dependent embryonic lethality and exaggerated vascular remodeling in heparin cofactor II-deficient mice | journal = The Journal of Clinical Investigation | volume = 117 | issue = 6 | pages = 1514–26 | date = June 2007 | pmid = 17549254 | pmc = 1878511 | doi = 10.1172/JCI27095 }}</ref> |
|||
| |
|||
| 22q11 |
|||
|{{PDB2|1JMJ}}, {{PDB2|1JMO}} |
|||
|- |
|||
| [[SERPINE1]] |
|||
| [[Plasminogen activator inhibitor 1]] |
|||
|Extracelular |
|||
| Inhibidor de thrombin, uPA y TPa.<ref name="Cale_2007">{{cite journal | vauthors = Cale JM, Lawrence DA | title = Structure-function relationships of plasminogen activator inhibitor-1 and its potential as a therapeutic agent | journal = Current Drug Targets | volume = 8 | issue = 9 | pages = 971–81 | date = September 2007 | pmid = 17896949 | doi = 10.2174/138945007781662337 }}</ref> |
|||
| |
|||
| |
|||
| 7q21.3-q22 |
|||
|{{PDB2|1DVN}}, {{PDB2|1OC0}} |
|||
|- |
|||
| [[SERPINE2]] |
|||
| [[SERPINE2|Glia derived nexin]] / [[SERPINE2|Protease nexin I]] |
|||
|Extracelular |
|||
| Inhibidor de uPA and tPA.<ref name="Lino_2007">{{cite journal | vauthors = Lino MM, Atanasoski S, Kvajo M, Fayard B, Moreno E, Brenner HR, Suter U, Monard D | title = Mice lacking protease nexin-1 show delayed structural and functional recovery after sciatic nerve crush | journal = The Journal of Neuroscience | volume = 27 | issue = 14 | pages = 3677–85 | date = April 2007 | pmid = 17409231 | doi = 10.1523/JNEUROSCI.0277-07.2007 }}</ref> |
|||
|Expresión anormal lleva a infertilidad masculina.<ref>{{cite journal | vauthors = Murer V, Spetz JF, Hengst U, Altrogge LM, de Agostini A, Monard D | title = Male fertility defects in mice lacking the serine protease inhibitor protease nexin-1 | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 98 | issue = 6 | pages = 3029–33 | date = March 2001 | pmid = 11248026 | pmc = 30601 | doi = 10.1073/pnas.051630698 }}</ref> En ratones KO causa epilepsia.<ref name="Lüthi_1997">{{cite journal | vauthors = Lüthi A, Van der Putten H, Botteri FM, Mansuy IM, Meins M, Frey U, Sansig G, Portet C, Schmutz M, Schröder M, Nitsch C, Laurent JP, Monard D | title = Endogenous serine protease inhibitor modulates epileptic activity and hippocampal long-term potentiation | journal = The Journal of Neuroscience | volume = 17 | issue = 12 | pages = 4688–99 | date = June 1997 | pmid = 9169529 | doi = }}</ref> |
|||
| |
|||
| 2q33-q35 |
|||
|{{PDB2|4DY0}} |
|||
|- |
|||
| [[SERPINF1]] |
|||
| [[SERPINF1|Factor derivado del epitelio pigmentado d]] |
|||
|Extracelular |
|||
| No-inhibitorio, potente molecula anti-angiogenica .<ref name="pedf2">{{cite journal | vauthors = Doll JA, Stellmach VM, Bouck NP, Bergh AR, Lee C, Abramson LP, Cornwell ML, Pins MR, Borensztajn J, Crawford SE | title = Pigment epithelium-derived factor regulates the vasculature and mass of the prostate and pancreas | journal = Nature Medicine | volume = 9 | issue = 6 | pages = 774–80 | date = June 2003 | pmid = 12740569 | doi = 10.1038/nm870 }}</ref> PEDF ha sido reportada por unir ácido hialurónico glicosaminoglicano.<ref name="Becerra_2008">{{cite journal | vauthors = Becerra SP, Perez-Mediavilla LA, Weldon JE, Locatelli-Hoops S, Senanayake P, Notari L, Notario V, Hollyfield JG | title = Pigment epithelium-derived factor binds to hyaluronan. Mapping of a hyaluronan binding site | journal = The Journal of Biological Chemistry | volume = 283 | issue = 48 | pages = 33310–20 | date = November 2008 | pmid = 18805795 | pmc = 2586245 | doi = 10.1074/jbc.M801287200 }}</ref> |
|||
|En ratones KO afecta la vasculatura y masa del pancreas y la próstata.<ref name="pedf2"/> <ref name="PEDF2">{{cite journal | vauthors = Andreu-Agulló C, Morante-Redolat JM, Delgado AC, Fariñas I | title = Vascular niche factor PEDF modulates Notch-dependent stemness in the adult subependymal zone | journal = Nature Neuroscience | volume = 12 | issue = 12 | pages = 1514–23 | date = December 2009 | pmid = 19898467 | doi = 10.1038/nn.2437 }}</ref> Mutaciones en humanos causa [[osteogenesis imperfecta]] tipo VI.<ref name="Homan_2011">{{cite journal | vauthors = Homan EP, Rauch F, Grafe I, Lietman C, Doll JA, Dawson B, Bertin T, Napierala D, Morello R, Gibbs R, White L, Miki R, Cohn DH, Crawford S, Travers R, Glorieux FH, Lee B | title = Mutations in SERPINF1 cause osteogenesis imperfecta type VI | journal = Journal of Bone and Mineral Research | volume = 26 | issue = 12 | pages = 2798–803 | date = December 2011 | pmid = 21826736 | pmc = 3214246 | doi = 10.1002/jbmr.487 }}</ref> |
|||
| |
|||
| 17p13.3 |
|||
|{{PDB2|1IMV}} |
|||
|- |
|||
| [[SERPINF2]] |
|||
| [[Alpha 2-antiplasmin|α2-antiplasmina]] |
|||
|Extracelular |
|||
| Inhibidor de plasmina, inhibidor of [[fibrinolysis|fibrinolisis]].<ref name="Wiman_1979">{{cite journal | vauthors = Wiman B, Collen D | title = On the mechanism of the reaction between human alpha 2-antiplasmin and plasmin | journal = The Journal of Biological Chemistry | volume = 254 | issue = 18 | pages = 9291–7 | date = September 1979 | pmid = 158022 | doi = }}</ref> |
|||
|En ratones Knockouts se muestra aumento de [[fibrinolisis]] pero sin desorden de hemorragia.<ref>{{cite journal | vauthors = Lijnen HR, Okada K, Matsuo O, Collen D, Dewerchin M | title = Alpha2-antiplasmin gene deficiency in mice is associated with enhanced fibrinolytic potential without overt bleeding | journal = Blood | volume = 93 | issue = 7 | pages = 2274–81 | date = April 1999 | pmid = 10090937 }}</ref> |
|||
|Deficiencyia causa un raro desorden de sangramiento.<ref>{{cite journal | vauthors = Carpenter SL, Mathew P | title = Alpha2-antiplasmin and its deficiency: fibrinolysis out of balance | journal = Haemophilia | volume = 14 | issue = 6 | pages = 1250–4 | date = November 2008 | pmid = 19141165 | doi = 10.1111/j.1365-2516.2008.01766.x }}</ref><ref>{{cite journal|title = Congenital α2-plasmin inhibitor deficiencies: a review | journal = British Journal of Haematology| date = 1 July 2001 | issn = 1365-2141 | pages = 4–10 | volume = 114 | issue = 1 | doi = 10.1046/j.1365-2141.2001.02845.x | first = R. | last = Favier | first2 = N. | last2 = Aoki | first3 = P. | last3 = De Moerloose | name-list-format = vanc }}</ref> |
|||
| 17pter-p12 |
|||
|{{PDB2|2R9Y}} |
|||
|- |
|||
| [[SERPING1]] |
|||
| [[C1-inhibitor|Complement 1-inhibitor]] |
|||
|Extracelular |
|||
| Inhibidor de esterasa C1.<ref name="Beinrohr_2007">{{cite journal | vauthors = Beinrohr L, Harmat V, Dobó J, Lörincz Z, Gál P, Závodszky P | title = C1 inhibitor serpin domain structure reveals the likely mechanism of heparin potentiation and conformational disease | journal = The Journal of Biological Chemistry | volume = 282 | issue = 29 | pages = 21100–9 | date = July 2007 | pmid = 17488724 | doi = 10.1074/jbc.M700841200 }}</ref> |
|||
| |
|||
|Varios polomorfismos asaociados con degeneración [[macular degeneration|macular]]<ref>{{cite journal | vauthors = Mollnes TE, Jokiranta TS, Truedsson L, Nilsson B, Rodriguez de Cordoba S, Kirschfink M | title = Complement analysis in the 21st century | journal = Molecular Immunology | volume = 44 | issue = 16 | pages = 3838–49 | date = September 2007 | pmid = 17768101 | doi = 10.1016/j.molimm.2007.06.150 }}</ref> angeoedema hereditaria.<ref>{{cite journal | vauthors = Triggianese P, Chimenti MS, Toubi E, Ballanti E, Guarino MD, Perricone C, Perricone R | title = The autoimmune side of hereditary angioedema: insights on the pathogenesis | journal = Autoimmunity Reviews | volume = 14 | issue = 8 | pages = 665–9 | date = August 2015 | pmid = 25827463 | doi = 10.1016/j.autrev.2015.03.006 }}</ref> |
|||
| 11q11-q13.1 |
|||
|{{PDB2|2OAY}} |
|||
|- |
|||
| [[SERPINH1]] |
|||
| [[47 kDa Heat shock protein]] (HSP47) |
|||
|Intracelular |
|||
| No-inhibitoria,chaperon molecular en doblaje de colágeno.<ref name="Mala_2010"/> |
|||
|En ratones KO letal<ref>{{cite journal | vauthors = Nagai N, Hosokawa M, Itohara S, Adachi E, Matsushita T, Hosokawa N, Nagata K | title = Embryonic lethality of molecular chaperone hsp47 knockout mice is associated with defects in collagen biosynthesis | journal = The Journal of Cell Biology | volume = 150 | issue = 6 | pages = 1499–506 | date = September 2000 | pmid = 10995453 | pmc = 2150697 | doi = 10.1083/jcb.150.6.1499 }}</ref> |
|||
|Mutación en humanos causa [[osteogenesis imperfecta]] severa.<ref>{{cite journal | vauthors = Marini JC, Reich A, Smith SM | title = Osteogenesis imperfecta due to mutations in non-collagenous genes: lessons in the biology of bone formation | journal = Current Opinion in Pediatrics | volume = 26 | issue = 4 | pages = 500–7 | date = August 2014 | pmid = 25007323 | pmc = 4183132 | doi = 10.1097/MOP.0000000000000117 }}</ref><ref>{{cite journal | vauthors = Byers PH, Pyott SM | title = Recessively inherited forms of osteogenesis imperfecta | journal = Annual Review of Genetics | volume = 46 | pages = 475–97 | date = 1 January 2012 | pmid = 23145505 | doi = 10.1146/annurev-genet-110711-155608 }}</ref> |
|||
| 11p15 |
|||
|{{PDB2|4AXY}} |
|||
|- |
|||
| [[SERPINI1]] |
|||
| [[SERPINI1|Neuroserpina]] |
|||
|Extracelular |
|||
| Inhibiidor de tPA, uPA y plasmina.<ref name="Osterwalder_1998">{{cite journal | vauthors = Osterwalder T, Cinelli P, Baici A, Pennella A, Krueger SR, Schrimpf SP, Meins M, Sonderegger P | title = The axonally secreted serine proteinase inhibitor, neuroserpin, inhibits plasminogen activators and plasmin but not thrombin | journal = The Journal of Biological Chemistry | volume = 273 | issue = 4 | pages = 2312–21 | date = January 1998 | pmid = 9442076 | doi = 10.1074/jbc.273.4.2312 }}</ref> |
|||
| |
|||
|La mutación causa demencia [[Familial encephalopathy with neuroserpin inclusion bodies|FENIB]] (serpinopatíay).<ref>{{cite journal | vauthors = Crowther DC | title = Familial conformational diseases and dementias | journal = Human Mutation | volume = 20 | issue = 1 | pages = 1–14 | date = July 2002 | pmid = 12112652 | doi = 10.1002/humu.10100 }}</ref><ref>{{cite journal | vauthors = Belorgey D, Hägglöf P, Karlsson-Li S, Lomas DA | title = Protein misfolding and the serpinopathies | journal = Prion | volume = 1 | issue = 1 | pages = 15–20 | date = 1 March 2007 | pmid = 19164889 | pmc = 2633702 | doi=10.4161/pri.1.1.3974}}</ref> |
|||
| 3q26 |
|||
|{{PDB2|1JJO}}, {{PDB2|3FGQ}}, {{PDB2|3F5N}}, {{PDB2|3F02}} |
|||
|- |
|||
| [[SERPINI2]] |
|||
| [[SERPINI2|Pancpina]] |
|||
|Extracelular |
|||
| Desconocida<ref name="pancipin">{{cite journal | vauthors = Ozaki K, Nagata M, Suzuki M, Fujiwara T, Miyoshi Y, Ishikawa O, Ohigashi H, Imaoka S, Takahashi E, Nakamura Y | title = Isolation and characterization of a novel human pancreas-specific gene, pancpin, that is down-regulated in pancreatic cancer cells | journal = Genes, Chromosomes & Cancer | volume = 22 | issue = 3 | pages = 179–85 | date = July 1998 | pmid = 9624529 | doi = 10.1002/(SICI)1098-2264(199807)22:3<179::AID-GCC3>3.0.CO;2-T }}</ref> |
|||
|Deficiencia en ratones causa insuficiencia pancreática por la pérdida de células acinares.<ref name="Loftus_2005">{{cite journal | vauthors = Loftus SK, Cannons JL, Incao A, Pak E, Chen A, Zerfas PM, Bryant MA, Biesecker LG, Schwartzberg PL, Pavan WJ | title = Acinar cell apoptosis in Serpini2-deficient mice models pancreatic insufficiency | journal = PLoS Genetics | volume = 1 | issue = 3 | pages = e38 | date = September 2005 | pmid = 16184191 | pmc = 1231717 | doi = 10.1371/journal.pgen.0010038 }}</ref> |
|||
| |
|||
| 3q26 |
|||
| |
|||
|} |
|||
|} |
|||
====Serpinas especializadas de mamíferos==== |
|||
Muchas serpinas de mamíferos han sido identificadas demostrando no tener una ortología obvia que compartir con la contraparte humana de la serpina. Ejemplos incluyen numeroras serpinas de roedores (particularmente algunas de las serpinas de murino intraelular) como también las serpinas uterinas. El término serpina uterina se refiere a los miembros del clado A de serpinas que son codificadas por el gen SERPINA14. Las serpinas uterinas son producidas por el [[endometrio]] en un grupo restringido de mamíferos bajo la influencia de [[progesterona]] y [[estrógeno]].<ref name="Padua_2010">{{cite journal | vauthors = Padua MB, Kowalski AA, Cañas MY, Hansen PJ | title = The molecular phylogeny of uterine serpins and its relationship to evolution of placentation | journal = FASEB Journal | volume = 24 | issue = 2 | pages = 526–37 | date = February 2010 | pmid = 19825977 | doi = 10.1096/fj.09-138453 }}</ref> Probablemente son ihibidores de proteinasa no funcionales y pueden funcionar durante el embarazo para inhibir la respuesta inmune materna contra el zigoto o para participar en el transporte transplacentaria.<ref name="Padua_Hansen_2010">{{cite journal | vauthors = Padua MB, Hansen PJ | title = Evolution and function of the uterine serpins (SERPINA14) | journal = American Journal of Reproductive Immunology | volume = 64 | issue = 4 | pages = 265–74 | date = October 2010 | pmid = 20678169 | doi = 10.1111/j.1600-0897.2010.00901.x }}</ref> |
|||
===Insectos=== |
|||
El genoma de ''[[Drosophila melanogaster]]'' contiene 29 genes codificadores de serpina.El análisis de la secuencia de aminoácidos ha colocado 14 de estas serpinas en el clado de serpinas Q y 3 serpinas en el clado K con las 12 restantes clasificadas como serpinas huérfanas al no pertenecer a ningún clado.<ref name="Reichhart_2005" >{{cite journal | vauthors = Reichhart JM | title = Tip of another iceberg: Drosophila serpins | journal = Trends in Cell Biology | volume = 15 | issue = 12 | pages = 659–65 | date = December 2005 | pmid = 16260136 | doi = 10.1016/j.tcb.2005.10.001 }}</ref> El sistema de clasificación de clados es difícil de usar para ''Drosophila'' serpins y en lugar, un sistema de nomenclatura se adoptó basado en la posición de los genes de serpina en los cromosomas de ''Drosophila''. Trece de las serpinas de ''Drosophila'' se encuentran como genes aislados en el genoma (incluyendo Serpina-27A,), con las 16 restantes organizadas en 5 agrupaciones de genes que ocurren en las posiciones del cromosoma 28D (2 serpinas), 42D (5 serpinas), 43A (4 serpinas), 77B (3 serpinas) y 88E (2 serpinas).<ref name="Reichhart_2005"/><ref name="Tang_2008">{{cite journal | vauthors = Tang H, Kambris Z, Lemaitre B, Hashimoto C | title = A serpin that regulates immune melanization in the respiratory system of Drosophila | journal = Developmental Cell | volume = 15 | issue = 4 | pages = 617–26 | date = October 2008 | pmid = 18854145 | pmc = 2671232 | doi = 10.1016/j.devcel.2008.08.017 }}</ref><ref name="Scherfer_2008">{{cite journal | vauthors = Scherfer C, Tang H, Kambris Z, Lhocine N, Hashimoto C, Lemaitre B | title = Drosophila Serpin-28D regulates hemolymph phenoloxidase activity and adult pigmentation | journal = Developmental Biology | volume = 323 | issue = 2 | pages = 189–96 | date = November 2008 | pmid = 18801354 | doi = 10.1016/j.ydbio.2008.08.030 }}</ref> |
|||
Estudios en las serpinas de ''Drosophila'' revelan que la Serpina-27A inhibe la proteasa de pascua(la proteasa final en el Nudel) Al igual que su rol central en los patrones embrionicos, la señalización también es importante para la respuesta inmune inata en insectos. Aparentemente, la serpina-27A también funciona para controlar la respuesta inmune de los insectos.<ref name="Hashimoto 945–950"/><ref>{{cite journal | vauthors = Rushlow C | title = Dorsoventral patterning: a serpin pinned down at last | journal = Current Biology | volume = 14 | issue = 1 | pages = R16-8 | date = January 2004 | pmid = 14711428 | doi = 10.1016/j.cub.2003.12.015 }}</ref><ref>{{cite journal | vauthors = Ligoxygakis P, Roth S, Reichhart JM | title = A serpin regulates dorsal-ventral axis formation in the Drosophila embryo | journal = Current Biology | volume = 13 | issue = 23 | pages = 2097–102 | date = December 2003 | pmid = 14654000 | doi = 10.1016/j.cub.2003.10.062 }}</ref><ref name="Jiang_2011">{{cite journal | vauthors = Jiang R, Zhang B, Kurokawa K, So YI, Kim EH, Hwang HO, Lee JH, Shiratsuchi A, Zhang J, Nakanishi Y, Lee HS, Lee BL | title = 93-kDa twin-domain serine protease inhibitor (Serpin) has a regulatory function on the beetle Toll proteolytic signaling cascade | journal = The Journal of Biological Chemistry | volume = 286 | issue = 40 | pages = 35087–95 | date = October 2011 | pmid = 21862574 | pmc = 3186399 | doi = 10.1074/jbc.M111.277343 }}</ref> |
|||
===Nematodos=== |
|||
El genoma del gusano [[Nematoda|nematodo]] ''[[Caenorhabditis elegans|C. elegans]]'' contaiene 9 serpinas, de las cuales ninguna tiene secuencias de señalización y por lo tanto son intracelulares.<ref name="elegans1">{{cite journal | vauthors = Pak SC, Kumar V, Tsu C, Luke CJ, Askew YS, Askew DJ, Mills DR, Brömme D, Silverman GA | title = SRP-2 is a cross-class inhibitor that participates in postembryonic development of the nematode Caenorhabditis elegans: initial characterization of the clade L serpins | journal = The Journal of Biological Chemistry | volume = 279 | issue = 15 | pages = 15448–59 | date = April 2004 | pmid = 14739286 | doi = 10.1074/jbc.M400261200 }}</ref> Sin embargo, sólo 5 de estas serpinas parecen funcionas como inhibidores de proteasa.<ref name="elegans1"/> Un, SRP-6, realiza una función protectora y protege contra la ruptura inducida por estrés asociada con calpaína. Además, SRP-6 inhibe las proteasas de cisteían lisosomales liberadas por la ruptura del lisosoma..<ref>{{cite journal | vauthors = Luke CJ, Pak SC, Askew YS, Naviglia TL, Askew DJ, Nobar SM, Vetica AC, Long OS, Watkins SC, Stolz DB, Barstead RJ, Moulder GL, Brömme D, Silverman GA | title = An intracellular serpin regulates necrosis by inhibiting the induction and sequelae of lysosomal injury | journal = Cell | volume = 130 | issue = 6 | pages = 1108–19 | date = September 2007 | pmid = 17889653 | pmc = 2128786 | doi = 10.1016/j.cell.2007.07.013 }}</ref> |
|||
===Plantas=== |
|||
Las serpinas de las plantas estaban entre los primeros miembros de la superfamilia en ser identificados.<ref>{{cite journal | vauthors = Hejgaard J, Rasmussen SK, Brandt A, SvendsenI | title = Sequence homology between barley endosperm protein Z and protease inhibitors of the alpha-1-antitrypsin family | journal = FEBS Lett. | volume = 180 | issue = 1 | year = 1985 | pages = 89–94 | doi = 10.1016/0014-5793(85)80238-6 }}</ref> Las serpinas de plantas son poderosos inhibidores de proteasas de serina como quimotripsina de mamíferos, ''in vitro'', el ejemplo mejor estudiado siendo la serpina Zx (BSZx), que es capaz de inhibir tripsina y quimotripsina al igual que a diversos factores de coagulación.<ref>{{cite journal | vauthors = Dahl SW, Rasmussen SK, Petersen LC, Hejgaard J | title = Inhibition of coagulation factors by recombinant barley serpin BSZx | journal = FEBS Letters | volume = 394 | issue = 2 | pages = 165–8 | date = September 1996 | pmid = 8843156 | doi = 10.1016/0014-5793(96)00940-4 }}</ref> Sin embargo, parientes cercanos de la proteasa de serina como quimotripsina están ausentes en plantas. El RCL de varias serpinas de grano de trigo y centeno contien seuencias que repiten poli-Q similares a esas presentes en las proteínas de almacenamiento de [[prolamina]] del [[Endospermo|endoesperma]].<ref>{{cite journal | vauthors = Ostergaard H, Rasmussen SK, Roberts TH, Hejgaard J | title = Inhibitory serpins from wheat grain with reactive centers resembling glutamine-rich repeats of prolamin storage proteins. Cloning and characterization of five major molecular forms | journal = The Journal of Biological Chemistry | volume = 275 | issue = 43 | pages = 33272–9 | date = October 2000 | pmid = 10874043 | doi = 10.1074/jbc.M004633200 }}</ref> Ha sido entonces sugerido que las serpinas de las plantas funcionen mejor en inhibir proteasas de insectos o microbios que de otra manera digerirían las proteínas de almacenamiento de granos. Soportando esta hipótesis diferentes serpinas de plantas han sido idenificadas en la [[savia]] del [[floema]] de la calabaza (CmPS-1)<ref name="plant">{{cite journal | vauthors = Yoo BC, Aoki K, Xiang Y, Campbell LR, Hull RJ, Xoconostle-Cázares B, Monzer J, Lee JY, Ullman DE, Lucas WJ | title = Characterization of cucurbita maxima phloem serpin-1 (CmPS-1). A developmentally regulated elastase inhibitor | journal = The Journal of Biological Chemistry | volume = 275 | issue = 45 | pages = 35122–8 | date = November 2000 | pmid = 10960478 | doi = 10.1074/jbc.M006060200 }}</ref> y plantas de pepino.<ref>{{cite journal | vauthors = la Cour Petersen M, Hejgaard J, Thompson GA, Schulz A | title = Cucurbit phloem serpins are graft-transmissible and appear to be resistant to turnover in the sieve element-companion cell complex | journal = Journal of Experimental Botany | volume = 56 | issue = 422 | pages = 3111–20 | date = December 2005 | pmid = 16246856 | doi = 10.1093/jxb/eri308 }}</ref><ref>{{cite journal | vauthors = Roberts TH, Hejgaard J | title = Serpins in plants and green algae | journal = Functional & Integrative Genomics | volume = 8 | issue = 1 | pages = 1–27 | date = February 2008 | pmid = 18060440 | doi = 10.1007/s10142-007-0059-2 }}</ref> Aunque se observó una correlación inversa entre la expresión de CmPS-1 y la supervivencia áfida, ''in vitro'' más experimentacion reveló que el CmPS-1 recombinante no parecía afectar la supervivencia de los insectos.<ref name="plant" /> |
|||
Roles alternativos y las proteasas objetivo para las serpinas de las plantas han sido propuestos. La serpina ''Arabidopsis'', AtSerpin1 (At1g47710; {{PDB2|3LE2}}), regula el punto de control sobre la muerte celular programada al marcar como objetivo (RD21) la proteasa de cisteína como papaína.<ref name="Lampl_2010" /><ref>{{cite journal | vauthors = Lampl N, Alkan N, Davydov O, Fluhr R | title = Set-point control of RD21 protease activity by AtSerpin1 controls cell death in Arabidopsis | journal = The Plant Journal | volume = 74 | issue = 3 | pages = 498–510 | date = May 2013 | pmid = 23398119 | doi = 10.1111/tpj.12141 }}</ref><ref name="Vercammen_2006" /> Otras dos serpinas ''Arabidopsis'' , AtSRP2 (At2g14540) y AtSRP3 (At1g64030) parecen estar relacionadas con respuestas al daño del ADN.<ref>{{cite journal | vauthors = Ahn JW, Atwell BJ, Roberts TH | title = Serpin genes AtSRP2 and AtSRP3 are required for normal growth sensitivity to a DNA alkylating agent in Arabidopsis | journal = BMC Plant Biology | volume = 9 | pages = 52 | year = 2009 | pmid = 19426562 | pmc = 2689219 | doi = 10.1186/1471-2229-9-52 }}</ref> |
|||
===Hongos=== |
|||
Una sola serpina [[Fungus|fungal]] ha sido caracterizada: celpina de ''[[Neocallimastigomycota|Piromyces]]'' [[spp.]] cepa E2. ''Piromyces'' es [[genus|género]]<nowiki/>ode hongo anaeróbico encontrado en el intestino de los rumiantes y es importante para la digestión de plantas. Se predice que la celpina es inhibitoria y contiene dos dominion con terminales-N además del dominio de la serpina.<ref name="Steenbakkers_2008"/> se sugiere que la celpina pueda proteger la celulosoma de proteasas de plantas..<ref name="thermo2"/> |
|||
===Procariotas === |
|||
Genes predecidos de serpina están distribuidos esporádicamente en procariotas.Estudios ''In vitro'' de algunas de las moléculas han revelado que son capaces de inhibir proteasas, y se sugiere que funcionan como inhibidores ''in vivo''. Varias serpinas procariotas se encuentran en extremofilos. En contraste con las serpinas de mamíferos, estas moléculas poseen gran resistencia a la desnaturalización por calor.<ref>{{cite journal | vauthors = Irving JA, Cabrita LD, Rossjohn J, Pike RN, Bottomley SP, Whisstock JC | title = The 1.5 A crystal structure of a prokaryote serpin: controlling conformational change in a heated environment | journal = Structure | volume = 11 | issue = 4 | pages = 387–97 | date = April 2003 | pmid = 12679017 | doi = 10.1016/S0969-2126(03)00057-1 }}</ref><ref>{{cite journal | vauthors = Fulton KF, Buckle AM, Cabrita LD, Irving JA, Butcher RE, Smith I, Reeve S, Lesk AM, Bottomley SP, Rossjohn J, Whisstock JC | title = The high resolution crystal structure of a native thermostable serpin reveals the complex mechanism underpinning the stressed to relaxed transition | journal = The Journal of Biological Chemistry | volume = 280 | issue = 9 | pages = 8435–42 | date = March 2005 | pmid = 15590653 | doi = 10.1074/jbc.M410206200 }}</ref> El papel preciso de la mayoría de las serpinas bacterianas permanece sin conocerse, aunque la serpina de ''[[Clostridium thermocellum]]'' se localiza en la celulosoma. Se considera que el rol de las serpinas asociadas a la celulosoma puedan ser de prevención de la activida de proteasas no deseadas contra la celulosoma.<ref name="thermo2">{{cite journal | vauthors = Kang S, Barak Y, Lamed R, Bayer EA, Morrison M | title = The functional repertoire of prokaryote cellulosomes includes the serpin superfamily of serine proteinase inhibitors | journal = Molecular Microbiology | volume = 60 | issue = 6 | pages = 1344–54 | date = June 2006 | pmid = 16796673 | doi = 10.1111/j.1365-2958.2006.05182.x }}</ref> |
|||
===Viral=== |
|||
Las serpinas también se expresan en virus como una manera de evitar la defensas inmunes del huésped.<ref name="Turner_2002">{{cite journal | vauthors = Turner PC, Moyer RW | title = Poxvirus immune modulators: functional insights from animal models | journal = Virus Research | volume = 88 | issue = 1-2 | pages = 35–53 | date = September 2002 | pmid = 12297326 | doi = 10.1016/S0168-1702(02)00119-3 }}</ref> En particular, las serpinas se expresan por virus de viruela, incluyendo viruela de la vaca (vaccinia) y viruela del conejo (myxoma), son de interés porque su uso potencial como nueva terapia para desórdenes inmunes e inflmatorios como para terapia de trasplante.<ref name="Richardson_2006">{{cite journal | vauthors = Richardson J, Viswanathan K, Lucas A | title = Serpins, the vasculature, and viral therapeutics | journal = Frontiers in Bioscience | volume = 11 | issue = | pages = 1042–56 | year = 2006 | pmid = 16146796 | doi = 10.2741/1862 }}</ref><ref name="Jiang_2007">{{cite journal | vauthors = Jiang J, Arp J, Kubelik D, Zassoko R, Liu W, Wise Y, Macaulay C, Garcia B, McFadden G, Lucas AR, Wang H | title = Induction of indefinite cardiac allograft survival correlates with toll-like receptor 2 and 4 downregulation after serine protease inhibitor-1 (Serp-1) treatment | journal = Transplantation | volume = 84 | issue = 9 | pages = 1158–67 | date = November 2007 | pmid = 17998872 | doi = 10.1097/01.tp.0000286099.50532.b0 | subscription = yes }}</ref> Serp1 suprime la respuesta inmune inata de TLR y permite la supervivencia del injerto cardiaco en ratas.<ref name="Richardson_2006"/><ref name="Dai_2003">{{cite journal | vauthors = Dai E, Guan H, Liu L, Little S, McFadden G, Vaziri S, Cao H, Ivanova IA, Bocksch L, Lucas A | title = Serp-1, a viral anti-inflammatory serpin, regulates cellular serine proteinase and serpin responses to vascular injury | journal = The Journal of Biological Chemistry | volume = 278 | issue = 20 | pages = 18563–72 | date = May 2003 | pmid = 12637546 | doi = 10.1074/jbc.M209683200 }}</ref> Crma y Serp2 son ambos inhibidores de clases cruzadas y tienen como objetivo tanto proteasas de serina como de cisteína.<ref name="Turner_1999">{{cite journal | vauthors = Turner PC, Sancho MC, Thoennes SR, Caputo A, Bleackley RC, Moyer RW | title = Myxoma virus Serp2 is a weak inhibitor of granzyme B and interleukin-1beta-converting enzyme in vitro and unlike CrmA cannot block apoptosis in cowpox virus-infected cells | journal = Journal of Virology | volume = 73 | issue = 8 | pages = 6394–404 | date = August 1999 | pmid = 10400732 | pmc = 112719 | doi = }}</ref><ref name="Munuswamy-Ramanujam_2006">{{cite journal | vauthors = Munuswamy-Ramanujam G, Khan KA, Lucas AR | title = Viral anti-inflammatory reagents: the potential for treatment of arthritic and vasculitic disorders | journal = Endocrine, Metabolic & Immune Disorders Drug Targets | volume = 6 | issue = 4 | pages = 331–43 | date = December 2006 | pmid = 17214579 | doi = 10.2174/187153006779025720 }}</ref> En comparación con su contraparte en mamíferos, las serpinas virales contienen deleciones significativas de elementos de estructura secundaria. Específicamente, el crmA carece de la hélice-D en la misma proporción que las hélices A y E..<ref name="Renatus_2000">{{cite journal | vauthors = Renatus M, Zhou Q, Stennicke HR, Snipas SJ, Turk D, Bankston LA, Liddington RC, Salvesen GS | title = Crystal structure of the apoptotic suppressor CrmA in its cleaved form | journal = Structure | volume = 8 | issue = 7 | pages = 789–97 | date = July 2000 | pmid = 10903953 | doi = 10.1016/S0969-2126(00)00165-9 }}</ref> |
|||
{{clear}} |
|||
== Véase también == |
== Véase también == |
||
| Línea 38: | Línea 567: | ||
== Referencias == |
== Referencias == |
||
{{listaref}} |
{{listaref}} |
||
{{notelist}} |
|||
{{Reflist|30em}} |
|||
Revisión del 09:57 17 jun 2016
Plantilla:Featured article Plantilla:Use dmy dates
| Serpina | ||
|---|---|---|
| Identificadores | ||
| Símbolo | Serpin, SERPIN (root symbol of family) | |
| Pfam | PF00079 | |
| InterPro | IPR000215 | |
| SCOP | 1hle | |
| CDD | cd00172 | |
Estructuras PDB disponibles: 1m37
A:1-378 1hle B:349-379 1jrr A:1-415 1by7 A:1-415 1ova A:1-385 1uhg A:1-385 1jti B:1-385 1att B:77-433 1nq9 L:76-461 1oyh I:76-461 1e03 L:76-461 1e05 I:76-461 1br8 L:76-461 1r1l L:76-461 1lk6 L:76-461 1ant L:76-461 2beh L:76-461 1dzh L:76-461 1ath A:78-461 1tb6 I:76-461 2ant I:76-461p 1dzg I:76-461 1azx L:76-461 1jvq I:76-461 1sr5 A:76-461 1e04 I:76-461 1xqg A:1-375 1xu8 B:1-375 1wz9 B:1-375 1xqj A:1-375 1c8o A:1-300 1m93 A:1-55 1f0c A:1-305 1k9o I:18-392 1sek :18-369 1atu
:45-415
1ezx B:383-415 8api A:43-382 1qmb A:49-376 1iz2 A:43-415 1oo8 A:43-415 1d5s B:378-415 7api A:44-382 1qlp A:43-415 1oph A:43-415 1kct :44-415 2d26
:47-415 1hp7
A:43-415 3caa A:50-383 1qmn A:43-420 4caa B:390-420 2ach A:47-383 1as4 A:48-383 1yxa B:42-417 1lq8 F:376-406 2pai B:374-406 1pai B:374-406 1jmo A:119-496 1jmj A:119-496 1oc0 A:25-402 1dvn A:25-402 1b3k D:25-402 1dvm D:25-402 1a7c A:25-402 1c5g A:25-402 1db2 B:26-402 9pai A:25-402 1lj5 A:25-402 1m6q A:138-498 1jjo D:101-361 1imv A:49-415 | ||
Las serpinas son una superfamilia de proteínas con estructuras similares quer fueron identificadas primero por su inhibición de proteasa y están encontradas en todos los reinos.[1] El acrónimo serpina fue establecido porque las primeras serpinas en ser identificadas actuaban como quimotripsina serina proteasa (serina proteasa inhibidora).[2][3] Son notables por su inusual mecanismo de acción, en el cual inhiben de manera irreversible su objetivo, la proteasa al someterse a un gran cambio conformacional para alterar su sitio activo.[4][5] Esto contrasta con el mecanismo más común de los inhibidores de proteasa que ses unen y bloqeuan el acceso de la proteasa al sitio activo.[5][6]
La inhibición de proteasa por serpinas controla el arreglo de los procesos biológicos, incluyendo la coagulación la inflamación y consecuentemente estas proteínas son el objetivo de investigación médica..[7] Su cambio conformacional único también las vuelve de interés a la biología estructural y a la investigación de doblaje de proteínas [4][5] El mecanismo del cambio conformacional contiene ciertas ventajas, pero también algunas desventajas; las serpinas son vulnerables a mutaciones que pueden resultar en serpinopatías como el doblaje erróneo de las proteínas y la formación de polímeros inactivos de cadenas largas.[8][9] La polimerización de serpinas no sólo reduce la cantidad de inhibidores activos, pero también conlleva a la acumulación de los polímeros, causando muerte celular y falla de órganos .[7]
Aunque la mayoría de las serpinas controlan las cascadas proteolíticas, algunas proteínas con estrcutura de serpina no son inhibidores de enzimas, pero realizan diversas funciones como almacenamiento(como en el huevo blanco—ovalbúlima), transporte como en las proteínas de transporte de hormonas (Globulina fijadora de tiroxina, globulina fijadora de cortisol) y de proteína chaperona(HSP47).[6] El término serpina se usa para decribir a estos miembro también, a pesar de su función no inhibitoria ya que están relacionados evolutivamente.[1]
Historia
La actividad inihibidora de la preoteasa en el plasma de la sangre fue reportada por primera vez a finales de los 1800,[10] pero no fue hasta los 50 que las serpinas antitrombina y alfa 1-antitripsina fueron aisladas.[11] la investigación inicial se concentraba en su papel en la enfermedad humana: deficiencia de alfa 1-antitripsina es uno de los desórdenes genéticos más comunes causando enfisema,[8][12][13] y la deficiencia de antitrombina resulta en trombosis.[14][15]
En los 80, se volvió claro que estos inhibidores eran parte de una superfamilia de proteínas relacionadas entre sí que incluían inhibidores de proteasa ( alfa 1-antitrpsina) y no inhibidores (ovalbúlima).[16] Durante el mismo periodo de tiempo, las primeras estructuras de la serpina fueron estudiadas (primero en su conformación relajada, después en la estresada).[17][18]La estructuras indicaban que el mecanismo inhibidor involucraba un cambio conformacional inusual y promovía el siguiente punto de enfoque estructural en los estudios de la serpina.[5][18]
Más de 1000 serpinas han sido ahora identificadas incluyendo, 36 proteínas humanas, además de moléculas en todos los reinos.[19][20][21] En los 2000, una nomenclatura sistemática fue introducida para categorizar miembros de la superfamilia de serpinas basado en sus relaciones evolutivas.[1] Las serpinas son, por lo tanto, la superfamilia más frande y deviersa de inhibidores de proteasa.[22]
Bioquímica
Se han identificado más de 1000 serpinas, incluyendo 36 proteínas humanas, así como moléculas de plantas (como la Arabidopsis thaliana), bacterias (entre ellos los Clostridium), parásitos (como la nematoda Caenorhabditis elegans), archaea y ciertos virus.[23][24] Las serpinas constituyen la familia de inhibidores de proteasas más numera y diversa.[25]
Actividad

La mayoría de las serpinas son inhibidores de proteasa, siendo su objetivo las proteasas de serina como quimotripsina. Estas proteasas poseen un reisduo de una serina nucleofílicaMen una tríada catalítica. Algunos ejemplos, incluyen trombina, tripsina y las elastas de nuetrófilos humanos.[26] Las serpinas actúan como inhibidores irreversibles y suicidas al atrapar un intermediario del mecanismo catalítico de la proteasa.[27]
Algunas serpinas inhiben otra clase de proteasas, normalmente proteasas de cisteína y se le conoce como inhibidores de clase cruzada. Estas enzimas difieren de la serinaproteasas en que una cisteína nucleofílica en lugar de una serina en su sitio activo.[28] No obastante, la química enzimática es el mismo para las dos clases de proteasa.[29] Ejemplos de serpinas inhibidoras de clase cruzada incluyen la serpina B4, un antigen 1 de carcinomas de células escamosas(SCCA-1) y la serpina aviar, una proteína de etapa específica, mieloide y eritoride de terminación nuclear.[30][31][32]
Función biológica y ubicación
Funciones
La mayoría de las serpinas controlan por inhibición cascadas proteolíticas catalizadas por enzimas proteasas de la familia de las quimotripsinas, mientras que otras no son inhibitorias de otras enzimas sino que realizan funciones variadas, tales como almacenamiento (es el caso de la ovoalbumina), proteínas de transporte hormonal (globulina fijadora de tiroxina, globulina fijadora de cortisol), genes supresores tumorales (como la maspina), regulación de la tensión arterial y desarrollo de linfocitos B, entre muchas otras.[33] Se emplea el término serpina para estas enzimas no inhibitorias, a pesar de su contradictoria función.[34]
Inhibición de la proteasa
Aproximadamente dos tercios de las serpinas humanas realizan roles extracelulares, inhibiendo proteaseas en el flujo sanguíneo para modular sus actividades. Por ejemplo las serpinas extracelulares regulan las cascadas proteícas esenciales para la coagulación de la sangre (antitrombina), las respuestas inmune e inflamatoria (antitripsina, antiquimotripsina y el inhibidor C1) y remodelación de tejido (PAI-1).[6] Al inhibir las proteasas de señalización de cascada, sólo pueden afectar el desarrollo. La tabla de serpinas humanas (abajo) proporciona ejemplos del rango de funciones realizadas por las serpinas humanas al igual que algunas de las enfermedades que resultan de la deficiencia de serpinas.[35][36] .
Las proteasas objetivo, de las serpinas inhibiidoras intracelulares han sido díficles de identificar ya que varias de estas moléculas parecen realizar tareas que se superponen. Además muchas serpinas humanas carecen de los equivalentes funcionales precisos en organismos modelos como el ratón. Sin embargo, una función importante de las sperinas intracelulares puede ser proteger de la actividad inapropiada de las proteasas dentro de la célula.[37] Por ejemplo, uno de las serpinas mejor caracterizadas es la serpina B9, que inhibe la proteasa de gránulo citotóxico, granzima B. Al hacerlo, la serpina B9 puede proteger contra la liberación inadvertida de granzima B y la actiación premtaura o no deseada de los mecanismos de muerte celular.[38]
Algunos virus usan serpinas para interrumpir las funciones de las proteasas en su huésped.La serpina viral de la viruela de las vacas CrmA se usa para evitar respuestas inflamatorias y apoptoticas de las células huéspedes infectadas.La CrmA aumenta la infección al suprimir la respuesta inflamatoria del huésped a través de la inhibicónde IL-1 y el procesamiento de L-18 por la proteasa de cisteína caspasa-1 .[39] En eucariontes una serpina de planta inhibe metacaspasas y una proteasa de cisteína como papaína[40][41]
Roles no-inhibitorios
Las serpinas extracelulares no inhibitorias también realizan un gran conjunto de roles importantes La globulina fijadora de tiroxina y la transcortina transportan las hormonas tiroxina y cortisol respectivamente.[42][43] La serpina de ovalbúlmina, no inhibitoria es la proteína más abundante de el huevo blanco. Su función exacta no se conoce, pero se cree que es una proteína de almacenamiento para fetos en desarrollo.[44] La serpina de choque térmico 47 es una chaperona, esencial para del doblaje apropiado del colágeno.Actúa estabilizando la triple hélice del colágeno mientras está siendo procesada en el retículo endoplasmático.[45]
Algunas serpinas son tanto inhibidoras de proteasas y realizan otras tareas. Por ejemplo, el inhibidor nuclear de proteasas de cisteina MENT, en pájaros también actúa como una molécula remodeladora de cromatina en las células rojas de un ave.[31][46]
Structure

Todas las serpinas comparten una estructura en común, a pesar de sus variadas funciones. Todas tienen típicamente 3 β-plegadas (llamada A, B y C) y ocho o nueve α-helices (llamada hA–hI).[17][18] Las regiones más significantes para la función de la serpina son la plegada-A y su loop de centro reactivo(RCL). La plegada-a incluye dos hebras-β que están en orientación paralela con una aregión entre ellas llamada 'shutter', y una región arriba llamada 'brecha'. El RCL forma la interacción inicial con la proteasa como objetivo en moléculas inhibidoras. Se han descifrado estructuras mostrando el RCL ya sea totalmente expuesto o parcialmente insertado en la plegada-A, y se piensa que las serpinas están en equilibrio dinámico entre estos dos estados.[5] El RCL también hace interacciones temporales con el resto de la estructura y es por lo tanto sumamente flexible y es expuesto al solvente.[5]
Las estructuras de serpinas que han sido determinadas, cubren varios tipos diferentes de conformaciones, que han sido necesarias para el entendimiento de su mecanismo de acción de múltiples pasos.La biología estructural ha jugado un papel centrar en el entendimiento de la función y biología de las serpinas.[5]
Cambio conformacional y mecanismo inhibitorio
Las serpinas inhibitorias no inhiben a su objetivo, las proteasas por el típico mecanismo competitivo (candado y llave) usado por la mayoría de los inhibidores de proteasa pequeños ( Kunitz-type inhibitors). En lugar de eso, las serpinas usan un cambio conformacional inusual, el cual altera la estructura de la proteasa y previene que complete la catálisis. El cambio conformacional incluye que el RCL se mueva al extremo contrario de la proteína e insertando una β-plegada A, formando una hebra-β extra antiparalela. Esto convierte a la serpinas de un estado estresado a un estado relajado de baja energía(transición de S a R).[4][5][49]
La serina y las proteasas de cisteína catalizan el rompimiento de un enlace peptídico por un proceso de dos pasos. Inicialmente, los residuos catalíticos de la sitio activo de lla tríada realiza un ataque nucleofílico en el enlace peptídico del sustrato. Esto libera las nuevas terminales-N y forma un enlace de éster covalente entre la enzima y el sustrato.[4] Este complejo covalente entre la enzima y el sustrato se llama un intermediario acil-enzima. Para sustratos estándares, el puente de éster es hidrolizado y una nueva terminal-C se libera para completar la catálisis. Sin embargo, cuando una serpina es separada por una proteasa, rápidamente atraviesa una transición de S a R antes de que el intermediario acil-enzima sea hidrolizado.[4] La eficiencia de la inhibición depende del hecho que la velocidad cinética relativa del cambio conformacional sea varios ordénes de magnitud más rápida que la hidrólisis de la proteasa.
Ya que el RCL está atado todavia covalentemente a la proteasa por el enlace de éster, la transición de S a R, toma a la proteasa de la cima al fondo de la serpina y distorsiona la tríada catalítica.La proteasa distorsionada solo puede hidrolizar el intermediarios acil-anzima extremadamente despacio, y entonces la proteasa permanece covalentemente unida desde días hasta semanas.[27] Las serpinas se clasifican como inhibidores irreversibles y como inhibidores suicidas ya que cada proteína de serpina inactiva permanentemente una sola proteasa y sólo puede funcionar una vez..[4]
Activación alostérica

La movilidad conformacional de las serpinas proporciona una ventaja clave sobre los inhibidores de proteasa de candado y llave.[50] En particular, la función de serpinas inhibitorias puede ser regulada por interacciones alostéricas con los factores específicos. Las estructuras cristalinas en rayos X de la antitrombina, el cofacto herapina II, MENT y la antiquimotripsina revelan que estas serpinas adopatan una conformación cuando en los primeros dos aminoácidos del RCL, están insertadas las β-plegadas A. La conformación parcialmente insertada es importante porque los cofactores pueden cambiar conformacionalmente ciertas serpinas inseertadas parcialmente en una forma comletamente expulsada.[51][52] Este arreglo confromacional hace a la serpina un inhibidor más eficiente.
El ejemplo arquetípico de esta situación es la antitrombina, que circula en el plasma en un estado relativamente inactivo al estar parcialmente insertado. xample of this situation is antithrombin, which circulates in plasma in a partially inserted relatively inactive state. Lo primero que se determina es que el residuo (de arginina P1) apunta hacia el cuerpo de la serpina y no está disponible para la proteasa. Después de unirse, una secuencia de pentasacáridos de gran afinidad en una cadena larga de heparina, la antitrombina sufre un cambio conformacional, la expulsión del RCL, y la exposición de la arginina P1. La heparina de pentasacáridos de antitrombina es, entonces un inhibidor más eficiente de la trombina y factor Xa.[53][54] Además, las proteasas de coagulación también contienen sitio de unión (llamados exositios) para la heparina. La heparina, por lo tanto, también actúa como un templados para la unión de ambas, la proteasa y la serpina, acelerando dramáticamente la interacción entre las dos entidades. Ddespués de la interacción inicial, el complejo final de la serpina se forma y la mitad de la heparina se libera. Esta interacción es fisiológicamente importante. Por ejemplo después de una herida a la pared de los vasos sanguíneos, la heparina es expuesta y la antitrombina se activa para controlar la respuesta de coagulación. Entender la base molecular de esta interacción permite el desarrollo de Fondaparinux, una forma sintética de heparina pentasacárida usada como un fármaco anticoagulante..[55][56]
Conformación latente

Ciertas serpinas son sometidas espontáneamente a la transición de S a R sin haber sido cortadas por una proteasa, para formar una conformación denominada como el estado latente.Las serpinas latentes son incapeces de interacturar con preoteasas y por lo tanto ya no son inhibidores de proteasa. El cambio conformacional a estado latente no es exactamente lo mismo que la transición de S a R de una serpina cortada. Ya que el RCL, sigue intacto, la primer hebra de la plegada-C tiene que despegarse para permitir la inserción completa del RCL.[57]
La regulación de la transición a estado latente puede actuar como un mecanismo de control en algunas serpinas como en PAI-1. Aunque PAI-1 se produce en la confromación inhibitoria S, se auto.inactiva aal cambiar a estado latente, a menos que se una al cofactor vitronectina.[57] De manera similar, la antitrombina puede convertirse espontáneamente a su estado latente, como un mecanismo de modulación adicional a su activación alostérica con heparina.[58] Finalmente, la terminal-N, una serpina de Thermoanaerobacter tengcongensis, se necesita para asegurar la molécula en su estado nativo inhibitorio. La ruptura de las interacciones hechas por la región de la terminal N resultan es cambios conformacionales espontáneos de la serpina a su conformación latente. .[59][60]
Cambio conformacional en funciones no inhibitorias
Algunas serpinas no inhibitorias también usan el cambio conformacional de la serpina como parte de su función. Por ejemplo, la forma nativa (S) de la globulina fijadora de tiroxina tiene una gran afinidad por la tiroxina, mientras que la forma cortada (R) tiene poca afinidad . De manera similar, la transcortina tiene mayor afinidad por el cortisol cuando está en su estado nativo (S) que cuando está en su estado cortado (R). Entonces, en estas serpinas, el RCL cortado y la transición de S a R se requiere para permitir la liberación de ligandos en lugar de la inhibición de proteasas..[42][43][61]
En algunas serpinas, la transición de S a R puede activar eventos de señalización celular. En estos caso, una serpina que ha formado un complejo con su proteasa ojetivo, es reconocida por un receptor. El evento de unión entonces conduce a una dsminución de señalización por el receptor..[62] La transición de S a R es usada para alertar células de la presencia de activida de proteasa.[62] Esto difiere de su mecanismo usual donde, las serpinas afectan la señalización simplemente al inhibir proteasas implicadas en una cascada de señalización.[35][36]
Degradación
Cuando una serpina inhibe una proteasa, forma un complejo permanente que necesita ser eliminado. Para las serpinas extracelulares, los complejos finales de serpina-enzima son rápidamente limpiados de la circulación. Un mecanismo por el que esto ocurre en mamíferos es a través de la proteína relacionada con el receptor de lipoproteínas de baja densidad (LRP) que se une a complejos inhibitorios hechos por la antitrombina, PA1-1, y la neuroserpina, provocando captación celular.[62][63] De manera similar,la serpina de Drosophila se degrada en el lisosoma después de haber sido llevada dentro de la célula por el recpeto Lipoforina 1 (homólogo al recepeto LDL de la familía de mamíferos.[64]
Enfermedad y serpinopatías
Las serpinas son parte de un gran arreglo de funciones fisiológicas, y por lo tanto, las mutaciones en los genes codificándolas pueden causar una serie de enfermedades.Mutaciones que cambian la actividad, la especificidad o propiedades agregadas de las serpinas pueden afectar la manera en que funcionan. La mayoría de las enfermedades relacionadas a las serpinas son el resultado de una polimerización de serpinas en conjuntos, aunque otro tipo de mutaciones ligadas a enfermedades pueden ocurrir.[5][65] El desorden de la deficiencia de α-Antitripsina es una de las enfermedades hereditarias más comunes.[8][13]
Inactividad o ausencia

Ya que el doblaje de la serpina estresada es de energía alta, las mutaciones pueden causar que se cambien incorrectamente a conformaciones de baja energía(relajadas o latentes) antes de que realicen correctamente su función inhibitoria.[7]
Las mutaciones que afectan la velocidad o que tanto se inserta el RCL en la plegada-A puede causar que la serpina sufra su cambio conformacional de S a R antes de haber interactuado con una proteasa. Como una serpina sólo puede hacer este cambio conformacional una sola vez, la serpina ahora es inactiva e incapaz de controlar apropiadamente a la proteasa.[7][66] De igual manera, las mutaciones que promueven la transición inapropiada hacia el monomérico estado latente causan enfermedades al reducir la cantidad de serpina inhibitoria.Por ejemplo, ambas variantes enfermas de antitrombina wibble y wobble,[67] promueven la formación del estado latente.
La estructura de la antiquimotripsina enferma (L55P) reveló otra, "la conformación- δ" inactiva. En la conformación- δ, se insertan cuatro residuos del RCL en la parte superior de la β-plegada A. La mitad del fondo de la plegada se llena como resultado de una de las α-helices (hélice F) cambiando parcialmente a una conformación de hebra-β, completando la unión de hidrógeno de la β-plegada.[68] No es claro si otras serpinas pueden adoptar este confórmero y si esta conformación tiene un tarea funcional, pero se especula que la conformación-δ puede ser adoptada por la globunlina fijadora de tiroxina durante la liberación de tiroxinas.[43] Las proteínas no inhibitorias relacionadas con las serpinas también pueden causar enfermedades cuando mutan. Por ejemplo la mutaciones en SERPINF1 causan osteogenesis imperfecta tipo VI en humanos.[69]
En la ausencia de la serpina requerida, la proteasa que normalmente regularía está hiperactiva, conduciendo a patologías.[7] Consecuentemente, una simple deficiencia de serpinas ( una mutación nula) puede resultar en enfermedad.[70].[71]
Cambio de especificidad
En algunos casos raros, un solo cambio en los aminoácidos del RCL de la serpina altera su especificidad y ataca a la proteasa incorrecta. Por ejemplo la mutación de Antitripsina-Pittsburgh (M358R) causa que la serpina α1-antitrypsin inhiba a la trombina causando un desorden de hemorragia.[72]
Polimerización y acumulación
La mayoría de las enfermedades de serpinas se deben a la acumulación de proteínas y se denominan como "serpinopatías".[9][68] Las serpinas son vulnerables a mutaciones que causen enfermedades que promueven la formación de polimeros mal doblados debido a sus estructuras inestables.[68] Serpinpatías bien caracterizadas incluyen la deficiencia de α1-antitropsina, que puede causar enfisema familiial y en algunos casos cirrosis, ciertas formas familiales de trombosis relacionadas con la deficiencia de antritrombina, [8][9][73]
Cada monomero del acumulado de serpinas existe es su conformación inactiva, relajada (con el RCL insertado en la plegada-A). Los polimeros son, por lo tanto, hiperestables a temperatura e incapaces de inhibir proteasas. Las serpinopatías , entonces causan patologías similares a otra protepatías ( enfermedades de prion) a través de dos mecanismos.[8][9] Primero, la ausencia de serpinas activas resulta en la actividad incontrolable de las proteasas y la destrucción de tejidos. Segundo, los polimeros hiperestables obstruyen el retículo endoplasmático de las células que sintetizan las serpinas, eventualmente resultando en muerte celular y daño de tejidos. En el caso de la deficiencia de antitripsina, los polimeros de antitripsina provocan la muerte de células hepaticas y cirrosis. Dentro de la célula, los polimeros de serpina se remueven lentamente por degradación en el retículo endoplasmático.[74] Sin embargo, los detalles de como los polimeros de serpina causan la muerte celular todavía no se entiende completamente.[8]
Se cree que los polimeros fisiológicos de serpina se forman a través de un cambio de dominio, donde un segmento de una proteína de serpina se inserta en otro.[75] Los cambios de dominio ocurren cuando las mutaciones o los factores ambientales interfieren con las etapas finales del doblaje de la serpina. causando que los intermediarios de alta energía se doblen mal.[76] Tanto las estructuras de los dímeros como de los trímeros que sufrieron cambio de dominio han sido resueltas. En el dímero (de antitrombina), el RCL y parte de la plegada-A se incorporan en la plegada-A de otra molécula de serpina.[75] el trímero de dominio cambiado (de antitripsina) forma, a través del intercambio de una región completamente diferente de la estructura, la beta-plegada (con el RCL de cada molécula insertado en su propia plegada-A).[77] También se ha propuesto que las serpinas puedan formar cambios de dominio al insertar el RCL de una proteína en la plegada-A de otra (polimerización de plegada-A).[73][78] Estas estructuras de dímeros y trímeros con cambio de dominio son suficientemente fuertes para ser los componentes de los acumulados de polimeros causantes de enfermedades, pero el mecanismo todavía no es claro.[75][76][77][79]
Estrategias terapeúticas
Varios acercamientos terapeúticos están siendo investigados para tratar la serinpatía más común, la deficiencia de antitripsina.[8] La terapia de aumento de antitripsina es aprobada para la deficiencia severa de antitripsina, relacionada con enfisema pulmonar.[80] En esta terpia, la antitripsina es pruificada del plasma de donadores de sangre y administrada por intravenosa (Prolastin).[8][81] Para tratar la deficiencia severa de antitripsina, el trasplante de pulmones e higado ha sido efectivo.[8][82] En modelos animales el direccionamiento de genes en células madre pluripotentes inducidas ha sido exitosamente usado para correcgir el defecto de polimerización de antitripsina y para restaurar la habilidad del hígado mamífero de secretar antitripsina activa.[83] Pequeñas moléculas tambíen han sido diseñadas que bloquean la polimerización de antitripsina in vitro.[84][85]
Evolución
Las serpinas son las superfamilia de proteinas inhibidoras más grande y más distribuida.[1][22] Se pensaba que estaban restringidas a organismos eucariotes. pero desde entonces, han sido encontradas en bacteria, arquea y algunos virus..[19][20][86] Permanece incierto si los genes procariotes son descendientes de una serpina procariótica ancestral o el producto de una transferencia genética horizontal de eucariontes. La mayoría de las serpinas permancen a un clado filogenético, si vienen de plantas o animales, indicando que las serpinas intracelulares y extracelulares pueden haberse separado antes de las plantas y los animales.[87] Excepciones incluyen la serpina de choque intracelular de calor HSP47, que es una chaperon esencial para el doblaje apropiado del colágeno y ciclos entre cis-Golgi y el retículo endoplasmático.[45]
La inhibición de proteasa es considerada la función ancestral, con miembros no inhibidores resultado de neofuncionamiento evolucionario de la estructura. El cambio conformacional de S a R también ha sido aaptado por algunas serpinas que se unen para regular la afinidad por sus objetivos.[43]
Investigaciones
Por razón de que las serpinas controlan procesos celulares tales como la coagulación y la inflamación, éstas son proteínas blanco para investigaciones científicas. Las serpinas también tienen importancia para la genómica estructural y el estudio del plegamiento de proteínas debido a que son capaces de dramáticos y muy únicos cambios en sus estructuras en el proceso de la inhibición enzimática.[88] Esa característica es poco usual, ya que los inhibidores de las proteasas tienden a fusionarse con la sencilléz de una llave y su cerradura, con formas moleculares prescisas en el sitio activo de la enzima. La desventaja de los mecanismos conformacionales de las serpinas es que las hace susceptibles a mutaciones que causan polímeros de larga cadena que son inactivas.[89][90]
Distribución
Animal
Humanos
El genoma humano codifica 16 clados de serpinas, que van desde serpinaA hasta serpinaP, incluyendo 29 proteínas de serpina inhibitorias y 7 no inhibitoria.[6][71] El sistema usado para nombrar las serpinas humanas está basado en un análisis filogenético de aproximadamente 500 serpinas del 2001, con proteínas llamada serpin XY, donde X es el clado de proteína y Y el número de proteinas dentro de ese clado..[1][19][71] Las funciones de las serpinas humanas han sido determinaas por una combinación de estudios bioquímicos, desórdenes humanos genéticos, y modelos de ratones knockout T.[71]
| Tabla de serpinas humanas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Serpinas especializadas de mamíferos
Muchas serpinas de mamíferos han sido identificadas demostrando no tener una ortología obvia que compartir con la contraparte humana de la serpina. Ejemplos incluyen numeroras serpinas de roedores (particularmente algunas de las serpinas de murino intraelular) como también las serpinas uterinas. El término serpina uterina se refiere a los miembros del clado A de serpinas que son codificadas por el gen SERPINA14. Las serpinas uterinas son producidas por el endometrio en un grupo restringido de mamíferos bajo la influencia de progesterona y estrógeno.[174] Probablemente son ihibidores de proteinasa no funcionales y pueden funcionar durante el embarazo para inhibir la respuesta inmune materna contra el zigoto o para participar en el transporte transplacentaria.[175]
Insectos
El genoma de Drosophila melanogaster contiene 29 genes codificadores de serpina.El análisis de la secuencia de aminoácidos ha colocado 14 de estas serpinas en el clado de serpinas Q y 3 serpinas en el clado K con las 12 restantes clasificadas como serpinas huérfanas al no pertenecer a ningún clado.[176] El sistema de clasificación de clados es difícil de usar para Drosophila serpins y en lugar, un sistema de nomenclatura se adoptó basado en la posición de los genes de serpina en los cromosomas de Drosophila. Trece de las serpinas de Drosophila se encuentran como genes aislados en el genoma (incluyendo Serpina-27A,), con las 16 restantes organizadas en 5 agrupaciones de genes que ocurren en las posiciones del cromosoma 28D (2 serpinas), 42D (5 serpinas), 43A (4 serpinas), 77B (3 serpinas) y 88E (2 serpinas).[176][177][178]
Estudios en las serpinas de Drosophila revelan que la Serpina-27A inhibe la proteasa de pascua(la proteasa final en el Nudel) Al igual que su rol central en los patrones embrionicos, la señalización también es importante para la respuesta inmune inata en insectos. Aparentemente, la serpina-27A también funciona para controlar la respuesta inmune de los insectos.[36][179][180][181]
Nematodos
El genoma del gusano nematodo C. elegans contaiene 9 serpinas, de las cuales ninguna tiene secuencias de señalización y por lo tanto son intracelulares.[182] Sin embargo, sólo 5 de estas serpinas parecen funcionas como inhibidores de proteasa.[182] Un, SRP-6, realiza una función protectora y protege contra la ruptura inducida por estrés asociada con calpaína. Además, SRP-6 inhibe las proteasas de cisteían lisosomales liberadas por la ruptura del lisosoma..[183]
Plantas
Las serpinas de las plantas estaban entre los primeros miembros de la superfamilia en ser identificados.[184] Las serpinas de plantas son poderosos inhibidores de proteasas de serina como quimotripsina de mamíferos, in vitro, el ejemplo mejor estudiado siendo la serpina Zx (BSZx), que es capaz de inhibir tripsina y quimotripsina al igual que a diversos factores de coagulación.[185] Sin embargo, parientes cercanos de la proteasa de serina como quimotripsina están ausentes en plantas. El RCL de varias serpinas de grano de trigo y centeno contien seuencias que repiten poli-Q similares a esas presentes en las proteínas de almacenamiento de prolamina del endoesperma.[186] Ha sido entonces sugerido que las serpinas de las plantas funcionen mejor en inhibir proteasas de insectos o microbios que de otra manera digerirían las proteínas de almacenamiento de granos. Soportando esta hipótesis diferentes serpinas de plantas han sido idenificadas en la savia del floema de la calabaza (CmPS-1)[187] y plantas de pepino.[188][189] Aunque se observó una correlación inversa entre la expresión de CmPS-1 y la supervivencia áfida, in vitro más experimentacion reveló que el CmPS-1 recombinante no parecía afectar la supervivencia de los insectos.[187]
Roles alternativos y las proteasas objetivo para las serpinas de las plantas han sido propuestos. La serpina Arabidopsis, AtSerpin1 (At1g47710; 3LE2 ), regula el punto de control sobre la muerte celular programada al marcar como objetivo (RD21) la proteasa de cisteína como papaína.[41][190][40] Otras dos serpinas Arabidopsis , AtSRP2 (At2g14540) y AtSRP3 (At1g64030) parecen estar relacionadas con respuestas al daño del ADN.[191]
Hongos
Una sola serpina fungal ha sido caracterizada: celpina de Piromyces spp. cepa E2. Piromyces es géneroode hongo anaeróbico encontrado en el intestino de los rumiantes y es importante para la digestión de plantas. Se predice que la celpina es inhibitoria y contiene dos dominion con terminales-N además del dominio de la serpina.[21] se sugiere que la celpina pueda proteger la celulosoma de proteasas de plantas..[192]
Procariotas
Genes predecidos de serpina están distribuidos esporádicamente en procariotas.Estudios In vitro de algunas de las moléculas han revelado que son capaces de inhibir proteasas, y se sugiere que funcionan como inhibidores in vivo. Varias serpinas procariotas se encuentran en extremofilos. En contraste con las serpinas de mamíferos, estas moléculas poseen gran resistencia a la desnaturalización por calor.[193][194] El papel preciso de la mayoría de las serpinas bacterianas permanece sin conocerse, aunque la serpina de Clostridium thermocellum se localiza en la celulosoma. Se considera que el rol de las serpinas asociadas a la celulosoma puedan ser de prevención de la activida de proteasas no deseadas contra la celulosoma.[192]
Viral
Las serpinas también se expresan en virus como una manera de evitar la defensas inmunes del huésped.[195] En particular, las serpinas se expresan por virus de viruela, incluyendo viruela de la vaca (vaccinia) y viruela del conejo (myxoma), son de interés porque su uso potencial como nueva terapia para desórdenes inmunes e inflmatorios como para terapia de trasplante.[196][197] Serp1 suprime la respuesta inmune inata de TLR y permite la supervivencia del injerto cardiaco en ratas.[196][198] Crma y Serp2 son ambos inhibidores de clases cruzadas y tienen como objetivo tanto proteasas de serina como de cisteína.[199][200] En comparación con su contraparte en mamíferos, las serpinas virales contienen deleciones significativas de elementos de estructura secundaria. Específicamente, el crmA carece de la hélice-D en la misma proporción que las hélices A y E..[201]
Véase también
Referencias
- ↑ a b c d e «The serpins are an expanding superfamily of structurally similar but functionally diverse proteins. Evolution, mechanism of inhibition, novel functions, and a revised nomenclature». The Journal of Biological Chemistry 276 (36): 33293-6. September 2001. PMID 11435447. doi:10.1074/jbc.R100016200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Serpins flex their muscle: I. Putting the clamps on proteolysis in diverse biological systems». The Journal of Biological Chemistry 285 (32): 24299-305. August 2010. PMC 2915665. PMID 20498369. doi:10.1074/jbc.R110.112771. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Serpins flex their muscle: II. Structural insights into target peptidase recognition, polymerization, and transport functions». The Journal of Biological Chemistry 285 (32): 24307-12. August 2010. PMC 2915666. PMID 20498368. doi:10.1074/jbc.R110.141408. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c d e f «Serpin structure, mechanism, and function». Chemical Reviews 102 (12): 4751-804. December 2002. PMID 12475206. doi:10.1021/cr010170. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c d e f g h i «Molecular gymnastics: serpin structure, folding and misfolding». Current Opinion in Structural Biology 16 (6): 761-8. December 2006. PMID 17079131. doi:10.1016/j.sbi.2006.10.005. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c d e f «An overview of the serpin superfamily». Genome Biology 7 (5): 216. 2006. PMC 1779521. PMID 16737556. doi:10.1186/gb-2006-7-5-216. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c d e «What do dysfunctional serpins tell us about molecular mobility and disease?». Nature Structural Biology 2 (2): 96-113. February 1995. PMID 7749926. doi:10.1038/nsb0295-96. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c d e f g h i j «The discovery of α1-antitrypsin and its role in health and disease». Respiratory Medicine 105 (8): 1129-39. August 2011. PMID 21367592. doi:10.1016/j.rmed.2011.02.002. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c d «Conformational disease». Lancet 350 (9071): 134-8. July 1997. PMID 9228977. doi:10.1016/S0140-6736(97)02073-4. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Fermi, C; Personsi, L (1984). «Untersuchungen uber die enzyme, Vergleichende Studie» [Studies on the enzyme, Comparative study]. Z Hyg Infektionskr (en german) (18): 83-89. Parámetro desconocido
|name-list-format=ignorado (ayuda) - ↑ Schultz, H; Guilder, I; Heide, K; Schoenenberger, M; Schwick, G (1955). «Zur Kenntnis der alpha-globulin des menschlichen normal serums» [For knowledge of the alpha - globulin of human normal serums]. Naturforsch (en german) (10): 463. Parámetro desconocido
|name-list-format=ignorado (ayuda) - ↑ «The electrophoretic α1-globulin pattern of serum in α1-antitrypsin deficiency. 1963». Copd. 10 Suppl 1: 3-8. 2013. PMID 23527532. doi:10.3109/15412555.2013.771956. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b de Serres, Frederick J. (1 November 2002). «Worldwide Racial and Ethnic Distribution of α-Antitrypsin Deficiency». CHEST Journal 122 (5): 1818-1829. doi:10.1378/chest.122.5.1818. Parámetro desconocido
|name-list-format=ignorado (ayuda) - ↑ «Inherited antithrombin deficiency causing thrombophilia». Thrombosis Et Diathesis Haemorrhagica 13: 516-30. June 1965. PMID 14347873. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Inherited antithrombin deficiency: a review». Haemophilia 14 (6): 1229-39. November 2008. PMID 19141163. doi:10.1111/j.1365-2516.2008.01830.x. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «A surprising new protein superfamily containing ovalbumin, antithrombin-III, and alpha 1-proteinase inhibitor». Biochemical and Biophysical Research Communications 95 (2): 864-71. July 1980. PMID 6968211. doi:10.1016/0006-291X(80)90867-0. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Human alpha 1-proteinase inhibitor. Crystal structure analysis of two crystal modifications, molecular model and preliminary analysis of the implications for function». Journal of Molecular Biology 177 (3): 531-57. August 1984. PMID 6332197. doi:10.1016/0022-2836(84)90298-5. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c «Crystal structure of ovalbumin as a model for the reactive centre of serpins». Nature 347 (6288): 99-102. September 1990. PMID 2395463. doi:10.1038/347099a0. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c «Phylogeny of the serpin superfamily: implications of patterns of amino acid conservation for structure and function». Genome Research 10 (12): 1845-64. December 2000. PMID 11116082. doi:10.1101/gr.GR-1478R. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Serpins in prokaryotes». Molecular Biology and Evolution 19 (11): 1881-90. November 2002. PMID 12411597. doi:10.1093/oxfordjournals.molbev.a004012. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «A serpin in the cellulosome of the anaerobic fungus Piromyces sp. strain E2». Mycological Research 112 (Pt 8): 999-1006. August 2008. PMID 18539447. doi:10.1016/j.mycres.2008.01.021. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Evolutionary families of peptidase inhibitors». The Biochemical Journal 378 (Pt 3): 705-16. March 2004. PMC 1224039. PMID 14705960. doi:10.1042/BJ20031825. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Irving JA, Pike RN, Lesk AM, Whisstock. (2000). «Phylogeny of the Serpin Superfamily: Implications of Patterns of Amino Acid Conservation for Structure and Function.». Genome Res. 10: 1845-64. PMID 11116082.
- ↑ Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasirving2002 - ↑ Rawlings ND, Tolle DP, Barrett AJ. (2004). «Evolutionary families of peptidase inhibitors.». Biochem J. 378: 705-16. PMID 14705960.
- ↑ «Families and clans of serine peptidases». Archives of Biochemistry and Biophysics 318 (2): 247-50. April 1995. PMID 7733651. doi:10.1006/abbi.1995.1227. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Structure of a serpin-protease complex shows inhibition by deformation». Nature 407 (6806): 923-6. October 2000. PMID 11057674. doi:10.1038/35038119. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Evolutionary lines of cysteine peptidases». Biological Chemistry 382 (5): 727-33. May 2001. PMID 11517925. doi:10.1515/BC.2001.088. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Evidence that serpin architecture intrinsically supports papain-like cysteine protease inhibition: engineering alpha(1)-antitrypsin to inhibit cathepsin proteases». Biochemistry 41 (15): 4998-5004. April 2002. PMID 11939796. doi:10.1021/bi0159985. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «The reactive site loop of the serpin SCCA1 is essential for cysteine proteinase inhibition». Proceedings of the National Academy of Sciences of the United States of America 95 (23): 13465-70. November 1998. PMC 24842. PMID 9811823. doi:10.1073/pnas.95.23.13465. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «X-ray crystal structure of MENT: evidence for functional loop-sheet polymers in chromatin condensation». The EMBO Journal 25 (13): 3144-55. July 2006. PMC 1500978. PMID 16810322. doi:10.1038/sj.emboj.7601201. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «DNA accelerates the inhibition of human cathepsin V by serpins». The Journal of Biological Chemistry 282 (51): 36980-6. December 2007. PMID 17923478. doi:10.1074/jbc.M706991200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ KORIN, Jorge. Antithrombin: 25 years later: A tribute to a long lasting source of knowledge in Hemostasis. Acta Bioquím. Clín. Latinoam. [online]. Jul./Sept. 2006, vol.40, no.3 [cited 19 March 2008], p.299-305. Available from World Wide Web: [1]. ISSN 0325-2957.
- ↑ Silverman GA, Bird PI, Carrell RW, Church FC, Coughlin PB, Gettins PG, Irving JA, Lomas DA, Luke CJ, Moyer RW, Pemberton PA, Remold-O'Donnell E, Salvesen GS, Travis J, Whisstock JC. (2001). «'The serpins are an expanding superfamily of structurally similar but functionally diverse proteins. Evolution, mechanism of inhibition, novel functions, and a revised nomenclature.». J Biol Chem 276: 33293-6. PMID 11435447.
- ↑ a b «The serpin PN1 is a feedback regulator of FGF signaling in germ layer and primary axis formation». Development 142 (6): 1146-58. March 2015. PMID 25758225. doi:10.1242/dev.113886. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c «Spatial regulation of developmental signaling by a serpin». Developmental Cell 5 (6): 945-50. December 2003. PMID 14667416. doi:10.1016/S1534-5807(03)00338-1. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Regulation of pro-apoptotic leucocyte granule serine proteinases by intracellular serpins». Immunology and Cell Biology 77 (1): 47-57. February 1999. PMID 10101686. doi:10.1046/j.1440-1711.1999.00787.x. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Selective regulation of apoptosis: the cytotoxic lymphocyte serpin proteinase inhibitor 9 protects against granzyme B-mediated apoptosis without perturbing the Fas cell death pathway». Molecular and Cellular Biology 18 (11): 6387-98. November 1998. PMID 9774654. doi:10.1128/mcb.18.11.6387. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Viral inhibition of inflammation: cowpox virus encodes an inhibitor of the interleukin-1 beta converting enzyme». Cell 69 (4): 597-604. May 1992. PMID 1339309. doi:10.1016/0092-8674(92)90223-Y. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Serpin1 of Arabidopsis thaliana is a suicide inhibitor for metacaspase 9». Journal of Molecular Biology 364 (4): 625-36. December 2006. PMID 17028019. doi:10.1016/j.jmb.2006.09.010. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Arabidopsis AtSerpin1, crystal structure and in vivo interaction with its target protease responsive to desiccation (RD21)». The Journal of Biological Chemistry 285 (18): 13550-60. April 2010. PMC 2859516. PMID 20181955. doi:10.1074/jbc.M109.095075. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c «Corticosteroid-binding globulin, a structural basis for steroid transport and proteinase-triggered release». The Journal of Biological Chemistry 282 (40): 29594-603. October 2007. PMID 17644521. doi:10.1074/jbc.M705014200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c d e «Structural mechanism for the carriage and release of thyroxine in the blood». Proceedings of the National Academy of Sciences of the United States of America 103 (36): 13321-6. September 2006. PMC 1557382. PMID 16938877. doi:10.1073/pnas.0604080103. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Structure and properties of ovalbumin». Journal of Chromatography. B, Biomedical Sciences and Applications 756 (1-2): 189-98. May 2001. PMID 11419711. doi:10.1016/S0378-4347(01)00108-6. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c «Interactions of heat shock protein 47 with collagen and the stress response: an unconventional chaperone model?». Life Sciences 87 (19-22): 579-86. November 2010. PMID 20888348. doi:10.1016/j.lfs.2010.09.024. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «MENT, a heterochromatin protein that mediates higher order chromatin folding, is a new serpin family member». The Journal of Biological Chemistry 274 (9): 5626-36. February 1999. PMID 10026180. doi:10.1074/jbc.274.9.5626. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Inhibitory conformation of the reactive loop of alpha 1-antitrypsin». Nature Structural Biology 3 (8): 676-81. August 1996. PMID 8756325. doi:10.1038/nsb0896-676. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The murine orthologue of human antichymotrypsin: a structural paradigm for clade A3 serpins». The Journal of Biological Chemistry 280 (52): 43168-78. December 2005. PMID 16141197. doi:10.1074/jbc.M505598200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Conformational changes in serpins: I. The native and cleaved conformations of alpha(1)-antitrypsin». Journal of Molecular Biology 296 (2): 685-99. February 2000. PMID 10669617. doi:10.1006/jmbi.1999.3520. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Shape-shifting serpins--advantages of a mobile mechanism». Trends in Biochemical Sciences 31 (8): 427-35. August 2006. PMID 16820297. doi:10.1016/j.tibs.2006.06.005. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The anticoagulant activation of antithrombin by heparin». Proceedings of the National Academy of Sciences of the United States of America 94 (26): 14683-8. December 1997. PMC 25092. PMID 9405673. doi:10.1073/pnas.94.26.14683. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Conformational changes in serpins: II. The mechanism of activation of antithrombin by heparin». Journal of Molecular Biology 301 (5): 1287-305. September 2000. PMID 10966821. doi:10.1006/jmbi.2000.3982. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Structure of the antithrombin-thrombin-heparin ternary complex reveals the antithrombotic mechanism of heparin». Nature Structural & Molecular Biology 11 (9): 857-62. September 2004. PMID 15311269. doi:10.1038/nsmb811. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Antithrombin-S195A factor Xa-heparin structure reveals the allosteric mechanism of antithrombin activation». The EMBO Journal 25 (9): 2029-37. May 2006. PMC 1456925. PMID 16619025. doi:10.1038/sj.emboj.7601089. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Fondaparinux: a synthetic heparin pentasaccharide as a new antithrombotic agent». Expert Opinion on Investigational Drugs 11 (3): 397-407. March 2002. PMID 11866668. doi:10.1517/13543784.11.3.397. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «A synthetic antithrombin III binding pentasaccharide is now a drug! What comes next?». Angewandte Chemie 43 (24): 3118-33. June 2004. PMID 15199558. doi:10.1002/anie.200300640. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Stability of plasminogen activator inhibitor 1 (PAI-1)». Thrombosis and Haemostasis 62 (2): 748-51. September 1989. PMID 2479113. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Latent antithrombin and its detection, formation and turnover in the circulation». Journal of Thrombosis and Haemostasis 2 (12): 2170-7. December 2004. PMID 15613023. doi:10.1111/j.1538-7836.2004.01047.x. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The N terminus of the serpin, tengpin, functions to trap the metastable native state». EMBO Reports 8 (7): 658-63. July 2007. PMC 1905895. PMID 17557112. doi:10.1038/sj.embor.7400986. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «A structural basis for loop C-sheet polymerization in serpins». Journal of Molecular Biology 376 (5): 1348-59. March 2008. PMID 18234218. doi:10.1016/j.jmb.2007.12.050. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Hormone binding globulins undergo serpin conformational change in inflammation». Nature 336 (6196): 257-8. November 1988. PMID 3143075. doi:10.1038/336257a0. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c «Endocytic receptor LRP together with tPA and PAI-1 coordinates Mac-1-dependent macrophage migration». The EMBO Journal 25 (9): 1860-70. May 2006. PMC 1456942. PMID 16601674. doi:10.1038/sj.emboj.7601082. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Specificity of binding of the low density lipoprotein receptor-related protein to different conformational states of the clade E serpins plasminogen activator inhibitor-1 and proteinase nexin-1». The Journal of Biological Chemistry 284 (27): 17989-97. July 2009. PMC 2709341. PMID 19439404. doi:10.1074/jbc.M109.009530. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Rulifson, Eric, ed. (June 2009). «Uptake of the necrotic serpin in Drosophila melanogaster via the lipophorin receptor-1». PLoS Genetics 5 (6): e1000532. PMC 2694266. PMID 19557185. doi:10.1371/journal.pgen.1000532. Parámetro desconocido
|vauthors=ignorado (ayuda); Parámetro desconocido|name-list-format=ignorado (ayuda) - ↑ «Mechanisms of serpin dysfunction in disease». Expert Reviews in Molecular Medicine 8 (31): 1-19. 1 January 2006. PMID 17156576. doi:10.1017/S1462399406000184. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Effects of mutations in the hinge region of serpins». Biochemistry 32 (30): 7650-7. August 1993. PMID 8347575. doi:10.1021/bi00081a008. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Antithrombins Wibble and Wobble (T85M/K): archetypal conformational diseases with in vivo latent-transition, thrombosis, and heparin activation». Blood 92 (8): 2696-706. October 1998. PMID 9763552. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c «Inactive conformation of the serpin alpha(1)-antichymotrypsin indicates two-stage insertion of the reactive loop: implications for inhibitory function and conformational disease». Proceedings of the National Academy of Sciences of the United States of America 97 (1): 67-72. January 2000. PMC 26617. PMID 10618372. doi:10.1073/pnas.97.1.67. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Mutations in SERPINF1 cause osteogenesis imperfecta type VI». Journal of Bone and Mineral Research 26 (12): 2798-803. December 2011. PMC 3214246. PMID 21826736. doi:10.1002/jbmr.487. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Human plasminogen activator inhibitor-1 (PAI-1) deficiency: characterization of a large kindred with a null mutation in the PAI-1 gene». Blood 90 (1): 204-8. July 1997. PMID 9207454. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c d e f «Update of the human and mouse SERPIN gene superfamily». Human Genomics 7: 22. 30 October 2013. PMC 3880077. PMID 24172014. doi:10.1186/1479-7364-7-22. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Mutation of antitrypsin to antithrombin. alpha 1-antitrypsin Pittsburgh (358 Met leads to Arg), a fatal bleeding disorder». The New England Journal of Medicine 309 (12): 694-8. September 1983. PMID 6604220. doi:10.1056/NEJM198309223091203. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «The mechanism of Z alpha 1-antitrypsin accumulation in the liver». Nature 357 (6379): 605-7. June 1992. PMID 1608473. doi:10.1038/357605a0. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Endoplasmic reticulum-associated degradation (ERAD) and autophagy cooperate to degrade polymerogenic mutant serpins». The Journal of Biological Chemistry 284 (34): 22793-802. August 2009. PMC 2755687. PMID 19549782. doi:10.1074/jbc.M109.027102. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c «Crystal structure of a stable dimer reveals the molecular basis of serpin polymerization». Nature 455 (7217): 1255-8. October 2008. PMID 18923394. doi:10.1038/nature07394. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «The structural diversity in α1-antitrypsin misfolding». EMBO Reports 12 (10): 983-4. October 2011. PMC 3185355. PMID 21921939. doi:10.1038/embor.2011.187. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Molecular basis of α1-antitrypsin deficiency revealed by the structure of a domain-swapped trimer». EMBO Reports 12 (10): 1011-7. October 2011. PMC 3185345. PMID 21909074. doi:10.1038/embor.2011.171. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Importance of the release of strand 1C to the polymerization mechanism of inhibitory serpins». Protein Science 6 (1): 89-98. January 1997. PMC 2143506. PMID 9007980. doi:10.1002/pro.5560060110. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «A novel monoclonal antibody to characterize pathogenic polymers in liver disease associated with alpha1-antitrypsin deficiency». Hepatology 52 (3): 1078-88. September 2010. PMID 20583215. doi:10.1002/hep.23760. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «alpha1-Antitrypsin deficiency . 6: new and emerging treatments for alpha1-antitrypsin deficiency». Thorax 59 (10): 904-9. October 2004. PMC 1746849. PMID 15454659. doi:10.1136/thx.2003.006551. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Expanding the clinical indications for α(1)-antitrypsin therapy». Molecular Medicine 18 (6): 957-70. PMC 3459478. PMID 22634722. doi:10.2119/molmed.2011.00196. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Hereditary alpha-1-antitrypsin deficiency and its clinical consequences». Orphanet Journal of Rare Diseases 3: 16. 2008. PMC 2441617. PMID 18565211. doi:10.1186/1750-1172-3-16. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Targeted gene correction of α1-antitrypsin deficiency in induced pluripotent stem cells». Nature 478 (7369): 391-4. October 2011. PMC 3198846. PMID 21993621. doi:10.1038/nature10424. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Small molecules block the polymerization of Z alpha1-antitrypsin and increase the clearance of intracellular aggregates». Journal of Medicinal Chemistry 50 (22): 5357-63. November 2007. PMC 2631427. PMID 17918823. doi:10.1021/jm070687z. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Automated high-content live animal drug screening using C. elegans expressing the aggregation prone serpin α1-antitrypsin Z». PloS One 5 (11): e15460. 2010. PMC 2980495. PMID 21103396. doi:10.1371/journal.pone.0015460. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Aeropin from the extremophile Pyrobaculum aerophilum bypasses the serpin misfolding trap». The Journal of Biological Chemistry 282 (37): 26802-9. September 2007. PMID 17635906. doi:10.1074/jbc.M705020200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Serpin protease inhibitors in plant biology». Physiologia Plantarum 145 (1): 95-102. May 2012. PMID 22085334. doi:10.1111/j.1399-3054.2011.01540.x. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Huntington J, Read R, Carrell R (2000). «Structure of a serpin-protease complex shows inhibition by deformation». Nature 407 (6806): 923-6. PMID 11057674.
- ↑ Carrell RW, Lomas DA. (1997). «Conformational disease.». Lancet. 350 (9071): 134-8. PMID 9228977.
- ↑ Lomas DA, Evans DL, Finch JT & Carrell RW (1992). «The mechanism of Z alpha 1-antitrypsin accumulation in the liver». Nature 357: 605-607. PMID 1608473.
- ↑ «Alpha1-antitrypsin deficiency». Lancet 365 (9478): 2225-36. 2005. PMID 15978931. doi:10.1016/S0140-6736(05)66781-5. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Discovery and optimization of a natural HIV-1 entry inhibitor targeting the gp41 fusion peptide». Cell 129 (2): 263-75. April 2007. PMID 17448989. doi:10.1016/j.cell.2007.02.042. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The molecular and cellular pathology of α₁-antitrypsin deficiency». Trends in Molecular Medicine 20 (2): 116-27. February 2014. PMID 24374162. doi:10.1016/j.molmed.2013.10.007. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Sequence diversity at the proximal 14q32.1 SERPIN subcluster: evidence for natural selection favoring the pseudogenization of SERPINA2». Molecular Biology and Evolution 24 (2): 587-98. February 2007. PMID 17135331. doi:10.1093/molbev/msl187. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Alpha 1-antichymotrypsin». The International Journal of Biochemistry & Cell Biology 28 (9): 961-4. September 1996. PMID 8930118. doi:10.1016/1357-2725(96)00032-5. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Nuclear α1-antichymotrypsin promotes chromatin condensation and inhibits proliferation of human hepatocellular carcinoma cells». Gastroenterology 144 (4): 818-828.e4. April 2013. PMID 23295442. doi:10.1053/j.gastro.2012.12.029. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Multi-functional capability of proteins: alpha1-antichymotrypsin and the correlation with Alzheimer's disease». Journal of Alzheimer's Disease 4 (2): 115-22. April 2002. PMID 12214135. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Kallistatin is a potent new vasodilator». The Journal of Clinical Investigation 100 (1): 11-7. July 1997. PMC 508159. PMID 9202051. doi:10.1172/JCI119502. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Kallistatin is a new inhibitor of angiogenesis and tumor growth». Blood 100 (9): 3245-52. November 2002. PMID 12384424. doi:10.1182/blood-2002-01-0185. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Depletion of endogenous kallistatin exacerbates renal and cardiovascular oxidative stress, inflammation, and organ remodeling». American Journal of Physiology. Renal Physiology 303 (8): F1230-8. October 2012. PMID 22811485. doi:10.1152/ajprenal.00257.2012. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Protein C inhibitor, a serpin with functions in- and outside vascular biology». Thrombosis and Haemostasis 97 (3): 343-7. March 2007. PMID 17334499. doi:10.1160/th06-09-0488. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Phosphatidylethanolamine critically supports internalization of cell-penetrating protein C inhibitor». The Journal of Cell Biology 179 (4): 793-804. November 2007. PMC 2080921. PMID 18025309. doi:10.1083/jcb.200707165. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Disruption of the protein C inhibitor gene results in impaired spermatogenesis and male infertility». The Journal of Clinical Investigation 106 (12): 1531-9. December 2000. PMC 381472. PMID 11120760. doi:10.1172/JCI10768. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Proteomic analysis of active multiple sclerosis lesions reveals therapeutic targets». Nature 451 (7182): 1076-81. February 2008. PMID 18278032. doi:10.1038/nature06559. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Corticosteroid-binding globulin gene polymorphisms: clinical implications and links to idiopathic chronic fatigue disorders». Clinical Endocrinology 67 (2): 161-7. August 2007. PMID 17547679. doi:10.1111/j.1365-2265.2007.02890.x. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Variations in thyroid hormone transport proteins and their clinical implications». Thyroid 2 (3): 237-45. 1992. PMID 1422238. doi:10.1089/thy.1992.2.237. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Clinical review: Central hypothyroidism: pathogenic, diagnostic, and therapeutic challenges». The Journal of Clinical Endocrinology and Metabolism 97 (9): 3068-78. September 2012. PMID 22851492. doi:10.1210/jc.2012-1616. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The intracellular renin-angiotensin system: a new paradigm». Trends in Endocrinology and Metabolism 18 (5): 208-14. July 2007. PMID 17509892. doi:10.1016/j.tem.2007.05.001. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Angiotensinogen-deficient mice with hypotension». The Journal of Biological Chemistry 269 (50): 31334-7. December 1994. PMID 7989296. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Angiotensinogen variants and human hypertension». Current Hypertension Reports 1 (1): 31-41. 1999. PMID 10981040. doi:10.1007/s11906-999-0071-0. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Angiotensinogen gene polymorphism, plasma angiotensinogen, and risk of hypertension and ischemic heart disease: a meta-analysis». Arteriosclerosis, Thrombosis, and Vascular Biology 23 (7): 1269-75. July 2003. PMID 12805070. doi:10.1161/01.ATV.0000079007.40884.5C. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Genetic basis of hypertension: revisiting angiotensinogen». Hypertension 48 (1): 14-20. July 2006. PMID 16754793. doi:10.1161/01.HYP.0000227932.13687.60. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Identification of centerin: a novel human germinal center B cell-restricted serpin». European Journal of Immunology 30 (10): 3039-48. October 2000. PMID 11069088. doi:10.1002/1521-4141(200010)30:10<3039::AID-IMMU3039>3.0.CO;2-H. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Molecular characterization of centerin, a germinal centre cell serpin». The Biochemical Journal 405 (3): 489-94. August 2007. PMC 2267310. PMID 17447896. doi:10.1042/BJ20070174. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Expression of the serpin centerin defines a germinal center phenotype in B-cell lymphomas». American Journal of Clinical Pathology 130 (1): 117-26. July 2008. PMID 18550480. doi:10.1309/9QKE68QU7B825A3U. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «An emerging role for Serine Protease Inhibitors in T lymphocyte immunity and beyond». Immunology Letters 152 (1): 65-76. April 2013. PMID 23624075. doi:10.1016/j.imlet.2013.04.004. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Characterization of the protein Z-dependent protease inhibitor». Blood 96 (9): 3049-55. November 2000. PMID 11049983. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Visceral adipose tissue-derived serine protease inhibitor: a unique insulin-sensitizing adipocytokine in obesity». Proceedings of the National Academy of Sciences of the United States of America 102 (30): 10610-5. July 2005. PMC 1180799. PMID 16030142. doi:10.1073/pnas.0504703102. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Higher vaspin levels in subjects with obesity and type 2 diabetes mellitus: a meta-analysis». Diabetes Research and Clinical Practice 106 (1): 88-94. October 2014. PMID 25151227. doi:10.1016/j.diabres.2014.07.026. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Sequence and molecular characterization of human monocyte/neutrophil elastase inhibitor». Proceedings of the National Academy of Sciences of the United States of America 89 (12): 5635-9. June 1992. PMC 49347. PMID 1376927. doi:10.1073/pnas.89.12.5635. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The neutrophil serine protease inhibitor serpinb1 preserves lung defense functions in Pseudomonas aeruginosa infection». The Journal of Experimental Medicine 204 (8): 1901-9. August 2007. PMC 2118684. PMID 17664292. doi:10.1084/jem.20070494. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The serine proteinase inhibitor (serpin) plasminogen activation inhibitor type 2 protects against viral cytopathic effects by constitutive interferon alpha/beta priming». The Journal of Experimental Medicine 187 (11): 1799-811. June 1998. PMC 2212304. PMID 9607921. doi:10.1084/jem.187.11.1799. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «SerpinB2 is critical to Th2 immunity against enteric nematode infection». Journal of Immunology 190 (11): 5779-87. June 2013. PMID 23630350. doi:10.4049/jimmunol.1200293. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The plasminogen activator inhibitor-2 gene is not required for normal murine development or survival». Proceedings of the National Academy of Sciences of the United States of America 96 (2): 686-91. January 1999. PMC 15197. PMID 9892694. doi:10.1073/pnas.96.2.686. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Squamous cell carcinoma antigen is a potent inhibitor of cysteine proteinase cathepsin L». FEBS Letters 359 (1): 78-80. February 1995. PMID 7851535. doi:10.1016/0014-5793(94)01456-b. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «SERPINB3 (serpin peptidase inhibitor, clade B (ovalbumin), member 3)». Atlas of Genetics and Cytogenetics in Oncology and Haematology 19 (3): 202-209. March 2015. PMC 4430857. PMID 25984243. doi:10.4267/2042/56413. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «A nonredundant role for mouse Serpinb3a in the induction of mucus production in asthma». The Journal of Allergy and Clinical Immunology 127 (1): 254-61, 261.e1-6. January 2011. PMC 3058372. PMID 21126757. doi:10.1016/j.jaci.2010.10.009. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Squamous cell carcinoma antigen 2 is a novel serpin that inhibits the chymotrypsin-like proteinases cathepsin G and mast cell chymase». The Journal of Biological Chemistry 272 (3): 1849-55. January 1997. PMID 8999871. doi:10.1074/jbc.272.3.1849. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Maspin (SERPINB5) is an obligate intracellular serpin». The Journal of Biological Chemistry 285 (14): 10862-9. April 2010. PMC 2856292. PMID 20123984. doi:10.1074/jbc.M109.073171. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Maspin, a serpin with tumor-suppressing activity in human mammary epithelial cells». Science 263 (5146): 526-9. January 1994. PMID 8290962. doi:10.1126/science.8290962. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Maspin is not required for embryonic development or tumour suppression». Nature Communications 5: 3164. 2014. PMC 3905777. PMID 24445777. doi:10.1038/ncomms4164. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Maspin plays an essential role in early embryonic development». Development 131 (7): 1479-89. April 2004. PMID 14985257. doi:10.1242/dev.01048. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The intracellular serpin proteinase inhibitor 6 is expressed in monocytes and granulocytes and is a potent inhibitor of the azurophilic granule protease, cathepsin G». Blood 93 (6): 2089-97. March 1999. PMID 10068683. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Absence of SERPINB6A causes sensorineural hearing loss with multiple histopathologies in the mouse inner ear». The American Journal of Pathology 183 (1): 49-59. July 2013. PMID 23669344. doi:10.1016/j.ajpath.2013.03.009. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Targeted disruption of SPI3/Serpinb6 does not result in developmental or growth defects, leukocyte dysfunction, or susceptibility to stroke». Molecular and Cellular Biology 24 (9): 4075-82. May 2004. PMC 387772. PMID 15082799. doi:10.1128/MCB.24.9.4075-4082.2004. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Naz, Sadaf (2012). Genetics of Nonsyndromic Recessively Inherited Moderate to Severe and Progressive Deafness in Humans. InTech. p. 260. ISBN 978-953-51-0366-0. doi:10.5772/31808. Parámetro desconocido
|name-list-format=ignorado (ayuda) - ↑ a b «Megsin gene: its genomic analysis, pathobiological functions, and therapeutic perspectives». Current Genomics 8 (3): 203-8. May 2007. PMC 2435355. PMID 18645605. doi:10.2174/138920207780833856. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Nagashima-type palmoplantar keratosis: a common Asian type caused by SERPINB7 protease inhibitor deficiency». The Journal of Investigative Dermatology 134 (8): 2076-9. August 2014. PMID 25029323. doi:10.1038/jid.2014.156. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Inhibition of soluble recombinant furin by human proteinase inhibitor 8». The Journal of Biological Chemistry 273 (4): 1851-4. January 1998. PMID 9442015. doi:10.1074/jbc.273.4.1851. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «A cytosolic granzyme B inhibitor related to the viral apoptotic regulator cytokine response modifier A is present in cytotoxic lymphocytes». The Journal of Biological Chemistry 271 (44): 27802-9. November 1996. PMID 8910377. doi:10.1074/jbc.271.44.27802. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Serine protease inhibitor 6 protects cytotoxic T cells from self-inflicted injury by ensuring the integrity of cytotoxic granules». Immunity 24 (4): 451-61. April 2006. PMID 16618603. doi:10.1016/j.immuni.2006.02.002. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Serpinb9 (Spi6)-deficient mice are impaired in dendritic cell-mediated antigen cross-presentation». Immunology and Cell Biology 90 (9): 841-51. October 2012. PMID 22801574. doi:10.1038/icb.2012.29. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Expression of bomapin, a novel human serpin, in normal/malignant hematopoiesis and in the monocytic cell lines THP-1 and AML-193». Blood 91 (4): 1256-62. February 1998. PMID 9454755. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «SERPINB11 is a new noninhibitory intracellular serpin. Common single nucleotide polymorphisms in the scaffold impair conformational change». The Journal of Biological Chemistry 282 (34): 24948-60. August 2007. PMID 17562709. doi:10.1074/jbc.M703182200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «SERPINB11 frameshift variant associated with novel hoof specific phenotype in Connemara ponies». PLoS Genetics 11 (4): e1005122. April 2015. PMID 25875171. doi:10.1371/journal.pgen.1005122. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «SERPINB12 is a novel member of the human ov-serpin family that is widely expressed and inhibits trypsin-like serine proteinases». The Journal of Biological Chemistry 276 (52): 49320-30. December 2001. PMID 11604408. doi:10.1074/jbc.M108879200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Hurpin is a selective inhibitor of lysosomal cathepsin L and protects keratinocytes from ultraviolet-induced apoptosis». Biochemistry 42 (24): 7381-9. June 2003. PMID 12809493. doi:10.1021/bi027307q. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Complete antithrombin deficiency in mice results in embryonic lethality». The Journal of Clinical Investigation 106 (7): 873-8. October 2000. PMC 517819. PMID 11018075. doi:10.1172/JCI10489. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Serpin structure, function and dysfunction». Journal of Thrombosis and Haemostasis. 9 Suppl 1: 26-34. July 2011. PMID 21781239. doi:10.1111/j.1538-7836.2011.04360.x. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Antithrombotic activity of dermatan sulfate in heparin cofactor II-deficient mice». Blood 104 (13): 3965-70. December 2004. PMID 15315969. doi:10.1182/blood-2004-02-0598. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Strain-dependent embryonic lethality and exaggerated vascular remodeling in heparin cofactor II-deficient mice». The Journal of Clinical Investigation 117 (6): 1514-26. June 2007. PMC 1878511. PMID 17549254. doi:10.1172/JCI27095. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Structure-function relationships of plasminogen activator inhibitor-1 and its potential as a therapeutic agent». Current Drug Targets 8 (9): 971-81. September 2007. PMID 17896949. doi:10.2174/138945007781662337. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Mice lacking protease nexin-1 show delayed structural and functional recovery after sciatic nerve crush». The Journal of Neuroscience 27 (14): 3677-85. April 2007. PMID 17409231. doi:10.1523/JNEUROSCI.0277-07.2007. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Male fertility defects in mice lacking the serine protease inhibitor protease nexin-1». Proceedings of the National Academy of Sciences of the United States of America 98 (6): 3029-33. March 2001. PMC 30601. PMID 11248026. doi:10.1073/pnas.051630698. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Endogenous serine protease inhibitor modulates epileptic activity and hippocampal long-term potentiation». The Journal of Neuroscience 17 (12): 4688-99. June 1997. PMID 9169529. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Pigment epithelium-derived factor regulates the vasculature and mass of the prostate and pancreas». Nature Medicine 9 (6): 774-80. June 2003. PMID 12740569. doi:10.1038/nm870. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Pigment epithelium-derived factor binds to hyaluronan. Mapping of a hyaluronan binding site». The Journal of Biological Chemistry 283 (48): 33310-20. November 2008. PMC 2586245. PMID 18805795. doi:10.1074/jbc.M801287200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Vascular niche factor PEDF modulates Notch-dependent stemness in the adult subependymal zone». Nature Neuroscience 12 (12): 1514-23. December 2009. PMID 19898467. doi:10.1038/nn.2437. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «On the mechanism of the reaction between human alpha 2-antiplasmin and plasmin». The Journal of Biological Chemistry 254 (18): 9291-7. September 1979. PMID 158022. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Alpha2-antiplasmin gene deficiency in mice is associated with enhanced fibrinolytic potential without overt bleeding». Blood 93 (7): 2274-81. April 1999. PMID 10090937. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Alpha2-antiplasmin and its deficiency: fibrinolysis out of balance». Haemophilia 14 (6): 1250-4. November 2008. PMID 19141165. doi:10.1111/j.1365-2516.2008.01766.x. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Favier, R.; Aoki, N.; De Moerloose, P. (1 July 2001). «Congenital α2-plasmin inhibitor deficiencies: a review». British Journal of Haematology 114 (1): 4-10. ISSN 1365-2141. doi:10.1046/j.1365-2141.2001.02845.x. Parámetro desconocido
|name-list-format=ignorado (ayuda) - ↑ «C1 inhibitor serpin domain structure reveals the likely mechanism of heparin potentiation and conformational disease». The Journal of Biological Chemistry 282 (29): 21100-9. July 2007. PMID 17488724. doi:10.1074/jbc.M700841200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Complement analysis in the 21st century». Molecular Immunology 44 (16): 3838-49. September 2007. PMID 17768101. doi:10.1016/j.molimm.2007.06.150. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The autoimmune side of hereditary angioedema: insights on the pathogenesis». Autoimmunity Reviews 14 (8): 665-9. August 2015. PMID 25827463. doi:10.1016/j.autrev.2015.03.006. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Embryonic lethality of molecular chaperone hsp47 knockout mice is associated with defects in collagen biosynthesis». The Journal of Cell Biology 150 (6): 1499-506. September 2000. PMC 2150697. PMID 10995453. doi:10.1083/jcb.150.6.1499. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Osteogenesis imperfecta due to mutations in non-collagenous genes: lessons in the biology of bone formation». Current Opinion in Pediatrics 26 (4): 500-7. August 2014. PMC 4183132. PMID 25007323. doi:10.1097/MOP.0000000000000117. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Recessively inherited forms of osteogenesis imperfecta». Annual Review of Genetics 46: 475-97. 1 January 2012. PMID 23145505. doi:10.1146/annurev-genet-110711-155608. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The axonally secreted serine proteinase inhibitor, neuroserpin, inhibits plasminogen activators and plasmin but not thrombin». The Journal of Biological Chemistry 273 (4): 2312-21. January 1998. PMID 9442076. doi:10.1074/jbc.273.4.2312. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Familial conformational diseases and dementias». Human Mutation 20 (1): 1-14. July 2002. PMID 12112652. doi:10.1002/humu.10100. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Protein misfolding and the serpinopathies». Prion 1 (1): 15-20. 1 March 2007. PMC 2633702. PMID 19164889. doi:10.4161/pri.1.1.3974. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Isolation and characterization of a novel human pancreas-specific gene, pancpin, that is down-regulated in pancreatic cancer cells». Genes, Chromosomes & Cancer 22 (3): 179-85. July 1998. PMID 9624529. doi:10.1002/(SICI)1098-2264(199807)22:3<179::AID-GCC3>3.0.CO;2-T. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Acinar cell apoptosis in Serpini2-deficient mice models pancreatic insufficiency». PLoS Genetics 1 (3): e38. September 2005. PMC 1231717. PMID 16184191. doi:10.1371/journal.pgen.0010038. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The molecular phylogeny of uterine serpins and its relationship to evolution of placentation». FASEB Journal 24 (2): 526-37. February 2010. PMID 19825977. doi:10.1096/fj.09-138453. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Evolution and function of the uterine serpins (SERPINA14)». American Journal of Reproductive Immunology 64 (4): 265-74. October 2010. PMID 20678169. doi:10.1111/j.1600-0897.2010.00901.x. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Tip of another iceberg: Drosophila serpins». Trends in Cell Biology 15 (12): 659-65. December 2005. PMID 16260136. doi:10.1016/j.tcb.2005.10.001. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «A serpin that regulates immune melanization in the respiratory system of Drosophila». Developmental Cell 15 (4): 617-26. October 2008. PMC 2671232. PMID 18854145. doi:10.1016/j.devcel.2008.08.017. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Drosophila Serpin-28D regulates hemolymph phenoloxidase activity and adult pigmentation». Developmental Biology 323 (2): 189-96. November 2008. PMID 18801354. doi:10.1016/j.ydbio.2008.08.030. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Dorsoventral patterning: a serpin pinned down at last». Current Biology 14 (1): R16-8. January 2004. PMID 14711428. doi:10.1016/j.cub.2003.12.015. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «A serpin regulates dorsal-ventral axis formation in the Drosophila embryo». Current Biology 13 (23): 2097-102. December 2003. PMID 14654000. doi:10.1016/j.cub.2003.10.062. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «93-kDa twin-domain serine protease inhibitor (Serpin) has a regulatory function on the beetle Toll proteolytic signaling cascade». The Journal of Biological Chemistry 286 (40): 35087-95. October 2011. PMC 3186399. PMID 21862574. doi:10.1074/jbc.M111.277343. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «SRP-2 is a cross-class inhibitor that participates in postembryonic development of the nematode Caenorhabditis elegans: initial characterization of the clade L serpins». The Journal of Biological Chemistry 279 (15): 15448-59. April 2004. PMID 14739286. doi:10.1074/jbc.M400261200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «An intracellular serpin regulates necrosis by inhibiting the induction and sequelae of lysosomal injury». Cell 130 (6): 1108-19. September 2007. PMC 2128786. PMID 17889653. doi:10.1016/j.cell.2007.07.013. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Sequence homology between barley endosperm protein Z and protease inhibitors of the alpha-1-antitrypsin family». FEBS Lett. 180 (1): 89-94. 1985. doi:10.1016/0014-5793(85)80238-6. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Inhibition of coagulation factors by recombinant barley serpin BSZx». FEBS Letters 394 (2): 165-8. September 1996. PMID 8843156. doi:10.1016/0014-5793(96)00940-4. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Inhibitory serpins from wheat grain with reactive centers resembling glutamine-rich repeats of prolamin storage proteins. Cloning and characterization of five major molecular forms». The Journal of Biological Chemistry 275 (43): 33272-9. October 2000. PMID 10874043. doi:10.1074/jbc.M004633200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Characterization of cucurbita maxima phloem serpin-1 (CmPS-1). A developmentally regulated elastase inhibitor». The Journal of Biological Chemistry 275 (45): 35122-8. November 2000. PMID 10960478. doi:10.1074/jbc.M006060200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Cucurbit phloem serpins are graft-transmissible and appear to be resistant to turnover in the sieve element-companion cell complex». Journal of Experimental Botany 56 (422): 3111-20. December 2005. PMID 16246856. doi:10.1093/jxb/eri308. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Serpins in plants and green algae». Functional & Integrative Genomics 8 (1): 1-27. February 2008. PMID 18060440. doi:10.1007/s10142-007-0059-2. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Set-point control of RD21 protease activity by AtSerpin1 controls cell death in Arabidopsis». The Plant Journal 74 (3): 498-510. May 2013. PMID 23398119. doi:10.1111/tpj.12141. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Serpin genes AtSRP2 and AtSRP3 are required for normal growth sensitivity to a DNA alkylating agent in Arabidopsis». BMC Plant Biology 9: 52. 2009. PMC 2689219. PMID 19426562. doi:10.1186/1471-2229-9-52. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «The functional repertoire of prokaryote cellulosomes includes the serpin superfamily of serine proteinase inhibitors». Molecular Microbiology 60 (6): 1344-54. June 2006. PMID 16796673. doi:10.1111/j.1365-2958.2006.05182.x. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The 1.5 A crystal structure of a prokaryote serpin: controlling conformational change in a heated environment». Structure 11 (4): 387-97. April 2003. PMID 12679017. doi:10.1016/S0969-2126(03)00057-1. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «The high resolution crystal structure of a native thermostable serpin reveals the complex mechanism underpinning the stressed to relaxed transition». The Journal of Biological Chemistry 280 (9): 8435-42. March 2005. PMID 15590653. doi:10.1074/jbc.M410206200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Poxvirus immune modulators: functional insights from animal models». Virus Research 88 (1-2): 35-53. September 2002. PMID 12297326. doi:10.1016/S0168-1702(02)00119-3. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «Serpins, the vasculature, and viral therapeutics». Frontiers in Bioscience 11: 1042-56. 2006. PMID 16146796. doi:10.2741/1862. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Induction of indefinite cardiac allograft survival correlates with toll-like receptor 2 and 4 downregulation after serine protease inhibitor-1 (Serp-1) treatment». Transplantation 84 (9): 1158-67. November 2007. PMID 17998872. doi:10.1097/01.tp.0000286099.50532.b0. (requiere suscripción). Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Serp-1, a viral anti-inflammatory serpin, regulates cellular serine proteinase and serpin responses to vascular injury». The Journal of Biological Chemistry 278 (20): 18563-72. May 2003. PMID 12637546. doi:10.1074/jbc.M209683200. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Myxoma virus Serp2 is a weak inhibitor of granzyme B and interleukin-1beta-converting enzyme in vitro and unlike CrmA cannot block apoptosis in cowpox virus-infected cells». Journal of Virology 73 (8): 6394-404. August 1999. PMC 112719. PMID 10400732. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Viral anti-inflammatory reagents: the potential for treatment of arthritic and vasculitic disorders». Endocrine, Metabolic & Immune Disorders Drug Targets 6 (4): 331-43. December 2006. PMID 17214579. doi:10.2174/187153006779025720. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Crystal structure of the apoptotic suppressor CrmA in its cleaved form». Structure 8 (7): 789-97. July 2000. PMID 10903953. doi:10.1016/S0969-2126(00)00165-9. Parámetro desconocido
|vauthors=ignorado (ayuda)