Virus del papiloma humano
| Virus del papiloma humano (VPH) | ||
|---|---|---|
 Virus del papiloma humano. | ||
| Especialidad | infectología | |
El virus del papiloma de humano (VPH o HPV, del inglés human papillomavirus) es una de las infecciones de transmisión sexual más frecuentes en todo el mundo. Se trata de grupos diversos de virus ADN pertenecientes a la familia de los Papillomaviridae. No poseen envoltura y tienen un diámetro aproximado de 52-55 nm.
Los VPH son virus que se replican específicamente en el núcleo de células epiteliales escamosas. A diferencia de lo que ocurre en otras familias virales, las proteínas de la cápside de los diversos tipos de VPH son antigénicamente similares, por lo tanto los VPH no pueden ser clasificados en serotipos, de tal forma que su clasificación en genotipos y subtipos se basa en las diferencias de su secuencia de ADN.[1]
Se conocen más de 200 tipos víricos, que se clasifican según su patogenia oncológica en tipos de alto y de bajo riesgo oncológico. La Agencia Internacional para la Investigación del Cáncer (IARC) considera que los tipos de VPH 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 66 son carcinógenos para los humanos ―tipos de alto riesgo oncológico― y que otros tipos, incluidos el VPH 6 y el VPH 11, son posibles carcinógenos para los humanos ―tipos de bajo riesgo oncológico―.[2] Como todos los virus de esta familia, los VPH solo establecen infecciones productivas en el epitelio estratificado de la piel y mucosas de humanos, así como de una variedad de animales. La mayoría de los VPH descritos no causan ningún síntoma en la mayor parte de la gente. Algunos tipos de VPH pueden causar verrugas o condilomas, mientras otros pueden generar infecciones subclínicas, que pueden (en una minoría de casos) dar lugar a cáncer cervical, de vulva, vagina y ano en mujeres, o cáncer del ano y pene en hombres.[3] La mayor parte de la gente infectada por VPH desconoce que lo está.[3] Todos los VPH se transmiten por contacto piel a piel, por saliva, uso de material contaminado o bien de la madre al feto.
Entre treinta y cuarenta tipos de VPH se transmiten normalmente por contacto sexual e infectan la región anogenital. Algunos tipos de VPH transmitidos por contacto sexual pueden producir verrugas genitales. La infección persistente con algunos tipos de VPH transmitidos sexualmente denominados de «alto riesgo» (diferentes de los que causan verrugas) puede evolucionar y producir lesiones precancerosas y cáncer invasivo.[4] La infección con VPH es la causa principal de casi todos los casos de cáncer cervical,[5] aunque en la mayor parte de las infecciones con este tipo de virus no se produce ninguna patología. En el año 2008, el médico alemán Harald zur Hausen recibió el Premio Nobel de Medicina por el descubrimiento del VPH como una causa de cáncer cervical.
Además, se ha caracterizado la influencia de este virus en cáncer de cabeza y cuello, estimándose la prevalencia del VPH en estos tumores entre el 23 y el 36 %, según la localización anatómica.[6]
La mayor parte de las infecciones con VPH en mujeres jóvenes son temporales, y tienen poca importancia a largo plazo. El 70 % de las infecciones desaparecen en 1 año y el 90 % en 2 años.[7] Sin embargo, cuando la infección persiste ―entre el 5 y el 10 por ciento de las mujeres infectadas― existe el riesgo de desarrollar lesiones precancerosas en el cuello del útero (el cérvix), que puede progresar a cáncer cervical invasivo. Este proceso normalmente lleva entre 15 y 20 años, dando muchas oportunidades a la detección y el tratamiento de las lesiones precancerosas, a menudo con altas tasas de curación.
En los países con recursos financieros suficientes se utiliza el test cervical papanicolaou (pap) para detectar células anormales que podrían degenerar en cancerosas. Un examen cervical (inspección visual) también puede detectar verrugas y otros crecimientos anormales, que aparecen como manchas blancas en la piel cuando se lavan con ácido acético. Las células anormales y cancerosas pueden eliminarse con un procedimiento simple, normalmente con un asa cauterizante o ―más frecuentemente en el mundo desarrollado― por congelación (crioterapia). Recientemente se han desarrollado tests de ADN para detectar VPH, más sensibles que el test pap y la inspección visual. Se están desarrollando también tests de bajo coste, adecuados para centros con pocos recursos, lo que permitirá realizar tests de manera sistemática en lugares donde ahora no es posible como en África, Asia y algunos países de Latinoamérica.
Los tests pap han reducido la incidencia y los fallecimientos por cáncer cervical en el mundo desarrollado, pero aun así hubo 11 000 casos y 3900 fallecimientos en Estados Unidos en el año 2008. El cáncer cervical presenta una elevada mortalidad en áreas pobres en recursos; a nivel mundial, se producen 490.000 casos y 270.000 fallecimientos cada año.[8][9] Sobre todo debido a que el test pap es difícil de mantener en centros con pocos recursos, entre el 80 y el 85 % de los fallecimientos por cáncer cervical tienen lugar en los países en desarrollo.
Las vacunas VPH, Cervarix y Gardasil, que previenen la infección con los tipos de VPH que causan el 70 % del cáncer cervical (tipos 16 y 18), pueden conducir a reducciones mayores.[8][10]
Historia
[editar]El hecho clave que llevó a los investigadores a relacionar la infección por VPH transmitida sexualmente con el cáncer cervical fue las mayores tasas de cáncer cervical registradas en prostitutas en comparación con las tasas registradas en monjas.[11] Hoy en día muchos estudios han demostrado claramente que el VPH se transmite fundamentalmente por contacto sexual.
Epidemiología
[editar]Las infecciones por VPH ocurren a nivel mundial. No hay países, razas, edades o sexos que no estén atacados. La mayoría de las primoinfecciones por VPH suceden en la infancia y en la niñez, pero no son descubiertas excepto por técnicas muy sofisticadas. La inmensa mayoría cursan de modo subclínico. Esto tanto como en las infecciones cutáneas como las genitales (vaginales, balanopostitis) u oro digestivas. Un factor primordial que puede ser causa asociada con las heridas y lesiones provocadas en zonas poco salubres sometidas a traumatismos repetidos como maceración de mucosas o de la piel.[12]
VPH cutáneos
[editar]La infección con VPH cutáneos es ubicua.[13] Algunos tipos de VPH, como VPH-5, puede establecer infecciones que persisten por el tiempo de vida de individuos, sin siquiera manifestar síntoma clínico alguno. Como la rémora que no daña al tiburón, esos tipos VPH pueden pensarse como comensales de humanos. Otros VPH cutáneos, como los tipos 1 o 2 de VPH, pueden causar verrugas comunes en algunos individuos infectados. Las verrugas cutáneas son muy comunes en la niñez, y típicamente aparecen y remiten espontáneamente con el curso de semanas a meses. Cerca del 10 % de adultos también sufre de verrugas cutáneas recurrentes. Se cree que todos los VPH son capaces de establecer infecciones «latentes» de largo término en un pequeño número de células madres presentes en la piel. Aunque esas infecciones latentes puede que nunca sean completamente erradicadas, el control inmunológico está pensado para bloquear la aparición de síntomas como verrugas. El control inmunológico del VPH es del tipo específico, significando esto que un individuo puede hacerse inmunológicamente resistente a un tipo de VPH mientras permanece susceptible a otros tipos.[cita requerida]
VPH genitales
[editar]Un gran incremento en la incidencia de infección genital por VPH ocurre a la edad donde los individuos comienzan a tener relaciones sexuales. La gran mayoría de las infecciones genitales por VPH nunca causan síntomas patentes, y son aclaradas por el sistema inmune en cuestión de meses.
Como con los VPH cutáneos, se cree que la inmunidad al VPH es de tipo específica. Un subgrupo de individuos infectados pueden fallar en producir infección genital de VPH bajo control inmunológico. Uniendo la infección con los tipos de VPH de alto riesgo, como los VPH 16, 18, 31 y 45, puede arrancar el desarrollo de cáncer cervical u otros tipos de cáncer.[14]
Los tipos VPH de alto riesgo 16 y 18 son responsables, juntos, del 65 % de los casos de cáncer cervical.[15][16]
El tipo 16 causa entre el 41 y el 54 % de los cánceres cervicales,[17][16] y agrega aún mayor cantidad de cánceres vaginales/vulvares inducidos por VPH,[18] cánceres de pene, anales y de cabeza y cuello.[19]
Salud pública y VPH genitales
[editar]De acuerdo a los Centros para el Control y la Prevención de Enfermedades de Estados Unidos, a los 50 años o más, el 80 % de las mujeres estadounidenses contraerán al menos un tipo de VPH genital. Se les encomienda a las mujeres hacerse anualmente un pap para detectar anormalidades celulares causadas por VPH.[20]
La vacuna VPH, Gardasil, protege contra los dos tipos de VPH que causan el 70 % de los casos de cáncer cervical, y los dos tipos de VPH causantes del 90 % de las verrugas genitales.
El CDC recomienda la vacunación entre los 11 y 26 años.[20]
Estadística perinatal
[editar]Aunque los tipos genitales de VPH son a veces transmitidos de madre a hijo durante el nacimiento, la aparición del VPH genital relacionado con enfermedades en recién nacidos es rara. La transmisión perinatal de tipos de VPH 6 y 11 puede resultar en el desarrollo de papilomatosis respiratoria recurrente juvenil (JORRP).[21] La JORRP es muy rara, con tasas de cerca de 2 casos cada 100 000 niños en Estados Unidos.[22] Aunque esa tasa de JORRP es sustancialmente mayor si la mujer presenta verrugas genitales al tiempo de dar a luz, el riesgo de JORRP en tales casos es menor al 1 %.
El VPH genital en Estados Unidos
[editar]Se estima que el VPH es la infección por transmisión sexual más frecuente en Estados Unidos.[23] Cerca de 6,2 millones de estadounidenses entre 15 y 44 años se infectaron con VPH genital en el año 2000. De estos, el 74 % tenía entre 15 y 24 años.[24]
La mayor parte de los hombres y mujeres sexualmente activos probablemente adquirirán una infección genital por VPH en algún momento de su vida.[16] En 2006, las proyecciones de la Asociación Estadounidense de Salud Social fueron aún más pesimistas, prediciendo que cerca del 75 % de la población reproductiva se infectará con VPH genital en algún momento de su vida.[25]
Las estimaciones de la prevalencia de VPH varían entre el 14 % a más del 90 %.[26] Una razón para esta discrepancia en las cifras es que algunos estudios consideran únicamente las mujeres que presentan una infección detectable en el momento del análisis, mientras que otros estudios incluyen todas las mujeres que han tenido alguna vez en su vida una infección detectable.[27][28] Otra causa de discrepancia es la diferencia en las cepas que se analizaron.
Un estudio halló que, durante 2003 y 2004, en un momento cualquiera, un 26,8 % de mujeres entre 14 a 59 años estaban infectadas con al menos un tipo de VPH. Esto fue mayor de lo previamente estimado. El 15,2 % estaban infectadas con uno o más de los tipos de alto riesgo que pueden producir cáncer. Sin embargo, solo el 3,4 % estaban infectadas con uno o más de los cuatro tipos prevenidos por la vacuna VPH Gardasil, menor de lo previamente estimado.[23]
Sin embargo, mientras que hace 50 años el cáncer cervical era la causa principal de los fallecimientos de mujeres en Estados Unidos, en la actualidad la tasa de fallecimientos se ha reducido en dos tercios hasta representar en este momento la octava causa de fallecimientos. La mayor parte de esta reducción se debe a la detección temprana gracias a la eficacia del test pap y la inspección visual del cérvix.[29]
Algunos estudios muestran que la infección por VPH es más prevalente en la población gay; mostrando una asociación entre la infección por VPH y los cáncer de pene y anal; el riesgo de cáncer anal es 17 a 31 veces mayor entre gais y hombres bisexuales que entre los heterosexuales.[30][31]
Aunque es posible testear el ADN del VPH en hombres,[32] no hay tests aprobados por la FDA, ya que la prueba es inconcluyente y médicamente innecesaria.[30][33][34]
No hay una prueba de infección para VPH en hombres. Sin embargo, aunque no hay una guía formal, algunos expertos creen que los hombres que reciben sexo anal deberían hacerse un papanicolaou anal de rutina, especialmente si ya saben que están infectados con HIV. Consulte con un profesional si debería ser probado.[35]
Información del Centro de Control de Enfermedades
[editar]De acuerdo a los Centros para el Control y la Prevención de Enfermedades de los Estados Unidos (CDC), a los 50 años, más del 80 % de las mujeres estadounidenses contraerán al menos uno de los tipos de VPH genital.[36][37][38] Se recomienda a todas las mujeres realizarse anualmente una prueba de papanicolaou para detectar anormalidades celulares causadas por VPH.[20]
De acuerdo a la NCCC (National Cervical Cancer Coalition: Coalición Nacional por el Cáncer Cervical), el 11 % de las mujeres estadounidenses no se hacen el pap; y esas mujeres sin control regular de cáncer cervical incrementan dramáticamente su posibilidad de tener cáncer cervical. La Sociedad Estadounidense del Cáncer estimaba que en 2008, se diagnosticaría cáncer cervical invasivo a alrededor de 11 070 mujeres en Estados Unidos, y que cerca de 3.870 mujeres estadounidenses fallecerían por esta causa.[39]
Información de la Asociación Médica de Estados Unidos
[editar]De acuerdo a la JAMA (Journal of the American Medical Association: Revista de la Asociación Médica Estadounidense, Dunne et al, 2007) la prevalencia de la infección con VPH entre mujeres estadounidenses es como sigue:[23]
| Edad (años) | Prevalencia |
|---|---|
| 14 a 19 | 24,5 % |
| 20 a 24 | 44,8 % |
| 25 a 29 | 27,4 % |
| 30 a 39 | 27,5 % |
| 40 a 49 | 25,2 % |
| 50 a 59 | 19,6 % |
| 14 a 59 | 26,8 % |
Puede observarse que la prevalencia presenta un pico en las jóvenes de 20 a 24 años (relacionado con el inicio sexual) y disminuye con la edad, cuando aumentan las relaciones monógamas. Esto puede deberse a que la infección es controlada y eliminada por el sistema inmune, o que cae a niveles indetectables a pesar de seguir presente en el cuerpo. Probablemente el VPH permanece en las células de un individuo infectado por tiempo indefinido, a menudo en estado latente.
Transmisión
[editar]El VPH genital suele diseminarse a través de un contacto directo sostenido con la piel, y las formas más comunes (no las únicas) son el sexo vaginal y el sexo anal.[40] Ocasionalmente, puede transmitirse de madre a bebé durante el embarazo. No se transmite a través de objetos comunes tales como el inodoro.[41]
El virus del papiloma humano (VPH) se transmite principalmente a través del contacto íntimo, siendo las mucosas y la humedad de estas su hábitat ideal. Los fluidos del área genital cargados con VPH pueden transferirse y empapar las zonas genitales de ambos miembros de la pareja. Las relaciones con mayor fricción, sin lubricación adecuada o de carácter traumático aumentan significativamente la probabilidad de transmisión del VPH. Durante estas actividades, las micro-erosiones en las mucosas crean un entorno propicio para la implantación del virus[42].
Los factores de riesgo para las infecciones persistentes de VPH genital son, entre otros:
- inicio de la actividad sexual a una edad temprana;
- múltiples parejas sexuales;
- tabaquismo;
- inmunosupresión[43] (por ejemplo, casos de diabetes mellitus avanzada)
Patogenia
[editar]| Virus del papiloma humano | ||
|---|---|---|
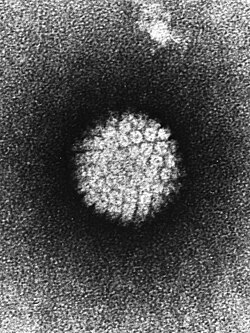 Virus del papiloma humano visto con microscopio electrónico de transmisión | ||
| Taxonomía | ||
| Familia: | Papillomaviridae | |
| Clasificación de Baltimore | ||
| Grupo: | I (Virus ADN bicatenario) | |
| Géneros | ||
De los 16 géneros de la familia Papillomavirus, únicamente 5 infectan a seres humanos, éstos son: Alphapapillomavirus, Betapapillomavirus, Gammapapillomavirus, Mupapillomavirus y Nupapillomavirus. Estos 5 géneros albergan a más de 170 tipos de virus que forman la clasificación no taxonómica de "virus del papiloma humano".[44]
Los viriones de VPH son partículas pequeñas, sin envoltura, con simetría icosaédrica. Cada virión está formado por 72 capsómeros, y cada uno de ellos contiene 5 moléculas de la proteína mayor de la cápsida, denominada L1. El genoma viral está formado por una molécula de ADN circular de doble hebra, asociada con nucleosomas formados por histonas celulares. Los papilomavirus comparten estas características con los virus de la familia Polyomaviridae, pero presentan diferencias con respecto a estos.[45]
Las diferencias genotípicas entre los tipos de papiloma virus vienen marcadas por los diferentes aminoácidos que constituyen la proteína L1 (proteína estructural del virus que posee además efecto antigénico). Son las características de esta proteína las que hacen que el virus pueda ser tratado como de «bajo o alto riesgo» y por ello su genotipo específico es el que se usa para poder clasificar a estos virus.
Según el genotipo de la proteína L1 podremos clasificar los virus como: L1 tipo 16, L1 tipo 18... o como VPH tipo 16, VPH tipo 18...
La mayoría de los genomas de los papilomavirus contienen entre 8 y 10 marcos abiertos de lectura. El genoma del papilomavirus humano tipo 16 contiene 6 genes de expresión temprana (denominados E1, E2, E3, E4, E5 y E6, por early genes) y 2 de expresión tardía (denominados L1 y L2, por late genes). A diferencia con los polyomavirus, todos los ARN mensajeros de los papilomavirus se transcriben a partir de una sola de las hebras del ADN. La secuencia que codifica las diferentes proteínas se solapa en algunos casos, lo que permite utilizar de forma eficiente un genoma muy pequeño.[45]
Ciclo de vida del VPH
[editar]
El ciclo de vida del VPH sigue estrictamente el programa de diferenciación de la célula huésped, el queratinocito.
Durante la infección del epitelio de las mucosas, los viriones deben alcanzar en primer lugar las células basales no diferenciadas. Por ello, se piensa que el virión VPH infecta tejidos epiteliales a través de microabrasiones que permiten un acceso más fácil a las zonas basales del epitelio. Una vez en contacto con las células objetivo, el virión se asocia con receptores putativos como son las alfa integrinas, la heparina y las lamininas. Los viriones entran en las células epiteliales basales por endocitosis mediada por vesículas recubiertas de clatrina y/o caveolina, dependiendo del tipo de VPH. Una vez en el interior celular, el genoma viral es transportado al núcleo por mecanismos desconocidos, donde se mantiene como un minicromosoma circular libre. Se transcriben entonces los genes tempranos (E), lo que permite realizar una replicación del ADN inicial que resulta en un número de copias de entre 50-100 genomas virales por célula. A partir de este momento, el genoma viral se replica en promedio una vez por ciclo celular, cuando las células basales se dividen, y los genomas virales se reparten a partes iguales entre las células hijas. Este tipo de replicación viral se denomina «replicación tipo plásmido».[45]
Cuando las células basales entran en el proceso de diferenciación que las convertirá en queratinocitos, a medida que migran hacia las capas superiores del epitelio, tiene lugar una «explosión» en la replicación del ADN viral, conocida como «replicación vegetativa». Además, en las capas superiores del epitelio del huésped se desencadena un complejo mecanismo de transcripción en cascada y se expresan los genes tardíos L1 y L2, que son las proteínas estructurales que encapsidan los genomas virales amplificados. El ensamblaje de los viriones hijos tiene lugar en el núcleo, liberándose cuando se descaman las células muertas del epitelio del huésped, de manera que el ciclo de vida viral continua. Actualmente se desconocen las señales intracelulares que regulan la transición del virus hacia la replicación vegetativa durante la diferenciación de los queratinocitos.[45]
Efecto sobre el ciclo de la célula anfitrión
[editar]Los oncogenes virales E6 y E7 modifican el ciclo celular, consiguiendo mantener el queratinocito diferenciado en un estado propicio para la replicación del genoma viral y la expresión tardía de los genes estructurales.
Los papilomavirus no poseen enzimas para replicar su ADN, por lo que para replicar sus genomas de ADN de doble hebra utilizan la maquinaria de la célula anfitrión. Como la replicación vegetativa tiene lugar en los queratinocitos diferenciados, que normalmente no se dividen y no replican su ADN, el virus debe inducir la síntesis de ADN celular: esta es la función de la proteína viral E7.
La proteína diana más importante de E7 es el producto del gen supresor tumoral denominado pRb, y además las proteínas asociadas p107 y p130. La proteína pRb es uno de los principales reguladores del ciclo celular, que funciona uniéndose e inhibiendo la actividad del factor de transcripción E2F. Cuando pRb libera E2F, este activa la expresión de genes implicados en la progresión en el ciclo celular y en la síntesis de ADN. E7 se une a pRb, inactivándolo, de manera que la célula entra en la fase S del ciclo celular y se activa la maquinaria de replicación del ADN, necesaria para la amplificación del genoma viral.[45]
Los productos del gen E7 de los tipos de alto riesgo VPH 16 y 18 se unen a pRb con mayor afinidad que proteínas E7 de virus no-oncogénicos, como VPH 6 y 11, lo cual explica en parte las diferencias en su capacidad oncogénica.
Por su parte, el producto del gen E6 de los tipos VPH 16 y 18 se caracteriza por su capacidad de mediar la destrucción de la proteína p53, a través de la vía proteolítica mediada por ubiquitina. La proteína p53 es el producto de otro gen supresor tumoral, que se ha denominado «el guardián del genoma», por su función central en la reparación del ADN dañado y la activación de la apoptosis (muerte celular programada) cuando las lesiones no pueden repararse. La proteína p53 es por ello fundamental para mantener la integridad del genoma y destruir las células dañadas, potencialmente tumorigénicas. De hecho, estudios clínicos muestran que más del 50 % de los casos de cáncer en humanos presentan mutaciones en p53. Los papilomavirus oncogénicos, el virus del simio 40 (SV40) y los adenovirus han evolucionado generando proteínas que reconocen e inhiben la actividad de p53, aunque utilizando diferentes mecanismos. La función principal de E6 es dirigir la degradación de p53, de manera que se inhibe la apoptosis de la célula infectada, manteniéndola con vida hasta que ha generado una cantidad suficiente de progenie viral.[45]
La acción conjunta de E7 (inhibiendo pRb) y E6 (degradando p53) produce un efecto sinergístico en la activación del ciclo celular, dando como resultado la proliferación descontrolada de las células infectadas por el virus que, asociado al efecto anti-apoptótico resultante de la inactivación de p53, es una potente combinación oncogénica.
Sin embargo, el objetivo final del virus no es inducir una transformación maligna en la célula huésped, sino replicar su genoma para finalizar un ciclo de vida productivo; y para replicarse en células diferenciadas, el virus debe actuar sobre las vías indicadas. Las células que han sido transformadas por papilomavirus en células cancerosas son incapaces de replicar el genoma viral, ya que estas solo contienen una parte del genoma del virus que se ha integrado en su genoma, por lo que el virus no puede replicarse de forma independiente ni generar viriones. Por ello, solo una pequeña proporción de individuos infectados con VPH presentan cáncer, ya que la integración del ADN viral en el genoma celular es un suceso que ocurre con muy baja frecuencia.[45]
Cuadro clínico
[editar]Algunos de los síntomas más importantes que sugieren la presencia de virus del papiloma humano son:
- Pequeñas verrugas en el área ano-genital: cérvix, vagina, vulva y uretra (en mujeres) y pene, uretra y escroto (en varones).
Pueden variar en apariencia (verrugas planas no visibles o acuminadas sí visibles), número y tamaño por lo que se necesita de la asistencia de un especialista para su diagnóstico. Alteraciones del Papanicolaou que nos habla de que en el cuello del útero hay lesiones escamosas Intraepiteliales (zonas infectadas por VPH, que pueden provocar cáncer).
Enfermedades inducidas por el VPH
[editar]Se han identificado más de 100 tipos diferentes de VPH, que se nombran con un número. Una infección persistente por el subgrupo conocido como de «alto riesgo», que incluye cerca de 13 tipos de virus VPH de transmisión sexual entre los que se encuentran los tipos diferentes de los que causan verrugas puede favorecer el desarrollo de:
- CIN (neoplasia cervical intraepitelial),
- VIN (neoplasia intraepitelial vulvar),
- PIN (neoplasia intraepitelial de pene), o
- AIN (neoplasia intraepitelial anal)
Esas son lesiones precancerosas y pueden progresar a cáncer invasivo.
| Enfermedad | Tipo VPH |
|---|---|
| Verruga común | 2, 7 |
| Verruga plantar | 1, 2, 4 |
| Verruga cutánea chata | 3, 10 |
| Verruga genital anal | 6, 11, 42, 43, 44, 55 |
| Malignidades genitales | |
| Epidermodisplasia verruciforme | más de 15 tipos |
| Hiperplasia focal epitelial (oral) | 13, 32 |
| Papilomas orales | 6, 7, 11, 16, 32 |
Verrugas cutáneas
[editar]- Verrugas comunes: algunos tipos «cutáneos» de VPH, como las VPH-1 y VPH-2, causan verrugas comunes; encontradas con frecuencia en manos y pies, pero pueden aparecer en otras áreas, como rodilla y codo. Estas verrugas tienen una superficie característica de coliflor, y típicamente elevada ligeramente por encima de la piel circundante. Los tipos cutáneos de VPH no suele causar usualmente verrugas genitales y no se asocian con el desarrollo de cáncer.
- Verrugas plantares: se encuentran en la base del pie y crecen hacia adentro, generalmente causando dolor al caminar.
- Verrugas subungueales o periungueales: se forman debajo de la uña (subungual), alrededor de la uña o en la cutícula (periungual). Pueden ser más difícil de tratar que otras verrugas de diferentes lugares.
- Verrugas planas: se ubican comúnmente en los brazos, cara o nuca. Como las verrugas comunes, estas planas se presentan más en niños y adolescentes. En personas con la función inmune normal, estas verrugas planas no se asocian con el desarrollo de cáncer.
Verrugas genitales
[editar]Las verrugas genitales o anales (Condilomata acuminata o verrugas venéreas) son los signos más reconocidos de esta infección del VPH genital. Aunque hay una amplia variedad de tipos de VPH que pueden causar verrugas genitales, los tipos 6 y 11 dan cerca del 90 % de todos los casos.[48][49]
Mucha gente que adquiere tipos de VPH asociados con verrugas genitales, resuelve la infección rápidamente sin siquiera desarrollar verrugas u otros síntomas. Se puede transmitir el virus a otros aún si no se ha desplegado ninguno de los síntomas de infección. Sin embargo, en la vasta mayoría de casos, esta no es causa de no hacerse adecuados tests rutinariamente administrados.
Los tipos de VPH que tienden a causar verrugas genitales no son los mismos que causan cáncer cervical. Sin embargo, puesto que un individuo puede infectarse con múltiples tipos de VPH, la presencia de verrugas no es regla de que esté ausente la posibilidad de la presencia de tipos de alto riesgo del virus.
Cáncer
[editar]
Tipos de cáncer inducidos por VPH. El gráfico muestra el número de casos anuales de diferentes tipos de cáncer en el mundo. La fracción de los casos de cáncer que se estima son inducidos por VPH se muestra en rojo. Por ejemplo, casi todos los casos de cáncer cervical se cree que están causados por VPH.[50]
Una infección de VPH es un factor necesario en el desarrollo de casi todos los casos de cáncer cervical.[51]
Cerca de una docena de tipos de VPH (incluyendo los tipos 16, 18, 31, 45) se llaman tipos de «alto riesgo» debido a que pueden disparar un cáncer cervical,[52] o también cáncer anal, cáncer vulvar, cáncer de pene.[50] Desde el punto de vista del cáncer cervical, los dos tipos más importantes son VPH 16 y 18: VPH 16 está asociado con casi el 60 % de los casos de cáncer cervical, y VPH 18 por otro 10 % de los casos.
Los factores de riesgo de transmisión del VPH están relacionados con características tanto del virus como del huésped, e incluyen:[29]
- en la mujer joven infecciones urinarias persistentes;
- edad temprana en la primera relación sexual;
- una pareja con muchos compañeros sexuales (a partir de los 16 años las mujeres presentan un gran riesgo de adquirir VPH con una pareja de este tipo);
- elevado número de partos;
- infección persistente con un VPH de alto riesgo (como VPH 16 o 18);
- inmunosupresión;
- ciertos subtipos de HLA (antígenos leucocitarios humanos);
- uso de anticonceptivos orales;
- uso de nicotina.
Varios tipos de VPH, particularmente el tipo 16, han sido hallados asociados con carcinoma orofaríngeo de células escamosas, una forma de cáncer de cabeza y cuello (en inglés),[53] los cuales muestran además características biológicas, clínicas y patológicas diferentes a los mismos tumores no desencadenados por el virus.[54]
Los cánceres inducidos por VPH con frecuencia tienen secuencias virales integradas en el ADN celular. Algunos de los genes «tempranos» de VPH, como E6 y E7, actúan como oncogenes promoviendo la proliferación celular y la transformación tumoral (véase también la sección Efecto sobre el ciclo de la célula huésped). Aunque se han encontrado otros mecanismos por los que el virus podría desencadenar el proceso tumoral mediante la alteración génica de la célula huésped, como son generación de transcritos alterados, disrupción de supresores de tumores, amplificaciones de oncogenes, traslocaciones génicas o cambios en los perfiles de metilación.[55]
La proteína endógena p53 previene el crecimiento celular en presencia de ADN dañado, activando la apoptosis (muerte celular programada), primariamente mediante la activación de la transcripción de la proteína proteína X asociada con BCL-2 (BAX) (que bloquea los efectos de la antiapoptosis del receptor BCL-2) mitocondrial). Además, p53 es un factor de transcripción que también activa la expresión de la proteína p21, la cual bloquea la formación del complejo ciclina D/Cdk4, que a su vez previene la fosforilación de pRb. Esto provoca una parada en la progresión del ciclo celular, ya que se impide la activación de E2F, un factor de transcripción necesario para la activación de genes implicados en la proliferación celular. En resumen, p53 es un gen supresor tumoral que detiene el ciclo celular cuando hay ADN dañado. Las proteínas virales E6 y E7 trabajan inhibiendo dos genes supresores de tumores: E6 activa la degradación de p53, y consecuentemente inhibe p21y pRb, mientras E7 se une directamente e inhibe pRb. Como se indicó previamente, la acción conjunta de E7 (inhibiendo pRb) y E6 (degradando p53) produce un efecto sinergístico en la activación del ciclo celular, dando como resultado la proliferación descontrolada de las células infectadas por el virus que, asociado al efecto anti-apoptótico resultante de la inactivación de p53, es una potente combinación oncogénica.
Se considera que una historia de infección con uno o más tipos de VPH de alto riesgo es un prerrequisito para el desarrollo de cáncer cervical (y la vasta mayoría de las infecciones VPH no son de alto riesgo); de acuerdo a la ACS (American Cancer Society: Sociedad Estadounidense de Cáncer), las mujeres sin historia de virus no desarrollan ese tipo de cáncer. Y la mayoría de las infecciones de VPH son resueltas rápidamente por el sistema inmune y no progresan a cáncer cervical. Debido a que el proceso de transformación de células cervicales normales en cancerosas es lento, el cáncer ocurre en personas que han sido infectadas con VPH por un largo tiempo, usualmente una década o más.[56][22]
Los VPH sexualmente transmitidos también pueden causar la mayor fracción de casos de cáncer anal y aproximadamente el 25 % de casos de cáncer de boca y garganta (orofaringe). Este último comúnmente presente en el área de las amígdalas; el VPH se enlaza con el incremento de cáncer oral en no fumadores.[57][58] El contacto de sexo anal o de sexo oral con una pareja sexual infectada de VPH puede incrementar el riesgo de desarrollar esos tipos de cánceres.[53]
Papilomatosis respiratorias
[editar]Los tipos de VPH 6 y 11 pueden causar una rara condición conocida como papilomatosis laríngea recurrente (una papilomatosis respiratoria), en donde las verrugas se forman en la laringe o en otras áreas del tracto respiratorio.[59][22]
Esas verrugas pueden recurrir frecuentemente, y requerir cirugías repetitivas, interferir con la respiración, y en casos extremadamente raros progresar hacia cáncer.[60][22]
Es necesario tener en cuenta que si la madre se encuentra afectada por los virus del papiloma humano genotipo 6 u 11, en el momento del parto el bebé podría llegar a inhalarlo; esto desencadenaría una papilomatosis respiratoria recurrente en él.[61]
Diagnóstico
[editar]Mucha gente se infecta con varios tipos cutáneos de VPH durante su niñez. Los virus del papiloma tienen una cubierta protectora proteica o cápside, que luego puede ser capaz de sobrevivir en el ambiente por largos periodos de tiempo. Debe evitarse el contacto con superficies contaminadas, tales como pisos de duchas comunales o de líneas aéreas, reduciendo el riesgo de infección por VPH cutáneo. También tratando las verrugas comunes bien pronto, puede reducir la expansión de la infección a sitios adicionales.
Las infecciones genitales de VPH pueden distribuirse ampliamente sobre piel genital y superficies mucosas, y la transmisión puede ocurrir aunque no se tengan síntomas visibles. Varias estrategias deberían emplearse para minimizar el riesgo de desarrollar enfermedades causadas por VPH genitales:

Ciertos tipos de VPH transmitidos sexualmente pueden causar cáncer cervical. Una infección persistente con uno o más de cerca de una docena de esos tipos de VPH de «alto riesgo» es un factor importante en la mayoría de todos los casos de cáncer cervical. El desarrollo del cáncer cervical inducido por HP es un proceso lento que generalmente tarda muchos años. Durante la fase de desarrollo, las células precancerosas pueden ser detectadas por una citología anual o semianual de papanicolaou (coloquialmente «pap»). El pap es una estrategia efectiva para reducir el riesgo de cáncer cervical. El test pap involucra tomar tejido del cérvix, colocarlo en una platina de vidrio, y examinar bajo microscopio para detectar células anormales. Es un método efectivo en un 70 a 80 % para detectar anormalidades celulares causadas por VPH. Un método más sensible es el «preparado delgado», en donde el tejido del cérvix se pone en una solución líquida, y es 85 % a 95 % efectivo para detectar anormalidades celulares causadas por VPH. Este último test pap se usa mayormente en mujeres mayores de 30 años. Es una combinación de test pap-ADN HPV. Si este test da negativo, puede esperarse tres años antes de hacérselo nuevamente. Se puede indicar una inspección detallada del cérvix por colposcopia si se detectan células anormales por test rutinario pap. Un ejemplo frecuente de ocurrencia de células anormales que se encuentran en asociación con el VPH son los coilocitos (ver figura).
Los CDC (Centros para el Control y la Prevención de Enfermedades) de Estados Unidos recomiendan que las mujeres se hagan el pap no más allá de 3 años después de su primera relación sexual y no más de 21 años de edad. Las mujeres deben hacerse un pap cada año hasta los 30. Y después, deben discutir los factores de riesgo con su médico para determinar si el pap debería hacerse anualmente. Si los factores de riesgo son bajos y los pap previos han dado negativo, muchas mujerers solo necesitan hacerse el test cada 2 o 3 años hasta los 65 (CDC, 2005).
Desde que se desarrollaron esas herramientas de control, las muertes por cáncer cervical han disminuido un 70 % en los últimos 50 años. El test pap ha demostrado ser uno de los más exitosos tests de control en la historia de la medicina, aunque el American College of Obstetricians and Gynecologists (Colegio Estadounidense de Obstetras y Ginecólogos) asegura que los nuevos tests basados en la citología (Thinprep y Surepath) harán caer entre un 15 y un 35 % los casos de CIN3 (neoplasia cervical intraepitelial) y cáncer.
En estudio publicado en abril de 2007 se sugirió que la extracción de tejido con el pap produce una respuesta inflamatoria citocínica que puede dar inicio a un clearance inmunológico de VPH, aunque reduce el riesgo de cáncer cervical.
La mujer que ha dado positivo en un solo pap en su historia tiene menor incidencia de cáncer. «Una declinación estadísticamente significativa en el VPH se correlaciona positivamente con la cantidad de pap en la vida humana».[62]
Se ha insinuado que el pap puede ser beneficioso para el control de cáncer anal en algunas subpoblaciones de gais.[63]
Pruebas de VPH
[editar]Una prueba de VPH detecta ciertos tipos de papilomavirus humano (VPHs), dependiendo de la prueba. Un método para detectar el ADN de los VPH de alto peligro ha sido agregado recientemente al rango de opciones clínicas para la detección de cáncer cervical.
En marzo de 2003, la organización estadounidense FDA (Administración Federal de Medicinas y Alimentos) aprobó una prueba de una captura híbrida, comercializada por Digene, como un utensilio de captura primario para la detección de infecciones por VPH de alto riesgo que pueden llegar al cáncer cérvico. Esta prueba fue aprobada también para usarla en conjunto con la prueba pap y debería ser realizada de manera rutinaria en una revisión ginecológica.
Añadir la prueba de VPH a todas las mujeres mayores de 30 años mejora la sensibilidad sobre la citología aislada hasta casi el 100 % y da la opción al facultativo de aumentar el intervalo entre citologías hasta 3 años.
El estudio experimental de las distintas vías moleculares implicadas en el desarrollo del cáncer de cérvix ha permitido el desarrollo de nuevos marcadores biológicos que podrían mejorar considerablemente el diagnóstico citológico e histológico de las lesiones cervicales. La detección del ARN mensajero de E6 y E7 (VPH OncoTect®) y el estudio de la proteína del ciclo celular p16 son dos de estos nuevos marcadores. Los primeros resultados publicados indican que estos marcadores son altamente sensibles y específicos, y permiten identificar las células en proceso de transformación cancerosa, lo que significa un gran avance desde el punto de vista clínico.
En el caso de los hombres, según la CDC, no existe una prueba para determinar la infección por VPH. Las «anormalidades» genitales son el único signo visible de VPH en hombres, y pueden ser identificadas mediante una inspección visual del área genital. Estas «anormalidades» visibles, sin embargo, son el resultado de tipos de VPH no cancerígenos. Soluciones de vinagre han sido útiles para identificar «anormalidades» haciéndolas más notorias, pero estas pruebas han resultado ser más favorables en áreas húmedas, como el tracto genital femenino.[3]
La CDC dice en su página web STD Facts-HPV Vaccine (‘hechos sobre el STD y la vacuna contra el VPH’) que «Una prueba de VPH o una prueba para que puedan detectar si una mujer tiene VPH, pero no puede especificar el tipo de VPH que la mujer tenga».[3]
Tratamiento
[editar]Actualmente no existe un tratamiento específico para la infección por VPH. Sin embargo, la infección viral, por lo general, se anula a sí misma a niveles indetectables. De acuerdo con el Centro para el Control y la Prevención de Enfermedades, el sistema inmunológico del cuerpo elimina el VPH naturalmente dentro de dos años para el 90 % de los casos.[64] Sin embargo, los expertos no están de acuerdo en si el virus se elimina completamente o se reduce a niveles indetectables, y es difícil saber cuándo es contagiosa.[65]
El tratamiento de las infecciones con VPH se basa en la actualidad en la utilización de algunas cremas tópicas disponibles cuya actividad antiviral no es bien conocida o que actúan activando una respuesta inmune local contra el virus. En el caso de las lesiones precancerosas producidas por VPH, el tratamiento más adecuado es la eliminación de las zonas afectadas mediante cirugía. En gran parte, este tratamiento es eficaz porque VPH produce lesiones superficiales bien localizadas, y los VPH no producen infecciones sistémicas.[45]
El DRACO (antiviral) es una droga que está actualmente en las primeras etapas de la investigación y puede ofrecer un tratamiento genérico contra el VPH si resulta exitoso.[66]
Papilocare es un gel vaginal que trata y previene las infecciones por VPH al mejorar el grado de epitelización del cuello uterino.[67]
Prevención
[editar]El uso de preservativo protege de la infección por VPH en un 70 % de los casos. El 30 % restante donde no protege se debe a la existencia de lesiones en zonas no cubiertas por el preservativo y el mal uso del mismo.[cita requerida]
Vacunas
[editar]El 8 de junio de 2006, la FDA aprobó Gardasil, una vacuna profiláctica contra el VPH comercializada por Merck & Co., Inc. Los ensayos clínicos de la vacuna,[68] realizados entre mujeres adultas con una mediana de edad de 23, mostraron protección contra la infección inicial por los serotipos 16 y 18, que en conjunto causan aproximadamente un 70 % de los cánceres de cérvix. Estos serotipos de VPH también causan tumores anorrectales tanto en mujeres como en hombres.
El ensayo también mostró una eficacia del 100 % frente a infecciones persistentes, no solo frente a las agudas. La vacuna también protege contra los serotipos 6 y 11, causantes del 90 % de las verrugas genitales. Las mujeres pueden ser vacunadas en un rango de edad de entre 9 y 26 años, aunque mujeres menores no formaron parte del ensayo clínico.
En la actualidad, además de Gardasil, GlaxoSmithKline ha comercializado la vacuna Cervarix. Tanto Gardasil como Cervarix protegen contra infecciones iniciales contra los tipos VPH 16 y 18, causantes de la mayor parte de los casos de cáncer cervical. Gardasil además protege contra los tipos VPH 6 y 11: estos cuatro tipos combinados (16, 18, 6, 11) corresponden al 90 % de los casos de cáncer cervical.[69]
La vacuna proporciona poco beneficio a las mujeres que ya estén infectadas con los tipos VPH 16 y 18, es decir, a la mayor parte de las mujeres sexualmente activas, ya que las vacunas no tienen ningún efecto terapéutico sobre la infección ya existente ni sobre las lesiones cervicales. Por esta razón, la vacuna se recomienda principalmente a mujeres que aún no hayan iniciado relaciones sexuales. La vacuna (tanto Gardasil como Cervarix) se administra en 3 dosis a lo largo de 6 meses con un coste de unos 300 euros. La CDC recomienda a mujeres entre 11 y 26 años que se vacunen, aunque niñas de incluso 9 años pueden verse beneficiadas. La efectividad real de las vacunas para reducir las tasas de incidencia y mortalidad por cáncer de cuello uterino es aún desconocida.[70]
Puesto que las actuales vacunas no protegen a las mujeres frente a todos los serotipos de VPH que causan cáncer cervical, es importante que las mujeres sigan con las pruebas de citología y papanicolau, incluso después de haber recibido la vacuna.
La vacuna también se puede aplicar en niños de 9 a 15 años, ayudan a proteger a los niños contra ciertos cánceres y pre cánceres anales, así como para ayudar a prevenir las verrugas anales y genitales. Estas vacunas se deben administrar antes de comenzar la actividad sexual, si ya ha comenzado actividad sexual garantizar no tener contacto con virus, aunque están aprobadas para distintos grupos de edad. La vacuna Gardasil fue aprobada para las edades de 9 a 26 años, y para las edades de 9 a 15 años. Aún no se sabe si estas vacunas ayudarán a los niños a evitar la transmisión del VPH a sus parejas. Se harán estudios piloto para verificar la eficacia de la vacuna en este grupo de edad. En caso de que sí ayuden, esto también reducirá el riesgo de cáncer asociado al VPH entre sus parejas sexuales. El Advisory Committee on Immunization Practices (ACIP) of the US Centers for Disease Control and Prevention recomienda que se administre cualquiera de las vacunas Gardasil a los niños y a los hombres jóvenes. El comité recomienda que los niños entre las edades de 11 y 12 años sean vacunados rutinariamente. También recomienda la vacuna para los varones de entre 13 y 21 años que no hayan recibido las tres vacunas. La vacuna también se puede administrar a niños a una edad tan temprana como desde los 9 años y a los hombres entre las edades de 22 y 26 años. Actualmente, la Sociedad Americana Contra El Cáncer no cuenta con recomendaciones sobre el uso de cualquier vacuna contra el VPH en hombres. La evidencia que respalda el uso de las vacunas del VPH en hombres se está revisando y las recomendaciones de la Sociedad Americana Contra El Cáncer para el uso de las vacunas del VPH se actualizarán. Esta información probablemente se publicará en 2016.[71]
En España se han dado 35 reacciones adversas graves, lo que incluye situaciones como diarrea, dolor, síncope o error en la vía de administración, aunque sólo 5 han requerido tratamiento.[72] Los tres casos más serios reportados en España, de dos menores que sufrieron crisis epilépticas tras ser vacunadas, y una fallecida no fueron provocados por la vacuna, sino por problemas de salud preexistentes, según el Ministerio de Sanidad.[73] Merck, así como la FDA y la CDC consideran que la vacuna es completamente segura y que no hay relación de causa-efecto.[74] No contiene mercurio, timerosal ni virus atenuados (solo virus muertos). Merck & Co., Inc, el manufacturador de Gardasil, continúa con las pruebas a mujeres que han recibido la vacuna para determinar su eficacia sobre un periodo de vida. En 2014 centenares de adolescentes de un municipio rural de Colombia experimentaron una serie de síntomas bizarros (paresterias, dolor de articulaciones, dolor torácico, trastornos en la menstruación, cefaleas, y síncopes, entre otros) que atribuyeron a una jornada de vacunación escolar por Gardasil. Aunque las autoridades no encontraron inicialmente un vínculo aparente entre los síntomas y la vacuna, y catalogaron el caso como una enfermedad psicógena masiva, tampoco pudieron establecer un diagnóstico etiológico basado en evidencia científica sobre lo sucedido[63]. El caso fue objeto de controversia científica, política, mediática y legal, y originó una drástica reducción de la cobertura de vacunación con este fármaco en todo el país. Desde 2017 Colombia determina que la vacuna contra el VPH no puede ser obligatoria y requiere del consentimiento informado para su aplicación en la población objeto de la misma[64].
Tanto hombres como mujeres son portadores del VPH. Para erradicar la enfermedad, en algún momento los hombres tendrían que ser vacunados. Hoy por hoy se están llevando a cabo estudios para determinar la eficiencia de vacunar niños varones con la vacuna actual.[75] En la mayoría de los países, las vacunas se han aprobado únicamente para uso femenino, pero en países como Estados Unidos y el Reino Unido se han aprobado también para uso masculino.
Preservativos
[editar]El Centers for Disease Control and Prevention (Centro para el Control y Prevención de Enfermedades, de Estados Unidos) afirma que «aunque no se conoce exactamente el efecto de los preservativos en la prevención de la infección por VPH, el uso de preservativo se ha asociado con una tasa más baja de cáncer de cérvix, enfermedad en directa relación con el VPH».[76]
De acuerdo con Marcus Steiner y Willard Cates en el New England Journal of Medicine, «la protección que ofrecen los preservativos no puede ser cuantificada exactamente».[77] Sin embargo, en un estudio en el mismo ejemplar,[78] de 82 mujeres universitarias seguidas en la práctica clínica habitual durante 8 meses, la incidencia de VPH genital fue 37,8 por cada 100 pacientes/año entre las mujeres cuyas parejas empleaban preservativo en todas sus relaciones sexuales, frente a 89,3 por cada 100 pacientes/año en aquellas cuyas parejas empleaban preservativo en menos del 5 % de las relaciones. Los investigadores concluyeron que «entre mujeres que empiezan a ser sexualmente activas, el uso constante del preservativo en sus relaciones por sus parejas parece ser que reduce el riesgo de infección por VPH cervical y vulvovaginal».
Otros estudios han sugerido que el uso regular del condón puede limitar efectivamente la insistencia y esparcimiento de VPH hacia otras áreas genitales en individuos ya infectados.[79][80]
El uso del condón puede reducir el riesgo que individuos infectados desarrollará hacia cáncer cervical o desarrollo de «anormalidades» genitales. Planned Parenthood (planificación familiar), recomienda el uso del condón con el fin de prevenir el riesgo de contagio de VPH.[81]
Bibliografía
[editar]- Pimenta, JM; Galindo, C; Jenkins, D; Taylor, SM (2013 Nov 21). «Estimate of the global burden of cervical adenocarcinoma and potential impact of prophylactic human papillomavirus vaccination». BMC Cancer 13: 553. PMC 3871005. PMID 24261839. doi:10.1186/1471-2407-13-553.
Referencias
[editar]- ↑ «Copia archivada». Archivado desde el original el 7 de mayo de 2017. Consultado el 4 de mayo de 2017.
- ↑ «Virus del papiloma humano. Situación actual, vacunas y perspectivas de su utilización». Comisión de Salud Pública/Consejo Interterritorial del Sistema Nacional de Salud. febrero de 2007. Archivado desde el original el 3 de mayo de 2011.
- ↑ a b c d «Infección genital por VPH - CDC Fact Sheet en español». Centers for Disease Control and Prevention (CDC). 24 de octubre de 2008. Archivado desde el original el 25 de enero de 2010. Consultado el 25 de enero de 2010.
- ↑ Schiffman M, Castle PE (August de 2003). «Human papillomavirus: epidemiology and public health». Archives of Pathology & Laboratory Medicine 127 (8): 930-934. PMID 12873163. Consultado el 18 de mayo de 2009.
- ↑ Walboomers JM, Jacobs MV, Manos MM (1999). «Human papillomavirus is a necessary cause of invasive cervical cancer worldwide». J. Pathol. 189 (1): 12-19. PMID 10451482. doi:10.1002/(SICI)1096-9896(199909)189:1<12::AID-PATH431>3.0.CO;2-F.
- ↑ Parfenov, Michael (28 de octubre de 2014). «Characterization of HPV and host genome interactions in primary head and neck cancers». PNAS 111 (43): 15544-15549. doi:10.1073/pnas.1416074111.
- ↑ Goldstein MA, Goodman A, del Carmen MG, Wilbur DC (March de 2009). «Case records of the Massachusetts General Hospital. Case 10-2009. A 23-year-old woman with an abnormal papanicolaou smear». N. Engl. J. Med. 360 (13): 1337-1344. PMID 19321871. doi:10.1056/NEJMcpc0810837. PMID 19321871
- ↑ a b Kahn JA (July de 2009). «HPV vaccination for the prevention of cervical intraepithelial neoplasia». N. Engl. J. Med. 361 (3): 271-278. PMID 19605832. doi:10.1056/NEJMct0806938. PMID 19605832
- ↑ «NCCC National Cervical Cancer Coalition». Archivado desde el original el 22 de agosto de 2008. Consultado el 1 de julio de 2008.
- ↑ Lowy DR, Schiller JT (2006). «Prophylactic human papillomavirus vaccines». J. Clin. Invest. 116 (5): 1167-1173. PMC 1451224. PMID 16670757. doi:10.1172/JCI28607.
- ↑ H. Zur Hausen, y E. M. de Villiers: «Human papillomaviruses», en Annu Rev Microbiol, 48: págs. 427-447, 1994.
- ↑ «Información sobre el Virus del papiloma humano». Archivado desde el original el 9 de abril de 2015. Consultado el 25 de marzo de 2015.
- ↑ Antonsson A, Forslund O, Ekberg H, Sterner G, Hansson BG (2000). «La ubicuidad e imprecisa diversidad genómica de los papilomavirus humanos cutáneos sugieren un comensalismo natural de esos virus». J. Virol. 74 (24): 11636-41. PMID 11090162.
- ↑ Schiffman M, Castle PE (2005). «La promesa de prevención global del cáncer cervical». N. Engl. J. Med. 353 (20): 2101-4. PMID 16291978. doi:10.1056/NEJMp058171.
- ↑ Cohen J (2005). «Salud Pública. Altas esperanzas y dilemas con una vacuna del cáncer cervical». Science 308 (5722): 618-21. PMID 15860602. doi:10.1126/science.308.5722.618.
- ↑ a b c Baseman JG, Koutsky LA (2005). «The epidemiology of human papillomavirus infections». J. Clin. Virol. 32 Suppl 1: S16-24. PMID 15753008. doi:10.1016/j.jcv.2004.12.008. Nota: en la pág. S17 los autores señalan «Sobre todo, estos estudios de ADN, combinados con mediciones de anicuerpos específicos contra los antígenos cápsidos de VPH, muestran que más del 50 % de las mujeres sexualmente activas han sido infectadas por uno o más tipos de VPH genital en algún momento».
- ↑ Noel J, Lespagnard L, Fayt I, Verhest A, Dargent J (2001). «Evidencia de infección con VPH, pero con falta del virus de Epstein-Barr en linfoepitelioma (semejante al carcinoma de cervix uterino: reporte de dos casos y revisión de literatura». Hum. Pathol. 32 (1): 135-8. PMID 11172309.
- ↑ Edwards QT, Saunders-Goldson S, Morgan PD, Maradiegue A, Macri C (2005). «Neoplasia intraepitelial vulvar: variados signos y síntomas: qué necesita Ud. saber». Advance for nurse practitioners 13 (3): 49-52. PMID 15777042.
- ↑ Bolt J, Vo QN, Kim WJ, McWhorter AJ, Thomson J, Hagensee.ñk,ME, Friedlander P, Brown KD, Gilbert J (2005). «El camino ATM/p53 comúnmente apuntado para inactivar carcinoma de células escamosas de cabeza y cuello (SCCHN) por múltiples mecanismos moleculares». Oral Oncol. 41 (10): 1013-20. PMID 16139561.
- ↑ a b c «STD Facts - VPH Vaccine». 1 de agosto de 2006. Consultado el 17 de agosto de 2007.
- ↑ Sinal SH, Woods CR (October de 2005). «Human papillomavirus infections of the genital and respiratory tracts in young children». Semin Pediatr Infect Dis 16 (4): 306-316. PMID 16210110. doi:10.1053/j.spid.2005.06.010.
- ↑ a b c d Sinal SH, Woods CR (2005). «Infecciones de papilomavirus humano en tracto genital y respiratorio de jóvenes». Seminars in pediatric infectious diseases 16 (4): 306-16. PMID 16210110. doi:10.1053/j.spid.2005.06.010.
- ↑ a b c Dunne EF, Unger ER, Sternberg M, et al (2007). «Prevalencia de la infección a VPH entre mujeres de Estados Unidos». JAMA 297 (8): 813-9. PMID 17327523. doi:10.1001/jama.297.8.813.
- ↑ Hillard Weinstock, Stuart Berman and Willard Cates, Jr. (enero/febrero 2004). «Sexually Transmitted Diseases Among American Youth: Incidence and Prevalence Estimates, 2000». Perspectives on Sexual and Reproductive Health 36 (1): 6. PMID 14982671. doi:10.1363/3600604.
- ↑ «American Social Health Association - HPV Resource Center». Archivado desde el original el 18 de julio de 2007. Consultado el 17 de agosto de 2007.
- ↑ Revzina NV, Diclemente RJ (2005). «Prevalencia e incidencia de la infección por papilomavirus humano en mujeres en Estados Unidos: una revisión sistemática». International journal of STD & AIDS 16 (8): 528-37. PMID 16105186. doi:10.1258/0956462054679214. «The prevalence of HPV reported in the assessed studies ranged from 14 % to more than 90 %».
- ↑ McCullough, Marie (28 de febrero de 2007). Razas de virus de cáncer más raras que las primeras estimaciones. The Philadelphia Inquirer. Archivado desde el original el 2 de marzo de 2007. Consultado el 2 de marzo de 2007.
- ↑ Brown, David (28 de febrero de 2007). Los estudios encuentran a más mujeres de lo esperado con VPH. San Francisco Chronicle. Archivado desde el original el 9 de noviembre de 2007. Consultado el 2 de marzo de 2007. (publicado originalmente en el Washington Post como «More american women have HPV than previously thought»)
- ↑ a b Kumar, MBBS, MD, FRCPath, V.; Abul K. Abbas, MBBS, Nelson Fausto, MD and Jon Aster, MD (2009). «Cervix: premalignant and malignant neoplasms». En Saunders (Elsevier), ed. Robbins & Cotran Pathologic Basis of Disease (8th edición). ISBN 978-1-4160-3121-5.
- ↑ a b «Hechos estadísticos entre VPH y hombres». Consultado el 17 de agosto de 2007.
- ↑ Frisch M, Smith E, Grulich A, Johansen C (2003). «Cáncer en una cohorte poblacional de hombres y mujeres con parejas registradas homosexuales». Am. J. Epidemiol. 157 (11): 966-72. PMID 12777359. Archivado desde el original el 21 de junio de 2008. «Sin embargo, el riesgo de carcinoma anal invasivo escamoso, que se cree es causado por ciertos tipos de papilomavirus humanos sexualmente transmitidos, notablemente el tipo 16, se elevó significativamente (31 veces) a una incidenca cruda del 25,6 cada 100 000 personas/año».
- ↑ Dunne EF, Nielson CM, Stone KM, Markowitz LE, Giuliano AR (2006). «Prevalencia de la infección por VPH entre hombres: revisión sistemática de la literatura». J. Infect. Dis. 194 (8): 1044-57. PMID 16991079. doi:10.1086/507432.
- ↑ «Qué necesita saber el hombre del VPH». 2006. Archivado desde el original el 7 de abril de 2007. Consultado el 4 de abril de 2007. «No hay ningún test de detección de VPH en hombres aprobado por la FDA. Esto es debido a que no se ha desarrollado aún una manera efectiva y fácil de colectar una muestra de células masculinas genitales de la piel, que detectaría el VPH.»
- ↑ {{Cita libro Buck HW (2005). Genital warts. Online version of Clinical Evidence (14): 1-13. Author Robin Parks, MS Editor Kathleen M. Ariss, MS Associate Editor Pat Truman Primary Medical Reviewer Joy Melnikow, MD, MPH - Family Medicine Specialist Medical Reviewer Jeanne Marrazzo, MD, MPH - Infectious Disease Última actualización 17 agosto de 2006}}
- ↑ «WebMD». Consultado el 17 de agosto de 2007.
- ↑ Planned Parenthood «In fact, the lifetime risk for contracting HPV is at least 50 percent for all sexually active women and men, and, it is estimated that, by the age of 50, at least 80 percent of women will have acquired sexually transmitted HPV (CDC, 2004; CDC, 2006)».
- ↑ Medical News Today
- ↑ Dunne EF, Unger ER, Sternberg M (February de 2007). «Prevalence of HPV infection among females in the United States». JAMA : the journal of the American Medical Association 297 (8): 813-819. PMID 17327523. doi:10.1001/jama.297.8.813.
- ↑ «What Are the Key Statistics About Cervical Cancer?». American Cancer Society. 28 de octubre de 2009. Archivado desde el original el 27 de octubre de 2009. Consultado el 4 de diciembre de 2009.
- ↑ "What is HPV?". CDC. 28 diciembre 2015.
- ↑ Human Papillomavirus (HPV) Questions and Answers. CDC. 28 de diciembre 2015.
- ↑ Alejandro Fernández Larrañaga (17 de mayo de 2024). «Qué hacer si mi pareja tiene el Virus del Papiloma Humano (HPV)». Https://urologoenvigo.com/.
- ↑ Human papillomavirus (HPV) and cervical cancer. WHO, junio 2016.
- ↑ Chouhy D, Bolatti EM, Perez GR, Giri AA (2013) Analysis of the genetic diversity and phylogenetic relationships of putative human papillomavirus types. J Gen Virol
- ↑ a b c d e f g h Acheson, Nicholas H. (2007). «Ch.11 Papillomaviruses». Fundamentals of Molecular Virology (1st edición). John Wiley & Sons Inc. ISBN 0-471-35151-2.
- ↑ a b Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson; Mitchell, Richard (2007). «Chapter 19 The Female Genital System and Breast». Robbins Basic Pathology (8 edición). Philadelphia: Saunders. ISBN 1-4160-2973-7.
- ↑ a b Muñoza N, Castellsaguéb X, Berrington de Gonzálezc A, Gissmann L (2006). «Chapter 1: HPV in the etiology of human cancer». Vaccine 24 (3): S1-S10. PMID 16949995. doi:10.1016/j.vaccine.2006.05.115.
- ↑ Greer CE, Wheeler CM, Ladner MB, et al (1995). «Distribución de tipo de papilomavirus humano (VPH), y respuesta serológica a partículas de virus VPH tipo 6 en pacientes con verrugas genitales». J. Clin. Microbiol. 33 (8): 2058-63. PMID 7559948.
- ↑ Gearheart PA, Randall TC, Buckley RM Jr (2004). «Papilomavirus humano». eMedicine.
- ↑ a b Parkin DM (2006). «The global health burden of infection-associated cancers in the year 2002». Int. J. Cancer 118 (12): 3030-44. PMID 16404738. doi:10.1002/ijc.21731.
- ↑ Walboomers JM, Jacobs MV, Manos MM, et al (1999). «El papilomavirus humano es una causa necesaria para propagar el cáncer cervical invasivo, mundialmente». J. Pathol. 189 (1): 12-9. PMID 10451482. doi:10.1002/(SICI)1096-9896(199909)189:1<12::AID-PATH431>3.0.CO;2-F.
- ↑ Enrique Aguirre Cabañas descubrió, en 1976, el papel del VPH en el cáncer cervical
- ↑ a b D'Souza G, Kreimer AR, Viscidi R, et al (2007). «Case-control study of human papillomavirus and oropharyngeal cancer». N. Engl. J. Med. 356 (19): 1944-56. PMID 17494927. doi:10.1056/NEJMoa065497.
- ↑ Parfenov, Michael (28 de octubre de 2014). «Characterization of HPV and host genome interactions in primary head and neck cancer». PNAS 111 (43): 15544-15549. doi:10.1073/pnas.1416074111.
- ↑ Parfenov, Michael. Characterization of HPV and host genome interactions in primary head and neck cancers. doi:10.1073/pnas.1416074111.
- ↑ Greenblatt R.J. 2005. Virus del papiloma humano: enfermedades, diagnosis, y posible vacuna Archivado el 12 de octubre de 2007 en Wayback Machine.. Clinical Microbiology Newsletter, 27(18), 139-145. Resumen disponible.
- ↑ Gillison ML, Koch WM, Capone RB, et al (2000). «Evidencia de una asociación causal entre el virus del papiloma humano y los cánceres de cabeza y cuello». J. Natl. Cancer Inst. 92 (9): 709-20. PMID 10793107.
- ↑ Gillison ML (2006). «Virus del papiloma humano y prognosis de carcinoma orofaríngeo de células escamosas: implicaciones en estudios clínicos de cánceres de cabeza y cuello». J. Clin. Oncol. 24 (36): 5623-5. PMID 17179099. doi:10.1200/JCO.2006.07.1829.
- ↑ Wu R, Sun S, Steinberg BM (2003). «Requerimiento de la activación de STAT3 para la diferenciación de epitelio mucoso estratificado escamoso». Mol. Med. 9 (3-4): 77-84. PMID 12865943.
- ↑ Moore CE, Wiatrak BJ, McClatchey KD, et al (1999). «Tipos de alto riesgo del papilomavirus humano y carcinoma de células escamosas en pacientes con papilomas respiratorias». Otolaryngology—head and neck surgery: Official Journal of American Academy of Otolaryngology-Head and Neck Surgery 120 (5): 698-705. PMID 10229596. doi:10.1053/hn.1999.v120.a91773.
- ↑ «MSD - Virus del papiloma humano». Consultado el 2009.
- ↑ [1], J Inflamm 2007;4.
- ↑ a b Chin-Hong PV, Vittinghoff E, Cranston RD, et al (2005). «Prevalencia relacionada con la edad de precursores de cáncer anal en hombres homosexuales: los estudios EXPLORE». J. Natl. Cancer Inst. 97 (12): 896-905. PMID 15956651. doi:10.1093/jnci/dji163.
- ↑ a b Centros para el Control y la Prevención de Enfermedades. «CDC, Human Papillomavirus (HPV)» (en inglés). Consultado el 22 de diciembre de 2014. «¿Cuáles son los signos, síntomas y posibles consecuencias para la salud del VPH?»
- ↑ Gilbert LK, Alexander L, Grosshans JF, Jolley L (marzo de 2003). «"Respondiendo a las preguntas más frecuentes sobre el VPH"». Sexually Transmitted Diseases (en inglés). pp. 193-4. doi:10.1097/00007435-200303000-00002. Consultado el 22 de diciembre de 2014. «(5) “Will I always have HPV?” A healthy immune system suppresses the virus. It is difficult to predict when HPV is no longer contagious. Experts disagree on whether the virus is eliminated from the body or whether it is reduced to undetectable levels.».
- ↑ Lincoln Laboratory, Massachusetts Institute of Technology (agosto de 2011). «MIT Lincoln Laboratory researchers develop a technique to cure a broad range of viruses» (en inglés). Archivado desde el original el 23 de agosto de 2013. Consultado el 22 de diciembre de 2014. «DRACO selectively induces apoptosis, or cell suicide, in cells containing any viral dsRNA, rapidly killing infected cells without harming uninfected cells.».
- ↑ «Procare Health presenta los resultados de un estudio con el gel Papilocare sobre lesiones del VPH». Consultado el 10 de octubre de 2017.
- ↑ Harper DM, Franco EL, Wheeler CM, et al (2006). «Eficacia sustentable de 4,5 años de una particular vacuna bivalente L1 virus- contra los tipos 16 y 18 del papillomavirus humano: seguido de un ensayo de control aleatorizado». Lancet 367 (9518): 1247-55. PMID 16631880. doi:10.1016/S0140-6736(06)68439-0.
- ↑ «Vacunas contra VPH». 25 de enero de 2010. Consultado el 25 de enero de 2010.
- ↑ Casado Buesa MI, García Hernández L, González Enríquez J, Imaz Iglesia I, Rubio González B, Zegarra Salas P. Evaluación económica de la introducción de la vacuna contra VPH en España para la prevención del cáncer de cuello uterino. Informe Público de Evaluación de Tecnologías Sanitarias IPE 2012/69. Madrid: Agencia de Evaluación de Tecnologías Sanitarias; diciembre de 2012. N.I.P.O. en línea: 725–12–053–X
- ↑ «¿Quién debe vacunarse contra el VPH y cuándo?». www.cancer.org. Consultado el 20 de enero de 2016.
- ↑ «Decenas de reacciones a la vacuna del papiloma». 13 de febrero de 2009. Consultado el 5 de febrero de 2010.
- ↑ «Revisión del Programa de Vacunación frente al Virus del Papiloma Humano en España». Archivado desde el original el 22 de diciembre de 2018. Consultado el 3 de diciembre de 2015.
- ↑ «Seguridad de la vacuna Gardasil». 28 de julio de 2008. Consultado el 25 de enero de 2010.
- ↑ «Cervical cancer vaccine approved». WebMD. Consultado el 17 de agosto de 2007.
- ↑ «Cáncer cervical». Consultado el 25 de enero de 2010.
- ↑ Markus J. Steiner and Willard Cates, Jr. (2006). «Condoms and Sexually-Transmitted Infections». N. Engl. J. Med. 354 (25): 2642-3.[2]
- ↑ Winer RL, Hughes JP, Feng Q, et al (2006). «Condom use and the risk of genital human papillomavirus infection in young women». N. Engl. J. Med. 354 (25): 2645-54. PMID 16790697. doi:10.1056/NEJMoa053284.[Free online]
- ↑ Moscicki AB (2005). «Impact of HPV infection in adolescent populations». The Journal of adolescent health : official publication of the Society for Adolescent Medicine 37 (6 Suppl): S3-9. PMID 16310138.
- ↑ Bleeker MC, Berkhof J, Hogewoning CJ, et al (2005). «HPV type concordance in sexual couples determines the effect of condoms on regression of flat penile lesions». Br. J. Cancer 92 (8): 1388-92. PMID 15812547. doi:10.1038/sj.bjc.6602524.
- ↑ «Planned Parenthood - HPV». Consultado el 17 de agosto de 2007.
Enlaces externos
[editar]- En MedlinePlus hay más información sobre Virus del papiloma humano
- CDC: Enlace con la hoja de información sobre la infección genital por VPH en español
- ICO Information Centre on HPV and Cancer (en inglés)
