Streptococcus agalactiae
| Streptococcus agalactiae | ||
|---|---|---|
 | ||
| Taxonomía | ||
| Dominio: | Bacteria | |
| Filo: | Bacillota | |
| Clase: | Bacilli | |
| Orden: | Lactobacillales | |
| Familia: | Streptococcaceae | |
| Género: | Streptococcus | |
| Especie: |
S. agalactiae Lehmann and Neumann, 1896 | |
El Streptococcus agalactiae, estreptococo del grupo B (Group B Streptococcus (GBS),[1] es una bacteria que puede ocasionar infecciones muy graves (infección por estreptococo del grupo B), en recién nacidos y adultos. Es un coco (bacteria redonda) gram positivo que al microscopio se dispone en cadenas (estreptococo), beta-hemolítico, catalasa negativo, oxidasa negativo y anaerobio facultativo, caracterizado por presentar en su pared el grupo B de antígenos del sistema de Lancefield. El EGB posee una cápsula bacteriana de polisacárido rica en ácido siálico y según su estructura se distinguen 10 serotipos antigénicamente diferentes (Ia, Ib, II-IX).[1][2][3] El EGB es un constituyente de la microbiota (flora intestinal), microbiota normal del intestino de los humanos y otros animales.
Identificación en el laboratorio[editar]
El EGB crece como colonias beta-hemolíticas en agar sangre (rodeadas por un halo pequeño de β-hemólisis) y puede ser identificado[4] detectando el antígeno de grupo B por medio de aglutinación con látex con antisueros específicos.[5][6]
Otros test para identificar EGB son la detección de la hidrólisis del hipurato y la prueba de CAMP,[5] que provoca la lisis de eritrocitos bovinos o de cordero previamente sensibilizados por la esfingomielinasa producida por Staphylococcus aureus.[5]
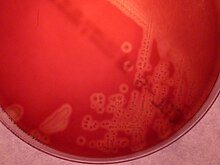
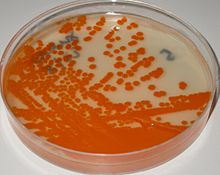

Las cepas hemolíticas de EGB cuando se cultivan en agar granada (medio granada)[7] se desarrollan como colonias rojas pues producen un pigmento poliénico no isoprenoide de color rojo –granadaeno-[8] específico del EGB que permite su identificación inmediata.[9]
La identificación del EGB puede también llevarse a cabo usando la técnica de MALDI-TOF (Matrix Assisted Laser Desorption Ionization- Time of Flight Mass Spectrometry).[10][11]
La identificación "tentativa" del EGB también es posible por el aspecto de sus colonias en un medio cromogénico específico donde crece como colonias de color distinto según el medio empleado.[4][12][13]
Si para la detección e identificación de EGBB se utilizan medios de cultivo cromogénicos siempre debe confirmarse que las colonias sospechosas (con aspecto de EGB) son realmente EGB utilizando una técnica segura de identificación e.g. detección de pigmento, aglutinación con látex, la prueba CAMP o MALDI-TOF.[4][9]

Virulencia[editar]
EGB puede encontrarse, como comensal, sin producir enfermedad (microbiota normal), en el aparato digestivo, urinario y genital hasta en un 30% de los adultos, (colonización), incluyendo la mujer embarazada.[2][14] Sin embargo, en ocasiones, el EGB es capaz de burlar los mecanismos de defensa del huésped humano, invadir los tejidos y causar infecciones graves ((Infección por estreptococo grupo B). Entre los principales factores de virulencia del EGB pueden citarse[15] el polisacárido capsular y la beta hemolisina (considerada idéntica al pigmento).[7][16][17][18][19][20]
Colonización e infección en la madre y el recién nacido[editar]
Se han publicado tasas de colonización por EGB en la embarazada (sin causar infección) (portadores) entre un 4 y 36%, dos recientes estudios sobre la tasa de colonización a nivel mundial por EGB usando metaanálisis han indicado porcentajes de colonización del 14,6% y del 18%.
Encontrándose grandes variaciones entre países e incluso entre regiones de un mismo país. Esta variación en los datos publicados puede deberse a diferentes métodos de estudio y a diferencias en las poblaciones estudiadas.[14][21][22][23]
Aunque la colonización por EGB normalmente no ocasiona síntomas ni problemas a la mujer sana durante el embarazo, puede provocar una enfermedad grave a la madre y al bebé durante la gestación y después del parto,[2][24] habiéndose relacionado con muerte fetal y parto prematuro.[25]
La infección por EGB puede causar infrecuentemente corioamnionitis (infección grave de las membranas placentarias) e infección posparto (después del nacimiento). Las infección urinaria por EGB pueden inducir el trabajo de parto y provocar un parto prematuro.[2]
En los países desarrollados EGB es la causa más frecuente de infección bacteriana grave del recién nacido, septicemia, neumonía y meningitis, pudiendo causar su muerte u originar secuelas permanentes.[2] En el recién nacido la infección por EGB causa dos síndromes clínicos diferentes, la infección de comienzo precoz (Early Onset Disease, EOD) y la infección de comienzo tardío (Late Onset Disease, LOD).[2]
La infección de comienzo precoz se desarrolla en los primeros siete días de vida, la gran mayoría de casos aparecen en las primeras 24 horas de vida casi siempre como sepsis sin foco, neumonía o meningitis. Los recién nacidos pueden contraer la infección intraútero o más frecuentemente al pasar por el tracto genital durante el parto. La transmisión vertical (madre-recién nacido) ocurre durante el parto y aproximadamente un 50% de los recién nacidos de madres colonizadas por EGB están también colonizados. En ausencia de medidas de prevención 1-2% de los recién nacidos de madres colonizadas desarrollan EOD.[26]
En US la incidencia de la EOD antes de la instauración de medidas de prevención era del 0.7 al 3.7 por mil recién nacidos[2] y en Europa se han comunicado incidencias desde 0.2 a 3.25 por mil recién nacidos.[21]
Diversos factores favorecen el desarrollo de la infección por EGB de comienzo precoz en un recién nacido cuya madre esta colonizada por EGB.[12][24] Aunque el riesgo fundamental para que el recién nacido desarrolle una infección neonatal por EGB es la colonización de la madre[24] otros factores de riego incluyen prematuridad, coriamnionitis materna, rotura prolongada de membranas (más de 18 h), fiebre intraparto, un hermano anterior que haya sufrido EOD y la bacteriuria por EGB durante el embarazo.[12][24] Otro importante factor de riesgo es la exposición a una alta concentración de EGB en el canal del parto. Sin embargo, la mayoría de los recién nacidos que desarrollan EOD nacen de madres que no presentan ninguno de estos factores.[12] La mortalidad por EOD que en los años 70 era de un 50% ha declinado actualmente en los países desarrollados a un 4-8%, fundamentalmente por los avances en los cuidados neonatales, siendo más alta entre los recién nacidos prematuros.[12][27]
La infección por EGB de comienzo tardío aparece después de una semana desde el nacimiento hasta los 90 días de vida, presentándose comúnmente como bacteriemia o meningitis sin que en muchos casos pueda conocerse el mecanismo de infección. Cuando LOD cursa como meningitis son frecuentes las secuelas permanentes como retraso mental o sordera.[2][28]
Recientes estimaciones estiman que a nivel mundial anualmente 400.000 recién nacidos desarrollan una infección por EGB de comienzo precoz o tardío con una estimación de 90.000 muertes.[29][30]
En España se ha publicado para el año 2018 una incidencia del 0,17 por mil recién nacidos para la infección neonatal precoz por EGB y del 0,05 por mil para la infección neonatal tardía.[31]
Como evitar la infección neonatal[editar]
La única alternativa que, hasta ahora, se ha mostrado eficaz para prevenir la infección neonatal precoz por EGB es administrar por vía intravenosa a la gestante colonizada por EGB un antibiótico adecuado (profilaxis antibiótica) durante un mínimo de 4 horas antes del final del parto. Esta conducta reduce la transmisión del EGB al recién nacido y previene que este desarrolle infección por EGB. Los antibióticos utilizados son penicilina y ampicilina, y en caso de hipersensibilidad (reacción alérgica) cefazolina, clindamicina o vancomicina.[12][24][32][33]
Para seleccionar las madres candidatas a recibir profilaxis antibiótica existen dos estrategias. Una se basa en detectar las portadoras de EGB en la semana 35-37 de embarazo (cribado universal)(pesquisa universal) y suministrar profilaxis antibiótica durante el parto a todas las madres colonizadas por EGB. Adicionalmente se debe administrar profilaxis a las embarazadas que presentan factores de riesgo y cuyo estado de portadora de EGB se desconoce en el momento del parto. La otra estrategia selecciona a las candidatas a recibir profilaxis antibiótica basándose en la sola presencia de los citados factores de riesgo.[12][24][34]
Los Centros para el Control y la Prevención de Enfermedades (en inglés Centers for Disease Control and Prevention, CDC) publicaron sus recomendaciones actualizadas para las prevención de la infección neonatal por EGB en 2010.[12] En el año 2018 los CDC transfirieron la actualización de sus recomendaciones al colegio americano de obstetras y ginecólogos (American College of Obstetricians and Gynecologists, ACOG), a la Academia Americana de Pediatría y a la Sociedad Americana de Microbiología que en 2019 y 2020 han publicado documentos actualizado de recomendaciones para prevención de la infección neonatal por EGB.[9][24][33]
El documento de la ACOG no introduce novedades importantes sobre las recomendaciones de los CDC. La novedad es la recomendación de efectuar la detección de EGB en la embarazada en la semana 36-37 en vez de 35-37. Esta nueva recomendación, que se ha mostrado más efectiva,[35] tiene por objeto hacer válido la detección de EGB hasta cubrir los partos en la semana 41, dada la validez de solo 5 semanas de la pruebas de detección de EGB en la embarazada.[36]
La estrategia de cribado universal se sigue en más de 35 países incluyendo la mayoría de países occidentales [37] como USA, España, Francia, Bélgica, Canadá, Australia, Argentina etc. La estrategia basada en factores de riesgo es seguida en la UE en UK y Holanda.[21] Esta estrategia se muestra menos eficaz pues más de la mitad de los casos de infección precoz se presentan en recién nacidos de embarazadas sin factores de riesgo aparentes.[27] Pero desafortunadamente la profilaxis intraparto no es eficaz para prevenir la infección neonatal de comienzo tardío.[21][24]
Desarrollo de una vacuna[editar]
La alternativa más eficaz para prevenir la infección por EGB será una vacuna capaz de provocar una adecuada respuesta inmune. Esta vacuna administrada a la madre protegería al recién nacido frente a la infección por EGB de comienzo precoz y también frente a la infección de comienzo tardío, así mismo protegería a los adultos susceptibles. El polisacárido de la cápsula del EGB es un importante factor de virulencia y constituye un excelente candidato para el desarrollo de vacunas para prevenir la infección por EGB.[21][38] Actualmente en adición a las vacunas basadas en el polisacárido capsular están en desarrollo y ensayo vacunas basadas en proteínas de superficie del EGB.[38][39]
Pero aunque existen estudios avanzados y ensayos clínicos avanzados, una vacuna efectiva aún no está disponible para su uso generalizado.[21][40][41][42]
Detección de portadores[editar]
Aunque el estado de portadora durante el embarazo puede ser intermitente, se acepta que los cultivos vagino-rectales para detectar la colonización por EGB realizados con menos de 5 semanas antes del parto predicen adecuadamente el estado de portadora de EGB durante el parto, sin embargo, los cultivos realizados con anterioridad a 5 semanas no son fiables.[12][24][43][36] Las últimas recomendaciones de la ACOG recomiendan efectuar el cultivo para detección de EGB entre las semanas 36 y 37 de embarazo.[24] La muestras a estudiar son muestras vaginales y rectales tomadas con torunda.[12][24] Actualmente se recomienda usar escobillones "floked" para la toma de las muestras vaginales y rectales, pues este tipo de escobillones permite una mejor liberación de la muestra al medio de cultivo.[9] La técnica recomendada por los Centros para el Control y Prevención de Enfermedades de Estados Unidos (Centers for Disease Control and Prevention, CDC)[12] y por la Sociedad Americana de Microbiología (American Society for Microbiology. ASM)[9] requiere incubar las muestras vaginales y rectales en un caldo de enriquecimiento selectivo (Todd Hewitt con antibióticos) y posterior subcultivo en agar sangre e identificación como EGB de las colonias sospechosas. También es adecuado subcultivar el caldo selectivo en medio Granada donde la aparición de colonias rojas es demostrativa de la presencia de EGB.[4][44][45] También pueden utilizarse medios de cultivo cromogénicos donde la aparición de colonias de color determinado indica la presencia de EGB.[12] Cuando se utilizan medios cromogénicos debe confirmarse que las colonias sospechosas (con aspecto de EGB) son realmente EGB mediante un procedimiento adecuado de confirmación e.g. aglutinación con látex o el test CAMP.[4]
Para detectar EGB en muestras vaginales y rectales también pueden utilizarse directamente -o tras una fase de enriquecimiento por cultivo en caldo selectivo- técnicas moleculares de amplificación de ácidos nucleicos como la reacción en cadena de la polimerasa,(Polymerase chain reaction) PCR.[12]
Las pruebas rápidas para detectar EGB (fundamentalmente técnicas moleculares) pueden ser en el futuro efectivas como substituto del cultivo para detectar las madres portadoras de EGB. Pero estas pruebas deben ser aún mejoradas para su uso como"Pruebas de laboratorio en el lugar de asistencia" point-of-care testing, POCT,v que pueda ser realizado en la sala de partos y reemplazar a la detección del EGB por cultivo.[12][24] Un inconveniente de estas técnicas es que actualmente no permiten conocer la sensibilidad a los antibióticos de la cepa de EGB, lo que es un problema serio si existe alergia a la penicilina.[12][24]

Infección en animales[editar]
EGB fue primariamente identificado como un patógeno animal causante principal de mastitis bovina[46] causando importantes perdidas en la producción de leche y por ello fue nombrado agalactiae (sin leche). La mastitis provocada por EGB puede tener un importante efecto sobre la cantidad y calidad de la leche producida y está asociada con contajes elevados de células y bacterias en la leche.[47]
EGB se ha encontrado también en múltiples especies animales como pollos, camellos, caballos, lagartos, ranas, hámster, gatos, ratones, monos y peces.[48] Las infecciones por EGB en peces causan septicemia y hemorragias internas y externas, constituyendo una importante fuente de perdidas en las piscifactorías.[49]
Para prevenir estas infecciones en peces causadas por EGB se está intentando el desarrollo de vacunas.[50]
Referencias[editar]
- ↑ a b Whiley RA, Hardie JM (2009). Genus I. Streptococcus Rosenbach 1884. Bergey's Manual of Systematic Bacteriology: Vol 3: The Firmicutes (2nd edición). pp. 655-711.
- ↑ a b c d e f g h Edwards MS, Nizet V. (2011). Group B streptococcal infections. Infectious Diseases of the Fetus and Newborn Infant (7th edición). Elsevier. pp. 419-469. ISBN 978-0-443-06839-3.
- ↑ Slotved HC, Kong F, Lambertsen L, Sauer S, Gilbert GL. (2007). «Serotype IX, a Proposed New Streptococcus agalactiae Serotype.». J Clin Microbiol. 45(9):2929-36. doi:10.1128/JCM.00117-07. Consultado el 17 de noviembre de 2019.
- ↑ a b c d e Rosa-Fraile M.,Spellerberg B. (2017). «Reliable Detection of Group B Streptococcus in the Clinical Laboratory.». Journal of Clinical Microbiology. 55: (9): 2590-2598. PMID 28659318. doi:10.1128/JCM.00582-17. Consultado el 19 de noviembre de 2019.
- ↑ a b c Tille P (2014). Bailey & Scott's Diagnostic Microbiology (13th edición). Elsevier Mosby. ISBN 978-0-323-08330-0.
- ↑ Delgado S, García-Garrote F, Padilla B, Rodríguez Gómez JM, Romero B. «Diagnóstico microbiológico de la infección bacteriana asociada al parto y al puerperio.-». Procedimientos en Microbiología Clínica. No.54. Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). 2015. Consultado el 10 de noviembre de 2023.
- ↑ a b Rosa-Fraile M, Dramsi S, Spellerberg B. (2014). «Group B streptococcal haemolysin and pigment, a tale of twins.». FEMS Microbiol Rev 38: 932-946.
- ↑ Rosa-Fraile M, Rodríguez-Granger J, Haidour-Benamin A, Cuerva JM, Sampedro A. (2006). «Granadaene: proposed structure of the group B Streptococcus polyenic pigment.». Appl Environ Microbiol. 72:6367-70. doi:10.1128/AEM.00756-06. Consultado el 15 Noviembre 2019..
- ↑ a b c d e Filkins L, Hauser J, Robinson-Dunn B, Tibbetts R, Boyanton B, Revell P. «10 March 2020. Guidelines for the Detection and Identification of Group B Streptococcus» (en inglés). Archivado desde el original el 27 de junio de 2021. Consultado el 30 de octubre de 2023.
- ↑ Binghuai L, Yanli S, Shuchen Z, Fengxia Z, Dong L, Yanchao C. (2014). «Use of MALDI-TOF mass spectrometry for rapid identification of group B Streptococcus on chromID Strepto B agar.». Int J Infect Dis. 2014 27:44-8. doi:10.1016/j.ijid.2014.06.023.
- ↑ To KN, Cornwell E, Daniel R, Goonesekera S, Jauneikaite E, Chalker V, Le Doare K. (2019). «Evaluation of matrix-assisted laser desorption ionisation time-of-flight mass spectrometry (MALDI-TOF MS) for the Identification of Group B Streptococcus.». BMC Res Notes. 2019:12:85. doi:10.1186/s13104-019-4119-1. Consultado el 17 de noviembre de 2019.
- ↑ a b c d e f g h i j k l m n ñ Verani JR, McGee L, Schrag SJ (2010). «Prevention of perinatal group B streptococcal disease: revised guidelines from CDC, 2010». MMWR Recomm Rep. 59(RR-10): 1-32.
- ↑ El Aila NA, Tency I, Claeys G, Saerens B, Cools P, Verstraelen H, Temmerman M, Verhelst R, Vaneechoutte M (2010). «Comparison of different sampling techniques and of different culture methods for detection of group B streptococcus carriage in pregnant women.». BMC Infect Dis. 2010 -10:285. doi:10.1186/1471-2334-10-285. Consultado el 18 de noviembre de 2019.
- ↑ a b Barcaite E, Bartusevicius A, Tameliene R, KliucinskasM, Maleckiene L, Nadisauskiene R (2014). «Prevalence of maternal group B streptococcal colonisation in European countries». Acta Obstet Gynecol Scand 87: 260-271.
- ↑ Rajagopal L. (2009). «Understanding the regulation of Group B Streptococcal virulence factors.». Future Microbiol. 4: 201-221.
- ↑ Whidbey C, Harrell MI, Burnside K, Ngo L, Becraft AK, Iyer LM, Aravind L, Hitti J, Waldorf KM, Rajagopal L. (2013). «A hemolytic pigment of Group B Streptococcus allows bacterial penetration of human placenta.». J Exp Med 3: 1265-1281.
- ↑ Whidbey C, Vornhagen J, Gendrin C, Boldenow E, Samson JM, Doering K, Ngo L, Ezekwe EA Jr, Gundlach JH, Elovitz MA, Liggitt D, Duncan JA, Adams Waldorf KM, Rajagopal L. (2015). «A streptococcal lipid toxin induces membrane permeabilization and pyroptosis leading to fetal injury.». EMBO Mol Med. 7: 488-505.
- ↑ Leclercq SY, Sullivan MJ, Ipe DS, Smith JP, Cripps AW, Ulett GC. (2016 Jul 7;6:29000). «Pathogenesis of Streptococcus urinary tract infection depends on bacterial strain and β-hemolysin/cytolysin that mediates cytotoxicity, cytokine synthesis, inflammation and virulence». Sci Rep 2016. Jul 7;6:29000. doi:10.1038/srep29000.
- ↑ Armistead B, Oler E, Adams Waldorf K, Rajagopal (2019). «The Double Life of Group B Streptococcus: Asymptomatic Colonizer and Potent Pathogen». J Mol Biol 431: 2914-2931. doi:10.1016/j.jmb.2019.01.035. Consultado el 3 de enero de 2021.
- ↑ Blair Armistead, Christopher Whidbey, Lakshminarayan M. Iyer, Pilar Herrero-Foncubierta, Phoenicia Quach, Ali Haidour, L. Aravind, Juan Manuel Cuerva, Heather B. Jaspan, Lakshmi Rajagopal (2020). «The cyl Genes Reveal the Biosynthetic and Evolutionary Origins of the Group B Streptococcus Hemolytic Lipid, Granadaene». Front Microbiol. 10: 3123. doi:10.3389/fmicb.2019.03123. Consultado el 3 de enero de 2021.
- ↑ a b c d e f Rodriguez-Granger J, Alvargonzalez JC, Berardi A, Berner R, Kunze M, Hufnagel M, Melin P, Decheva A, Orefici G, Poyart C, Telford J, Efstratiou A, Killian M, Krizova P, Baldassarri L, Spellerberg B, Puertas A, Rosa-Fraile M. (2012). «Prevention of group B streptococcal neonatal disease revisited. The DEVANI European project». Eur J Clin Microbiol Infect Dis 31: 2097-2104.
- ↑ Russell NJ, Seale AC, O'Driscoll M, O'Sullivan C, et al. (2017). «Maternal Colonization With Group B Streptococcus and Serotype Distribution Worldwide: Systematic Review and Meta-analyses». Clin Infect Dis . 65(suppl_2): S100-111. doi:10.1093/cid/cix658. Consultado el 12 de noviembre de 2023.
- ↑ Gonçalves BP, Procter SR, Clifford S, Koukounari A, Paul P, Lewin A, Jit M, Lawn J. (2021). «Estimation of country-level incidence of early- onset invasive Group B Streptococcus disease in infants using Bayesian methods». PLoS Comput Biol. 17: e1009001. doi:10.1371/journal.pcbi.1009001. Consultado el 12 de noviembre de 2023.
- ↑ a b c d e f g h i j k l m The American College of Oftetricians and Ginecologists (2019). «Prevention of Group B Streptococcal Early-Onset Disease in Newborns: ACOG Committee Opinion, Number 782.». Obstet Gynecol. 2019 ;134:e19-e40. 10.1097/AOG.0000000000003334. doi:10.1097/AOG.0000000000003334. Consultado el 16 de noviembre de 2019.
- ↑ Muller AE, Oostvogel PM, Steegers EA, Dörr PJ. (2006). «Morbidity related to maternal group B streptococcal infections.». Acta Obstet Gynecol Scand. 2006;85:1027-37. doi:10.1080/00016340600780508. Consultado el 16 de noviembre de 2019.
- ↑ Boyer KM, Gotoff SP (1985). «Strategies for chemoprophylaxis of GBS early-onset infections.». Antibiot Chemother 35: 267-280.
- ↑ a b Giménez M, Sanfeliu I, Sierra M, Dopico E, Juncosa T, Andreu A, Lite J, Guardià C, Sánchez F, Bosch J (2014). «Evolución de la sepsis neonatal precoz por Streptococcus agalactiae en el área de Barcelona (2004-2010). Análisis de los fallos del cumplimiento del protocolo de prevención». Enferm Infecc Microbiol Clin.
- ↑ Libster R, Edwards KM, Levent F, Edwards MS, Rench MA, Castagnini LA, Cooper T, Sparks RC, Baker CJ, Shah PE (2012). «Long-term outcomes of group B streptococcal meningitis.». Pediatrics 130: e8´15. doi:10.1542/peds.2011-3453.
- ↑ Paul P, Gonçalves BP, Le Doare K, Lawn JE (2023). «20 million pregnant women with group B streptococcus carriage: consequences, challenges, and opportunities for prevention». Curr Opin Pediatr 35: 223-230. doi:10.1097/MOP.0000000000001223. Consultado el 12 de noviembre de 2023.
- ↑ Gonçalves BP, Procter SR, Paul P, Chandna J, et al. (2022). «Group B streptococcus infection during pregnancy and infancy: estimates of regional and global burden». Lancet Glob Health. 10: e807-e819. doi:10.1016/S2214-109X(22)00093-6. Consultado el 12 de noviembre de 2023.
- ↑ Rosa-Fraile M, Alos JI (2022). «Group B Streptococcus neonatal infections, the ongoing history». Enferm Infecc Microbiol Clin 40: 349-352. doi:10.1016/j.eimce.2022.01.002.
- ↑ Alós Cortés JI, Andreu Domingo A, Arribas Mir L, Cabero Roura L, Cueto Lopez M, López Sastre J, Melchor Marcos JC, Puertas Prieto A, Rosa Fraile M, Salcedo Abizanda S, Sánchez Luna M, Sánchez Pérez MJ, Torrejón Cardoso R. (2012). «Prevención de la infección perinatal por estreptococo del grupo B. Recomendaciones españolas. Actualización 2012». Rev Esp Quimioter. 2012;25:79-88. 25: 79-88. Consultado el 18 de noviembre de 2019.
- ↑ a b Puopolo KM, Lynfield R, Cummings JJ, AAP COMMITTEE ON FETUS AND NEWBORN, AAP COMMITTEE ON INFECTIOUS DISEASES (2019). «Management of Infants at Risk for Group B Streptococcal Disease.». Pediatrics 144: :e20191881. doi:10.1542/peds.2019-1881. Consultado el 3 de enero de 2021.
- ↑ Clifford V, Garland SM, Grimwood K (2011). «Prevention of neonatal group B streptococcus disease in the 21st century.». J Paediatr Child Health 48: 808-815. doi:10.1111/j.1440-1754.2011.02203.x.
- ↑ Williams M, Zantow E, Turrentine M. (2020). «Cost Effectiveness of Latest Recommendations for Group B Streptococci Screening in the United States». Obstet Ginecol. 135: 789-798. doi:10.1097/AOG.0000000000003649.
- ↑ a b Yancey MK, Schuchat A, Brown LK, Ventura VL, Markenson GR. (1996). «The accuracy of late antenatal screening cultures in predicting genital group B streptococcal colonization at delivery.». Obstet Gynecol. 88(5):811-5. doi:10.1016/0029-7844(96)00320-1.
- ↑ Le Doare K, O’Driscoll M, Turner k, Seedat F, Russell NJ, et al. (2017). «Intrapartum Antibiotic Chemoprophylaxis Policies for the Prevention of Group B Streptococcal Disease Worldwide: Systematic Review». Clin Infect Dis . 65(suppl_2): :S143-S151. doi:10.1093/cid/cix654. Consultado el 13 de noviembre de 2023.
- ↑ a b Song JY, Lim JH, Lim S, Yong Z, Seo HS. (2018). «Progress toward a group B streptococcal vaccine.». Hum Vaccin Immunother. 2018;14(11):2669-2681. doi:10.1080/21645515.2018.1493326. Consultado el 18 Noviembre 2019..
- ↑ Carreras-Abad C, Ramkhelawon L, Heath PT, Le Doare K (2020). «A Vaccine Against Group B Streptococcus: Recent Advances.». Infect Drug Resist. (en inglés) 13: 263-1272. doi:10.2147/IDR.S203454. Consultado el 3 de enero de 2021.
- ↑ Baker CJ, Carey VJ, Rench MA, Edwards MS, Hillier SH, Kasper DL, Platt R. (2014). «Maternal Antibody at Delivery Protects Neonates From Early Onset Group B Streptococcal Disease». J Infect Dis 209: 781-788.
- ↑ Heath PT. (2016). «Status of vaccine research and development of vaccines for GBS». Vaccine. 34:: 28762879. PMID 26988258. doi:10.1016/j.vaccine.2015.12.072/j.vaccine.2015.12.072. Consultado el 27 de noviembre de 2017.
- ↑
- ↑ Valkenburg-van den Berg AW, Houtman-Roelofsen RL, Oostvogel PM, Dekker FW, Dorr PJ, Sprij AJ. (2010). «Timing of group B streptococcus screening in pregnancy: a systematic review». Gynecol Obstet Invest 69: 174-183.
- ↑ Rosa-Fraile M, Rodriguez-Granger J, Cueto-Lopez M, Sampedro A, Biel Gaye E, Haro M & Andreu A. (1999). «Use of Granada medium to detect group B streptococcal colonization in pregnant women». J Clin Microbiol 37: 2674-2677.
- ↑ Carey RB. «Group B Streptococci: Chains & Changes New Guidelines for the Prevention of Early-Onset GBS». Archivado desde el original el 5 de octubre de 2017. Consultado el 17 de septiembre de 2015.
- ↑ Keefe GP. (1997). «Streptococcus agalactiae mastitis: a review.». Can Vet J 38: 429-437. Consultado el 19 de noviembre de 2019.
- ↑ Ruegg PL. (2017). «A 100-Year Review: Mastitis detection, management, and prevention». J Dairy Sci. 2017;100:10381-10397. doi:10.3168/jds.2017-13023. Consultado el 17 Noviembre 2018..
- ↑ Garcia JC, Klesius PH, Evans JJ, Shoemaker CA (2008). «Non-infectivity of cattle Streptococcus agalactiae in Nile tilapia, Oreochromis niloticus and channel catfish, Ictalurus punctatus». Aquaculture. 281: 151-154.
- ↑ Evans JJ, Klesius PH, Pasnik DJ, Bohnsack JF (2009). «Human Streptococcus agalactiae isolate in Nile tilapia (Oreochromis niloticus).». Emerg Infect Dis. 15: 774-776.
- ↑ Bashir S, Phuoc NN, Herath T, Basit A, Zadoks RN, Murdan S (2023). «An oral pH-responsive Streptococcus agalactiae vaccine formulation provides protective immunity to pathogen challenge in tilapia: A proof-of-concept study». PLoS ONE 18: e0278277. Consultado el 9 de noviembre de 2023.
