Agar granada
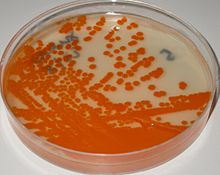




El agar granada es un medio de cultivo selectivo y diferencial específico para estreptococos del grupo B (EGB, Streptococcus agalactiae).
El medio granada fue desarrollado por el Dr. Manuel de la Rosa Fraile y sus colaboradores en el Servicio de Microbiología del Hospital Universitario Virgen de las Nieves en Granada para el aislamiento e identificación directa de EGB en muestras clínicas.[1]
Tras 24-48 horas de incubación a 35-37 °C en agar granada las cepas hemolíticas de EGB se desarrollan como colonias naranjas o rojas.[2] La identificación de las colonias de EGB en el medio granada es inmediata y se basa en la detección del granadaeno, que es el pigmento poliénico de color rojo, específico de EGB.[3][4]
El medio granada es comercializado en la Unión Europea como marca registrada (®) por BioMérieux[5] y BectonDickinson.[6] y en US por Hardy Diagnostics [7]
Composición[editar]
[1]
| Componente | Cantidad por litro | Función |
|---|---|---|
| Agar-agar | 10 g | Gelificante |
| Proteosa Peptona N.º 3. BD-BectonDickinson | 25 g | Nutriente/ activación pigmento.
No puede ser sustituida por ningún otro tipo de peptona |
| Suero de caballo | 15 mL | Nutriente |
| Glucosa | 2.5 g | Nutriente |
| Almidón | 20 g | Estabilizador del pigmento |
| MOPS hemisódico, (3-(n-morfolino)ácido propanesulfónico) sal hemisódica | 11 g | Buffer de Good |
| Fosfato disódico anhidro | 8.5 g | Buffer |
| Metotrexato | 6 mg | Activador pigmento |
| Cristal violeta | 0.2 mg | Inhibe bacterias Gram positivas |
| Sulfato de colistina | 5 mg | Inhibe bacterias Gram negativas |
| Metronidazol | 1 mg | Inhibe anaerobios |
| Sulfato Magnesio | 0.2 g | ---- |
| Ácido pirúvico sal sódica | 1 g | Fuente de energía adicional, protege frente a las especies reactivas de oxígeno |
pH 7.45±0.1
Fundamento[editar]
Se basa en la detección en el medio de cultivo del granadaeno que es un pigmento rojo específico de las cepas hemolíticas de EGB.[8] El granadaeno es un pigmento poliénico con un sistema de doce dobles enlaces conjugados (ornitinramnododecaeno).[3][9][10] En EGB la producción de β-hemolisina y del pigmento están codificados por un grupo (clúster) de 12 genes de denominados cyl.[11][12]
Componentes del medio granada[editar]
En el medio granada la producción del pigmento granadaeno es activada por el metotrexato. Los inhibidores de la vía del folato activan in vitro la formación de pigmento en el EGB por un mecanismo no conocido.[8]
Componente clave del medio Granada es Proteose Peptone 3 (Difco & BD),[13] esta peptona pépsica fue desarrollada por DIFCO (Digestive Ferments Company) durante la primera guerra mundial para preparar toxinas bacterianas para fabricación de vacunas. Fundamental para el desarrollo de colonias rojo-naranjas de EGB es la presencia en la peptona usada para preparar el medio del péptido Ile-Ala-Arg-Arg-His-Pro-Tyr-Phe,[14] que solo se produce en la hidrólisis pépsica de la albúmina de mamíferos.[14] Para la producción óptima del pigmento de EGB es también necesaria la presencia en la peptona usada de otros compuestos, aún no caracterizados, procedentes de los tejidos del tracto digestivos de los animales utilizados en la fabricación de la peptona.[15]
La presencia de almidón en el medio es fundamental para la estabilización del pigmento y observación de colonias rojas de EGB.[8] Sin embargo, si se utiliza almidón soluble ello resulta en una pobre estabilidad del medio pues el almidón es rápidamente hidrolizado por la amilasa contenida en el suero añadido como suplemento. Este problema puede ser solucionado bien omitiendo el suero en la formulación del medio o utilizando en vez de almidón soluble almidón no modificado y por ello más difícil de hidrolizar por la amilasa.[16]
Uso y características[editar]
Detección e identificación de Streptococcus agalactiae. S.agalactiae se desarrolla en agar granada como colonias rojo-naranja después de 18-48 horas de incubación (35-37 °C) preferentemente en anaerobiosis.[2] El medio es selectivo para EGB aunque pueden desarrollarse (como colonias incoloras o blancas) algunas otras bacterias resistentes a los inhibidores usados, como Enterococcus y algunas levaduras.[2] El agar granada puede ser usado para detección de EGB en muestras vaginales y rectales en embarazadas para detectar las portadoras de EGB y seleccionar las candidatas a recibir profilaxis antibiótica intraparto para prevenir la infección neonatal precoz por EGB.[17][18][19] Entre un 1 y un 5 % de cepas de EGB son no hemolicas y no producen pigmento,[8] sin embargo estas cepas de EGB (no hemolíticas y no pigmentadas) se consideran menos virulentas.[20][21][22][23] Así mismo se ha postulado que la intensidad de producción de pigmento en el medio Granada puede ser un buen predictor de la virulencia de la cepa de EGB.[24]
Variantes[editar]
El desarrollo de colonias rojo intenso de EGB puede conseguirse en agar granada en aerobiosis colocando un cubreobjetos sobre la superficie inoculada del medio.[2] El agar granada también puede usarse en forma de medio líquido[25]como el medio carrot [26] en cuyo caso no se requiere incubación en anaerobiosis.[2]
Granadaeno y Streptococcus agalactiae[editar]
La producción de granadaeno está codificada en Streptococcus agalactiae por un grupo de 12 genes denominados cyl que también codifican la producción de hemolisina en EGB[11][12] (la denominación cyl se refiere a la amplia acción citolítica de la hemolisina del EGB). El grupo de genes cyl desempeñan un importante papel en la virulencia del EGB.[8][20] Se ha postulado que el granadaeno y la hemolisina de S.agalactiae pueden ser la misma molécula o al menos compuestos muy relacionados.[8][20] Así mismo se ha comprobado que en determinadas condiciones experimentales la molécula de granadaeno se comporta como una citotoxina muy activa capaz de alterar las membranas celulares y causar daño fetal.[20][21][22][27][28][29]
Referencias[editar]
- ↑ a b Rosa M., Perez M., Carazo C., Peis J.I., Pareja L., Hernandez F. (1992). «New Granada Medium for detection and identification of group B streptococci». J Clin Microbiol 30: 1019-1021.
- ↑ a b c d e Rosa-Fraile M., Rodriguez-Granger J., Cueto-Lopez M., Sampedro A., Biel Gaye E., Haro M., Andreu A. (1999). «Use of Granada medium to detect group B streptococcal colonization in pregnant women.». J Clin Microbiol. 37: 2674-2677.
- ↑ a b Rosa-Fraile M., Rodriguez-Granger J., Haidour-Benamin A., Cuerva J.M., Sampedro A. (2006). «Granadaene: proposed structure of the group B streptococcus polyenic pigment». Appl Environ Microbiol 72: 2674-2677.
- ↑ Rosa-Fraile M., Spellerberg B. (septiembre de 2017). «Reliable Detection of Group B Streptococcus in the Clinical Laboratory.». Journal of Clinical Microbiology 55 (9): 2590-2598. doi:10.1128/JCM.00582-17.
- ↑ «Medio Granada bioMérieux».
- ↑ «BD Group B Streptococcus Differential Agar (Granada Medium)».
- ↑ «Granada Medium, Hardy diagnostics» (en inglés). Consultado el 11 de octubre de 2023.
- ↑ a b c d e f Rosa-Fraile M., Dramsi S., Spellerberg B. (2014). «Group B streptococcal haemolysin and pigment, a tale of twins». FEMS Microbiol Rev 38: 932-946.
- ↑ Paradas M., Jurado R., Haidour A., Rodríguez Granger J., Sampedro Martínez A., de la Rosa Fraile M., Robles R., Justicia J., Cuerva J.M. (2012). «Clarifying the structure of granadaene: total synthesis of related analogue [2]-granadaene and confirmation of its absolute stereochemistry.». Bioorg Med Chem. 20: 6655-6661. doi:10.1016/j.bmc.2012.09.017.
- ↑ Madden K.S., Mosa F.A., Whiting A. (2014). «Non-isoprenoid polyene natural products – structures and synthetic strategies». Bioorg Med Chem. 12: 7877-7899. doi:10.1039/c4ob01337a.
- ↑ a b Spellerberg B, Pohl B, Haase G, Martin S, Weber-Heynemann J, Lutticken R. 1999. (1999). «Identification of genetic determinants for the hemolytic activity of Streptococcus agalactiae by ISS1 transposition». FEMS Microbiol Lett 181: 3212-3219.
- ↑ a b Spellerberg B, Martin S, Brandt C, Lutticken R. (2000). «The cyl genes of Streptococcus agalactiae are involved in the production of pigment.». FEMS Microbiol Lett 188: 125-128.
- ↑ BD Diagnostics – Diagnostic Systems (2009). Difco & BBL Manual Manual of Microbiological Culture Media 2nd Ed. (en inglés). Becton, Dickinson and Company. ISBN 0-9727207-1-5.
- ↑ a b Rosa-Fraile M., Sampedro A., Varela J., Garcia-Peña M., Gimenez-Gallego G. (1999). «Identification of a peptide from mammal albumins responsible for enhanced pigment production by group B streptococci.». Clin Diagn Lab Immunol. 6:425.
- ↑ Enrique Camacho Muñoz. (2005). Importancia de la Proteosa Peptona N.º 3 en la Producción de Pigmento por Streptococcus agalactiae en el Medio Granada. TESIS DOCTORAL-Universidad de Granada.. Universidad de Granada. ISBN 84-338-3741-9. Consultado el 20 de marzo de 2023.
- ↑ Rosa-Fraile M., Rodríguez-Granger J., Camacho-Muñoz E., Sampedro A. (2005). «Use of unmodified starches and partial removal of serum to improve Granada medium stability.». J Clin Microbiol. 43:1989-1991.
- ↑ Verani J.R., McGee L., Schrag S.J. (2010). «Prevention of perinatal group B streptococcal disease: revised guidelines from CDC, 2010». MMWR Recomm Rep. 59(RR-10): 1-32.
- ↑ Alós Cortés J.I., Andreu Domingo A., Arribas Mir L., Cabero Roura L., de Cueto López M., López Sastre J., Melchor Marcos J.C., Puertas Prieto A., de la Rosa Fraile M., Salcedo Abizanda S., Sánchez Luna M., Sánchez Pérez M.J., Torrejon Cardoso R. (2012). «Prevención de la infección perinatal por estreptococo del grupo B. Recomendaciones españolas. Actualización 2012 Enferm Infecc Microbiol Clin.». Enferm Infecc Microbiol Clin. 31: 159-172. Archivado desde el original el 1 de diciembre de 2017. Consultado el 20 de abril de 2015.
- ↑ Filkins L., Hauser J., Robinson-Dunn B., Tibbetts R., Boyanton B., Revell P. (10 de marzo de 2020). «Guidelines for the Detection and Identification of Group B Streptococcus.» (en inglés). ASM. Archivado desde el original el 27 de junio de 2021. Consultado el 10 de octubre de 2020.
- ↑ a b c d Whidbey C, Harrell MI, Burnside K, Ngo L, Becraft AK, Iyer LM, Aravind L, Hitti J, Adams Waldorf KM, Rajagopal L. (2013). «A hemolytic pigment of Group B Streptococcus allows bacterial penetration of human placenta.». J Exp Med. 210: 1265-1281.
- ↑ a b Whidbey C, Vornhagen J, Gendrin C, Boldenow E, Samson JM, Doering K, Ngo L, Ezekwe EA Jr, Gundlach JH, Elovitz MA, Liggitt D, Duncan JA, Adams Waldorf KM, Rajagopal L. (2015). «A streptococcal lipid toxin induces membrane permeabilization and pyroptosis leading to fetal injury.». EMBO Mol Med. 7: 488-505.
- ↑ a b Christopher-Mychael Whidbey (2015). Characterization of the Group B Streptococcus Hemolysin and its Role in Intrauterine Infection (en inglés). University of Washington. Consultado el 19 de junio de 2016.
- ↑ Rodriguez-Granger J., Spellerberg B., Asam D., Rosa-Fraile M. (Diciembre de 2015). «Non-haemolytic and non-pigmented group b streptococcus, an infrequent cause of early onset neonatal sepsis.». Pathog Dis. 73 (9). doi:10.1093/femspd/ftv089.
- ↑ Huebner EM, Gudjónsdóttir MJ, Dacanay MB, Nguyen S, Brokaw A, Sharma K, Elfvin A, Hentz E, Rivera YR, Burd N, Shivakumar M, Coler B, Li M, Li A, Munson J, Orvis A, Coleman M, Jacobsson B, Rajagopal L, Adams Waldorf KM. (2022). «"Virulence, phenotype and genotype characteristics of invasive group B Streptococcus isolates obtained from Swedish pregnant women and neonates"». Ann Clin Microbiol Antimicrob. 21: 43. doi:10.1186/s12941-022-00534-2. Consultado el 20 de marzo de 2023.
- ↑ Carvalho Mda G, Facklam R, Jackson D, Beall B, McGee L. (2009). «Evaluation of three commercial broth media for pigment detection and identification of a group B Streptococcus (Streptococcus agalactiae).». J Clin Microbiol 47: 4161-4163. doi:10.1128/JCM.01374-09. Consultado el 21 de octubre de 2023.
- ↑ «CARROT BROTH» (en inglés). Consultado el 11 de octubre de 2023.
- ↑ Armistead B., Oler E., Adams Waldorf K., Rajagopal L. (2019). «The Double Life of Group B Streptococcus: Asymptomatic Colonizer and Potent Pathogen.». J Mol Biol 431: 2914-2931. doi:10.1016/j.jmb.2019.01.035. Consultado el 7 de diciembre de 2020.
- ↑ Armistead B, Herrero-Foncubierta P, Coleman M, Quach P, Whidbey C, Justicia J, Tapia R, Casares R, Millán A, Haidour A, Granger JR, Vornhagen J, Santana-Ufret V, Merillat S, Adams Waldorf K, Cuerva JM, Rajagopal L. (2020). «Lipid analogs reveal features critical for hemolysis and diminish granadaene mediated Group B Streptococcus infection». Nat Commun. 11: 1502. doi:10.1038/s41467-020-15282-0. Consultado el 7 de diciembre de 2020.
- ↑ Armistead B., Whidbey C., Iyer L.M., Herrero-Foncubierta P., Quach P., Haidour A., Aravind L., Cuerva J.M., Jaspan H.B., Rajagopal L. (2020). «The cyl Genes Reveal the Biosynthetic and Evolutionary Origins of the Group B Streptococcus Hemolytic Lipid, Granadaene.». Frontiers in Microbiology 10: 3123. doi:10.3389/fmicb.2019.03123. Consultado el 7 de diciembre de 2020.
