Grupo activante
En química, especialmente en química orgánica, se dice que un grupo funcional es un grupo activante o grupo activador cuando aumenta la reactividad química de la molécula hacia un tipo de reacción química particular. La expresión grupo activante suele aplicarse en química de compuestos aromáticos, en donde el grupo activante es un sustituyente del anillo que aumenta la reactividad del mismo en las reacciones de sustitución electrofílica aromática (SEAr). Los grupos activadores modifican la reactividad de un grupo funcional al alterar la densidad electrónica de este último. Este cambio en la densidad electrónica facilita reacciones posteriores.
Aplicaciones
[editar]Los grupos activantes encuentran diversidad de aplicaciones, especialmente cuando es necesario dirigir una reacción hacia un caso único en presencia de otros grupos funcionales sensibles. En este caso, suele usárseles junto a grupos protectores para los demás grupos funcionales. El uso de grupos activantes ha venido a revolucionar procedimientos de síntesis aplicados a la bioquímica, como la síntesis química de péptidos y la síntesis química de oligonucléotidos -fragmentos pequeños de ácidos nucleicos.
Grupos activantes según el grupo funcional
[editar]| Grupo funcional | Grupo activante | Agente activante | Reacción |
|---|---|---|---|
| Alcoholes -OH | Sulfonato[1] | Halogenuros de sulfonilo:
|
Sustitución nucleofílica |
| Alquiloxifosfonio[5] | Azodicarboxilatos:
|
Reacción de Mitsunobu | |
Azodicarboxamidas:
| |||
| Alquenilfosforanos: | |||
| Ácidos carboxílicos -COOH | Cloruro de acilo | Halogenuros de ácidos inorgánicos: | Sustitución nucleofílica acílica |
| Adenilato de acilo | ATP[14] | ||
| bis(2-oxo-1,3-oxazolidin-3-il)fosfinato de acilo[15] | 3,3'-(clorofosfindiil)dioxazolidin-2-ona[15] | ||
| carbonato de tert-butil 3-(3,4-dihidrobenzotriazin-4-on)ilo[16] | |||
Carbodiimidas:
| |||
| Reactivos de Mukaiyama[19] | |||
| 1,1-carbonildiimidazol (CDI)[20] | |||
| Aromáticos | Hidroxilo | Sustitución electrofílica aromática | |
| Alquiloxi | |||
| Amino | |||
| Amina sustituida | |||
| Acetamido | |||
| Amida α,β-insaturada | Derivados de triflilo:
|
Adición nucleofílica | |
| Cloruro de aluminio en exceso[21] | |||
| Aldehídos | Enolato | Amidas: | Adición nucleofílica conjugada |
| Organoborados: |
Grupos activantes en síntesis de biopolímeros
[editar]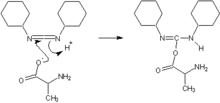
En la síntesis de péptidos, el grupo carboxilo de un aminoácido debe unirse con el grupo amino de otro aminoácido para formar el enlace peptídico. Pero este proceso no es muy eficiente en condiciones suaves. De ahí que se utiliza un agente activante. Se utilizan actualmente carbodiimidas, como la diciclohexilcarbodiimida[17] (DCC) o la diisopropilcarbodiimida (DIC). que hacen que el átomo de carbono sea más susceptible al ataque nucleofílico del grupo amino, y la reacción de formación del enlace peptídico mediante una sustitución nucleofílica acílica puede hacerse mediante condiciones suaves.
En la síntesis de oligonucleótidos por el método del fosfodiéster, el grupo activante proviene de la reacción in situ del grupo hidroxilo de un nucleótido con DCC o cloruro de tosilo.[26] En ambos casos, la base se vuelve más susceptible al ataque nucleofílico del grupo fosfato de la siguiente base, con la formación del enlace fosfatídico.
Grupos activantes en sistemas aromáticos
[editar]
En compuestos aromáticos, se hace énfasis en la activación del anillo aromático hacia la reacción de sustitución electrofílica aromática. Los grupos activantes son grupos funcionales liberadores de electrones, o que estabilizan al complejo sigma formado durante la reacción SEAr. En general, un grupo funcional unido a un anillo aromático es más activante mientras menor sea la electronegatividad del mismo, pero también es fuertemente influyente la capacidad del grupo funcional de formar orbitales pi de enlace con el complejo sigma aromático.
Los grupos activantes más potentes son los grupos amino primario -NH2, amino secundario -NHR, amino terciario -NR2, y el anión amida -NH-. También son fuertemente activantes los grupos hidroxilo -OH, alcoxi -OR, y el anión oxi -O-. Otros grupos activantes son el grupo acetamido, los grupos alquilo y los grupos fenilo.
Estos grupos activantes tienen el efecto contrario en la reacción de sustitución nucleofílica aromática, dificultando la reacción, por lo que se convierten entonces en grupos desactivantes. Sin embargo, al referirse a grupos activantes y compuestos aromáticos, se suele sobreentender que se refiere a activación con respecto a la reacción SEAr.
Véase también
[editar]Referencias
[editar]- ↑ Patai, Saul; Rappoport, Zvi; Bentley, T. William (2006). «Chapter 16. Directing and Activating Effects in Reactions Involving Sulphonic Acids and Derivatives». Sulphonic Acids, Esters and their Derivatives. John Wiley & Sons, Ltd. pp. 671-696. ISBN 9780470034392. doi:10.1002/0470034394.ch16.
- ↑ Veeravagu, P.; Arnold, R. T.; Eigenmann, E. W. (agosto de 1964). «Competitive Elimination-Substitution Reactions. Some Dramatic Differences between Bromides and Tosylates». J. Am. Chem. Soc. (Am. Chem. Soc.) 86 (15): 3072-3075. doi:10.1021/ja01069a020.
- ↑ a b c Jerry, March; Michael B., Smith (2007). «Chapter 10. Aliphatic substitution: nucleophilic and organometallic». March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6 edición). John Wiley & Sons, Ltd. p. 497. ISBN 978-0-471-72091-1. doi:10.1002/0470034394.ch16.
- ↑ Su, Tah Mun; Sliwinski, Wallace F.; Schleyer, Paul Von R. (septiembre de 1969). «Solvolysis of highly unreactive substrates using the trifluoromethanesulfonate (triflate) leaving group». J. Am. Chem. Soc. (American Chemical Society) 91 (19): 5386-5388. doi:10.1021/ja01047a035.
- ↑ Mitsunobu, Oyo (octubre de 1981). «The Use of Diethyl Azodicarboxylate and Triphenylphosphine in Synthesis and Transformation of Natural Products». Synthesis (Thieme Publishing Group) 1981 (01): 1-28. doi:10.1055/s-1981-29317.
- ↑ Mitsunobu, Oyo; Yamada, Masaaki (octubre de 1967). «Preparation of Esters of Carboxylic and Phosphoric Acid via Quaternary Phosphonium Salts». Bull. Chem. Soc. Jap. (Chemical Society of Japan) 40 (10): 2380-2382. doi:10.1246/bcsj.40.2380.
- ↑ Yang, Jianhai; Dai, Liyan; Wang, Xiaozhong; Chen, Yingqi (15 de enero de 2011). «Di-p-nitrobenzyl azodicarboxylate (DNAD): an alternative azo-reagent for the Mitsunobu reaction». Tetrahedron (Elsevier). doi:10.1016/j.tet.2010.12.036.
- ↑ Volante, R. P. (1981). «A new, highly efficient method for the conversion of alcohols to thiolesters and thiols». Tet. Lett. (Elsevier) 22 (33): 3119-3122. doi:10.1016/S0040-4039(01)81842-6.
- ↑ Lipshutz, Bruce H.; Chung, David W.; Rich, Brian; Corral, Ricardo (octubre de 2006). «Simplification of the Mitsunobu Reaction. Di-p-chlorobenzyl Azodicarboxylate: A New Azodicarboxylate». Org. Lett. (Am. Chem. Soc.) 8 (22): 5069-5072. doi:10.1021/ol0618757.
- ↑ Hagiya, Kazutake; Muramoto, Natsuko; Misaki, Tomonori; Sugimura, Takashi (agosto de 2009). «DMEAD: a new dialkyl azodicarboxylate for the Mitsunobu reaction». Tetrahedron (Elsevier) 65 (31): 6109-6114. doi:10.1016/j.tet.2009.05.048.
- ↑ a b Tsunoda, Tetsuto; Uemoto, Kaori; Nagino, Chisato; Kawamura, Megumi; Kaku, Hiroto; Itô, Shô (8 de octubre de 1999). «A facile one-pot cyanation of primary and secondary alcohols. Application of some new Mitsunobu reagents». Tetrahedron Lett. (Elsevier) 40 (41): 7355-7358. doi:10.1016/S0040-4039(99)01509-9.
- ↑ Tsunoda, Tetsuto; Nagaku, Miwa; Nagino, Chisato; Kawamura, Yumi; Ozaki, Fumie; Hioki, Hideaki; Itô, Shô (abril de 1995). «Carbon-carbon bond formation with new Mitsunobu reagents». Tet. Lett. (Elsevier) 36 (14): 2531-2534. doi:10.1016/0040-4039(95)00300-2.
- ↑ Tsunoda, Tetsuto; Ozaki, Fumie; Itô, Shô (11 de julio de 1994). «Novel reactivity of stabilized methylenetributylphosphorane: A new mitsunobu reagent». Tetrahedron Lett. (Elsevier) 35 (28): 5081-5082. doi:10.1016/S0040-4039(00)73326-0.
- ↑ KEGG REACTION R01280
- ↑ a b US patent 4230849, Palomo Coll et al., "Process for the activation of carboxylic acids", concedida 1980-10-28
- ↑ Basel, Yochai; Hassner, Alfred (abril de 2002). «Activation of carboxylic acids as their active esters by means of tert-butyl 3-(3,4-dihydrobenzotriazine-4-on)yl carbonate». Tet. Lett. (Elsevier) 43 (14): 2529-2533. doi:10.1016/S0040-4039(02)00324-6.
- ↑ a b Sheehan, John C.; Hess, George P. (febrero de 1955). «A New Method of Forming Peptide Bonds». J. Am. Chem. Soc. (Am. Chem. Soc.) 77 (4): 1067-1068. doi:10.1021/ja01609a099.
- ↑ Sheehan, John C.; Cruickshank, Philip; Boshart, Gregory (julio de 1961). «Notes- A Convenient Synthesis of Water-Soluble Carbodiimides.». J. Org. Chem. (Am. Chem. Soc.) 26 (7): 2525-2528. doi:10.1021/jo01351a600.
- ↑ Li, Jie Jack (2006). «Mukaiyama reagent». Name Reactions. Springer Berlin Heidelberg. pp. 406-407. ISBN 978-3-540-30031-1. doi:10.1007/3-540-30031-7_183.
- ↑ Morton, Robert C.; Mangroo, Dev; Gerber, Gerhard E. (julio de 1988). «A novel method of complete activation by carbonyldiimidazole: application to ester synthesis». Can. J. Chem (NRC Research Press) 66 (7): 1701-1705.
- ↑ a b Koltunov, Konstantin Yu.; Walspurger, Stéphane; Sommer, Jean (2004). «Superacidic Activation of α,β-Unsaturated Amides and Their Electrophilic Reactions». Eur. J. Org. Chem. (WILEY-VCH Verlag) 2004 (19): 4039-4047. doi:10.1002/ejoc.200400313.
- ↑ Xiang, Shao-Hua; Xu, Jian; Huang, Pei-Qiang (2010). «ChemInform Abstract: Amide Activation by Tf2O: Reduction of Amides to Amines by NaBH4 under Mild Conditions.». ChemInform (WILEY-VCH Verlag) 41 (48). doi:10.1002/chin.201048054.
- ↑ Movassaghi, Mohammad; Hill, Matthew D.; Ahmad, Omar K. (2007). «Direct Synthesis of Pyridine Derivatives.». ChemInform (WILEY-VCH Verlag) 38 (51). doi:10.1002/chin.200751182.
- ↑ Carlier, Paul R.; Lo, Cedric W.-S.; Williams, Ian D. (agosto de 2000). «HMPA Promotes Retro-Aldol Reaction, Resulting in Syn-Selective Addition of Lithiated 1-Naphthylacetonitrile to Aromatic Aldehydes». Org. Lett. (Am. Chem. Soc.) 2 (16): 2443-2445. doi:10.1021/ol006099w.
- ↑ a b c Brown, Herbert C.; Dhar, R. K.; Bakshi, R. K.; Pandiarajan, P. K.; Singaram, B. (1989). «Major effect of the leaving group in dialkylboron chlorides and triflates in controlling the stereospecific conversion of ketones into either E- or Z-enol borinates». J. Am. Chem. Soc. 111: 3441-3442. doi:10.1021/ja00191a058.
- ↑ Gilham, P. T.; Khorana, H. G. (1958). «Studies on Polynucleotides. I. A New and General Method for the Chemical Synthesis of the C5″-C3″ Internucleotidic Linkage. Syntheses of Deoxyribo-dinucleotides». J. Am. Chem. Soc. 80: 6212. doi:10.1021/ja01556a016.
