Organofosforado
Un compuesto organofosforado o compuesto de organofósforo es un compuesto orgánico degradable que contiene enlaces fósforo-carbono (excepto los ésteres de fosfato y fosfito), utilizados principalmente en el control de plagas como alternativa a los hidrocarburos clorados que persisten en el ambiente. La química de los organofosforados es la ciencia que estudia las propiedades y la reactividad de los compuestos organofosforados. El fósforo comparte el grupo 15 de la tabla periódica con el nitrógeno y otros elementos. Los compuestos de nitrógeno y los compuestos de fósforo son un tanto similares.[1][2][3]
La definición de los compuestos organofosforados es variable, lo que puede llevar a confusión. En química industrial y ambiental, un compuesto organofosforado necesita contener solamente un sustituyente orgánico, pero no necesita tener un enlace directo P-C. Así la mayoría de los insecticidas, como por ejemplo el malatión, se incluyen a menudo en esta clase de compuestos.
Estado de oxidación, número de coordinación y valencia
[editar]Para ayudar a establecer los enlaces de un átomo de fósforo en un compuesto organofosforado se emplean tres números.
| NC | Símbolos | Fórmula general | Grupo de compuestos[4] |
|---|---|---|---|
| 1 | σ11n | R—P | Fosfinidenos |
| 1 | σ1λ3 | R—CP | Fosfoalquinos |
| 2 | σ2λ3 | R2C=P—R | Fosfoalquenos |
| 2 | σ2λ3 | RO—P=O | Oxofosfinos |
| 2 | σ2λ3 | R—P=S | Tioxofosfinos |
| 2 | σ2λ3 | R—N=P | Iminofosfinos |
| 2 | σ2λ3 | R—P=P—R | Difosfenos |
| 2 | σ2λ2 | R2P+ | Catión fosfenio |
| 3 | σ3λ3 | R3P | Fosfinas |
| 3 | σ3λ3 | R—PX2 | Dihaluro alquilfosfonoso |
| 3 | σ3λ3 | R2P—X | Haluro de dialquilfosfino |
| 3 | σ3λ3 | R—P(OR)2 | Dialquilfosfonito |
| 3 | σ3λ3 | (RO)3P | Trialquilfosfito |
| 3 | σ3λ5 | R—PO2 | Dioxofosforanos |
| 3 | σ3λ5 | RO—PO2 | Alquilmetafosfato |
| 3 | σ3λ5 | R—P(O)(=CH2) | Metilenoxofosforano |
| 3 | σ3λ5 | R—P(=CR2)2 | Bis(metilen)fosforano |
| 4 | σ4λ4 | R4P+ | Ion fosfonio |
| 4 | σ4λ5 | R—P(O)(OH)2 | Ácido fosfónico |
| 4 | σ4λ5 | R2—P(O)(OH) | Ácido fosfínico |
| 4 | σ4λ5 | R3—P(O) | Óxido de fosfina |
| 4 | σ4λ5 | RO—P(O)(OH)2 | alquilfosfato |
| 4 | σ4λ5 | (RO)2P(O)(OH) | dialquilfosfato |
| 4 | σ4λ5 | (RO)3P(O) | trialquilfosfato |
| 5 | σ5λ5 | R5P | fosforanos |
| 6 | σ6λ6 | R6P- | Sin nombre común |
Estado de oxidación o número de oxidación: En un modelo de enlace iónico, es la carga iónica que queda en cada átomo después de aplicar unas reglas[5] que asignan los pares de electrones compartidos a los átomos más electronegativos.[6] El fósforo puede adoptar diversos estados de oxidación, y es nabitual clasificar a los compuestos organofosforados sobre la base de que sean derivados del fósforo (V) o del fósforo (III), que son las clases predominantes de compuestos de fósforo.
En la nomenclatura de sustitución de la IUPAC, una nomenclatura descriptiva que aún es poco utilizada, para nombrar los compuestos de fósforo y otros elementos que no presentan el número de enlace estándar se emplean la convención λ (lambda).[7] Junto a ella se emplea el número de coordinación σ.
El número de coordinación, que se representa por las letras griegas sigma σ con un superíndice, es el número de átomos a los que está directamente enlazado el átomo central, o el número de enlaces σ que forma el átomo central.[4] El número de coordinación δ del fósforo puede variar entre 1 y 6.
En la convención lambda, el número total de enlaces n entre un elemento y sus átomos vecinos se indica como λn, llamado valencia λ. El símbolo λ5-fosfano indica que el fósforo se enlaza con cinco hidrógenos, es decir, el símbolo λ se utiliza para indicar que el fósforo presenta un estado de valencia no estándar (el estándar es 3) y el superíndice indica cinco enlaces con hidrógeno.
En este sistema, la fosfina o fosfano es un compuesto σ3λ3. En un compuesto σmλn, el átomo de fósforo está unido a m átomos mediante un total de n enlaces.
Una clasificación de los compuestos organofosforados, según el número de coordinación
[editar]En la tabla de la derecha se muestran diversos grupos de compuestos organofosforados, según su diferente número de coordinación (NC) y sus valencias lambda, λ.
Oxoácidos fundamentales mononucleares de fósforo
[editar]| Fórmula | Nombre químico | Derivados orgánicos |
|---|---|---|
| (HO)3P | Ácido fosforoso | fosfitos |
| (HO)2HP | Ácido fosfonoso | fosfonitos |
| (HO)H2P | Ácido fosfinoso | fosfinitos |
| (HO)PO | Ácido metafosforoso o fosfenoso | metafosfitos |
| (HO)3PO | Ácido fosfórico | fosfatos |
| (HO)2HPO | Ácido fosfónico | fosfonatos |
| (HO)H2PO | Ácido fosfínico o hipofosforoso | fosfinatos |
| (HO)PO2 | Ácido metafosfórico o fosfénico | metafosfatos |
Tautomería de los H-organofosforados
[editar]Los H-organofosforados son aquellos organofosforados con un átomo de hidrógeno directamente unido al átomo central de fósforo. Ese enlace P-H tiene unas propiedades químicas especiales. El primer grupo más estudiado de esta familia son los fosfitos, en los que aunque al principio se creyó que existían principalmente en formas tautoméricas fosfito, en las que el átomo central es trivalente, hace décadas que está bien establecido que la gran mayoría de estos compuestos prefieren estructuras tipo H-fosfonato con átomos de fósforo pentavalente:[8]


Los espectros infrarrojos para todos, salvo uno, de los organofosforados de dialquilo conocidos, muestran fuertes absorciones correspondientes a los estiramientos de los enlaces P=O y P-H y, excepto para R=R'=OH, ¡no muestran evidencia alguna de estiramientos OH característicos! Solo el compuesto bis(trifluorometil) (R=R'=CF3) está actualmente demostrado para existir como tautómero fosfito.[9]
A pesar de que los tautómeros oxiácidos [2] de todos los demás fosfonatos (R= R'= alcoxi), fosfinatos (R= alcoxi; R'= alquilo, arilo) y óxidos de fosfina secundarios (R=R'= alquilo, arilo) nunca se han observado directamente, muchos mecanismos de reacción requieren de la tautomerización, 1 ↔ 2, que a menudo han aparecido en la literatura química. Por ejemplo, mientras que las sales de metal alcalino y plata de los diaquilfosfonatos no muestran una banda de estiramiento P=O en el infrarrojo, lo que indica que en realidad son derivados del ácido fosforoso, su preparación a partir de los correspondientes diaquilfosfonatos (el primer paso en la reacción de Michaelis-Becker) requiere la intervención del tautómero oxiácido inestable.[10][11]
Compuestos organofosforados de fósforo(V)
[editar]Ésteres de fosfato y amidas
[editar]Los ésteres fosfóricos o ésteres fosfato tienen la estructura general P(=O)(O)3 en la que el fósforo tiene estado de oxidación 5+, P (V). Estas especies son de gran importancia tecnológica como agentes ignífugos y plastificantes. A falta de un enlace P-C, estos compuestos no son técnicamente compuestos organofosforados, sino ésteres del ácido fosfórico. En la naturaleza se encuentran muchos derivados, como la fosfatidilcolina. Los ésteres fosfóricos son sintetizados por alcohólisis de oxicloruro de fósforo. También se conoce una variedad de derivados mixtos amido-alcoxo, por ejemplo la ciclofosfamida que es un medicamento de importancia médica contra el cáncer. También los derivados que contienen el grupo tiofosforilo (P=S) entre los que se encuentra el pesticida malatión. Los organofosforados preparados a mayor escala son los ditiofosfatos de zinc, un aditivo para aceite de motor. Varios millones de kilogramos de este complejo de coordinación se producen anualmente por la reacción de alcoholes con pentasulfuro de fósforo.[12]

En el medio ambiente, estos compuestos se degradan por hidrólisis para producir finalmente el fosfato y el alcohol o la amina orgánica de la que se derivan.
Ácidos fosfónico, fosfínico y sus ésteres
[editar]Los fosfonatos son ésteres del ácido fosfórico y tienen la fórmula general RP(=O)(O)2. Los fosfonatos tienen muchas aplicaciones técnicas, como por ejemplo, el glifosato, más conocido como Roundup, un herbicida. Con la fórmula (HO)2P(O)CH2NHCH2CO2H, este derivado de la glicina es uno de los herbicidas más utilizados. Los bifosfonatos (a veces llamados bisfosfonatos, denominación correcta de la IUPAC) son una clase de fármacos para tratar la osteoporosis.[13] El gas nervioso agente sarín, que contiene los enlaces C-P y F-P, es un fosfonato.
Los fosfinatos con dos enlaces C-P, tienen la fórmula general R2P(=O)(O). Un miembro comercialmente significativo es el herbicida glufosinato. Similar al glifosato que se mencionó anteriormente, tiene la estructura CH3P(O)(OH)CH2CH2CH(NH2)CO2H.

La reacción de Michaelis-Arbuzov es el principal método para la síntesis de estos compuestos. Por ejemplo, el dimetilmetilfosfonato (ver figura anterior) surge de la reorganización de trimetilfosfito, que es catalizada por el yoduro de metilo. En la reacción de Horner-Wadsworth-Emmons y en la homologación de Seyferth-Gilbert, los fosfonatos se utilizan en reacciones con compuestos carbonilo. La reacción de Kabachnik-Campos es un método para la preparación de aminofosfonatos. Estos compuestos contienen un enlace muy inerte entre el fósforo y el carbono. En consecuencia, se hidrolizan para dar derivados del ácido fosfónico y fosfínico, pero no fosfato.
Óxidos de fosfina y compuestos relacionados con enlace P-N
[editar]Los óxidos de fosfina (designación δ3λ3) tienen la estructura general R3P=O con estado de oxidación formal 5+, P (V). Los óxidos de fosfina forman enlaces de hidrógeno y algunos, por lo tanto, son solubles en agua. El enlace P=O es muy polar con un momento dipolar de 4.51 D para el óxido de trifenilfosfina. Compuestos relacionados con los óxidos de fosfina son las imidas (R3PNR') y calcogenuros relacionados (R3PE, donde E= S, Se, Te). Estos compuestos son algunos de los compuestos organofosforados térmicamente más estables, pero pocos son útiles en cantidades significativas.
Sales de fosfonio y fosforanos
[editar]Las sales de fosfonio poseen la fórmula [PR4+]X- pues incluyen el ion fosfonio, R4P+. Estas especies son compuestos tetraédricos de fósforo (V). Desde el punto de vista comercial, el miembro más importante es cloruro de tetrakis(hidroximetil)fosfonio, [P(CH2OH)4]Cl, que se utiliza como retardante del fuego en el sector textil. Aproximadamente 2 millones de kg se producen anualmente de este cloruro y del sulfato de ese catión.[12] Se obtienen por reacción de fosfinas con formaldehído en presencia de un ácido mineral:
- PH3 + HX + 4 CH2O → [P(CH2OH)4+]X-
Una gran variedad de sales de fosfonio se pueden preparar por alquilación y arilación de organofosfinas:
- PR3 + R'X → [PR3R'+]X-
La metilación de trifenilfosfina es el primer paso en la preparación del reactivo de Wittig.

El fosforano padre (δ5λ5) es PH5 y no es conocido. Son bastante comunes otros compuestos relacionados conteniendo halogenuros y otros sustituyentes orgánicos de fósforo. Aquellos derivados con cinco sustituyentes orgánicos son raros, aunque es conocido P(C6H5)5, que deriva del tetrafenilfosfonio, P(C6H5)4, por reacción con fenillitio.
Los iluros de fósforo son fosforanos insaturados, conocidos como reactivos de Wittig, por ejemplo, CH2P(C6H5)3. Estos compuestos derivan del fósforo tetraédrico (V) y se consideran relacionados de los óxidos de fosfina. También se derivan de las sales de fosfonio, pero por desprotonación, no por alquilación.
Compuestos organofosforados de fósforo(III)
[editar]Fosfitos, fosfonitos y fosfinitos
[editar]Los fosfitos, a veces llamados ésteres fosforosos o ésteres de fosfito, tienen la estructura general P(OR)3, presentando el fósforo un estado de oxidación +3, P(III). Estas especies derivan de la alcohólisis del tricloruro de fósforo:
- PCl3 + 3 ROH → P(OR)3 + 3 HCl
La reacción es general, por lo que se conocen un gran número de especies. Los fosfitos se emplean en la reacción de Perkow y la reacción de Michaelis-Arbuzov. También sirven como ligandos en la química organometálica.
También existen compuestos intermedios entre los fosfitos y las fosfinas: son los fosfonitos, P(OR)2R'), y los fosfinitos, P(OR)R'2. Estas especies se obtienen a partir de reacciones de alcohólisis de los correspondientes cloruros fosfonoso y fosfínoso, PClR'2 y PCl2R' respectivamente).
Fosfinas
[editar]El principal compuesto de la fosfinas es PH3, llamado fosfina, aunque su nombre aconsejado por la IUPAC es fosfano.[14] La sustitución de uno o más átomos de hidrógeno por un sustituyente orgánico (alquilo, arilo), forma una organofosfina, PH3−xRx, generalmente llamada también fosfina.

.
Comparación entre fosfinas y aminas
[editar]

El átomo de fósforo en las fosfinas tiene un estado de oxidación formal de -3 (δ3 λ3; unido a tres átomos mediante tres enlaces sencillos</ sup>), por lo que el fósforo es análogo al nitrógeno en las aminas. Al igual que las aminas, las fosfinas tienen una geometría molecular piramidal trigonal, aunque habitualmente con ángulos C-E-C más pequeños (E = N, P), al menos en ausencia de efectos estéricos. El ángulo de enlace C-P-C es de 98,6° para la trimetilfosfina, aumentando hasta 109,7° cuando los grupos metilo se sustituyen por grupos terc-butilo. Cuando se utiliza como ligando, el volumen estérico de las fosfinas terciarias se evalúa por su ángulo del cono. La barrera a la inversión es mucho mayor que en las aminas para que se produzca un proceso como la inversión de nitrógeno, y por lo tanto las fosfinas con tres sustituyentes diferentes se pueden separar en isómeros ópticos térmicamente estables. Las fosfinas son menos básicas que las aminas correspondientes, por ejemplo, el ion fosfonio en sí tiene un pKa de -14 en comparación con 9,21 para el ion amonio; el trimetilfosfonio tiene un pKa de 8,65 frente a 9,76 para la trimetilamina. Sin embargo, la trifenilfosfina (pKa = 2.73) es más básica que la trifenilamina (pKa = -5), principalmente debido a que el par solitario del nitrógeno en NPh3 está parcialmente deslocalizado en los tres anillos de fenilo. Considerando que el par solitario del nitrógeno está deslocalizado en el pirrol, sin embargo, el par solitario en el átomo de fósforo en el equivalente de fósforo del pirrol (llamado fosfol) no lo está. La reactividad de las fosfinas coincide con la de las aminas en relación con su nucleofilicidad en la formación de sales de fosfonio con la estructura general PR4 +X -. Esta propiedad se utiliza en la reacción de Appel para la conversión de alcoholes en halogenuros de alquilos. Las fosfinas son oxidadas fácilmente a su correspondiente óxidos de fosfina, mientras que los óxidos de amina son generados menos fácilmente. En parte por esta razón, las fosfinas muy rara vez se encuentran en la naturaleza.
Formas de obtención
[editar]Desde el punto de vista comercial, la fosfina más importante es la trifenilfosfina, de la que se producen anualmente varios millones de kilogramos. Se prepara a partir de la reacción del clorobenceno, C6H5-Cl o Ph-Cl, con magnesio en presencia de PCl3.[12]
PhCl + Mg -> PhMgCl
3 PhMgCl + PCl3 -> PPh3 + 3 MgCl2
Las fosfinas de carácter más especializado se preparan generalmente por otras vías. Los haluros de fósforo sufren desplazamiento nucleófilo por parte de los reactivos organometálicos como los reactivos de Grignard. Por el contrario, en algunas síntesis están implicados desplazamientos nucleofílicos de equivalentes del anión fosfuro ("R2P-") por haluros de arilo o de alquilo.
Las fosfinas primarias (RPH2) y secundarias (RR'PH y R2PH) sufren reacciones de adición a alquenos en presencia de una base fuerte (por ejemplo, KOH en DMSO). Se aplica la regla de Markovnikov. Reacciones similares se producen con la participación de alquinos.[15] No es necesario el medio básico para alquenos deficientes de electrones (por ejemplo, los derivados de acrilonitrilo) y para alquinos.
En condiciones libres de radicales, los enlaces P-H de las fosfinas primarias y secundarias se añaden a los alquenos. Estas reacciones cumplen la regla de antiMarkovnikov. Como iniciadores se utilizan AIBN o peróxidos orgánicos. Los óxidos y sulfuros de fosfinas terciarias se pueden reducir con clorosilanos y otros reactivos.
Reacciones
[editar]Los tipos principales de reacción de las fosfinas son como nucleófilos y como bases. Su nucleofilicidad se pone en evidencia por sus reacciones con halogenuros de alquilo para dar las sales de fosfonio. Las fosfinas son catalizadores nucleofílicos en la dimerización de enonas en diversas reacciones de síntesis orgánica, por ejemplo, la reacción de Rauhut-Currier.
Las fosfinas son agentes reductores, como se ilustra en la reducción de Staudinger que convierte las azidas en aminas, y en la reacción de Mitsunobu para la conversión de alcoholes en ésteres. En estos procesos la fosfina se oxida dando óxido de fosfina. Las fsfinas también pueden reducir a los grupos carbonilo activados, por ejemplo, la reducción de un α-cetoéster a un α-hidroxiéster según se aprecia en el esquema 2.[16] En el mecanismo de reacción propuesto, el primer ion hidrógeno es cedido por el grupo metilo de la trifenilfosfina (la trifenilfosfina no reacciona).

Ligandos fosfina
[editar]| Nombre y estructura molecular de algunos ligandos fosfina | |||
| sPhos | 
|
SPANphos | 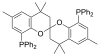
|
| SEGphos | 
|
Triphos | |
| Xantphos | 
|
XPhos | 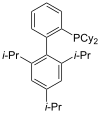
|
| Chiraphos | 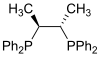
|
duPhos | 
|
Las fosfinas como por ejemplo la trimetilfosfina son importantes ligandos en la química organometálica. Debido principalmente a la utilidad de la síntesis asimétrica, se han popularizado algunas variedades de difosfina quiral, como BINAP y DIPAMP. Todas ellas reciben, incluyendo las difosfinas, reciben el nombre de ligandos fosfina (en inglés, phos ligands)
Fosfinas primarias y secundarias
[editar]
Además de las otras reacciones asociadas con fosfinas, los grupos que llevan P-H presentan reactividad adicional asociada a los enlaces P-H. Son fácilmente desprotonados por bases fuertes para dar aniones fosfuro. Las fosfinas primarias y secundarias se preparan generalmente por reducción de haluros de fósforo o ésteres relacionados. Por ejemplo, los fosfonatos se reducen a fosfinas primarias:[17]
La estabilidad se atribuye a la conjugación entre el anillo aromático y el par solitario del fósforo.
Fosfoalquenos y fosfoalquinos
[editar]Los compuestos de carbono con fósforo (III) formando enlaces múltiples se llaman fosfoalquenos, (R2C=P-R), y fosfoalquinos, (RCPR). En el compuesto llamado fosforina, un grupo H-C en el benceno se sustituye por un átomo de fósforo. Las especies de este tipo son relativamente raras pero aun así son de interés para los investigadores. Un método general para la síntesis de fosfoalquenos es la 1,2-eliminación de los precursores adecuados, iniciada térmicamente o por bases como la DBU, DABCO o trietilamina:
La termólisis de dimetilfosfina, Me2PH, genera el fosfoalqueno defórmula CH2 = PMe, una especie inestable en la fase condensada.
Compuestos organofosforados de fósforo (0), (I) y (II)
[editar]Los compuestos de fósforo, donde el estado de oxidación formal es menos de III son raros, pero se conocen ejemplos de cada clase. Unos ejemplos de compuestos organofosforados de fósforo (0) son los aductos del carbeno, como [P(NHC)]2, donde NHC es un carbeno N-heterocíclico. [9] Los compuestos de fósforo (I) y (II) tienen las fórmulas (RP)n (R2P)2, respectivamente, y se generan por reducción de los cloruros organofosforados de fósforo (III) relacionados:
Los difosfenos, con la fórmula general R2P2, formalmente contienen dobles enlaces fósforo=fósforo. Estas especies con fósforo (I) son raras, pero son estables, siempre que los sustituyentes orgánicos sean lo suficientemente grandes para evitar encadenamiento.
Se conocen también muchos compuestos de valencia mixta, por ejemplo, el compuesto en forma de jaula, P7(CH3)3.
Véase también
[editar]Enlaces externos
[editar]- Química de los organofosforados @ users.ox.ac.uk; @ www.chem.wisc.edu
- Predictor RMN para desplazamientos químicos de compuestos organofosforados, de Alan Brisdon's Research Group Enlace
- Compuestos orqanofosforados anticolinesterasa (COFA)[18]
Enlaces químicos del carbono con el resto de átomos
[editar]| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Química orgánica básica. | Muchos usos en Química. |
| Investigación académica, pero no un amplio uso. |
Enlace desconocido / no evaluado. |
Véase también
[editar]Referencias
[editar]- ↑ Dillon, K. B.; Mathey, F.; Nixon, J. F. Phosphorus. The Carbon Copy; John Wiley & Sons, 1997. ISBN 0-471-97360-2
- ↑ Quin, L. D. A Guide to Organophosphorus Chemistry; John Wiley & Sons, 2000. ISBN 0-471-31824-8
- ↑ Racke, K.D., 1992. Degradation of organophosphorus insecticides in environmental matrices. In: Chambers, J.E., Levi, P.E. (Eds.), Organophosphates: Chemistry, Fate, and Effects. Academic Press, San Diego, pp. 47–73.
- ↑ a b A guide to organophosphorus chemistry. Louis D. Quin. Wiley-IEEE, 2000. ISBN 0471318248 Pág. 8
- ↑ Principios básicos de química. Harry B. Gray, Gilbert P. Haight. Editorial Reverteé, 1981. ISBN 8429172009 Pág. 5.9
- ↑ Química organometálica de los metales de transición. Robert H. Crabtree. Ediciones de la Universitat Jaume I, 1997. ISBN 8480211342 Pág. 55
- ↑ Convenciones kappa, lambda y delta. Archivado el 10 de junio de 2015 en Wayback Machine. Jesús Marcos Segura. Química e Industria de la Asociación Nacional de Químicos de España. 554, julio-agosto, 22-28, 2004.
- ↑ W. J. Pietro; W. J. Hehre (1982). «Tautomerization of dimethyl phosphonate». J. Am. Chem. Soc 104 (13): 3594-3595. doi:10.1021/ja00377a009.
- ↑ J. E. Griffiths; A. B. Burg (1960). «THE PHOSPHINOUS ACID (CF3)2POH AND THE DIPHOSPHOXANE (CF3)2POP(CF3)2». J. Am. Chem. Soc 82 (6): 1507-1508. doi:10.1021/ja01491a062.
- ↑ G. O. Doak; L. D. Freedman (1961). «The Structure and Properties of the Dialkyl Phosphonates». Chem. Rev. 61 (1): 31-44. doi:10.1021/cr60209a002.
- ↑ Frank R. Hartley (1996). The Chemistry of Organophosphorus Compounds: Ter- and Quinque-Valent Phosphorus Acids and Their Derivatives (Patai's Chemistry of Functional Groups). Wiley. ISBN 978-0471957065.
- ↑ a b c Jürgen Svara, Norbert Weferling, Thomas Hofmann “Phosphorus Compounds, Organic” in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006. doi 10.1002/14356007.a19_545.pub2
- ↑ Bifosfonatos y osteoporosis posmenopáusica. Joaquín Calaf Alsina. Scientific Communication Management, 2003. ISBN 8475926673 144 páginas
- ↑ Gold Book IUPAC: Link
- ↑ Arbuzova, S. N.; Gusarova, N. K.; Trofimov, B. A. "Nucleophilic and free-radical additions of phosphines and phosphine chalcogenides to alkenes and alkynes." Arkivoc 2006, part v, 12–36 (EL-1761AR). Article Archivado el 7 de febrero de 2008 en Wayback Machine.
- ↑ Zhang, W.; Shi, M. "Reduction of activated carbonyl groups by alkyl phosphines: formation of α-hydroxy esters and ketones." Chem. Commun. 2006, 1218–1220. doi 10.1039/b516467b
- ↑ Taming a Functional Group: Creating Air-Stable, Chiral Primary Phosphanes Rachel M. Hiney, Lee J. Higham, Helge Müller-Bunz, Declan G. Gilheany Angewandte Chemie International Edition Volume 45, Issue 43, Pages 7248 - 7251 2006 doi 10.1002/anie.200602143
- ↑ Evangelista, Marcela (7 de febrero de 2004). «Compuestos orqanofosforados anticolinesterasa (COFA)». sertox.com.ar. Archivado desde el original el 27 de febrero de 2017. Consultado el 19 de diciembre de 16.



