Ácido fosfórico
| Ácido fosfórico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ácido tetraoxofosfórico (V) | ||
| General | ||
| Otros nombres |
Ácido ortofosfórico Tetraoxofosfato (V) de hidrógeno | |
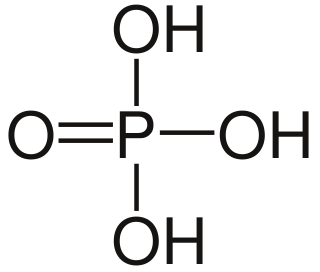
| Fórmula estructural | Ver imagen | |
| Fórmula molecular | H3PO4 | |
| Identificadores | ||
| Número CAS | 7664-38-2[1] | |
| Número RTECS | TB6300000 | |
| ChEBI | 26078 | |
| ChEMBL | CHEMBL1187 | |
| ChemSpider | 979 | |
| DrugBank | DB09394 | |
| PubChem | 22486802 1004, 22486802 | |
| UNII | E4GA8884NN | |
| KEGG | C00009 D05467, C00009 | |
| Propiedades físicas | ||
| Densidad | 1685 kg/m³; 1,685 g/cm³ | |
| Masa molar | 98 g/mol | |
| Punto de fusión | 315 K (42 °C) | |
| Punto de ebullición | 431 K (158 °C) | |
| Presión crítica | Q atm | |
| Propiedades químicas | ||
| Acidez | 2.12, 7.21, 12.67 pKa | |
| Solubilidad en agua | Miscible | |
| Peligrosidad | ||
| SGA |
 | |
| NFPA 704 |
0
2
0
COR
| |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido fosfórico (a veces llamado ácido ortofosfórico) es un compuesto químico ácido (más precisamente un compuesto ternario que pertenece a la categoría de los oxácidos) de fórmula H3PO4.[2] Es un ortofosfato cuyo código en el Sistema Internacional de Numeración es E-338. No se debe usar agua para eliminar este químico, puesto que esta produce su activación.
Propiedades químicas
El anión asociado al ácido fosfórico se llama ion fosfato, muy importante en la biología, especialmente en los compuestos derivados de los azúcares fosforilados, como el ADN, el ARN y la adenosina trifosfato (ATP).
En su forma pura, este ácido es un sólido cristalino de color blanco, higroscópico y delicuescente. Con mayor frecuencia, el ácido fosfórico se almacena y distribuye en solución: en esta presentación, tiene un aspecto líquido transparente, ligeramente amarillento.
Se obtiene mediante el tratamiento de rocas de fosfato de calcio con ácido sulfúrico, filtrando posteriormente el líquido resultante para extraer el sulfato de calcio. Otro modo de obtención consiste en quemar vapores de fósforo y tratar el óxido resultante con vapor de agua.
El ácido fosfórico es un ácido triprótico. Esto significa que puede disociarse en agua hasta tres veces, liberando cada vez un protón al agua como se muestra en las siguientes reacciones:
- H3PO4(s) + H2O(l)
 H3O+(aq) + H2PO4−(aq) Ka1= 7.25×10−3 [pKa1 = 2,14]
H3O+(aq) + H2PO4−(aq) Ka1= 7.25×10−3 [pKa1 = 2,14] - H2PO4−(aq)+ H2O(l)
 H3O+(aq) + HPO42−(aq) Ka2= 6.31×10−8 [pKa2 = 7,2]
H3O+(aq) + HPO42−(aq) Ka2= 6.31×10−8 [pKa2 = 7,2] - HPO42−(aq)+ H2O(l)
 H3O+(aq) + PO43−(aq) Ka3= 3.98×10−13 [pKa3 = 12,4]
H3O+(aq) + PO43−(aq) Ka3= 3.98×10−13 [pKa3 = 12,4]
Usos
El ácido no es muy útil en el laboratorio debido a su resistencia a la oxidación, a la reducción y a la evaporación. Entre otras aplicaciones, el ácido fosfórico se emplea como ingrediente de bebidas no alcohólicas como por ejemplo de las gaseosas (aditivo alimentario E-338), de un modo particular en las de tipo cola; como elemento acondicionador de la superficie del esmalte dental, pues al desmineralizar la superficie del mismo crea microretenciones en su estructura lo cual facilita la adhesión de los materiales de restauración dental ; como catalizador, en metales inoxidables[cita requerida] y para fosfatos que se utilizan como ablandadores de agua, fertilizantes y detergentes. Muy utilizado en laboratorios químicos en la preparación de disoluciones tampón o reguladoras del pH.
La neutralización del ácido fosfórico con el amoniaco produce Fosfato Monoamónico (MAP), un fertilizante complejo altamente concentrado que contiene nitrógeno y fósforo aprovechable.[3] También se usa para mezclar con aceite urea, brea, betún, piedrilla con arena para crear asfalto para pavimento en suelos de carreteras y reparaciones de roturas en suelo con solo agregar agua para activar, derretir el asfalto y compactar con una aplanadora.[cita requerida]
Propiedades físicas
- Densidad relativa (agua = 1): 1,68
- Solubilidad en agua: Muy elevada
- Presión de vapor a 20 °C: 4 Pa
- Densidad relativa de vapor (aire = 1): 3,4
- Masa Molar: 97,995182 [g/mol]
Véase también
Referencias
- ↑ Número CAS
- ↑ Äcido fosfórico, también llamado ácido ortofosfórico
- ↑ «Copia archivada». Archivado desde el original el 18 de enero de 2012. Consultado el 27 de febrero de 2012.

