Diferencia entre revisiones de «CRISPR»
Página creada con «File:CRISPR_español.png|thumb|500px|right|Diagrama del posible mecanismo de los CRISPR.<ref name= Horvath><span class="citation journal">Horvath, P.; Barrangou, R. (2010...» |
(Sin diferencias)
|
Revisión del 17:19 2 mar 2015
Los CRISPRs (en inglés: clustered regularly interspaced short palindromic repeats, o bien, repetidos cortos palindrómicos aglomerados regularmente interespaciados) son locus de ADN que contienen repeticiones cortas de secuencias de bases. Después de cada repetición hay segmentos cortos de "ADN espaciador" proveniente de exposiciones previas a un virus.[2]
Los CRISPRs se encuentran en aproximadamente el 40% de los genomas bacterianos secuenciados y el 90% de los genomas de las arqueas secuenciadas. [3] [4]
Los CRISPRs son frecuentemente asociados con los genes cas que codifican para proteínas relacionadas a los CRISPRs. El sistema CRISPR/Cas es un sistema inmune procariótico que confiere resistencia a elementos genéticos externos como plásmidos y fagos [5] [6] y provee una forma de inmunidad adquirida. Los espaciadores de los CRISPR reconocen y cortan esos elementos génicos exógenos en una manera análoga al ARNi en sistemas eucarióticos.[2]
Desde el 2013, el sistema CRISPR/Cas se ha utilizado para la edición de genes (agregando, interrumpiendo o cambiando las secuencias de genes específicos) y la regulación génica a lo largo de las especies vivas.[7] Al administrar la proteína Cas9 y los RNA guía apropiado a una célula, el genoma del organismo puede ser cortado en cualquier lugar deseado.
Puede ser posible usar a los CRISPRs para construir sistemas de entrega de genes guiados por ARN que sean capaces de alterar los genomas de poblaciones enteras.[8]
Historia
Las bacterias pueden incorporar DNA externo en otras circunstancias e incluso pueden tomar ADN dañado de su medio.[9]
Los repetidos fueron descritos por primera vez en 1987 en la bacteria Escherichia coli.[10] En el año 2000, repetidos aglomerados similares fueron identificados en otras bacterias y arqueas y fueron nombrados repetidos cortos regularmente espaciados: Short Regularly Spaced Repeats (SRSR).[11] Se les cambió el nombre a los SRSR a CRISPR in 2002.[12] Fue encontrado que un conjunto de genes, algunos de los cuales codifican nucleasas o helicasas putativas, estaba asociado a los repetidos CRISPR (los genes cas o asociados a CRISPR).[12]

En el 2005, tres grupos de investigación independientes mostraron que algunos de los espaciadores de los CRISPRs se derivan de diversas fuentes de ADN como ADN de fagos y ADN extracromosomal como los plásmidos.[13][14][15] Esas observaciones clave indican que el sistema CRISPR/cas puede tener un rol en la inmunidad adaptativa en bacterias.[1] Koonin y sus asociados[16] propusieron que los espaciadores sirven como plantilla para moléculas de ARN, análogo a un sistema que usan los eucariontes llamado interferencia por ARN.
En 2007 Barrangou, Horvath (científicos de la industria alimenticia en Danisco) y el grupo de Moineau en la Université Laval (Canadá) mostaron que podían alterar la resistencia de Streptococcus thermophilus a atques de fagos con ADN espaciador.[16]
Doudna y Charpentier habían estado explorando de manera independiente a las proteínas asociadas a CRISPRpara aprender cómo las bacterias utilizan a los espaciadores en sus sistemas inmunes. Juntos, estudiaron un sistema CRISPR más simple que se basa en una proteína llamada Cas9. Encontraron que las bacterias responden ante un fago invasor al transcribir espaciadores y ADN palindrómico en una larga molécula de ARN y que entonces la célula utilizaba a un ARN llamado Trans-activating crRNA (tracrRNA) y a Cas9 para cortarla en pedazos llamados ARNcr.[16]
Cas9 es una nucleasa, una enzima especializada en cortar ADN, con dos sitios de corte activos (HNH and RuvC), uno para cada hebra de la doble hélice. El equipo demostró que podrían desactivar uno o ambos sitios preservando la habilidad de Cas9 de ser específico para su ADN objetivo. Jinek combinó al tracrRNA y ARN espaciador para formar una molécula llamada "single-guide RNA" que, al combinarse con Cas9, podía encontrar y cortar los blancos correctos de ADN. Jinek propuso que estos ARN guía sintéticos podrían usarse para la edición de genes.[16]
La primera vez que se mostró que CRISPR funcionaba como una herramienta de ingeniería de genoma en cultivos de células humanas fue en 2012.[17][18] Desde entonces se ha utilizado en muchos organismos incluyendo a la levadura del pan (S. cerevisiae),[19] pez cebra (D. rerio),[20] moscas(D. melanogaster),[21] nemátodos (C. elegans),[22] plantas,[23] ratones,[24] entre otros.
Adicionalmente CRISPR ha sido modificada para hacer factores de transcripción programables que permiten a los científicos silenciar o activar ciertos genes.[25]
Existen ahora librerías con decenas de miles de ARN guía.[16]
La primera evidencia de que CRISPR puede revertir síntomas de enfermedad en organismos vivos fue demostrada en marzo de 2014, cuando investigadores del MIT curaron a ratones de desórdenes genéticos de hígado. [26]
Predecesores para edición génica
Al inicio de la década de los 2000, investigadores desarrollaron las nucleasas con dedos de zinc, proteínas sintéticas cuyoas regiones de unión a ADN les permitían cortar el ADN en puntos específicos. Después, las nucleasas sintéticas llamadas TALENs dieron una vía más sencilla para llegar a ADN específico y se predijo que sobrepasarían a los dedos de zinc. Ambas dependen en hacer proteínas específicas para cada ADN objetivo, un procedimiento bastante más complicado que los ARN guía. Los CRISPRs son más eficientes y pueden llegar a más genes que ambas técnicas.[27]
Estrucura del locus
Repetidos y espaciadores
Los locus de CRISPR van de 24 a 48 pares de bases.[28] Usualmente muestran algún grado de estructura palindrómica implicando la formación de una estructura secundaria de ácidos nucleicos como los stem-loop y los hairpin, pero no son palindrómicas del todo.[29] Los repetidos están separados pr espaciadores de longitud similar.[28] Algunas secuencias espaciadoras de CRISPR son complemetarias a aquellas de los plásmidos y fagos,[13][14][15] aunque algunos espaciadores se complementan con el genoma procarionte (espaciadores autoreplicativos).[13][30] Pueden añadirse rápidamente espaciadores nuevos como resuesta a una infección por un fago.[31]
Genes cas y subtipos de CRISPR
Los genes asociados a CRISPR, los genes cas, son genes frecuentemente son relacionados con los arreglos de repetidos CRISPR. Análisis extensivos de genómica comparativa han identificado a muchos genes cas diferentes; un análisis inicial de 40 genomas de bacterias y arqueas sugirió que podría haver 45 familias de genes cas, con sólo dos genes, cas1 y cas2, siendo omnipresentes. [28] El sistema actual de clasificación de CRISPR agrupa a los operones en cas en tres grupos mayores, cada uno con múltiples subdivisiones basadas en filogenia de cas1 y en el complemento del operón del gen cas.[32] Apartde de cas1 y cas2, las tres divisiones mayores tienen conjuntos muy diferentes de genes constitutivos, con cada una de las divisiones conteniendo un ‘gen característico’ encontrado exclusivamente en esa subdivisión. Muchos organismos contienen múltiples sistemas CRISPR-Cas sugiriendo que son compatibles e inclusive podrían compartir elementos.[33][34] La distribución esporádica de los subtipos de CRISPR/Cas sugiere que el sistema está sujeto a la transferencia genética horizontal durante la evolución microbiana.
| Tipo Cas | Gen característico | Función | Referencia |
|---|---|---|---|
| I | Cas3 | Nucleasa para ADN de cadena sencilla. Helicasa dependiente de ATP | [35] |
| IA | Cas8a | Subunidad del módulo de interferencia | [36] |
| IB | Cas8b | ||
| IC | Cas8c | ||
| ID | Cas10d | Contiene un dominio homólogo al dominio de las polimerasas de ácidos nucleicos y ciclasas de nucleótidos | [32][37] |
| IE | Cse1 | ||
| IF | Csy1 | Indeterminado | |
| II | Cas9 | Las nucleasas RuvC and HNH, juntas, producen cortes en cadena doble, y de manera separada pueden producir cortes en cadena sencilla | [38] |
| IIA | Csn2 | Indeterminado | |
| IIB | Cas4 | Indeterminado | |
| IIC | Caracterizado por la ausencia ya sea de Csn2 o Cas4 | [39] | |
| III | Cas10 | Homólogo de Cas10d y Cse1 | [37] |
| IIIA | Csm2 | Indeterminado | |
| IIIB | Cmr5 | Indeterminado |
Mecanismo

Adquisición de los espaciadores dentro de los locus de los CRISPR
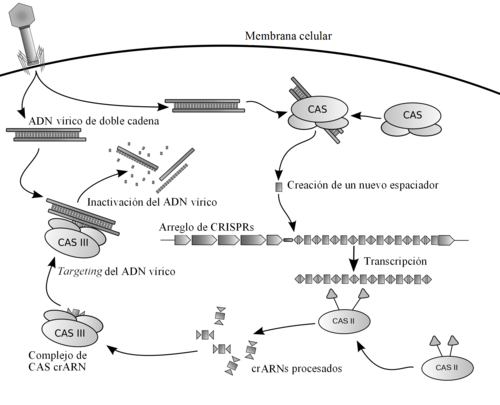
Capturar al ADN invasor e integrarlo en un locus CRISPR en forma de un espaciador es la primera etapa en la respuesta inmune. La prevalencia de cas1 y cas2 fue la primera piste de que estaban involucrados en la adquisición de los espaciadores ya que todos los CRISPRs comparten la estructura repetitiva regular. Estudios de mutaciones confirmaron esta hipótesis ya que al remover cas1 o cas2 impedía la adquisición de espaciadores, sin afectar la respuesta inmune CRISPR en sí.[36][40][41][42][43] La función exacta de Cas1 y Cas2 se desconoce, sin embargo un número de proteínas Cas1 se han caracterizado bioquímicamente y se han resuelto sus estructuras.[44][45][46] Las proteínas Cas1 tienen secuencias de aminoácidos muy diversas, sin embargo sus estructuras cristalinas son sorprendentemente similares y todas las cas1 purificadas son nucleasas dependientes de metales que se unen a ADN en modo indpendiente de secuencia.[33] Las proteínas Cas2 representativas también han sido caracterizadas y poseen actividad específica de endoribonucleasa ya sea para ARN de cadena sencilla o ADN de cadena doble [47] [48][49] Los datos funcionales y estudios de mutación genética sugieren que Cas1 y Cas2 cortan fragmentos de ADN invasor y los insertan en arreglos CRISPR.
El análisis bioinformático de regiones de genomas de fagos que fueron cortados como espaciadores (denominados protoespaciadores) reveló que éstos no estaban distribuidos aleatoriamente en sino más bien se econtraban adyacentes a secuencias cortas de ADN (de 3 a 5 pb) llamadas PAMs (protospacer adjacent motifs en inglés). El análisis de los sistemas CRISPR-Cas de las tres divisiones mayores han mostrado que los PAms son importantes para los sistemas tipo I y II, pero no para el III durante el proceso de adqusición de espaciadores.[15][50][51][52][53][54] En sistemas tipo I y II, los protoespaciadores se cortan es posiciones adyacentes a una secuencia PAM, con el otro extremo del espaciador siendo cortado con un mecanismo tipo regla inherente a la proteína Cas1, manteniendo así la regularidad en tamaño de los espaciadores a lo largo del arreglo de CRISPR.[55][56] La conservación de la secuencia PAM difiere entre los sistemas CRISPR-Cas y parece estar ligado evolutivamente a cas1 y a la secuencia líder.[54][57]
Los nuevos espaciadores se añaden a un arreglo de CRISPR en un modo direccional,[13] ocurriendo preferencialmente [50][51][58][59][60] pero no exlusivamente, adyancentes [53][56] a la secuencia líder. El análisis del sistema tipo I-E de E. coli ha demostrado que el primer repetido directo, adyacente a la secuencia líder, es copiado, con el espaciador recientemente adquirido siendo insertado entre el primer y segundo repetidos directos. [42][55] La secuencia PAM también parece ser importante durante la inserción de espaciadores den sistemas tipo I-E. La secuencia PAM del sistema I-E contiene un nucleótido final fuertemente conservado (adyacente al primer nucleótido del protoespaciador) y se ha mostrado que este nucleótido se convierte en la base final en el primer repetido directo.[43][61][62] Esto sugiere que la maquinaria de adquisición de espaciadores genera overhangs de cadena sencilla en la penúltima posición del repetido directo y en el PAM durante la inserción del espaciador. Sin embargo no todos los sistemas CRISPR-Cas parecen tener este mecanismo ya que los PAMs caracterizados en otros organismos no muestran el mismo nivel de cobservación en la posición final.[57] Es probable qye en esos sistemas, un extremo romo es generado al final del repetido directo y el protoespaciador durante la adquisición. Análisis reciente de CRISPRs de Sulfolobus solfataricus han revelado más complejidades al modelo canónico de la inserción de espaciadores ya que uno de sus seis locus insertó espaciadores de manera aleatoria a lo largo de su arreglo CRISPR, opuesto a una inserción más cercana a la secuencia líder.[56]
Ha sido notado en una cantidad de CRISPRs que estos contienen muchos espaciadores para el mismo fago. El mecanismo que causa este fenómeno ha sido dilucidado recuentemente en el sistema tipo I-E de E. coli. Una mejora significativa en la adquisición de espaciadores ha sido detectada donde ya hay espaciadores con el fago como objetivo inclusive con "mismatches" al protoespaciador. Este ‘cebado’ requiere que tanto las proteínas Cas involucradas en adquisición como en interferencia interactúen entre sí. Los espaciadores nuevamente adquiridos que resultan del mecanismo de cebado siempre se encuentran en la misma cadena que la del espaciador original que produjo el cebado.[43][61][62] Esta observación ha llevado a la hipótesis de que la maquinaria de adquisición recorre el ADN extraño después del cebado para encontrar un nuevo protoespaciador.[62]
Etapa de interferencia
La respuesta inmune por CRISPR ocurre en dos etapas: la biogénesis de CRISPR-ARN (ARNcr) y la interferencia guiada por ARNcr. Un arreglo de CRISPR es transcrito de un promotor en el líder en un sólo transcrito largo.[36][63][64] Este transcrito es procesado por cortes dentro de las secuencias repetidas para formar ARNcr. Los mecanismos para producir ARNcr maduros varían de gran manera entre los tres sistemas principales de CRISPR-Cas. Tanto en sistemas del tipo I-E como I-F las proteínas Cas6e y Cas6f respectivamente, reconocen giros [65][66][67] creados por la naturaleza palindrómica de los repetidos directos.[29] Esas proteínas cortan el transcrito primario en la unión entre los ARN de cadena sencilla y doble, dejando un extremo 5ʹ de 8 nucleótidos originado del repetido en los ARNcr maduros y con una secuencia espaciadora. Los sistemas tipo III también utilizan Cas6, sin embargo los repetidos encontrados en sistemas de tipo III no producen giros, sino que los cortes ocurren por el "enroscamiento" del transcrito primario a lo largo de la Cas6 para permitar corte to allow cleavage de 8 nucleótidos río arriba de la unición de los espaciadores repetidos.[68][69][70] Los sistemas tipo II no poseen el gen Cas6 así que utilizan a la ARNsaIII para hacer los cortes. Los sistemas funcionales tipo II codifican un pequeño ARN adicional que es complementario a la secuencia de los repetidos conocido como ARN trans-activador(tracrRNA).[40] La transcripción del tracrRNA y del transcrito primario CRISPR resulta en apareamiento de bases u la formación de ARN de doble cadena en la secencia de repetidos, la cual es subsecuentemente cortada por la ARNasaIII para producir ARNcr. A diferencia de los otros dos sistemas el ARNcr no contiene al espaciador completo, está truncado en un extremo por 10 nucleótidos.[38]
Los ARNcr se asocian con las proteínas Cas para formar complejos de ribonucleótidos que reconocen ácidos nucleicos extraños. Expremientos con fagos y plásmidos han indicado que los ARNcr no tienen preferencia por cadenas codificantes o no codificantes, lo cual indica un sistema específico para ADN guiado por ARN.[6] [36][43][71][72][73][74] El complejo tipo I-E (llamado Cascade de forma común) requiere cnico proteínas Cas arregladas en una configuración que recuerda a un caballo de mar, unidas al ARNcr de cadena sencilla que estpa unido a lo largo del "lomo".[75][76] Durante el estado de interferencia en los sistemas tipo I la secuencia PAM es reconocida en la cadena complementaria al ARNcr y se requiere junto con el apareamiento de ARNcr. En los sistemas tipo I, el correcto apareamitno entre el ARNcr y los protoespaciadores señaliza un cambio conformacional en Cascade que recluta a Cas3 para la degradación del ADN.
Los sistemas de tipo II utilizan una proteína multifuncional, Cas9, para el paso de interferencia.[38] La Cas9 requiere tanto al ARNcr como al tracrRNA para funcionar y corta al ADN usando sus dominios duales de endonucleasa: HNH y RuvC. El apareamiento de bases entre el PAM y el genoma del fago también se requiere en los sistemas tipo II, sin embargo el PAM es reconocido en la misma cadena que el ARNcr (la cadena opuesta a los sistemas tipo I).
Los sistemas tipo III, como los de tipo I, requieren un complejo multiproteico para asociarse con el ARNcr. Análisis bioquímicos y estructurales de S. solfataricus y Pyrococcus furiosus han dilucidado que seis o siete proteínas cas se unen a los ARNcr, respectivamente.[77][78] Sorpredentemente, los sistemas tipo III analizados en S. solfataricus y P. furiosus son específicos para el ARNm de fagos y plásmidos,[34][78] lo cual puede hacer a esos sitemas capaces de ser específicos para genomas de fagos basados en ARN.[33]
El mecanismo para distinguir ADN propio del externo durante la interferencia está dentro de los ARNcr y por lo tanto se infiere que es conservado en los 3 sistemas. Aun a través del proceso de maduración distinitva de cada uno de los tipos, todos los ARNcr contienen una secuencia espaciadora y una porción del repetido en uno o ambos extremos. Es la secuencia parical de repetidos la que previene que el sistema CRISPR-Cas ataque al cromosoma ya que el apareamiento de bases más allá de la secuencia del espaciador es una señal de que pertenece así mismo y previene el corte de ADN en el cromosoma.[79] Las enzimas de CRISPR guiadas por ARN se clasifican como enzimas de restricción tipo V.
| Proteína asociada a CRISPR | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura cristalina de una proteína asociada a CRISPR de Thermus thermophilus | |||||||||
| Identificadores | |||||||||
| Símbolo | CRISPR_assoc | ||||||||
| Pfam | PF08798 | ||||||||
| clanPfam | CL0362 | ||||||||
| InterPro | IPR010179 | ||||||||
| CDD | cd09727 | ||||||||
| |||||||||
| Proteína asociada a CRISPR Cas2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura cristalina de la proteína hipotética tt1823 de Thermus thermophilus | |||||||||
| Identificadores | |||||||||
| Símbolo | CRISPR_Cas2 | ||||||||
| Pfam | PF09827 | ||||||||
| InterPro | IPR019199 | ||||||||
| CDD | cd09638 | ||||||||
| |||||||||
| Proteína asociada a CRISPR Cse1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Symbol | CRISPR_Cse1 | ||||||||
| Pfam | PF09481 | ||||||||
| InterPro | IPR013381 | ||||||||
| CDD | cd09729 | ||||||||
| |||||||||
| Proteína asociada a CRISPR Cse2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | CRISPR_Cse2 | ||||||||
| Pfam | PF09485 | ||||||||
| InterPro | IPR013382 | ||||||||
| CDD | cd09670 | ||||||||
| |||||||||
Evolución y diversidad
Estudios en Streptococcus thermophilus fueron los primeros indicativos de cómo los CRISPRs mueven a la evolución de fagos y bacterias. Un espaciador CRISPR debe corresponer perfectamente a la secuencia del gen objetivo del fago. Los fagos pueden seguir infectando a sus hospederos cuando hay mutaciones puntuales en el espaciador.[79] Requiermientos similares se siguen en el PAM o la cepa seguirá siendo sensible a fagos.[51][79] El modelo básico de evolución CRISPR se explica como el modelo donde los espaciadores recientemente incorporados llevan a los fagos a mutar sus genomas creando diversidad en las poblaciones tanto de fagos y bacterias.
La evolución CRISPR ha sido estudiada usando a la genómica comparativa de muchas cepas de S. thermophilus, Escherichia coli y Salmonella enterica. Un estudio de 124 cepas de S. thermophilus mostró que 26% de todos los espaciadores eran únicos y que los fierentes locus de CRISPR mostraban diferentes tasas de adqusición de espaciadores.[50] Los resultados mostraton que un locus de CRISPR particular puede evolucionar más rápidamente que otros, lo cual ayuda a establecer relaciones filogeenéticas entre cepas. Un análisis similar de cepas de E. coli y S. enterica reveló que evolucionaron mucho más lentamente que S. thermophilus. Las cepas de esta última que habían divergido hace más de 250,000 años todavía contenían el mismo complemento de espaciador.[80]
La diversidad de CRISPR fue estudiada en múltiples comunidades ambientales usando metagenómica. El análisis de los biofilms de los drenajes ácidos de dos minas mostraron que uno de los CRISPRs analizados contenía deleciones y espaciadores extensivas en comparación al otro biofilm, lo cual sugiere una mayor actividad de fagos en una comunidad en comparación con otra.[59] En la cavidad oral, un estudio temporal determinó que aproximademente del 7 al 22% de los espaciadores eran compartidos en períodos en el tiempo a lo largo de 17 meses en un mismo individuo y menos del 2% de los espaciadores fueron compartidos entre diferentes individuos en cualquier período en el tiempo. [60] Del mismo ambiente, una cepa particular fue aislada usando primers de PCR específicos para su CRISPR. A diferencia de los resultados generales de la presencia/ausencia de los espaciadores, los cuales mostraban diversidad significativa, este CRISPR añadió 3 espaciadores a lo largo de 17 meses,[60] sugiriendo que aun en un ambiente con diversidad importante de CRISPR, algunos locus evolucionan lentamente. Los CRISPRs también han sido analizados desde los metagenomas producidos por el proyecto del microbioma humano.[81] Aunque la mayoría de los CRISPRs eran específicos en un sitio, algunos CRISPRs dentro del sitio eran ampliamente encontrados entre individuos. Uno de esos locus de CRISPR se origino con estudios de especies de Streptococcus y contuvieron ~15,000 espaciadores, 50% de los cuales eran únicos. De modo similar a los estudios dirigidos de la cavidad oral, algunos de los CRISPRs mostraton poca evolución entre períodos en el tiempo.[81]
La evolución CRISPR ha sido estudiada en quimiostatos usando a S. thermophilus para examinar de manera explícita la tasa de adquisición de espaciadores. En el período de una semana, cepas de S. thermophilus adquirieron hasta tres espaciadores cuando eran expuestos ante sólo un fago.[82] En el mismo período de tiempo, el fago desarrolló varios SNPs que se quedaron fijos es la población, sugiriendo que CRISPR había prevenido la repliación de todos los otros tipos de fagos sin estas mutaciones.[82] Otros exprimentos, también con S. thermophilus, mostraton que los fagos pueden infectar y replicarse en hospederos que tienen sólo un espaciador y que los hospederos sensibles existen en ambientes con altas concentraciones de fagos.[83] Los estudios por quimiostatos y observaciones en los CRISPRs sugieren muchas consecuencias al resultado de la evolución de CRISPR y fagos.
Identificación bioinformática de los CRISPR en genomas y metagenomas
Los CRISPRs están altamente distribuidos entre bacterias y arqueas [32] y muestran similitudes en las secuencias,[29] sin embargo su característica principal son sus espaciadores repetidos y repetidos directos. Esta característica hace a los CRISPRs fáciles de indentificar el largas secuencias de ADN, ya que el número de copias repetidas disminuye la posibilidad de una unión tipo falso positivo. En la actualidad hay tres programas utilizados para la identificación de repetidos CRISPR que buscan repetidos interespaciados en secuencias grandes: CRT,[84] PILER-CR [85] y CRISPRfinder.[86]
El análisis de los CRISPRs en los datos de metagenómica es mucho más demandante, ya que los locus de CRISPR no suelen asemblarse debido a su naturaleza repetitiva ni por variación de cepas, lo cual confunde a los algoritmos. Mientras que hay muchos genomas de referencias disponibles, la PCR se puede utilizar para amplificar arreglos de CRISPR y así analizar el contenido de los espaciadores. [50][60][87][88][89] Sin embargo, este enfoque sólo dará información de CRISPRs específicamente buscados y en organismos con suficiente representación en bases de datos públicas para poder hacer el diseño de primers de PCR confiables.
El enfoque alterativo es extraer y reconstuir los arreglos de CRISPR arrays basándose en datos shotgun metagenómicos. La identificación de los arreglos de CRISPR de lecturas metagenómias es una tarea computacionalmente más difícil, particularmente con las tecnologías de decuenciación de segunda generación (como son 454, Illumina), ya que las longitudes cortas previenen que más de dos o tres unidades repetidas se presenten en una sóla lectura. La identificación de CRISPR en lecturas crudas es lograda usando puramente identificaión denovo [90] o al usar secuencias repetidas directas en arreglos CRISPR parcialmente ordenados [81] y secuencias repetidas de genes publicados [91] como herramienta para identificar repetidos directos en lecturas individuales.
Importancia evolutiva
Un estudio bioinformático mostró que los CRISPRs son evolutivamente conservados y que se pueden aglomerar en tipos relacionados. Muchos muestran la posibilidad de una estructura secundaria conservada.[29]
A través del mecanismo CRISPR/Cas, las bacterias pueden adquirir immunidad a ciertos fagos y por ende detener la consecuene transimisión de estos fagos. Por esta razión los CRISPR/Cas se describen como un mecanismo de herencia Lamarckiano .[92] Otros han investigado la coevolución de los genomas vitales y hospederos.[93]
Las proteínas Cas9 están altamente enriquecidas en bacterias patogénicas y comensales. La regulación mediada por CRISPR/Cas puede contribuir a la regulación de los genes endógenos bacterianos, particularmente en la interacción bacteriana con hospederos eucariontes. Por ejemplo, la proteína Cas9 de Francisella novicida usa un pequeño y único ARN asociado a CRISPR/Cas para reprimir un transcrito endógeno que coficia para una lipoproteína bacteriana que es crítica para F. novicida para reducir la respuesta del hospedero y promover la virulencia.[94]
Aplicaciones
La prueba que demostró el principio de la redirección específica del sistema CRISPR/Cas llegó en 2012[95] y fue un primer paso para la materialización de propuestas para la biotecnología derivada de CRISPR:[96]
- Inmunización artificial contra fagos por introducción de locus CRISPR en bacterias industrialmente importantes, incluyendo a esas utilizadas en la producción de comida y fermentaciones a gran escala.
- La ingeniería genética a nivel celular u organísmico al reprogramar un sistema CRISPR/Cas para lograr ingeniería del genoma guiada por ARN. Los estudios lo han demostrado tanto in vitro[17][97] como in vivo[24][98][99][100]
- Discriminación de cepas bacterianas por comparación de secuencias espaciadoras
Terapias
Editas Medicine, una start up de 43 millones de dólares, busca desarrollar tratamientos que usen CRISPR/Cas para hacer ediciones desde pares de bases específicas hasta segmentos más grandes de ADN. Algunas enfermedades heredadas como la fibrosis quística y la anemia son causadas por mutaciones de un sólo par de bases; la tecnología CRISPR/Cas tiene el potencial de corregir esos errores. El gen "corregido" permanece en su lugar habitual en su cromosoma, quien contiene la forma en que la célula normalmente activa o inhibe su expresión.[101]
Después de cultivar precursores de células sanguíneas llamados hemocitoblastos de la médula ósea de un paciente, la cirugía genética con CRISPR podría corregir el gen defectuoso. Entonces las células con el genoma corregido serían reintroducidas a la médula del paciente, que ahora producirá células sanas. Reemplazar el 70% de las células defectuosas significaría tener una cura.[27]
Antes de que pueda usarse clínicamente, la compañía debe poder garantizar que sólo la región objetivo será afectada y debe determinar cómo entregar la terapia a las células del paciente.[101]
Otras patologías que se podrían tratar con CRISPR incluyen la enfermedad de Huntington, los efectos de la vejez, esquizofrenia y autismo e inclusive la modificación de ADN en embriones vivos.[27]
Mejorar el sistema de dirección es fundamental antes de que CRISPR pueda ser utilizado en aplicaciones médicas. Los ARN guía existentes podrían trabajar sobre secuencias que difieren en algunas pares de bases de la secuencia objetivo.[16]
En 2014, investigadores de la UCSF usaron a los CRISPR para crear crear bersopnes sanas de células madre de pacientes con beta-talasemia patients.[102]
Modelos murinos
CRISPR simplifica la creación de modelos de ratones y reduce el tiempo requerido de meses o más a tan sólo semanas. El knockdown de genes endógenos ha sido logrado por transfección con un plásmido que contiene un área CRISPR con un espaciador, que inhibe un gen objetivo. La inyección de cigotos de ratón con Cas9 y dos ARN guía pudo lograr desactivar dos genes con el 80% de eficacia. La llamada reparación dirigida por homología involucrs el uso de Cas9 para "cortar" al ADN, y así introducir nuevas partes génicas al cigoto.[cita requerida]
Agricultura
En 2014, el investigador chino Gao Caixia aplicó para patentes para la creación de una cepa de trigo que es resistente al oídio. A la cepa le faltan genes que producen proteínas que reprimen las defensas en contra del oídio. Los investigadores borraton todas las copias de los genes del genoma hexaploide del trigo.La cepa promete reducir o eliminar el gran uso de fungicidas para controlar la enfermedad. Gao usó los sistemas de edición génica Transcription activator-like effector nuclease(TALENs) y CRISPR agregar o cambiar ningún otro gen. Aún no han habido pruebas de campo.[103][104]
Funciones
Edición
Los CRISPRs pueden agregar y eliminar pares de bases en locus de ADN altamente específicos. Se han usado los CRISPRs para cortar más de cinco genes a la vez.[16]
Knockdown reversible
Los "CRISPRi", análogos a los ARNi, apagan los genes en un modo reversible al ser específicos pero sin hacer cortes. En bacterias, la presencia es lo único que se necesita para detener la transcripción, pero en aplicaciones de mamíferos, una sección de proteína es añadida. Guía al ARN que es específico para el ADN regulatorio, que son promotores que preceden al gen de interés.[16]
Activación
La Cas9 se usó para llevar factores de transcripción sintéticos (fragmentos proteicos que encienden genes) que activaban genes humanos específicos. Esta técnica logró un fuerte efecto al dirigir múltiples constructos de CRISPR a lugares ligeramente diferentes en el promotor del gen.[16]
Los genes incluían algunos atados a enfermedades humanos, diferenciación muscular, cáncer, inflamación y de producción de hemoglobina fetal.[16]
Uso por fagos
Otro mecanismo para la defensa de las bacterias contra invasión de fagos es teniendo islas genómicas. Un subtipo de islas llamada "phage-inducible chromosomal island" (PICI) es cortada del cromosoma bacteriano cuando se presenta la infección por fago y puede inhibir su replicación.[105] Los mecanismos que inducen el sistema PICI y cómo PICI inhibe la replicación del fago no se tienen entendidos hasta ahora. Un estudio mostró que el fago lítico ICP1, el cual específicamente ataca al serotipo 01 de Vibrio cholerae ha adquirido un sistema CRISPR/Cas que apunta a un elemento de tipo PICI en V. cholera. El sistema tiene dos locus CRISPR y 9 genes Cas. Parece ser que es homólogo al sistema 1-F system encontrado en Yersinia pestis. Además, igual que el sistema bacteriano CRISPR/Cas el sistema ICP1 CRISPR/Cas puede adquirir nuevas secuencias, lo cual permite al fago co-evolucionar con su hospedero. host.[106]
Automatización y soporte de librerías
Existe software gratuito para diseñar ARN para "targetear" cualquier gen deseado. El repositorio de Addgene ofrece a los académicos a posibilidad de crear su propio sistema CRISPR system por 65 dólares En 2013 Addgene distribuyó más de 10,000 constructos de CRISPR. La asociación ha recibido sequencias génicas activadoras de CRISPR de 11 equipos de investigación independientes.[16]
Patente
Una aplicación de patente providional sobre el uso del sistema CRISPR para la edición de genes y regulación de expresión génica fue solicitada por el equipo de Doudna el 12 de mayo de 2012. Aplicaciones subsecuentes fueron combinadas el 6 de marzo de 2014, con los resultados siendo publicados por el organismo USPTO.[107] Los derechos de patente han sido asignados por los inventores a los regentes de la Universidad de California y la Universidad de Viena.
Desde entonces, Feng Zhang en el Broad Institute, quien había desarrollado y demostrado la tecnología CRISPR en células humanas, ha obtenido una patente de CRISPR en células con núcleo: células de humano, animal y planta. De acuerdo con Zhang, las predicciones de Doudna en su propia aplicación de patente de que su descubrimiento podría funcionar en humanos, fueron una "mera conjetura", y que, en otra mano, él fue el primero en demostrarlo, en un acto de invención separado y "sorprendente".[108] Esta segunda patente es controversial, ya que otros científicos sugieren que en términos de patente, era "obvio" que la tecnología CRISPR funcionaría en células humanas y que la "invención de Zhang no era merecedora de una patente propia.[108] Desde diciembre de 2014, se espera que Doudna y Charpentier monten una interferencia en contra de la patente del Broad Institute.[108]
Ver también
Referencias
- ↑ a b c Horvath, P.; Barrangou, R. (2010). "CRISPR/Cas, the Immune System of Bacteria and Archaea". Science 327 (5962): 167–170. doi:10.1126/science.1179555. PMID 20056882.
- ↑ a b c Marraffini, L. A.; Sontheimer, E. J. (2010). "CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea". Nature Reviews Genetics 11 (3): 181–190. doi:10.1038/nrg2749. PMC 2928866. PMID 20125085. name="pmid20125085">
- ↑ 71/79 Archaea, 463/1008 Bacteria CRISPRdb, Date: 19.6.2010
- ↑ a b Grissa, I.; Vergnaud, G.; Pourcel, C. (2007). "The CRISPRdb database and tools to display CRISPRs and to generate dictionaries of spacers and repeats". BMC Bioinformatics 8: 172. doi:10.1186/1471-2105-8-172. PMC 1892036. PMID 17521438.
- ↑ Barrangou, R.; Fremaux, C.; Deveau, H.; Richards, M.; Boyaval, P.; Moineau, S.; Romero, D. A.; Horvath, P. (2007). "CRISPR Provides Acquired Resistance Against Viruses in Prokaryotes". Science 315 (5819): 1709–1712. doi:10.1126/science.1138140. PMID 17379808.
- ↑ a b Marraffini, L. A.; Sontheimer, E. J. (2008). "CRISPR Interference Limits Horizontal Gene Transfer in Staphylococci by Targeting DNA". Science 322 (5909): 1843–1845. doi:10.1126/science.1165771. PMC 2695655. PMID 19095942.
- ↑ Mali, P; Esvelt, K. M.; Church, G. M. (2013). "Cas9 as a versatile tool for engineering biology". Nature Methods 10 (10): 957–63. doi:10.1038/nmeth.2649. PMC 4051438. PMID 24076990.
- ↑ Kevin M Esvelt, Andrea L Smidler, Flaminia Catteruccia, George M Church (2014). "Concerning RNA-guided gene drives for the alteration of wild populations". eLife. doi:10.7554/eLife.03401.
- ↑ Overballe-Petersen, S.; Harms, K.; Orlando, L. A. A.; Mayar, J. V. M.; Rasmussen, S.; Dahl, T. W.; Rosing, M. T.; Poole, A. M.; Sicheritz-Ponten, T.; Brunak, S.; Inselmann, S.; De Vries, J.; Wackernagel, W.; Pybus, O. G.; Nielsen, R.; Johnsen, P. J.; Nielsen, K. M.; Willerslev, E. (2013). "Bacterial natural transformation by highly fragmented and damaged DNA". Proceedings of the National Academy of Sciences 110 (49): 19860–5. doi:10.1073/pnas.1315278110. PMID 24248361.
- ↑ Ishino, Y.; Shinagawa, H.; Makino, K.; Amemura, M.; Nakata, A. (1987). "Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product". Journal of bacteriology 169 (12): 5429–5433. PMC 213968. PMID 3316184.
- ↑ Mojica, F. J.; Díez-Villaseñor, C.; Soria, E.; Juez, G. (2000). "Biological significance of a family of regularly spaced repeats in the genomes of Archaea, Bacteria and mitochondria". Molecular microbiology 36 (1): 244–246. doi:10.1046/j.1365-2958.2000.01838.x. PMID 10760181.
- ↑ a b Jansen, R.; Embden, J. D.; Gaastra, W.; Schouls, L. M. (2002). "Identification of genes that are associated with DNA repeats in prokaryotes". Molecular microbiology 43 (6): 1565–1575. doi:10.1046/j.1365-2958.2002.02839.x. PMID 11952905.
- ↑ a b c d Pourcel C, Salvignol G, Vergnaud G (Mar 2005). "CRISPR elements in Yersinia pestis acquire new repeats by preferential uptake of bacteriophage DNA, and provide additional tools for evolutionary studies". Microbiology 151 (Pt 3): 653–663. doi:10.1099/mic.0.27437-0. PMID 15758212.
- ↑ a b Mojica, F. J. M.; Díez-Villaseñor, C. S.; García-Martínez, J. S.; Soria, E. (2005). "Intervening Sequences of Regularly Spaced Prokaryotic Repeats Derive from Foreign Genetic Elements". Journal of Molecular Evolution 60 (2): 174–182. doi:10.1007/s00239-004-0046-3. PMID 15791728.
- ↑ a b c Bolotin, A.; Quinquis, B.; Sorokin, A.; Ehrlich, S. D. (2005). "Clustered regularly interspaced short palindrome repeats (CRISPRs) have spacers of extrachromosomal origin". Microbiology 151 (8): 2551–2561. doi:10.1099/mic.0.28048-0. PMID 16079334.
- ↑ a b c d e f g h i j k Pennisi, E. (2013). "The CRISPR Craze". Science 341 (6148): 833–836. doi:10.1126/science.341.6148.833. PMID 23970676.
- ↑ a b Jinek, M.; Chylinski, K.; Fonfara, I.; Hauer, M.; Doudna, J. A.; Charpentier, E. (2012). "A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity". Science 337 (6096): 816–821. doi:10.1126/science.1225829. PMID 22745249.
- ↑ "CRISPR gene therapy: Scientists call for more public debate around breakthrough technique - Science - News". The Independent. 2013-11-07. Retrieved 2013-11-25.
- ↑ Dicarlo, J. E.; Norville, J. E.; Mali, P; Rios, X; Aach, J; Church, G. M. (2013). "Genome engineering in Saccharomyces cerevisiae using CRISPR-Cas systems". Nucleic Acids Research 41 (7): 4336–43. doi:10.1093/nar/gkt135. PMC 3627607. PMID 23460208.
- ↑ Hwang, W. Y.; Fu, Y; Reyon, D; Maeder, M. L.; Tsai, S. Q.; Sander, J. D.; Peterson, R. T.; Yeh, J. R.; Joung, J. K. (2013). "Efficient genome editing in zebrafish using a CRISPR-Cas system". Nature Biotechnology 31 (3): 227–9. doi:10.1038/nbt.2501. PMC 3686313. PMID 23360964.
- ↑ Gratz, S. J.; Cummings, A. M.; Nguyen, J. N.; Hamm, D. C.; Donohue, L. K.; Harrison, M. M.; Wildonger, J; O'Connor-Giles, K. M. (2013). "Genome engineering of Drosophila with the CRISPR RNA-guided Cas9 nuclease". Genetics 194 (4): 1029–35. doi:10.1534/genetics.113.152710. PMC 3730909. PMID 23709638.
- ↑ Friedland, A. E.; Tzur, Y. B.; Esvelt, K. M.; Colaiácovo, M. P.; Church, G. M.; Calarco, J. A. (2013). "Heritable genome editing in C. Elegans via a CRISPR-Cas9 system". Nature Methods 10 (8): 741–3. doi:10.1038/nmeth.2532. PMC 3822328. PMID 23817069.
- ↑ Jiang, W; Zhou, H; Bi, H; Fromm, M; Yang, B; Weeks, D. P. (2013). "Demonstration of CRISPR/Cas9/sgRNA-mediated targeted gene modification in Arabidopsis, tobacco, sorghum and rice". Nucleic Acids Research 41 (20): e188. doi:10.1093/nar/gkt780. PMC 3814374. PMID 23999092.
- ↑ a b Wang, H.; Yang, H.; Shivalila, C. S.; Dawlaty, M. M.; Cheng, A. W.; Zhang, F.; Jaenisch, R. (2013). "One-Step Generation of Mice Carrying Mutations in Multiple Genes by CRISPR/Cas-Mediated Genome Engineering". Cell 153 (4): 910–918. doi:10.1016/j.cell.2013.04.025. PMID 23643243.
- ↑ Larson, M. H.; Gilbert, L. A.; Wang, X; Lim, W. A.; Weissman, J. S.; Qi, L. S. (2013). "CRISPR interference (CRISPRi) for sequence-specific control of gene expression". Nature Protocols 8 (11): 2180–96. doi:10.1038/nprot.2013.132. PMID 24136345.
- ↑ «Researchers reverse a liver disorder in mice by correcting a mutated gene». PhysOrg. 30 March 2014. Consultado el 31 March 2014.
- ↑ a b c Young, Susan (11 de febrero de 2014). «CRISPR and Other Genome Editing Tools Boost Medical Research and Gene Therapy’s Reach | MIT Technology Review». Technologyreview.com. Consultado el 13 de abril de 2014.
- ↑ a b c Haft, D. H.; Selengut, J.; Mongodin, E. F.; Nelson, K. E. (2005). "A Guild of 45 CRISPR-Associated (Cas) Protein Families and Multiple CRISPR/Cas Subtypes Exist in Prokaryotic Genomes". PLoS Computational Biology 1 (6): e60. doi:10.1371/journal.pcbi.0010060. PMC 1282333. PMID 16292354. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid16292354» está definido varias veces con contenidos diferentes - ↑ a b c d Kunin, V.; Sorek, R.; Hugenholtz, P. (2007). "Evolutionary conservation of sequence and secondary structures in CRISPR repeats". Genome Biology 8 (4): R61. doi:10.1186/gb-2007-8-4-r61. PMC 1896005. PMID 17442114. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid17442114» está definido varias veces con contenidos diferentes - ↑ Stern, A.; Keren, L.; Wurtzel, O.; Amitai, G.; Sorek, R. (2010). "Self-targeting by CRISPR: Gene regulation or autoimmunity?". Trends in Genetics 26 (8): 335–340. doi:10.1016/j.tig.2010.05.008. PMC 2910793. PMID 20598393.
- ↑ Tyson, G. W.; Banfield, J. F. (2007). "Rapidly evolving CRISPRs implicated in acquired resistance of microorganisms to viruses". Environmental Microbiology 10 (1): 200–207. doi:10.1111/j.1462-2920.2007.01444.x. PMID 17894817.
- ↑ a b c Chylinski, K; Makarova, K. S.; Charpentier, E; Koonin, E. V. (2014). "Classification and evolution of type II CRISPR-Cas systems". Nucleic acids research 42 (10): 6091–105. doi:10.1093/nar/gku241. PMC 4041416. PMID 24728998. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid24728998» está definido varias veces con contenidos diferentes - ↑ a b c Wiedenheft, B; Sternberg, S. H.; Doudna, J. A. (2012). "RNA-guided genetic silencing systems in bacteria and archaea". Nature 482 (7385): 331–8. doi:10.1038/nature10886. PMID 22337052. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid22337052» está definido varias veces con contenidos diferentes - ↑ a b Deng, L; Garrett, R. A.; Shah, S. A.; Peng, X; She, Q (2013). "A novel interference mechanism by a type IIIB CRISPR-Cmr module in Sulfolobus". Molecular microbiology 87 (5): 1088–99. doi:10.1111/mmi.12152. PMID 23320564. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid23320564» está definido varias veces con contenidos diferentes - ↑ Sinkunas, T; Gasiunas, G; Fremaux, C; Barrangou, R; Horvath, P; Siksnys, V (2011). "Cas3 is a single-stranded DNA nuclease and ATP-dependent helicase in the CRISPR/Cas immune system". The EMBO journal 30 (7): 1335–42. doi:10.1038/emboj.2011.41. PMC 3094125. PMID 21343909.
- ↑ a b c d Aliyari, R; Ding, S. W. (2009). "RNA-based viral immunity initiated by the Dicer family of host immune receptors". Immunological reviews 227 (1): 176–88. doi:10.1111/j.1600-065X.2008.00722.x. PMC 2676720. PMID 19120484. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid19120484» está definido varias veces con contenidos diferentes - ↑ a b Makarova, K. S.; Aravind, L; Wolf, Y. I.; Koonin, E. V. (2011). "Unification of Cas protein families and a simple scenario for the origin and evolution of CRISPR-Cas systems". Biology direct 6: 38. doi:10.1186/1745-6150-6-38. PMC 3150331. PMID 21756346. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid21756346» está definido varias veces con contenidos diferentes - ↑ a b c Gasiunas, G.; Barrangou, R.; Horvath, P.; Siksnys, V. (2012). "Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria". Proceedings of the National Academy of Sciences 109 (39): E2579–E2586. doi:10.1073/pnas.1208507109. PMC 3465414. PMID 22949671. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid22949671» está definido varias veces con contenidos diferentes - ↑ Chylinski, K; Le Rhun, A; Charpentier, E (2013). "The tracrRNA and Cas9 families of type II CRISPR-Cas immunity systems". RNA biology 10 (5): 726–37. doi:10.4161/rna.24321. PMC 3737331. PMID 23563642.
- ↑ a b Dugar, G; Herbig, A; Förstner, K. U.; Heidrich, N; Reinhardt, R; Nieselt, K; Sharma, C. M. (2013). "High-resolution transcriptome maps reveal strain-specific regulatory features of multiple Campylobacter jejuni isolates". PLoS genetics 9 (5): e1003495. doi:10.1371/journal.pgen.1003495. PMC 3656092. PMID 23696746. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid23696746» está definido varias veces con contenidos diferentes - ↑ Hatoum-Aslan, A; Maniv, I; Marraffini, L. A. (2011). "Mature clustered, regularly interspaced, short palindromic repeats RNA (crRNA) length is measured by a ruler mechanism anchored at the precursor processing site". Proceedings of the National Academy of Sciences of the United States of America 108 (52): 21218–22. doi:10.1073/pnas.1112832108. PMC 3248500. PMID 22160698.
- ↑ a b Yosef, I; Goren, M. G.; Qimron, U (2012). "Proteins and DNA elements essential for the CRISPR adaptation process in Escherichia coli". Nucleic acids research 40 (12): 5569–76. doi:10.1093/nar/gks216. PMC 3384332. PMID 22402487. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid22402487» está definido varias veces con contenidos diferentes - ↑ a b c d Swarts, D. C.; Mosterd, C; Van Passel, M. W.; Brouns, S. J. (2012). "CRISPR interference directs strand specific spacer acquisition". PloS one 7 (4): e35888. doi:10.1371/journal.pone.0035888. PMC 3338789. PMID 22558257. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid22558257» está definido varias veces con contenidos diferentes - ↑ Babu, M; Beloglazova, N; Flick, R; Graham, C; Skarina, T; Nocek, B; Gagarinova, A; Pogoutse, O; Brown, G; Binkowski, A; Phanse, S; Joachimiak, A; Koonin, E. V.; Savchenko, A; Emili, A; Greenblatt, J; Edwards, A. M.; Yakunin, A. F. (2011). "A dual function of the CRISPR-Cas system in bacterial antivirus immunity and DNA repair". Molecular microbiology 79 (2): 484–502. doi:10.1111/j.1365-2958.2010.07465.x. PMC 3071548. PMID 21219465.
- ↑ Han, D; Lehmann, K; Krauss, G (2009). "SSO1450--a CAS1 protein from Sulfolobus solfataricus P2 with high affinity for RNA and DNA". FEBS letters 583 (12): 1928–32. doi:10.1016/j.febslet.2009.04.047. PMID 19427858.
- ↑ Wiedenheft, B; Zhou, K; Jinek, M; Coyle, S. M.; Ma, W; Doudna, J. A. (2009). "Structural basis for DNase activity of a conserved protein implicated in CRISPR-mediated genome defense". Structure (London, England : 1993) 17 (6): 904–12. doi:10.1016/j.str.2009.03.019. PMID 19523907.
- ↑ Beloglazova, N; Brown, G; Zimmerman, M. D.; Proudfoot, M; Makarova, K. S.; Kudritska, M; Kochinyan, S; Wang, S; Chruszcz, M; Minor, W; Koonin, E. V.; Edwards, A. M.; Savchenko, A; Yakunin, A. F. (2008). "A novel family of sequence-specific endoribonucleases associated with the clustered regularly interspaced short palindromic repeats". The Journal of biological chemistry 283 (29): 20361–71. doi:10.1074/jbc.M803225200. PMC 2459268. PMID 18482976.
- ↑ Samai, P; Smith, P; Shuman, S (2010). "Structure of a CRISPR-associated protein Cas2 from Desulfovibrio vulgaris". Acta crystallographica. Section F, Structural biology and crystallization communications 66 (Pt 12): 1552–6. doi:10.1107/S1744309110039801. PMC 2998353. PMID 21139194.
- ↑ Nam, K. H.; Ding, F; Haitjema, C; Huang, Q; Delisa, M. P.; Ke, A (2012). "Double-stranded endonuclease activity in Bacillus halodurans clustered regularly interspaced short palindromic repeats (CRISPR)-associated Cas2 protein". The Journal of biological chemistry 287 (43): 35943–52. doi:10.1074/jbc.M112.382598. PMC 3476262. PMID 22942283.
- ↑ a b c d Horvath, P.; Romero, D. A.; Coûté-Monvoisin, A. -C.; Richards, M.; Deveau, H.; Moineau, S.; Boyaval, P.; Fremaux, C.; Barrangou, R. (2007). "Diversity, Activity, and Evolution of CRISPR Loci in Streptococcus thermophilus". Journal of Bacteriology 190 (4): 1401–1412. doi:10.1128/JB.01415-07. PMC 2238196. PMID 18065539. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid18065539» está definido varias veces con contenidos diferentes - ↑ a b c Deveau, H.; Barrangou, R.; Garneau, J. E.; Labonté, J.; Fremaux, C.; Boyaval, P.; Romero, D. A.; Horvath, P.; Moineau, S. (2007). "Phage Response to CRISPR-Encoded Resistance in Streptococcus thermophilus". Journal of Bacteriology 190 (4): 1390–1400. doi:10.1128/JB.01412-07. PMC 2238228. PMID 18065545. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid18065545» está definido varias veces con contenidos diferentes - ↑ Mojica, F. J. M.; Diez-Villasenor, C.; Garcia-Martinez, J.; Almendros, C. (2009). "Short motif sequences determine the targets of the prokaryotic CRISPR defence system". Microbiology 155 (3): 733–740. doi:10.1099/mic.0.023960-0. PMID 19246744.
- ↑ a b Lillestøl, R. K.; Shah, S. A.; Brügger, K.; Redder, P.; Phan, H.; Christiansen, J.; Garrett, R. A. (2009). "CRISPR families of the crenarchaeal genus Sulfolobus: Bidirectional transcription and dynamic properties". Molecular Microbiology 72 (1): 259–272. doi:10.1111/j.1365-2958.2009.06641.x. PMID 19239620. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid19239620» está definido varias veces con contenidos diferentes - ↑ a b Shah, S. A.; Hansen, N. R.; Garrett, R. A. (2009). "Distribution of CRISPR spacer matches in viruses and plasmids of crenarchaeal acidothermophiles and implications for their inhibitory mechanism". Biochemical Society Transactions 37 (Pt 1): 23–28. doi:10.1042/BST0370023. PMID 19143596. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid19143596» está definido varias veces con contenidos diferentes - ↑ a b Díez-Villaseñor, C; Guzmán, N. M.; Almendros, C; García-Martínez, J; Mojica, F. J. (2013). "CRISPR-spacer integration reporter plasmids reveal distinct genuine acquisition specificities among CRISPR-Cas I-E variants of Escherichia coli". RNA biology 10 (5): 792–802. doi:10.4161/rna.24023. PMC 3737337. PMID 23445770. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid23445770» está definido varias veces con contenidos diferentes - ↑ a b c Erdmann, S; Garrett, R. A. (2012). "Selective and hyperactive uptake of foreign DNA by adaptive immune systems of an archaeon via two distinct mechanisms". Molecular microbiology 85 (6): 1044–56. doi:10.1111/j.1365-2958.2012.08171.x. PMC 3468723. PMID 22834906. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid22834906» está definido varias veces con contenidos diferentes - ↑ a b Shah, S. A.; Erdmann, S; Mojica, F. J.; Garrett, R. A. (2013). "Protospacer recognition motifs: Mixed identities and functional diversity". RNA biology 10 (5): 891–9. doi:10.4161/rna.23764. PMC 3737346. PMID 23403393. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid23403393» está definido varias veces con contenidos diferentes - ↑ Andersson, A. F.; Banfield, J. F. (2008). "Virus Population Dynamics and Acquired Virus Resistance in Natural Microbial Communities". Science 320 (5879): 1047–1050. doi:10.1126/science.1157358. PMID 18497291.
- ↑ a b Tyson, G. W.; Banfield, J. F. (2007). "Rapidly evolving CRISPRs implicated in acquired resistance of microorganisms to viruses". Environmental Microbiology 10 (1): 200–207. doi:10.1111/j.1462-2920.2007.01444.x. PMID 17894817. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid17894817» está definido varias veces con contenidos diferentes - ↑ a b c d Pride, D. T.; Sun, C. L.; Salzman, J; Rao, N; Loomer, P; Armitage, G. C.; Banfield, J. F.; Relman, D. A. (2011). "Analysis of streptococcal CRISPRs from human saliva reveals substantial sequence diversity within and between subjects over time". Genome research 21 (1): 126–36. doi:10.1101/gr.111732.110. PMC 3012920. PMID 21149389. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid21149389» está definido varias veces con contenidos diferentes - ↑ a b Goren, M. G.; Yosef, I; Auster, O; Qimron, U (2012). "Experimental definition of a clustered regularly interspaced short palindromic duplicon in Escherichia coli". Journal of molecular biology 423 (1): 14–6. doi:10.1016/j.jmb.2012.06.037. PMID 22771574. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid22771574» está definido varias veces con contenidos diferentes - ↑ a b c Datsenko, K. A.; Pougach, K; Tikhonov, A; Wanner, B. L.; Severinov, K; Semenova, E (2012). "Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system". Nature communications 3: 945. doi:10.1038/ncomms1937. PMID 22781758. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid22781758» está definido varias veces con contenidos diferentes - ↑ Tang, T. H.; Bachellerie, J. P.; Rozhdestvensky, T; Bortolin, M. L.; Huber, H; Drungowski, M; Elge, T; Brosius, J; Hüttenhofer, A (2002). "Identification of 86 candidates for small non-messenger RNAs from the archaeon Archaeoglobus fulgidus". Proceedings of the National Academy of Sciences of the United States of America 99 (11): 7536–41. doi:10.1073/pnas.112047299. PMC 124276. PMID 12032318.
- ↑ Tang, T. H.; Polacek, N; Zywicki, M; Huber, H; Brugger, K; Garrett, R; Bachellerie, J. P.; Hüttenhofer, A (2005). "Identification of novel non-coding RNAs as potential antisense regulators in the archaeon Sulfolobus solfataricus". Molecular microbiology 55 (2): 469–81. doi:10.1111/j.1365-2958.2004.04428.x. PMID 15659164.
- ↑ Gesner, E. M.; Schellenberg, M. J.; Garside, E. L.; George, M. M.; MacMillan, A. M. (2011). "Recognition and maturation of effector RNAs in a CRISPR interference pathway". Nature structural & molecular biology 18 (6): 688–92. doi:10.1038/nsmb.2042. PMID 21572444.
- ↑ Sashital, D. G.; Jinek, M; Doudna, J. A. (2011). "An RNA-induced conformational change required for CRISPR RNA cleavage by the endoribonuclease Cse3". Nature structural & molecular biology 18 (6): 680–7. doi:10.1038/nsmb.2043. PMID 21572442.
- ↑ Haurwitz, R. E.; Jinek, M; Wiedenheft, B; Zhou, K; Doudna, J. A. (2010). "Sequence- and structure-specific RNA processing by a CRISPR endonuclease". Science 329 (5997): 1355–8. doi:10.1126/science.1192272. PMC 3133607. PMID 20829488.
- ↑ Carte, J.; Wang, R.; Li, H.; Terns, R. M.; Terns, M. P. (2008). "Cas6 is an endoribonuclease that generates guide RNAs for invader defense in prokaryotes". Genes & Development 22 (24): 3489–3496. doi:10.1101/gad.1742908. PMC 2607076. PMID 19141480.
- ↑ Wang, R; Preamplume, G; Terns, M. P.; Terns, R. M.; Li, H (2011). "Interaction of the Cas6 riboendonuclease with CRISPR RNAs: Recognition and cleavage". Structure (London, England : 1993) 19 (2): 257–64. doi:10.1016/j.str.2010.11.014. PMC 3154685. PMID 21300293.
- ↑ Niewoehner, O; Jinek, M; Doudna, J. A. (2014). "Evolution of CRISPR RNA recognition and processing by Cas6 endonucleases". Nucleic acids research 42 (2): 1341–53. doi:10.1093/nar/gkt922. PMC 3902920. PMID 24150936.
- ↑ Garneau, J. E.; Dupuis, Marie-Ève; Villion, M; Romero, D. A.; Barrangou, R; Boyaval, P; Fremaux, C; Horvath, P; Magadán, A. H.; Moineau, S (2010). "The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA". Nature 468 (7320): 67–71. Bibcode:2010Natur.468...67G. doi:10.1038/nature09523. PMID 21048762.
- ↑ Semenova, E; Jore, M. M.; Datsenko, K. A.; Semenova, A; Westra, E. R.; Wanner, B; Van Der Oost, J; Brouns, S. J.; Severinov, K (2011). "Interference by clustered regularly interspaced short palindromic repeat (CRISPR) RNA is governed by a seed sequence". Proceedings of the National Academy of Sciences of the United States of America 108 (25): 10098–103. doi:10.1073/pnas.1104144108. PMC 3121866. PMID 21646539.
- ↑ Gudbergsdottir, S; Deng, L; Chen, Z; Jensen, J. V.; Jensen, L. R.; She, Q; Garrett, R. A. (2011). "Dynamic properties of the Sulfolobus CRISPR/Cas and CRISPR/Cmr systems when challenged with vector-borne viral and plasmid genes and protospacers". Molecular microbiology 79 (1): 35–49. doi:10.1111/j.1365-2958.2010.07452.x. PMC 3025118. PMID 21166892.
- ↑ Manica, A; Zebec, Z; Teichmann, D; Schleper, C (2011). "In vivo activity of CRISPR-mediated virus defence in a hyperthermophilic archaeon". Molecular microbiology 80 (2): 481–91. doi:10.1111/j.1365-2958.2011.07586.x. PMID 21385233.
- ↑ Jore, M. M.; Lundgren, M; Van Duijn, E; Bultema, J. B.; Westra, E. R.; Waghmare, S. P.; Wiedenheft, B; Pul, U; Wurm, R; Wagner, R; Beijer, M. R.; Barendregt, A; Zhou, K; Snijders, A. P.; Dickman, M. J.; Doudna, J. A.; Boekema, E. J.; Heck, A. J.; Van Der Oost, J; Brouns, S. J. (2011). "Structural basis for CRISPR RNA-guided DNA recognition by Cascade". Nature structural & molecular biology 18 (5): 529–36. doi:10.1038/nsmb.2019. PMID 21460843.
- ↑ Wiedenheft, B; Lander, G. C.; Zhou, K; Jore, M. M.; Brouns, S. J.; Van Der Oost, J; Doudna, J. A.; Nogales, E (2011). "Structures of the RNA-guided surveillance complex from a bacterial immune system". Nature 477 (7365): 486–9. doi:10.1038/nature10402. PMID 21938068.
- ↑ Zhang, J; Rouillon, C; Kerou, M; Reeks, J; Brugger, K; Graham, S; Reimann, J; Cannone, G; Liu, H; Albers, S. V.; Naismith, J. H.; Spagnolo, L; White, M. F. (2012). "Structure and mechanism of the CMR complex for CRISPR-mediated antiviral immunity". Molecular cell 45 (3): 303–13. doi:10.1016/j.molcel.2011.12.013. PMC 3381847. PMID 22227115.
- ↑ a b Hale, C. R.; Zhao, P.; Olson, S.; Duff, M. O.; Graveley, B. R.; Wells, L.; Terns, R. M.; Terns, M. P. (2009). "RNA-Guided RNA Cleavage by a CRISPR RNA-Cas Protein Complex". Cell 139 (5): 945–956. doi:10.1016/j.cell.2009.07.040. PMC 2951265. PMID 19945378. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid19945378» está definido varias veces con contenidos diferentes - ↑ a b c Marraffini, L. A.; Sontheimer, E. J. (2010). "Self versus non-self discrimination during CRISPR RNA-directed immunity". Nature 463 (7280): 568–571. doi:10.1038/nature08703. PMC 2813891. PMID 20072129. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid20072129» está definido varias veces con contenidos diferentes - ↑ Touchon, M.; Rocha, E. P. C. (2010). Randau, Lennart, ed. "The Small, Slow and Specialized CRISPR and Anti-CRISPR of Escherichia and Salmonella". PLoS ONE 5 (6): e11126. doi:10.1371/journal.pone.0011126. PMC 2886076. PMID 20559554.
- ↑ a b c Rho, M; Wu, Y. W.; Tang, H; Doak, T. G.; Ye, Y (2012). "Diverse CRISPRs evolving in human microbiomes". PLoS genetics 8 (6): e1002441. doi:10.1371/journal.pgen.1002441. PMC 3374615. PMID 22719260. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid22719260» está definido varias veces con contenidos diferentes - ↑ a b Sun, C. L.; Barrangou, R; Thomas, B. C.; Horvath, P; Fremaux, C; Banfield, J. F. (2013). "Phage mutations in response to CRISPR diversification in a bacterial population". Environmental microbiology 15 (2): 463–70. doi:10.1111/j.1462-2920.2012.02879.x. PMID 23057534. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid23057534» está definido varias veces con contenidos diferentes - ↑ Kuno, S; Sako, Y; Yoshida, T (2014). "Diversification of CRISPR within coexisting genotypes in a natural population of the bloom-forming cyanobacterium Microcystis aeruginosa". Microbiology (Reading, England) 160 (Pt 5): 903–16. doi:10.1099/mic.0.073494-0. PMID 24586036.
- ↑ Bland, C; Ramsey, T. L.; Sabree, F; Lowe, M; Brown, K; Kyrpides, N. C.; Hugenholtz, P (2007). "CRISPR recognition tool (CRT): A tool for automatic detection of clustered regularly interspaced palindromic repeats". BMC bioinformatics 8: 209. doi:10.1186/1471-2105-8-209. PMC 1924867. PMID 17577412.
- ↑ Edgar, R. C. (2007). "PILER-CR: Fast and accurate identification of CRISPR repeats". BMC bioinformatics 8: 18. doi:10.1186/1471-2105-8-18. PMC 1790904. PMID 17239253.
- ↑ Grissa, I; Vergnaud, G; Pourcel, C (2007). "CRISPRFinder: A web tool to identify clustered regularly interspaced short palindromic repeats". Nucleic acids research 35 (Web Server issue): W52–7. doi:10.1093/nar/gkm360. PMC 1933234. PMID 17537822.
- ↑ Pride, D. T.; Salzman, J; Relman, D. A. (2012). "Comparisons of clustered regularly interspaced short palindromic repeats and viromes in human saliva reveal bacterial adaptations to salivary viruses". Environmental microbiology 14 (9): 2564–76. doi:10.1111/j.1462-2920.2012.02775.x. PMC 3424356. PMID 22583485.
- ↑ Held, N. L.; Herrera, A; Whitaker, R. J. (2013). "Reassortment of CRISPR repeat-spacer loci in Sulfolobus islandicus". Environmental microbiology. doi:10.1111/1462-2920.12146. PMID 23701169.
- ↑ Held, N. L.; Herrera, A; Cadillo-Quiroz, H; Whitaker, R. J. (2010). "CRISPR associated diversity within a population of Sulfolobus islandicus". PloS one 5 (9). doi:10.1371/journal.pone.0012988. PMC 2946923. PMID 20927396.
- ↑ Skennerton, C. T.; Imelfort, M; Tyson, G. W. (2013). "Crass: Identification and reconstruction of CRISPR from unassembled metagenomic data". Nucleic acids research 41 (10): e105. doi:10.1093/nar/gkt183. PMC 3664793. PMID 23511966.
- ↑ Stern, A; Mick, E; Tirosh, I; Sagy, O; Sorek, R (2012). "CRISPR targeting reveals a reservoir of common phages associated with the human gut microbiome". Genome research 22 (10): 1985–94. doi:10.1101/gr.138297.112. PMC 3460193. PMID 22732228.
- ↑ Koonin, E. V.; Wolf, Y. I. (2009). "Is evolution Darwinian or/and Lamarckian?". Biology Direct 4: 42. doi:10.1186/1745-6150-4-42. PMC 2781790. PMID 19906303.
- ↑ Heidelberg, J. F.; Nelson, W. C.; Schoenfeld, T.; Bhaya, D. (2009). Ahmed, Niyaz, ed. "Germ Warfare in a Microbial Mat Community: CRISPRs Provide Insights into the Co-Evolution of Host and Viral Genomes". PLoS ONE 4 (1): e4169. doi:10.1371/journal.pone.0004169. PMC 2612747. PMID 19132092.
- ↑ Sampson, T. R.; Saroj, S. D.; Llewellyn, A. C.; Tzeng, Y. L.; Weiss, D. S. (2013). "A CRISPR/Cas system mediates bacterial innate immune evasion and virulence". Nature 497 (7448): 254–7. doi:10.1038/nature12048. PMC 3651764. PMID 23584588.
- ↑ Hale, C. R.; Majumdar, S.; Elmore, J.; Pfister, N.; Compton, M.; Olson, S.; Resch, A. M.; Glover Cv, C. V. C.; Graveley, B. R.; Terns, R. M.; Terns, M. P. (2012). "Essential Features and Rational Design of CRISPR RNAs that Function with the Cas RAMP Module Complex to Cleave RNAs". Molecular Cell 45 (3): 292–302. doi:10.1016/j.molcel.2011.10.023. PMC 3278580. PMID 22227116.
- ↑ Sorek, R.; Kunin, V.; Hugenholtz, P. (2008). "CRISPR — a widespread system that provides acquired resistance against phages in bacteria and archaea". Nature Reviews Microbiology 6 (3): 181–186. doi:10.1038/nrmicro1793. PMID 18157154.
- ↑ Gasiunas, G.; Barrangou, R.; Horvath, P.; Siksnys, V. (2012). "Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria". Proceedings of the National Academy of Sciences 109 (39): E2579–E2586. doi:10.1073/pnas.1208507109. PMC 3465414. PMID 22949671.
- ↑ Cong L, Ran F, Cox D, Lin S, Barretto R, Habib N et al. (Feb 2013). "Multiplex genome engineering using CRISPR/Cas systems". Science 339 (6121): 819–823. doi:10.1126/science.1231143. PMC 3795411. PMID 23287718.
- ↑ Mali P, Yang L, Esvelt K, Aach J, Guell M, DiCarlo J et al. (Feb 2013). "RNA-guided human genome engineering via Cas9". Science 339 (6121): 823–826. doi:10.1126/science.1232033. PMC 3712628. PMID 23287722.
- ↑ Hou Z, Zhang Y, Propson N, Howden S, Chu L, Sontheimer E et al. (Sep 2013). "Efficient genome engineering in human pluripotent stem cells using Cas9 from Neisseria meningitidis". Proceedings of the National Academy of Sciences of the United States of America 110 (39): 15644. doi:10.1073/pnas.1313587110.
- ↑ a b Young, Susan. «Biotech Startup Editas Medicine Wants to Cure Grievous Genetic Diseases with New Genome Editing Technology | MIT Technology Review». Technologyreview.com. Consultado el 30 de noviembre de 2013.
- ↑ «Seamless gene correction of β-thalassemia mutations in patient-specific iPSCs using CRISPR/Cas9 and piggyBac».
- ↑ Talbot, David (19 de julio de 2014). «Beijing Researchers Use Gene Editing to Create Disease-Resistant Wheat | MIT Technology Review». Technologyreview.com. Consultado el 23 de julio de 2014.
- ↑ Wang, Yanpeng (2014). "Simultaneous editing of three homoeoalleles in hexaploid bread wheat confers heritable resistance to powdery mildew". Nature Biotechnology. doi:10.1038/nbt.2969.
- ↑ Novick, R. P.; Christie, G. E.; Penadés, J. R. (2010). "The phage-related chromosomal islands of Gram-positive bacteria". Nature Reviews Microbiology 8 (8): 541–551. doi:10.1038/nrmicro2393. PMC 3522866. PMID 20634809.
- ↑ Seed, K. D.; Lazinski, D. W.; Calderwood, S. B.; Camilli, A. (2013). "A bacteriophage encodes its own CRISPR/Cas adaptive response to evade host innate immunity". Nature 494 (7438): 489–491. doi:10.1038/nature11927. PMC 3587790. PMID 23446421.
- ↑ «Methods And Compositions For Rna-directed Target Dna Modification And For Rna-directed Modulation Of Transcription». Freshpatents.com. Consultado el 13 de abril de 2014.
- ↑ a b c Who Owns the Biggest Biotech Discovery of the Century? Antonio Regalado, Technology Review, 04 December 2014.
Mayor información
- Sander, J. D.; Joung, J. K. (2014). "CRISPR-Cas systems for editing, regulating and targeting genomes". Nature Biotechnology 32 (4): 347–55. doi:10.1038/nbt.2842. PMID 24584096.
- Terns, R. M.; Terns, M. P. (2014). "CRISPR-based technologies: Prokaryotic defense weapons repurposed". Trends in Genetics 30 (3): 111–8. doi:10.1016/j.tig.2014.01.003. PMID 24555991.
- Westra, E. R.; Buckling, A.; Fineran, P. C. (2014). "CRISPR–Cas systems: Beyond adaptive immunity". Nature Reviews Microbiology. doi:10.1038/nrmicro3241.
- Horvath, P.; Romero, D. A.; Coûté-Monvoisin, A. -C.; Richards, M.; Deveau, H.; Moineau, S.; Boyaval, P.; Fremaux, C.; Barrangou, R. (2007). "Diversity, Activity, and Evolution of CRISPR Loci in Streptococcus thermophilus". Journal of Bacteriology 190 (4): 1401–1412. doi:10.1128/JB.01415-07. PMC 2238196. PMID 18065539.
- Deveau, H.; Barrangou, R.; Garneau, J. E.; Labonté, J.; Fremaux, C.; Boyaval, P.; Romero, D. A.; Horvath, P.; Moineau, S. (2007). "Phage Response to CRISPR-Encoded Resistance in Streptococcus thermophilus". Journal of Bacteriology 190 (4): 1390–1400. doi:10.1128/JB.01412-07. PMC 2238228. PMID 18065545.
- Andersson, A. F.; Banfield, J. F. (2008). "Virus Population Dynamics and Acquired Virus Resistance in Natural Microbial Communities". Science 320 (5879): 1047–1050. doi:10.1126/science.1157358. PMID 18497291.
- Hale, C.; Kleppe, K.; Terns, R. M.; Terns, M. P. (2008). "Prokaryotic silencing (psi)RNAs in Pyrococcus furiosus". RNA 14 (12): 2572–2579. doi:10.1261/rna.1246808. PMC 2590957. PMID 18971321.
- Carte, J.; Wang, R.; Li, H.; Terns, R. M.; Terns, M. P. (2008). "Cas6 is an endoribonuclease that generates guide RNAs for invader defense in prokaryotes". Genes & Development 22 (24): 3489–3496. doi:10.1101/gad.1742908. PMC 2607076. PMID 19141480.
- Shah, S. A.; Hansen, N. R.; Garrett, R. A. (2009). "Distribution of CRISPR spacer matches in viruses and plasmids of crenarchaeal acidothermophiles and implications for their inhibitory mechanism". Biochemical Society Transactions 37 (Pt 1): 23–28. doi:10.1042/BST0370023. PMID 19143596.
- Lillestøl, R. K.; Shah, S. A.; Brügger, K.; Redder, P.; Phan, H.; Christiansen, J.; Garrett, R. A. (2009). "CRISPR families of the crenarchaeal genus Sulfolobus: Bidirectional transcription and dynamic properties". Molecular Microbiology 72 (1): 259–272. doi:10.1111/j.1365-2958.2009.06641.x. PMID 19239620.
- Mojica, F. J. M.; Diez-Villasenor, C.; Garcia-Martinez, J.; Almendros, C. (2009). "Short motif sequences determine the targets of the prokaryotic CRISPR defence system". Microbiology 155 (3): 733–740. doi:10.1099/mic.0.023960-0. PMID 19246744.
- Van Der Ploeg, J. R. (2009). "Analysis of CRISPR in Streptococcus mutans suggests frequent occurrence of acquired immunity against infection by M102-like bacteriophages". Microbiology 155 (6): 1966–1976. doi:10.1099/mic.0.027508-0. PMID 19383692.
- Hale, C. R.; Zhao, P.; Olson, S.; Duff, M. O.; Graveley, B. R.; Wells, L.; Terns, R. M.; Terns, M. P. (2009). "RNA-Guided RNA Cleavage by a CRISPR RNA-Cas Protein Complex". Cell 139 (5): 945–956. doi:10.1016/j.cell.2009.07.040. PMC 2951265. PMID 19945378.
- Van Der Oost, J.; Brouns, S. J. J. (2009). "RNAi: Prokaryotes Get in on the Act". Cell 139 (5): 863–865. doi:10.1016/j.cell.2009.11.018. PMID 19945373.
- Marraffini, L. A.; Sontheimer, E. J. (2010). "Self versus non-self discrimination during CRISPR RNA-directed immunity". Nature 463 (7280): 568–571. doi:10.1038/nature08703. PMC 2813891. PMID 20072129.
- Karginov, F. V.; Hannon, G. J. (2010). "The CRISPR System: Small RNA-Guided Defense in Bacteria and Archaea". Molecular Cell 37 (1): 7–19. doi:10.1016/j.molcel.2009.12.033. PMC 2819186. PMID 20129051.
- Pul, Ü.; Wurm, R.; Arslan, Z.; Geissen, R.; Hofmann, N.; Wagner, R. (2010). "Identification and characterization ofE. ColiCRISPR-caspromoters and their silencing by H-NS". Molecular Microbiology 75 (6): 1495–1512. doi:10.1111/j.1365-2958.2010.07073.x. PMID 20132443.
- Diez-Villasenor, C.; Almendros, C.; Garcia-Martinez, J.; Mojica, F. J. M. (2010). "Diversity of CRISPR loci in Escherichia coli". Microbiology 156 (5): 1351–1361. doi:10.1099/mic.0.036046-0. PMID 20133361.
- Deveau, H. L. N.; Garneau, J. E.; Moineau, S. (2010). "CRISPR/Cas System and Its Role in Phage-Bacteria Interactions". Annual Review of Microbiology 64: 475–493. doi:10.1146/annurev.micro.112408.134123. PMID 20528693.
- Koonin, E. V.; Makarova, K. S. (2009). "CRISPR-Cas: An adaptive immunity system in prokaryotes". F1000 Biology Reports 1: 95. doi:10.3410/B1-95. PMC 2884157. PMID 20556198.
- Touchon, M.; Rocha, E. P. C. (2010). Randau, Lennart, ed. "The Small, Slow and Specialized CRISPR and Anti-CRISPR of Escherichia and Salmonella". PLoS ONE 5 (6): e11126. doi:10.1371/journal.pone.0011126. PMC 2886076. PMID 20559554.