Enlace carbono-nitrógeno
Un enlace carbono-nitrógeno es un enlace covalente entre carbono y nitrógeno y uno de los más abundantes en la química orgánica y la bioquímica.[1]
El nitrógeno tiene cinco electrones de valencia, y en las aminas simples es trivalente, formando los dos electrones sobrantes un par solitario. Con ese par, el nitrógeno puede formar un enlace adicional con hidrógeno, resultando así tetravalente, con una carga positiva en las sales de amonio. Muchos compuestos de nitrógeno pueden por tanto ser básicos, pero su grado de basicidad depende en su configuración: el átomo de nitrógeno de las amidas no es básico debido a la deslocalización del par solitario en un enlace doble, y en el caso del pirrol el par solitario es parte de un sexteto aromático.
Al igual que los enlaces carbono-carbono, se pueden formar enlaces dobles carbono-nitrógeno, como en el caso de las iminas, o incluso triples, como en los nitrilos. La longitud de enlace es de 147,9 pm en las aminas simples, 147,5 pm en los compuestos C-N= como el nitrometano, 135,2 pm en los enlaces dobles parciales de la piridina y 115,8 pm en los enlaces triples de compuestos tales como los nitrilos.[2] La fuerza de enlace de un enlace CN es mayor (184 kcal/mol) que la de un enlace CC (145 kcal/mol).[2]
Los enlaces CN están fuertemente polarizados hacia el nitrógeno, ya que es más electronegativo (3,04) que el carbono (2,55), por lo que los momentos dipolares pueden ser elevados: 4,27 D en la cianamida, 1,5 D en el diazometano, 2,17 D en la metilazida y 2,19 D en la piridina. Por este motivo, muchos de los compuestos que contienen enlaces CN son solubles en agua.
Grupos funcionales con nitrógeno
| Nombre | Orden de enlace | Fórmula | Fórmula estructural | Ejemplo | Longitud media de enlace C-N (Å)[3] |
|---|---|---|---|---|---|
| Aminas | 1 | R2C-NH2 | 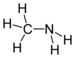 Metilamina |
1,469 (neutral amine) 1.499 (sal de amonio) | |
| Aziridinas | 1 | CH2NHCH2 | 
|
 Mitomicina |
1,472 |
| Azidas | 1 | R2C-N3 |  Fenilazida |
||
| Anilinas | 1 | Ph-NH2 | 
|
 Anisidina |
1,355 (sp2 N) 1,395 (sp3 N) 1,465 (sal de amonio) |
| Pirroles | 1 | 
|
 Porfirina |
1,372 | |
| Amidas | 1,2 | R-CO-NR2 | 
|
 Acetamida |
1,325 (primario) 1,334 (secundario) 1,346 (terciario) |
| Piridinas | 1,5 | pyr | 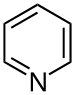
|
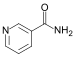 Nicotinamida |
1,337 |
| Iminas | 2 | R2C=NR | imina |  DBN |
1,279 (enlace C=N) 1,465 (enlace C–N) |
| Nitrilos | 3 | R-CN |  Benzonitrilo |
1,136 | |
| Isonitrilos | 3 | R-NC | TOSMIC |
Véase también
- Otros enlaces entre el carbono y elementos del grupo 15: por ejemplo, enlace carbono-fósforo
- Otros enlaces entre el carbono y elementos del periodo 2: enlace carbono-litio, enlace carbono-berilio, enlace carbono-boro, enlace carbono-carbono, enlace carbono-oxígeno, enlace carbono-flúor
Enlaces químicos del carbono con el resto de átomos
| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Química orgánica básica. | Muchos usos en Química. |
| Investigación académica, pero no un amplio uso. |
Enlace desconocido / no evaluado. |
Referencias
- ↑ Organic Chemistry John McMurry 2nd Ed.
- ↑ a b CRC Handbook of Chemistry and Physics 65Th Ed.
- ↑ F. H. Allen, O. Kennard, D. G. Watson, L. Brammer, A. G. Orpen. Tables of bond Lengths determined by X-Ray and Neutron Diffraction. Part 1. Bond Lengths in Organic Compounds. J. Chem. Soc. Perkin Trans. II 1987, S1-S19.
