Compuesto de organoselenio

Los compuestos de organoselenio son compuestos químicos que contienen enlaces químicos entre átomos de carbono y de selenio. La química de organoselenio es la ciencia a la que corresponde explorar sus propiedades y reactividad.[1][2][3][4] El selenio pertenece junto al oxígeno y el azufre al grupo 16 de elementos de la tabla periódica y son de esperar similitudes en su comportamiento químico.
El selenio puede tener distintos estados de oxidación: -2, +2, +4 y +6. El selenio (II), Se(II), es la forma dominante en la química de organoselenio. Al bajar por el grupo 16 de elementos, la fuerza del enlace carbono-anfígeno se hace cada vez menor (234 kJ/mol para el enlace C-Se y 272 kJ/mol para el enlace C-S) y las longitudes de enlace se hacen mayores (C-O: 141 pm, C-S: 181 pm y C- Se: 198 pm). Los compuestos de selenio son más nucleofílicos que los correspondientes compuestos de azufre y también son más ácidos. Los valores de pKa de los compuestos de fórmula XH2 son de 16 para el oxígeno, 7 para el azufre y 3,8 para el selenio.
A diferencia de los sulfóxidos, los correspondientes selenóxidos son inestables en presencia de β-protones y esta propiedad se utiliza en muchas reacciones orgánicas de compuestos de selenio, sobre todo en las oxidaciones de selenóxidos y en las eliminaciones de selenóxido.
Los compuestos de organoselenio se encuentran a nivel de trazas en aguas ambientales, suelos y sedimentos.[5] El primero compuesto de organoselenio aisladao, fue el seleniuro de dietilo o dietilselenio, en 1836.[6]
Clasificación estructural de los compuestos de organoselenio
- Selenoles(RSeH) son los equivalentes de selenio de los alcoholes y tioles. Estos compuestos son relativamente inestables y generalmente tienen un olor desagradable. El fenilselenol (también llamado selenofenol o PhSeH) es más ácido(pKa=5,9) que el tiofenol (pKa=6,5) y se oxida con mayor facilidad a diseleniuro. El selenofenol se prepara por reducción de diseleniuro de difenilo.[7]
- Diseleniuros (R-Se-Se-R) son los equivalentes de selenio de peróxidos y disulfuros. Son precursores útiles y estables de otros reactivos de organoselenio de mayor reactividad como los selenoles y los haluros de selenenilo. El más conocido en química orgánica es el diseleniuro de difenilo, preparado a partir de bromuro de fenilmagnesio y selenio, seguido por la oxidación del PhSeMgBr producido.[8]
- Haluros de selenilo (R-Se-Cl, R-Se-Br) se preparan por halogenación de diseleniuros. La bromación de diseleniuro de difenilo da bromuro de selenilfenilo (PhSeBr). Estos compuestos son fuentes de "PHSE+".
- Seleniuros orgánicos (R-Se-R), también llamado selenoéteres, son los equivalentes de selenio de los éteres y tioéteres. Estos son los compuestos de organoselenio más frecuentes. Los seleniuros simétricos se preparan por alquilación de seleniuros inorgánicos de metales alcalinos, por ejemplo, seleniuro de sodio. Los seleniuros asimétricos se preparan por alquilación de seleniatos. Estos compuestos por lo general reaccionan como nucleófilos, por ejemplo, con haluros de alquilo (R'-X) para dar sales de selenonio R'RRSe+X-. El selenio divalente también puede interactuar con heteroátomos suaves para formar centros hipervalentes de selenio[9] También reaccionan en determinadas circunstancias, como electrófilos, por ejemplo, con reactivos de organolitio (R'Li) para dar el complejo ato[10] R'RRSe-Li+.
- Selenóxidos (R-Se(O)-R) son los equivalentes de selenio de los sulfóxidos. Pueden ser oxidados aselenonas R-Se(O)2R, análogos de selenio de las sulfonas.
- Ácidos perselenícos (RSe(O)OOH) catalizan las reacciones de epoxidación y la oxidación de Baeyer-Villiger.

- Selenuranos son compuestos hipervalentes de organoselenio, formalmente derivados de los tetrahaluros como SeCl4. Ejemplos de ello son del tipo ArSeCl3.[11] Los cloruros son obtenidos mediante la cloración del cloruro de selenenilo.
- Seleniranos son anillos de tres miembros (padres: C2H4Se) relacionados con los tiiranos, pero, a diferencia de los tiiranos, los seleniranos son cinéticamente inestables, eliminando directamente selenio (sin oxidación) para formar alquenos. Esta propiedad ha sido utilizada en la química orgánica sintética.[12]
- Selonas (R2C=Se, llamadas a veces selenonas) son los análogos de selenio de las cetonas. Son raras, porque a su tendencia a la oligomerizarse.[13] La diselenobenzoquinona es estable como complejo metálico.[14] La selenourea es un ejemplo de un compuesto estable que contiene un enlace doble C=Se.
Compuestos de organoselenio en la naturaleza
El selenio es necesario para la vida, aunque sólo en pequeñas cantidades. La selenocisteína es un aminoácido que contiene selenol que se encuentra codificado de una manera especial por el ADN.[15] La selenometionina es un aminoácido que contiene selenio, que también se presenta de forma natural, aunque se genera por modificación post-transcripcional. La glutatión oxidasa es una enzima con un diseleniuro en su sitio activo. La glutatión peroxidasa actúa como catalizador en la reducción del peróxido de hidrógeno, previniendo el daño del tejido por oxidación.[16]
Química de organoselenio en las síntesis orgánicas
Los compuestos de organoselenio son un conjunto especializado de reactivos, pero útiles en síntesis orgánica, a pesar de que son generalmente excluidos de los procesos útiles para productos farmacéuticos, debido a cuestiones reglamentarias. Su utilidad depende de ciertos atributos, incluyendo la debilidad del enlace C-Se y la fácil oxidación de los compuestos de selenio divalente.
Seleniuros vinílicos
Los seleniuros vinílicos son compuestos de organoselenio que juegan un papel en síntesis orgánica, especialmente en el desarrollo de prácticas rutas estereoselectivas para obtener alquenos funcionalizados.[17] Aunque existen diversos métodos para la preparación de seleniuro de vinilo, uno de los procedimiento más útiles se centra en la adición nucleófila o electrofílica de compuestos de organoselenio a alquinos terminales o internos.[18][19][20][21] For example, the nucleophilic addition of selenophenol to alkynes affords, preferentially, the Z-vinylic selenides after longer reaction times at room temperature.The reaction is faster at a high temperature; however, the mixture of Z- and E-vinylic selenides was obtained in an almost 1:1 ratio.[22] Por otro lado, los aductos dependerán de la naturaleza de los sustituyentes en el triple enlace. Por el contrario, los seleniuros vinílicos se pueden preparar por hidroselenación catalizada por paladio de alquinos para permitir la formación de aductos de Markownikov con buenos rendimientos. Hay algunas limitaciones asociadas con las metodologías para preparar seleniuros vinílicos que se ilustran arriba; los procedimientos descritos emplean diseleniuros de diorganoílo o selenofenol como materias primas, que son volátiles e inestables y tienen un olor desagradable. Además, la preparación de estos compuestos es compleja.
Oxidaciones de selenóxidos
El dióxido de selenio es útil en las oxidaciones orgánicas. En concreto, SeO2 convertirá un grupo metileno alílico en el correspondiente alcohol. Otros reactivos también llevan a cabo esta reacción.

En términos del mecanismo de reacción, el SeO2 y el sustrato alílico reaccionan a través de procesos pericíclicos a partir de una reacción eno que activa el enlace C-H. El segundo paso es una [2,3] reacción sigmatrópica. Las oxidaciones en las que participa el dióxido de selenio a menudo se llevan a cabo con cantidades catalíticas del compuesto de selenio y en presencia de un catalizador sacrificial o co-oxidante tal como peróxido de hidrógeno.
Las oxidaciones basadas en SeO2 a veces producen compuestos con grupos carbonilo, tales como cetonas,[23] β-pineno[24] y la oxidación de ciclohexanona en 1,2-ciclohexanodiona.[25] La oxidación de cetonas que tienen grupos α-metileno producen dicetonas. Este tipo de oxidación con óxido de selenio se llamaoxidación Riley.[26]
Eliminaciones de selenóxido
En presencia de un β-protón, un seleniuro dará una reacción de eliminación después de la oxidación, para producir un alqueno y un selenol. En la reacción de eliminación, los cinco centros participantes en la reacción son coplanares y, por tanto, la estereoquímica de la reacción es la de una eliminación syn. Los agentes oxidantes utilizados son peróxido de hidrógeno, ozono o MCPBA. Este tipo de reacción se utiliza a menudo con cetonas que conducen a enonas. Un ejemplo es la eliminación de acetilciclohexanona con cloruro de selenilbenceno e hidruro de sodio[27]
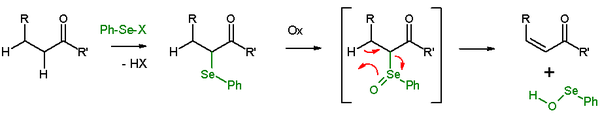
La eliminación Grieco es una eliminación similar a la de selenóxido con o-nitrofenilselenocianato y tributilfosfina para causar la eliminación de los elementos de H2O.
Véase también
 Wikimedia Commons alberga una categoría multimedia sobre Compuesto de organoselenio.
Wikimedia Commons alberga una categoría multimedia sobre Compuesto de organoselenio.- Química del carbono enlazado a otros elementos de la tabla periódica:
Enlaces químicos del carbono con el resto de átomos
| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Química orgánica básica. | Muchos usos en Química. |
| Investigación académica, pero no un amplio uso. |
Enlace desconocido / no evaluado. |
Referencias
- ↑ A. Krief, L. Hevesi, Organoselenium Chemistry I. Functional Group Transformations., Springer, Berlin, 1988 ISBN 3-540-18629-8
- ↑ S. Patai, Z. Rappoport (Eds.), The Chemistry of Organic Selenium and Tellurium Compounds, John. Wiley and Sons, Chichester, Vol. 1, 1986 ISBN 0-471-90425-2
- ↑ Paulmier, C. Selenium Reagents and Intermediates in Organic Synthesis; Baldwin, J. E., Ed.; Pergamon Books Ltd.: New York, 1986 ISBN 0-08-032484-3
- ↑ Freudendahl, Diana M.; Santoro, Stefano; Shahzad, Sohail A.; Santi, Claudio; Wirth, Thomas (2009). «Green Chemistry with Selenium Reagents: Development of Efficient Catalytic Reactions». Angewandte Chemie International Edition 48 (45): 8409. PMID 19802863. doi:10.1002/anie.200903893.
- ↑ Wallschläger, D.; Feldmann, F. (2010). Formation, Occurrence, Significance, and Analysis of Organoselenium and Organotellurium Compounds in the Environment. Metal Ions in Life Sciences. 7, Organometallics in Environment and Toxicology. RSC Publishing. pp. 319-364. ISBN 978-1-84755-177-1.
- ↑ Lwig, C. J. Pogg. Ann. 1836, 37, 552
- ↑ Organic Syntheses, Coll. Vol. 3, p. 771 (1955); Vol. 24, p. 89 (1944) Online Article.
- ↑ Organic Syntheses, Coll. Vol. 6, p. 533 (1988); Vol. 59, p. 141 (1979) Article
- ↑ Organoselenium Chemistry: Role of Intramolecular Interactions 2010 Anna J. Mukherjee, Sanjio S. Zade, Harkesh B. Singh and Raghavan B. Sunoj Chem. Rev., Article ASAP doi 10.1021/cr900352j
- ↑ Un complejo ato es la contrapartida negativa de un complejo onio (amonio, oxonio). Química orgánica. Robert Thornton Morrison, Robert Neilson Boyd. Pearson Educación, 1998. ISBN: 9684443404. Pág. 100
- ↑ Chemistry of hypervalent compounds (1999) Kin-ya Akiba ISBN 978-0-471-24019-8
- ↑ Enlace Developments in the chemistry of selenaheterocyclic compounds of practical importance in synthesis and medicinal biology Arkivoc 2006 (JE-1901MR) Jacek Młochowski, Krystian Kloc, Rafał Lisiak, Piotr Potaczek, and Halina Wójtowicz
- ↑ Okazaki, R.; Tokitoh, N. (2000). «Heavy ketones, the heavier element congeners of a ketone». Accounts of chemical research (en inglés) 33 (9): 625-630. PMID 10995200. doi:10.1021/ar980073b.
- ↑ Amouri, H., Moussa, J., Renfrew, A. K., Dyson, P. J., Rager, M. N. and Chamoreau, L.-M. (2010), Discovery, Structure, and Anticancer Activity of an Iridium Complex of Diselenobenzoquinone. Angewandte Chemie International Edition, 49: 7530–7533. doi 10.1002/anie.201002532
- ↑ Selenocisteína. En: Biología molecular del gen. James Watson. Ed. Médica Panamericana, 2006. ISBN: 8479035056. Pág. 453
- ↑ La importancia del selenio. Seleno Source AF 2000
- ↑ Comasseto, João Valdir; Ling, Lo Wai; Petragnani, Nicola; Stefani, Helio Alexandre (1997). «Vinylic Selenides and Tellurides - Preparation, Reactivity and Synthetic Applications». Synthesis 1997 (04): 373. doi:10.1055/s-1997-1210.
- ↑ Comasseto, J (1983). «Vinylic selenides». Journal of Organometallic Chemistry 253 (2): 131. doi:10.1016/0022-328X(83)80118-1.
- ↑ Zeni, Gilson; Stracke, Marcelo P.; Nogueira, Cristina W.; Braga, Antonio L.; Menezes, Paulo H.; Stefani, Helio A. (2004). «Hydroselenation of Alkynes by Lithium Butylselenolate: an Approach in the Synthesis of Vinylic Selenides». Organic Letters 6 (7): 1135. PMID 15040741. doi:10.1021/ol0498904.
- ↑ Dabdoub, M (2001). «Synthesis of (Z)-1-phenylseleno-1,4-diorganyl-1-buten-3-ynes: hydroselenation of symmetrical and unsymmetrical 1,4-diorganyl-1,3-butadiynes». Tetrahedron 57 (20): 4271. doi:10.1016/S0040-4020(01)00337-4.
- ↑ Doregobarros, O; Lang, E; Deoliveira, C; Peppe, C; Zeni, G (2002). «Indium(I) iodide-mediated chemio-, regio-, and stereoselective hydroselenation of 2-alkyn-1-ol derivatives». Tetrahedron Letters 43 (44): 7921. doi:10.1016/S0040-4039(02)01904-4.
- ↑ Comasseto, J (1981). «Stereoselective synthesis of vinylic selenides». Journal of Organometallic Chemistry 216 (3): 287. doi:10.1016/S0022-328X(00)85812-X.
- ↑ Organic Syntheses Coll. Vol. 9, p. 396 (1998); Vol. 71, p. 181 (1993) Online article
- ↑ organic Syntheses Coll. Vol. 6, p. 946 (1988); Vol. 56, p. 25 (1977). Online article
- ↑ Organic Syntheses, Coll. Vol. 4, p. 229 (1963); Vol. 32, p. 35 (1952). Online article
- ↑ Riley, Harry Lister; Morley, John Frederick; Friend, Norman Alfred Child (1932). «255. Selenium dioxide, a new oxidising agent. Part I. Its reaction with aldehydes and ketones». Journal of the Chemical Society (Resumed): 1875. doi:10.1039/JR9320001875.
- ↑ Organic Syntheses Coll. Vol. 6, p. 23 (1988); Vol. 59, p. 58 (1979) Online Article
