Diferencia entre revisiones de «Microbiota»
Lordthe6 trasladó la página Microbiota a Microbiota (desambiguación): solo existe una definición de microbiota, por lo que no requiere ser su página principal Etiqueta: Redirección nueva |
Creado al traducir la página «Microbiota» Etiquetas: Redirección eliminada Traducción de contenido Traducción de contenido, versión 2 |
||
| Línea 1: | Línea 1: | ||
{{AP|Microbiota humana}} |
|||
[[Archivo:The_plant_microbiome.jpg|miniaturadeimagen| Diversas comunidades microbianas de microbiota característica forman parte de los [[microbioma vegetal|microbiomas vegetales]] y se encuentran en las superficies exteriores y en los tejidos internos de la planta huésped, así como en el suelo circundante. <ref>Dastogeer, K.M., Tumpa, F.H., Sultana, A., Akter, M.A. and Chakraborty, A. (2020) "Plant microbiome–an account of the factors that shape community composition and diversity". ''[[Plant Biology|Current Plant Biology]]'', '''23''': 100161. {{Doi|10.1016/j.cpb.2020.100161}}. [[File:CC-BY_icon.svg|50x50px]] Material was copied from this source, which is available under a [[creativecommons:by/4.0/|Creative Commons Attribution 4.0 International License]].</ref>]] |
|||
La '''microbiota''' es la gama de [[Microorganismo|microorganismos]] que pueden ser [[Comensalismo|comensales]], [[Simbiosis|simbióticos]] o [[Agente biológico patógeno|patógenos]] que se encuentran en y sobre todos los [[Organismo pluricelular|organismos multicelulares]], incluidas las [[Plantae|plantas]]. La microbiota incluye [[Bacteria|bacterias]], [[Archaea|arqueas]], [[Protista|protistas]], [[Fungi|hongos]] y [[virus]], <ref>{{Cita publicación|url=https://www.sciencedirect.com/science/article/pii/S1931312819300587|título=The battle within: interactions of bacteriophages and bacteria in the gastrointestinal tract|apellidos=De Sordi|nombre=Luisa|apellidos2=Lourenço|nombre2=Marta|fecha=2019|publicación=[[Cell Host & Microbe]]|volumen=25|número=2|páginas=210–18|doi=10.1016/j.chom.2019.01.018|pmid=30763535|apellidos3=Debarbieux|nombre3=Laurent}}</ref> <ref name="hmp">{{Cita publicación|título=The NIH Human Microbiome Project|apellidos=Peterson|nombre=J|apellidos2=Garges|nombre2=S|publicación=[[Genome Research]]|editorial=NIH HMP Working Group|volumen=19|número=12|páginas=2317–23|doi=10.1101/gr.096651.109|pmc=2792171|pmid=19819907|año=2009|número-autores=etal}}</ref> y se ha descubierto que son cruciales para la [[homeostasis]] inmunológica, hormonal y metabólica de su huésped. |
|||
El término ''[[microbioma]]'' describe los [[Genoma|genomas]] colectivos de los microbios que residen en un [[nicho ecológico]] o [[endosimbionte|dentro]] de los mismos microbios. <ref>{{Cita publicación|título=Host-Bacterial Mutualism in the Human Intestine|apellidos=Backhed|nombre=F.|apellidos2=Ley|nombre2=R. E.|publicación=[[Science (journal)|Science]]|volumen=307|número=5717|páginas=1915–20|bibcode=2005Sci...307.1915B|doi=10.1126/science.1104816|pmid=15790844|apellidos3=Sonnenburg|nombre3=J. L.|apellidos4=Peterson|nombre4=D. A.|apellidos5=Gordon|nombre5=J. I.|año=2005}}</ref> <ref>{{Cita publicación|título=The Human Microbiome Project|apellidos=Turnbaugh|nombre=P. J.|apellidos2=Ley|nombre2=R. E.|publicación=[[Nature (journal)|Nature]]|volumen=449|número=7164|páginas=804–10|bibcode=2007Natur.449..804T|doi=10.1038/nature06244|pmc=3709439|pmid=17943116|apellidos3=Hamady|nombre3=M.|apellidos4=Fraser-Liggett|nombre4=C. M.|apellidos5=Knight|nombre5=R.|apellidos6=Gordon|nombre6=J. I.|año=2007}}</ref> <ref>{{Cita publicación|título=Ecological and Evolutionary Forces Shaping Microbial Diversity in the Human Intestine|apellidos=Ley|nombre=R. E.|apellidos2=Peterson|nombre2=D. A.|publicación=[[Cell (journal)|Cell]]|volumen=124|número=4|páginas=837–48|doi=10.1016/j.cell.2006.02.017|pmid=16497592|apellidos3=Gordon|nombre3=J. I.|año=2006}}</ref> |
|||
El microbioma y el huésped surgieron durante la [[Evolución biológica|evolución]] como una unidad [[Sinergia|sinérgica]] a partir de la [[epigenética]] y las características genéticas, a veces denominadas colectivamente [[holobionte]]. <ref name="Salvucci2014">{{Cita publicación|título=Microbiome, holobiont and the net of life|apellidos=Salvucci|nombre=E.|publicación=[[Critical Reviews in Microbiology]]|volumen=42|número=3|páginas=485–94|doi=10.3109/1040841X.2014.962478|pmid=25430522|año=2016}}</ref> <ref>{{Cita publicación|título=Symbiogenesis: The holobiont as a unit of evolution|apellidos=Guerrero|nombre=R.|apellidos2=Margulis|nombre2=Lynn|enlaceautor2=Lynn Margulis|publicación=[[International Microbiology]]|volumen=16|número=3|páginas=133–43|doi=10.2436/20.1501.01.188|pmid=24568029|apellidos3=Berlanga|nombre3=M.|año=2013}}</ref> La presencia de microbiota en intestinos humanos y de otros metazoos ha sido fundamental para comprender la coevolución entre metazoos y bacterias. <ref>Davenport, Emily R et al. "The human microbiome in evolution". ''[[BMC Biology]]''. vol. 15,1 127. 27 Dec. 2017, doi:10.1186/s12915-017-0454-7</ref> <ref>"Evolution of the human gut flora". |
|||
Andrew H. Moeller, Yingying Li, Eitel Mpoudi Ngole, Steve Ahuka-Mundeke, Elizabeth V. Lonsdorf, Anne E. Pusey, Martine Peeters, Beatrice H. Hahn, Howard Ochman. |
|||
''[[Proceedings of the National Academy of Sciences]]''. Nov 2014, 111 (46) 16431-35; doi: 10.1073/pnas.1419136111 |
|||
</ref> La microbiota juega un papel clave en las respuestas inmunitarias y metabólicas intestinales a través de su producto de fermentación ([[Ácidos grasos de cadena corta|ácido graso de cadena corta]]), el [[acetato]]. <ref>{{Cita publicación|url=http://dx.doi.org/10.1016/j.immuni.2021.05.017|título=Microbiota-derived acetate activates intestinal innate immunity via the Tip60 histone acetyltransferase complex|apellidos=Jugder|nombre=Bat-Erdene|apellidos2=Kamareddine|nombre2=Layla|publicación=[[Immunity (journal)|Immunity]]|volumen=54|número=8|páginas=1683–97.e3|issn=1074-7613|doi=10.1016/j.immuni.2021.05.017|pmc=8363570|pmid=34107298|apellidos3=Watnick|nombre3=Paula I.|año=2021}}</ref> |
|||
== Introducción == |
|||
[[Archivo:Skin_Microbiome20169-300.jpg|miniaturadeimagen| Las especies predominantes de [[Bacteria|bacterias]] en la [[piel humana]]]] |
|||
Todas las plantas y animales, desde [[Protista|formas de vida simples]] hasta humanos, viven en estrecha asociación con organismos microbianos. <ref name="Mendes2015">{{Cita publicación|título=Cross-kingdom similarities in microbiome functions|apellidos=Mendes|nombre=R.|apellidos2=Raaijmakers|nombre2=J.M.|publicación=The ISME Journal|volumen=9|número=9|páginas=1905–1907|doi=10.1038/ismej.2015.7|pmc=4542044|pmid=25647346|año=2015}}</ref> Varios avances han impulsado la percepción de los microbiomas, entre ellos:<ref name="BoMc2011">{{Cita publicación|título=Metaorganisms as the new frontier|apellidos=Bosch|nombre=T. C. G.|apellidos2=McFall-Ngai|nombre2=M. J.|publicación=Zoology|volumen=114|número=4|páginas=185–190|doi=10.1016/j.zool.2011.04.001|pmc=3992624|pmid=21737250|año=2011}}</ref> |
|||
* La capacidad de realizar análisis genómicos y de expresión génica de células individuales y de comunidades microbianas completas en las disciplinas de [[metagenómica]] y [[metatranscriptómica]] |
|||
* Bases de datos accesibles para investigadores de múltiples disciplinas |
|||
* Métodos de análisis matemático adecuados para conjuntos de datos complejos |
|||
Los biólogos han llegado a apreciar que los microbios constituyen una parte importante del [[fenotipo]] de un organismo, mucho más allá del estudio de caso simbiótico ocasional. <ref name="BoMc2011">{{Cita publicación|título=Metaorganisms as the new frontier|apellidos=Bosch|nombre=T. C. G.|apellidos2=McFall-Ngai|nombre2=M. J.|publicación=Zoology|volumen=114|número=4|páginas=185–190|doi=10.1016/j.zool.2011.04.001|pmc=3992624|pmid=21737250|año=2011}}</ref> |
|||
=== Tipos de relaciones microbio-huésped === |
|||
El [[comensalismo]], un concepto desarrollado por [[Pierre-Joseph van Beneden]] (1809–1894), un profesor belga de la [[Universidad Católica de Lovaina (1834-1968)|Universidad de Lovaina]] durante el siglo XIX <ref>Poreau B., ''[http://www.theses.fr/2014LYO10114 Biologie et complexité : histoire et modèles du commensalisme]''. PhD Dissertation, University of Lyon, France, 2014.</ref> es fundamental para el microbioma, donde la microbiota coloniza un huésped en una coexistencia no dañina. La relación con su huésped se denomina [[Mutualismo (biología)|mutualista]] cuando los organismos realizan tareas que se sabe que son útiles para el huésped, <ref name="Prescotts">{{Cita libro|apellidos2=Willey|nombre2=Joanne|apellidos=Sherwood|nombre=Linda|apellidos3=Woolverton|nombre3=Christopher|título=Prescott's Microbiology|url={{google books |plainurl=y |id=sBCSRAAACAAJ}}|año=2013|isbn=9780073402406|editorial=McGraw Hill|ubicación=New York|edición=9th|páginas=713–721|oclc=886600661}}</ref> <ref name="Quigley2013rev">{{Cita publicación|título=Gut bacteria in health and disease|apellidos=Quigley|nombre=E. M.|fecha=Sep 2013|publicación=Gastroenterol Hepatol (N Y)|volumen=9|número=9|páginas=560–9|pmc=3983973|pmid=24729765}}</ref> [[Parasitismo|parásito]], cuando es desventajoso para el huésped. Otros autores definen una situación como mutualista donde ambos se benefician y comensal, donde el huésped no afectado beneficia al simbionte. <ref name="pnas">{{Cita publicación|título=Four hundred-million-year-old vesicular arbuscular mycorrhizae|publicación=Proc. Natl. Acad. Sci. USA|volumen=91|número=25|páginas=11841–3|bibcode=1994PNAS...9111841R|doi=10.1073/pnas.91.25.11841|pmc=45331|pmid=11607500|año=1994}}</ref> Un intercambio de nutrientes puede ser bidireccional o unidireccional, puede depender del contexto y puede ocurrir de diversas maneras. <ref name="pnas" /> La microbiota que se espera que esté presente y que, en circunstancias normales, no causa enfermedad, se considera ''flora'' normal o ''microbiota normal'' ; <ref name="Prescotts" /> la flora normal no solo puede ser inofensiva, sino que también puede proteger al huésped. <ref>{{Cita publicación|url=https://www.biomebliss.com/learning-center/gi-microbiome-and-the-immune-system/|título=The World Within Us|apellidos=Copeland|nombre=CS|fecha=Sep–Oct 2017|publicación=Healthcare Journal of New Orleans}}</ref> |
|||
=== Adquisición y cambio === |
|||
La [[adquisición inicial de la microbiota]] en los animales, desde los mamíferos hasta las [[Porifera|esponjas]] marinas, se produce al nacer, e incluso puede ocurrir a través de la línea de células germinales. En las plantas, el proceso de colonización puede iniciarse bajo tierra en la [[Rizosfera|zona de la raíz]], alrededor de la semilla en germinación, la [[espermosfera|espermósfera]], u originarse en las partes de la superficie, la [[filosfera]] y la zona de la [[flor]] o antósfera. <ref name="pgpg">{{Cita publicación|título=Use of Plant Growth-Promoting Bacteria for Biocontrol of Plant Diseases: Principles, Mechanisms of Action, and Future Prospects|publicación=Appl Environ Microbiol|volumen=71|número=9|páginas=4951–9|bibcode=2005ApEnM..71.4951C|doi=10.1128/AEM.71.9.4951-4959.2005|pmc=1214602|pmid=16151072|año=2005}}</ref> La estabilidad de la microbiota de la rizosfera a lo largo de las generaciones depende del tipo de planta, pero aún más de la composición del suelo, es decir, del entorno vivo y no vivo. <ref>{{Cita publicación|título=Stability and succession of the rhizosphere microbiota depends upon plant type and soil composition|apellidos=Tkacz|nombre=Andrzej|apellidos2=Cheema|nombre2=Jitender|fecha=Nov 2015|publicación=ISME J.|volumen=9|número=11|páginas=2349–2359|doi=10.1038/ismej.2015.41|pmc=4611498|pmid=25909975|apellidos3=Chandra|nombre3=Govind|apellidos4=Grant|nombre4=Alastair|apellidos5=Poole|nombre5=Philip S.}}</ref> Clínicamente, se puede adquirir nueva microbiota a través del trasplante de microbiota fecal para tratar infecciones como la infección crónica por ''C. difficile''. <ref>{{Cita web|url=https://www.vitalacy.com/post/clostridium-difficile-and-hand-hygiene|título=What is Clostridium difficile?|autor=Copeland|nombre=CS|fecha=19 April 2019|sitioweb=Vitalacy}}</ref> |
|||
== Microbiota por huésped == |
|||
[[Archivo:Commensals_vs_pathogens_mechanism.png|miniaturadeimagen| Microbiota [[Agente biológico patógeno|patógena]] que causa [[inflamación]] en el pulmón]] |
|||
=== Humanos === |
|||
{{AP|Human microbiota}} |
|||
La microbiota humana incluye [[Bacteria|bacterias]], [[Fungi|hongos]], [[Archaea|arqueas]] y virus. Se excluyen [[Microanimal|los microanimales]] que viven en el cuerpo humano. El [[Microbiota normal|microbioma humano]] se refiere a sus [[Genoma|genomas]] colectivos. <ref name="Prescotts">{{Cita libro|apellidos2=Willey|nombre2=Joanne|apellidos=Sherwood|nombre=Linda|apellidos3=Woolverton|nombre3=Christopher|título=Prescott's Microbiology|url={{google books |plainurl=y |id=sBCSRAAACAAJ}}|año=2013|isbn=9780073402406|editorial=McGraw Hill|ubicación=New York|edición=9th|páginas=713–721|oclc=886600661}}</ref> |
|||
Los seres humanos están colonizados por muchos microorganismos; la estimación tradicional era que los humanos viven con diez veces más células no humanas que células humanas; estimaciones más recientes han reducido esto a 3:1 e incluso a aproximadamente 1:1. <ref name="Rosner">Judah L. Rosner for Microbe Magazine, Feb 2014. [http://www.asmscience.org/content/journal/microbe/10.1128/microbe.9.47.2 Ten Times More Microbial Cells than Body Cells in Humans?]</ref> <ref name="NN2016">Alison Abbott for Nature News. Jan 8 2016 [http://www.nature.com/news/scientists-bust-myth-that-our-bodies-have-more-bacteria-than-human-cells-1.19136 Scientists bust myth that our bodies have more bacteria than human cells]</ref> <ref name="Sender">{{Cita publicación|título=Are We Really Vastly Outnumbered? Revisiting the Ratio of Bacterial to Host Cells in Humans|apellidos=Sender|nombre=R|apellidos2=Fuchs|nombre2=S|fecha=Jan 2016|publicación=Cell|volumen=164|número=3|páginas=337–40|doi=10.1016/j.cell.2016.01.013|pmid=26824647|apellidos3=Milo|nombre3=R}}</ref> |
|||
De hecho, estos son tan pequeños que hay alrededor de 100 billones de microbiota en el cuerpo humano. <ref>"On and in You." Micropia, www.micropia.nl/en/discover/stories/on-and-in-you/#:~:text=They're%20on%20you%2C%20in,re%20known%20as%20human%20microbiota.</ref> |
|||
El [[Proyecto Microbioma Humano]] secuenció el genoma de la microbiota humana, centrándose particularmente en la microbiota que normalmente habita en la piel, la boca, la nariz, el tracto digestivo y la vagina. <ref name="Prescotts">{{Cita libro|apellidos2=Willey|nombre2=Joanne|apellidos=Sherwood|nombre=Linda|apellidos3=Woolverton|nombre3=Christopher|título=Prescott's Microbiology|url={{google books |plainurl=y |id=sBCSRAAACAAJ}}|año=2013|isbn=9780073402406|editorial=McGraw Hill|ubicación=New York|edición=9th|páginas=713–721|oclc=886600661}}</ref> Alcanzó un hito en 2012 cuando publicó los resultados iniciales. <ref name="hmpdata">{{Cita web|url=http://www.nih.gov/news/health/jun2012/nhgri-13.htm|título=NIH Human Microbiome Project defines normal bacterial makeup of the body|fecha=13 June 2012|editorial=NIH News}}</ref> |
|||
=== Animales === |
|||
* Los anfibios tienen microbiota en la piel. <ref>{{Cita publicación|título=Microbiome Variation Across Amphibian Skin Regions: Implications for Chytridiomycosis Mitigation Efforts|apellidos=Bataille|nombre=A|apellidos2=Lee-Cruz|nombre2=L|fecha=Jan 2016|publicación=Microb. Ecol.|volumen=71|número=1|páginas=221–32|doi=10.1007/s00248-015-0653-0|pmid=26271741|apellidos3=Tripathi|nombre3=B|apellidos4=Kim|nombre4=H|apellidos5=Waldman|nombre5=B}}</ref> Algunas especies son capaces de portar un hongo llamado ''Batrachochytrium dendrobatidis'', que en otras puede causar una infección mortal llamada [[Quitridiomicosis]] dependiendo de su microbioma, resistiendo la colonización de patógenos o inhibiendo su crecimiento con péptidos cutáneos antimicrobianos. <ref>{{Cita publicación|título=Innate immune defenses of amphibian skin: antimicrobial peptides and more|publicación=Animal Conservation|volumen=10|número=4|páginas=425–8|doi=10.1111/j.1469-1795.2007.00150.x|año=2007}}</ref> |
|||
* En los mamíferos, los herbívoros como el ganado dependen de su microbioma [[Rumen|ruminal]] para convertir la celulosa en proteínas, ácidos grasos de cadena corta y gases. Los métodos de cultivo no pueden proporcionar información sobre todos los microorganismos presentes. Los estudios metagenómicos comparativos arrojaron el sorprendente resultado de que el ganado individual posee estructuras comunitarias, fenotipo predicho y potenciales metabólicos marcadamente diferentes, <ref>{{Cita publicación|título=Gene-centric metagenomics of the fiber-adherent bovine rumen microbiome reveals forage specific glycoside hydrolases|apellidos=Brulc JM|apellidos2=Antonopoulos DA|publicación=Proc. Natl. Acad. Sci. USA|volumen=106|número=6|páginas=1948–53|bibcode=2009PNAS..106.1948B|doi=10.1073/pnas.0806191105|pmc=2633212|pmid=19181843|apellidos3=Miller MEB|año=2009|número-autores=et al}}</ref> a pesar de que fueron alimentados con dietas idénticas, fueron alojados juntos y aparentemente fueron funcionalmente idénticos en su utilización de recursos de la pared celular vegetal. |
|||
* Los [[ratón|ratones]] se han convertido en los mamíferos más estudiados en cuanto a sus microbiomas. La microbiota intestinal se ha estudiado en relación con la enfermedad alérgica de las vías respiratorias, la obesidad, las enfermedades gastrointestinales y la diabetes. El cambio perinatal de la microbiota a través de dosis bajas de antibióticos puede tener efectos duraderos sobre la susceptibilidad futura a la enfermedad alérgica de las vías respiratorias. La frecuencia de ciertos subconjuntos de microbios se ha relacionado con la gravedad de la enfermedad. La presencia de microbios específicos al principio de la vida posnatal instruye futuras respuestas inmunitarias. <ref name="pmid = 22422004">{{Cita publicación|título=Early life antibiotic-driven changes in microbiota enhance susceptibility to allergic asthma|apellidos=Russell SL, Gold MJ|fecha=May 2012|publicación=EMBO Rep.|volumen=13|número=5|páginas=440–7|doi=10.1038/embor.2012.32|pmc=3343350|pmid=22422004|número-autores=etal}}</ref> <ref name="pmid = 25145536">{{Cita publicación|título=Perinatal antibiotic-induced shifts in gut microbiota have differential effects on inflammatory lung diseases|fecha=Aug 2014|publicación=J Allergy Clin Immunol|volumen=135|número=1|páginas=100–9|doi=10.1016/j.jaci.2014.06.027|pmid=25145536}}</ref> En ratones gnotobióticos, se descubrió que ciertas bacterias intestinales transmitían un fenotipo particular a los ratones receptores libres de gérmenes, lo que promovía la acumulación de células T reguladoras del colon y cepas que modulaban la adiposidad del ratón y las concentraciones de metabolitos cecales. <ref name="pmid = 17183312">{{Cita publicación|título=An obesity-associated gut microbiome with increased capacity for energy harvest|fecha=Dec 2006|publicación=Nature|volumen=444|número=7122|páginas=1027–31|bibcode=2006Natur.444.1027T|doi=10.1038/nature05414|pmid=17183312}}</ref> Este enfoque combinatorio permite una comprensión a nivel de sistemas de las contribuciones microbianas a la biología humana. <ref name="pmid = 24452263">{{Cita publicación|título=Identifying gut microbe-host phenotype relationships using combinatorial communities in gnotobiotic mice.|fecha=Jan 2014|publicación=Sci. Transl. Med.|volumen=6|número=220|páginas=220|doi=10.1126/scitranslmed.3008051|pmc=3973144|pmid=24452263}}</ref> Pero también se han estudiado otros tejidos mucoides como el pulmón y la vagina en relación con enfermedades como el asma, la alergia y la vaginosis. <ref>{{Cita publicación|título=The murine lung microbiome in relation to the intestinal and vaginal bacterial communities|apellidos=Barfod|nombre=KK|apellidos2=Roggenbuck|nombre2=M|publicación=BMC Microbiol|volumen=13|página=303|doi=10.1186/1471-2180-13-303|pmc=3878784|pmid=24373613|apellidos3=Hansen|nombre3=LH|apellidos4=Schjørring|nombre4=S|apellidos5=Larsen|nombre5=ST|apellidos6=Sørensen|nombre6=SJ|apellidos7=Krogfelt|nombre7=KA|año=2013}}</ref> |
|||
* Los insectos tienen sus propios microbiomas. Por ejemplo, las [[hormigas cortadoras de hojas]] forman enormes colonias subterráneas que cosechan cientos de kilogramos de hojas cada año y no pueden digerir la celulosa de las hojas directamente. Mantienen jardines de hongos como principal fuente de alimento de la colonia. Si bien el hongo en sí no digiere la celulosa, sí lo hace una comunidad microbiana que contiene una diversidad de bacterias. El análisis del genoma de la población microbiana reveló muchos genes que intervienen en la digestión de la celulosa. El perfil enzimático de degradación de carbohidratos predicho de este microbioma es similar al del rumen bovino, pero la composición de especies es casi completamente diferente. <ref>{{Cita publicación|título=An Insect Herbivore Microbiome with High Plant Biomass-Degrading Capacity|apellidos=Suen|apellidos2=Scott JJ|publicación=PLOS Genet|volumen=6|número=9|páginas=e1001129|apellidos-editor=Sonnenburg|nombre-editor=Justin|doi=10.1371/journal.pgen.1001129|pmc=2944797|pmid=20885794|apellidos3=Aylward FO|año=2010|número-autores=et al}}</ref> La microbiota intestinal de la [[Drosophila melanogaster|mosca de la fruta]] puede afectar la apariencia de su intestino, al afectar la tasa de renovación epitelial, el espacio celular y la composición de diferentes tipos de células en el epitelio. <ref>{{Cita publicación|título=Microbiota-Induced Changes in Drosophila melanogaster Host Gene Expression and Gut Morphology|apellidos=Broderick|nombre=Nichole A.|apellidos2=Buchon|nombre2=Nicolas|publicación=mBio|volumen=5|número=3|páginas=e01117–14|doi=10.1128/mBio.01117-14|pmc=4045073|pmid=24865556|apellidos3=Lemaitre|nombre3=Bruno|año=2014}}</ref> Cuando la polilla [[Spodoptera exigua]] se infecta con [[Baculoviridae|baculovirus]], los genes relacionados con el sistema inmunológico se regulan a la baja y la cantidad de su microbiota intestinal aumenta. <ref name="baculo">{{Cita publicación|título=Increase in Gut Microbiota after Immune Suppression in Baculovirus-infected Larvae|apellidos=Jakubowska|nombre=Agata K.|apellidos2=Vogel|nombre2=Heiko|fecha=May 2013|publicación=PLOS Pathog|volumen=9|número=5|página=e1003379|doi=10.1371/journal.ppat.1003379|pmc=3662647|pmid=23717206|apellidos3=Herrero|nombre3=Salvador}}</ref> En el intestino de los dípteros, las células [[célula enteroendocrina|enteroendocrinas]] detectan los metabolitos derivados de la microbiota intestinal y coordinan las ramas antibacteriana, mecánica y metabólica de la respuesta inmunitaria innata del intestino del huésped a la microbiota comensal. <ref>{{Cita publicación|url=|título=Microbial Control of Intestinal Homeostasis via Enteroendocrine Cell Innate Immune Signaling|apellidos=Watnick|nombre=Paula I.|apellidos2=Jugder|nombre2=Bat-Erdene|fecha=2020-02-01|publicación=Trends in Microbiology|volumen=28|número=2|páginas=141–149|idioma=en|issn=0966-842X|doi=10.1016/j.tim.2019.09.005|pmc=6980660|pmid=31699645}}</ref> |
|||
* Los peces tienen sus propios microbiomas, incluida la especie de vida corta [[Nothobranchius furzeri]] (killis turquesa). La transferencia de la microbiota intestinal de los killis jóvenes a los killis de mediana edad prolonga significativamente la vida útil de los killis de mediana edad. <ref name="pmid31403049">{{Cita publicación|título=The influence of the microbiota on immune development, chronic inflammation, and cancer in the context of aging|publicación=Microbial Cell|volumen=6|número=8|páginas=324–334|doi=10.15698/mic2019.08.685|pmc=6685047|pmid=31403049|año=2019}}</ref> |
|||
=== Plantas === |
|||
[[Archivo:Colonization_of_potato_tubers_by_bacteria.png|miniaturadeimagen| {{Centrar|Routes of colonization of potato tubers by bacteria{{hs}}<ref name=Buchholz2019>Buchholz, F., Antonielli, L., Kostić, T., Sessitsch, A. and Mitter, B. (2019) "The bacterial community in potato is recruited from soil and partly inherited across generations". ''PLOS One'', '''14'''(11): e0223691. {{doi|10.1371/journal.pone.0223691}}. [[File:CC-BY icon.svg|50px]] Material was copied from this source, which is available under a [https://creativecommons.org/licenses/by/4.0/ Creative Commons Attribution 4.0 International License].</ref>}}]] |
|||
Recientemente, se descubrió que el microbioma de la planta se origina a partir de la semilla. <ref name=":2">{{Cita publicación|url=https://sfamjournals.onlinelibrary.wiley.com/doi/abs/10.1111/1462-2920.15392|título=Experimental evidence of microbial inheritance in plants and transmission routes from seed to phyllosphere and root|apellidos=Abdelfattah|nombre=Ahmed|apellidos2=Wisniewski|nombre2=Michael|publicación=Environmental Microbiology|volumen=23|número=4|páginas=2199–2214|idioma=en|issn=1462-2920|doi=10.1111/1462-2920.15392|pmid=33427409|apellidos3=Schena|nombre3=Leonardo|apellidos4=Tack|nombre4=Ayco J. M.|año=2021}}</ref> Los microorganismos que se transmiten a través de la semilla migran a la plántula en desarrollo en una ruta específica en la que una comunidad se mueve hacia las hojas y otra hacia las raíces. <ref name=":2" /> En el diagrama de la derecha, la microbiota que coloniza la [[rizosfera]], ingresa a las raíces y coloniza la próxima generación de tubérculos a través de los [[Estolón|estolones]], se visualiza con un color rojo. Las bacterias presentes en el [[tubérculo]] madre, que pasan a través de los estolones y migran a la planta, así como a la próxima generación de tubérculos, se muestran en azul. |
|||
* El suelo es el principal reservorio de bacterias que colonizan los tubérculos de papa. |
|||
* Las bacterias se reclutan del suelo más o menos independientemente de la variedad de patata. |
|||
* Las bacterias pueden colonizar los tubérculos predominantemente desde el interior de las plantas a través del estolón. |
|||
* La microbiota bacteriana de los tubérculos de patata consiste en bacterias transmitidas de una generación de tubérculos a la siguiente y bacterias reclutadas del suelo que colonizan las plantas de patata a través de la raíz. |
|||
[[Archivo:Cycas_coralloid_root_XS_high.jpg|izquierda|miniaturadeimagen|200x200px| Micrografía de luz de una sección transversal de una raíz coraloide de una cícada, que muestra la capa que alberga cianobacterias simbióticas]] |
|||
{{clear left}}Las plantas son anfitriones atractivos para los microorganismos ya que proporcionan una variedad de nutrientes. Los microorganismos en las plantas pueden ser [[Planta epífita|epífitos]] (que se encuentran en las plantas) o [[Endófito|endófitos]] (que se encuentran dentro del tejido vegetal). <ref>{{Cita publicación|título=Novel techniques and findings in the study of plant microbiota: Search for plant probiotics|apellidos=Berlec|nombre=Aleš|fecha=2012-09-01|publicación=Plant Science|volumen=193–194|páginas=96–102|doi=10.1016/j.plantsci.2012.05.010|pmid=22794922}}</ref> <ref>{{Cita publicación|url=http://wrap.warwick.ac.uk/449/1/WRAP_Bending_JAM_review_revised_4_April_2008.pdf|título=Phyllosphere microbiology with special reference to diversity and plant genotype|apellidos=Whipps|nombre=J.m.|apellidos2=Hand|nombre2=P.|fecha=2008-12-01|publicación=Journal of Applied Microbiology|volumen=105|número=6|páginas=1744–1755|idioma=en|issn=1365-2672|doi=10.1111/j.1365-2672.2008.03906.x|pmid=19120625|apellidos3=Pink|nombre3=D.|apellidos4=Bending|nombre4=G.d.}}</ref> Los [[Oomycetes|oomicetos]] y los [[Fungi|hongos]], a través de la evolución convergente, han desarrollado una morfología similar y ocupan nichos ecológicos similares. Desarrollan [[Hifa|hifas]], estructuras parecidas a hilos que penetran en la célula huésped. En situaciones [[Mutualismo (biología)|mutualistas]], la planta a menudo intercambia azúcares de hexosa por fosfato inorgánico del simbionte fúngico. Se especula que asociaciones tan antiguas ayudaron a las plantas cuando colonizaron la tierra por primera vez. <ref name="pnas">{{Cita publicación|título=Four hundred-million-year-old vesicular arbuscular mycorrhizae|publicación=Proc. Natl. Acad. Sci. USA|volumen=91|número=25|páginas=11841–3|bibcode=1994PNAS...9111841R|doi=10.1073/pnas.91.25.11841|pmc=45331|pmid=11607500|año=1994}}</ref> <ref>{{Cita publicación|título=Common themes in nutrient acquisition by plant symbiotic microbes, described by the Gene Ontology|publicación=BMC Microbiology|volumen=9(Suppl 1)|páginas=S6|doi=10.1186/1471-2180-9-S1-S6|pmc=2654666|pmid=19278554|año=2009}}</ref> Las [[Rizobacterias promotoras del crecimiento vegetal|bacterias promotoras del crecimiento vegetal]] (PGPB) brindan a la planta servicios esenciales como la [[fijación de nitrógeno]], la solubilización de minerales como el fósforo, la síntesis de [[Fitohormona|hormonas vegetales]], la mejora directa de la absorción de minerales y la protección contra patógenos. <ref>{{Cita libro|título=Soil microbial ecology: applications in agricultural and environmental management|capítulo=Plant growth-promoting rhizobacteria as biological control agents|apellidos=Kloepper|nombre=J. W|editor=Metting, F. B. Jr|año=1993|editorial=Marcel Dekker Inc|ubicación=New York|isbn=978-0-8247-8737-0|páginas=255–274}}</ref> <ref name="BloembergLugt2001">{{Cita publicación|título=Molecular basis of plant growth promotion and biocontrol by rhizobacteria|apellidos=Bloemberg|nombre=G. V.|apellidos2=Lugtenberg|nombre2=B. J. J.|publicación=Current Opinion in Plant Biology|volumen=4|número=4|páginas=343–350|doi=10.1016/S1369-5266(00)00183-7|pmid=11418345|año=2001}}</ref> Los PGPB pueden proteger a las plantas de los patógenos compitiendo con el patógeno por un nicho ecológico o un sustrato, produciendo [[Alelopatía|aleloquímicos]] inhibidores o induciendo una resistencia sistémica en las plantas huésped al patógeno <ref name="pgpg">{{Cita publicación|título=Use of Plant Growth-Promoting Bacteria for Biocontrol of Plant Diseases: Principles, Mechanisms of Action, and Future Prospects|publicación=Appl Environ Microbiol|volumen=71|número=9|páginas=4951–9|bibcode=2005ApEnM..71.4951C|doi=10.1128/AEM.71.9.4951-4959.2005|pmc=1214602|pmid=16151072|año=2005}}</ref>{{clear left}} |
|||
== Investigación == |
|||
La relación simbiótica entre un huésped y su microbiota está bajo investigación de laboratorio para determinar cómo puede dar forma al [[Sistema inmunitario|sistema inmunológico]] de los mamíferos. <ref name="Palm">{{Cita publicación|título=Immune–microbiota interactions in health and disease|apellidos=Palm|nombre=Noah W.|apellidos2=de Zoete|nombre2=Marcel R.|fecha=30 June 2015|publicación=Clinical Immunology|volumen=159|número=2|páginas=122–127|issn=1521-6616|doi=10.1016/j.clim.2015.05.014|pmc=4943041|pmid=26141651|apellidos3=Flavell|nombre3=Richard A.}}</ref> <ref name="Round">{{Cita publicación|título=Coordination of tolerogenic immune responses by the commensal microbiota|apellidos=Round|nombre=June L.|apellidos2=O'Connell|nombre2=Ryan M.|publicación=Journal of Autoimmunity|volumen=34|número=3|páginas=J220–J225|doi=10.1016/j.jaut.2009.11.007|pmc=3155383|pmid=19963349|apellidos3=Mazmanian|nombre3=Sarkis K.|año=2010}}</ref> En muchos animales, el sistema inmunitario y la microbiota pueden participar en una "conversación cruzada" mediante el intercambio de señales químicas, lo que puede permitir que la microbiota influya en la reactividad y la orientación inmunitarias. <ref name="Cahenzli">{{Cita publicación|título=Microbial-immune cross-talk and regulation of the immune system|apellidos=Cahenzli|nombre=Julia|apellidos2=Balmer|nombre2=Maria L.|publicación=Immunology|volumen=138|número=1|páginas=12–22|doi=10.1111/j.1365-2567.2012.03624.x|pmc=3533697|pmid=22804726|apellidos3=McCoy|nombre3=Kathy D.|año=2012}}</ref> Las bacterias se pueden transferir de madre a hijo a través del contacto directo y después del [[nacimiento]]. <ref name="Rosenberg">{{Cita publicación|título=Microbes drive evolution of animals and plants: the hologenome concept|apellidos=Rosenberg|nombre=Eugene|apellidos2=Zilber-Rosenberg|nombre2=Ilana|publicación=mBio|volumen=7|número=2|páginas=e01395–15|doi=10.1128/mbio.01395-15|pmc=4817260|pmid=27034283|año=2016}}</ref> A medida que se establece el microbioma infantil, las bacterias comensales pueblan rápidamente el intestino, lo que provoca una variedad de respuestas inmunitarias y "programa" el sistema inmunitario con efectos duraderos. <ref name="Cahenzli" /> Las bacterias pueden estimular el tejido linfoide asociado con la mucosa intestinal, lo que permite que el tejido produzca anticuerpos contra los patógenos que pueden ingresar al intestino. <ref name="Cahenzli" /> |
|||
El microbioma humano puede desempeñar un papel en la activación de los [[Receptor de tipo Toll|receptores tipo toll]] en los intestinos, un tipo de receptor de reconocimiento de patrones que las células huésped utilizan para reconocer peligros y reparar daños. Los patógenos pueden influir en esta coexistencia, lo que conduce a una desregulación inmunitaria, incluida la susceptibilidad a enfermedades, mecanismos de [[inflamación]], [[tolerancia inmunitaria]] y [[Enfermedad autoinmunitaria|enfermedades autoinmunes]]. <ref name="Blander">{{Cita publicación|título=Regulation of inflammation by microbiota interactions with the host|apellidos=Blander|nombre=J Magarian|apellidos2=Longman|nombre2=Randy S|fecha=19 July 2017|publicación=Nature Immunology|volumen=18|número=8|páginas=851–860|issn=1529-2908|doi=10.1038/ni.3780|pmc=5800875|pmid=28722709|apellidos3=Iliev|nombre3=Iliyan D|apellidos4=Sonnenberg|nombre4=Gregory F|apellidos5=Artis|nombre5=David}}</ref> <ref>{{Cita publicación|url=https://ir.lib.uwo.ca/cgi/viewcontent.cgi?article=1038&context=mnipub|título=Reciprocity in microbiome and immune system interactions and its implications in disease and health|apellidos=Nikoopour|nombre=E|apellidos2=Singh|nombre2=B|publicación=Inflamm Allergy Drug Targets|volumen=13|número=2|páginas=94–104|doi=10.2174/1871528113666140330201056|pmid=24678760|año=2014}}</ref> |
|||
== Coevolución de la microbiota == |
|||
[[Archivo:Keppelbleaching.jpg|miniaturadeimagen|200x200px| Coral ramificado blanqueado (primer plano) y coral ramificado normal (fondo). Islas Keppel, [[Gran Barrera de Coral]].]] |
|||
Los organismos evolucionan dentro de los ecosistemas de modo que el cambio de un organismo afecta el cambio de los demás. La [[Concepto de evolución hologenómica|teoría de la evolución del hologenoma]] propone que un objeto de la selección natural no es el organismo individual, sino el organismo junto con sus organismos asociados, incluidas sus comunidades microbianas. |
|||
'''Arrecifes de coral'''. La teoría del hologenoma se originó en estudios sobre arrecifes de coral. <ref name=":0">{{Cita publicación|título=The role of microorganisms in coral health, disease and evolution|publicación=Nature Reviews Microbiology|volumen=5|número=5|páginas=355–362|doi=10.1038/nrmicro1635|pmid=17384666|año=2007}}</ref> Los arrecifes de coral son las estructuras más grandes creadas por organismos vivos y contienen comunidades microbianas abundantes y altamente complejas. Durante las últimas décadas, se han producido importantes disminuciones en las poblaciones de coral. El [[Calentamiento global|cambio climático]], la contaminación del agua y la pesca excesiva son tres factores de estrés que se han descrito como causantes de la susceptibilidad a las enfermedades. Se han descrito más de veinte enfermedades coralinas diferentes, pero de estas, solo unas pocas han tenido sus agentes causales aislados y caracterizados. El [[Blanqueo del coral|blanqueamiento de corales]] es la más grave de estas enfermedades. En el mar Mediterráneo, el blanqueamiento de ''[[Oculina]] patagonica'' se describió por primera vez en 1994 y pronto se determinó que se debía a una infección por ''[[Vibrio shiloi]]''. De 1994 a 2002, el blanqueamiento bacteriano de ''O. patagonica'' ocurrió cada verano en el Mediterráneo oriental. Sorprendentemente, sin embargo, después de 2003, ''O. patagonica'' en el Mediterráneo oriental ha sido resistente a la infección por ''V. shiloi'', aunque otras enfermedades todavía causan blanqueamiento. La sorpresa proviene del conocimiento de que los corales son longevos, con vidas del orden de décadas, <ref name="BBRT2009">{{Cita publicación|url=http://www.reefresilience.org/pdf/Baird_etal_2009.pdf|título=Coral bleaching: the role of the host|publicación=Trends in Ecology and Evolution|volumen=24|número=1|páginas=16–20|doi=10.1016/j.tree.2008.09.005|pmid=19022522|año=2009}}</ref> y no tienen [[Sistema de inmunidad adquirida|sistemas inmunológicos adaptativos]]. Su [[sistema inmunitario innato]] no produce anticuerpos, y aparentemente no deberían ser capaces de responder a nuevos desafíos, excepto en escalas de tiempo evolutivas. |
|||
El enigma de cómo los corales lograron adquirir resistencia a un patógeno específico llevó a una propuesta de 2007, que existe una relación dinámica entre los corales y sus comunidades microbianas simbióticas. Se cree que al alterar su composición, el [[holobionte]] puede adaptarse a las condiciones ambientales cambiantes mucho más rápidamente que solo mediante la mutación y la selección genéticas. La extrapolación de esta hipótesis a otros organismos, incluidas plantas y animales superiores, condujo a la propuesta de la teoría de la evolución del hologenoma. <ref name=":0">{{Cita publicación|título=The role of microorganisms in coral health, disease and evolution|publicación=Nature Reviews Microbiology|volumen=5|número=5|páginas=355–362|doi=10.1038/nrmicro1635|pmid=17384666|año=2007}}</ref> |
|||
A 2007 todavía se estaba debatiendo la teoría del hologenoma.<ref>{{Cita publicación|título=The hologenome theory disregards the coral holobiont|publicación=Nature Reviews Microbiology|volumen=5|número=10|páginas=Online Correspondence|doi=10.1038/nrmicro1635-c1|año=2007}}</ref> Una de las principales críticas ha sido la afirmación de que V. shiloi se identificó erróneamente como el agente causante del blanqueamiento de corales y que su presencia en O. patagonica blanqueada era simplemente una colonización oportunista.<ref>{{Cita publicación|título=Bacteria are not the primary cause of bleaching in the Mediterranean coral ''Oculina patagonica''|publicación=The ISME Journal|volumen=2|número=1|páginas=67–73|doi=10.1038/ismej.2007.88|pmid=18059488|año=2008}}</ref> Si esto es cierto, la observación básica que conduce a la teoría no sería válida. La teoría ha ganado una popularidad significativa como una forma de explicar los cambios rápidos en la adaptación que de otro modo no pueden explicarse mediante los mecanismos tradicionales de selección natural. Dentro de la teoría del hologenoma, el holobionte no sólo se ha convertido en la unidad principal de la selección natural sino también en el resultado de otro paso de integración que también se observa a nivel celular ([[simbiogénesis]], [[endosimbiosis]]) y genómico.<ref name="Salvucci2014" /> |
|||
== Métodos de búsqueda == |
|||
=== Secuenciación de amplicones dirigidos === |
|||
La secuenciación de [[amplicón|amplicones]] dirigidos se basa en tener algunas expectativas sobre la composición de la comunidad que se está estudiando. En la secuenciación del amplicón diana, se apunta a un marcador filogenéticamente informativo para la secuenciación. Tal marcador debería estar presente idealmente en todos los organismos esperados. También debería evolucionar de tal manera que se conserve lo suficiente como para que los cebadores puedan apuntar a genes de una amplia gama de organismos mientras evoluciona lo suficientemente rápido como para permitir una resolución más fina a nivel taxonómico. Un marcador común para los estudios del microbioma humano es el gen del [[ARN ribosomal 16S|ARNr 16S]] bacteriano ( ''es decir'', "ADNr 16S", la secuencia de ADN que codifica la molécula de ARN ribosómico). <ref name="Kucz2012">{{Cita publicación|título=Experimental and analytical tools for studying the human microbiome|apellidos=Kuczynski|nombre=J.|apellidos2=Lauber|nombre2=C. L.|publicación=[[Nature Reviews Genetics]]|volumen=13|número=1|páginas=47–58|doi=10.1038/nrg3129|pmc=5119550|pmid=22179717|apellidos3=Walters|nombre3=W. A.|apellidos4=Parfrey|nombre4=L. W.|apellidos5=Clemente|nombre5=J. C.|apellidos6=Gevers|nombre6=D.|apellidos7=Knight|nombre7=R.|año=2011}}</ref> Dado que los ribosomas están presentes en todos los organismos vivos, el uso de 16S rDNA permite amplificar el ADN de muchos más organismos que si se usara otro marcador. El gen 16S rRNA contiene regiones de evolución lenta y 9 regiones de evolución rápida, también conocidas como [[Región hipervariable|regiones hipervariables]] (HVR); <ref>{{Cita publicación|título=A detailed analysis of 16S ribosomal RNA gene segments for the diagnosis of pathogenic bacteria|apellidos=Chakravorty|nombre=Soumitesh|apellidos2=Helb|nombre2=Danica|fecha=May 2007|publicación=Journal of Microbiological Methods|volumen=69|número=2|páginas=330–339|idioma=en|doi=10.1016/j.mimet.2007.02.005|pmc=2562909|pmid=17391789|apellidos3=Burday|nombre3=Michele|apellidos4=Connell|nombre4=Nancy|apellidos5=Alland|nombre5=David}}</ref> el primero se puede utilizar para diseñar cebadores amplios, mientras que el último permite una distinción taxonómica más precisa. Sin embargo, la resolución a nivel de especie no suele ser posible con el ADNr 16S. La selección de cebadores es un paso importante, ya que cualquier cosa que no pueda ser objetivo del cebador no se amplificará y, por lo tanto, no se detectará; además, se pueden seleccionar diferentes conjuntos de cebadores para amplificar diferentes HVR en el gen, o pares de ellos. La elección adecuada de qué HVR amplificar debe hacerse de acuerdo con los grupos taxonómicos de interés, ya que se ha demostrado que las diferentes regiones objetivo influyen en la clasificación taxonómica. <ref>{{Cita publicación|título=Influence of 16S rRNA target region on the outcome of microbiome studies in soil and saliva samples|apellidos=Soriano-Lerma|nombre=Ana|apellidos2=Pérez-Carrasco|nombre2=Virginia|fecha=December 2020|publicación=Scientific Reports|volumen=10|número=1|páginas=13637|idioma=en|bibcode=2020NatSR..1013637S|issn=2045-2322|doi=10.1038/s41598-020-70141-8|pmc=7423937|pmid=32788589|apellidos3=Sánchez-Marañón|nombre3=Manuel|apellidos4=Ortiz-González|nombre4=Matilde|apellidos5=Sánchez-Martín|nombre5=Victoria|apellidos6=Gijón|nombre6=Juan|apellidos7=Navarro-Mari|nombre7=José María|apellidos8=García-Salcedo|nombre8=José Antonio|apellidos9=Soriano|nombre9=Miguel}}</ref> |
|||
Los estudios específicos de comunidades eucariotas y virales son limitados <ref name="Marchesi2010">{{Cita libro|apellidos=Marchesi|nombre=J. R.|capítulo=Prokaryotic and Eukaryotic Diversity of the Human Gut|doi=10.1016/S0065-2164(10)72002-5|título=Advances in Applied Microbiology Volume 72|serie=Advances in Applied Microbiology|volumen=72|páginas=43–62|año=2010|isbn=9780123809896|pmid=20602987}}</ref> y están sujetos al desafío de excluir el ADN del huésped de la amplificación y la reducción de la biomasa eucariota y viral en el microbioma humano. <ref name="Vest2008">{{Cita publicación|título=Blocking primers to enhance PCR amplification of rare sequences in mixed samples – a case study on prey DNA in Antarctic krill stomachs|apellidos=Vestheim|nombre=H.|apellidos2=Jarman|nombre2=S. N.|publicación=Frontiers in Zoology|volumen=5|páginas=12|doi=10.1186/1742-9994-5-12|pmc=2517594|pmid=18638418|año=2008}}</ref> |
|||
Después de secuenciar los amplicones, se utilizan métodos [[Análisis moleculares de ADN|filogenéticos moleculares]] para inferir la composición de la comunidad microbiana. Esto se puede hacer a través de metodologías de [[Análisis de grupos|agrupamiento]], agrupando los amplicones en [[Unidad taxonómica operativa|unidades taxonómicas operativas]] (OTU); o alternativamente con metodologías de eliminación de ruido, identificando [[Variante de secuencia de amplicón|variantes de secuencia de amplicón]] (ASV). |
|||
Luego se infieren las relaciones filogenéticas entre las secuencias. Debido a la complejidad de los datos, las medidas de distancia, como las distancias [[UniFrac]], generalmente se definen entre muestras de microbioma, y los métodos multivariantes posteriores se llevan a cabo en las matrices de distancia. Un punto importante es que la escala de los datos es extensa y se deben adoptar enfoques adicionales para identificar patrones a partir de la información disponible. Las herramientas utilizadas para analizar los datos incluyen VAMPS, <ref>{{Cita web|url=http://vamps.mbl.edu/|título=VAMPS: The Visualization and Analysis of Microbial Population Structures|fechaacceso=11 March 2012|editorial=Bay Paul Center, MBL, Woods Hole}}</ref> [[QIIME]], <ref name="CapoKucz2010">{{Cita publicación|título=QIIME allows analysis of high-throughput community sequencing data|apellidos=Caporaso|nombre=J. G.|apellidos2=Kuczynski|nombre2=J.|publicación=Nature Methods|volumen=7|número=5|páginas=335–336|doi=10.1038/nmeth.f.303|pmc=3156573|pmid=20383131|apellidos3=Stombaugh|nombre3=J.|apellidos4=Bittinger|nombre4=K.|apellidos5=Bushman|nombre5=F. D.|apellidos6=Costello|nombre6=E. K.|apellidos7=Fierer|nombre7=N.|apellidos8=Peña|nombre8=A. G.|apellidos9=Goodrich|nombre9=J. K.|año=2010}}</ref> [[mothur]] <ref name="SchlossWest2009">{{Cita publicación|título=Introducing mothur: Open-Source, Platform-Independent, Community-Supported Software for Describing and Comparing Microbial Communities|apellidos=Schloss|nombre=P. D.|apellidos2=Westcott|nombre2=S. L.|publicación=Applied and Environmental Microbiology|volumen=75|número=23|páginas=7537–7541|bibcode=2009ApEnM..75.7537S|doi=10.1128/AEM.01541-09|pmc=2786419|pmid=19801464|apellidos3=Ryabin|nombre3=T.|apellidos4=Hall|nombre4=J. R.|apellidos5=Hartmann|nombre5=M.|apellidos6=Hollister|nombre6=E. B.|apellidos7=Lesniewski|nombre7=R. A.|apellidos8=Oakley|nombre8=B. B.|apellidos9=Parks|nombre9=D. H.|año=2009}}</ref> y DADA2 <ref>{{Cita publicación|título=DADA2: High-resolution sample inference from Illumina amplicon data|apellidos=Callahan|nombre=Benjamin J.|apellidos2=McMurdie|nombre2=Paul J.|fecha=July 2016|publicación=Nature Methods|volumen=13|número=7|páginas=581–583|idioma=en|issn=1548-7105|doi=10.1038/nmeth.3869|pmc=4927377|pmid=27214047|apellidos3=Rosen|nombre3=Michael J.|apellidos4=Han|nombre4=Andrew W.|apellidos5=Johnson|nombre5=Amy Jo A.|apellidos6=Holmes|nombre6=Susan P.}}</ref> o UNOISE3 <ref>{{Cita publicación|url=https://www.biorxiv.org/content/10.1101/081257v1|título=UNOISE2: improved error-correction for Illumina 16S and ITS amplicon sequencing|apellidos=Edgar|nombre=Robert C.|fecha=2016-10-15|páginas=081257|idioma=en|doi=10.1101/081257}}</ref> para la eliminación de ruido. |
|||
=== Secuenciación metagenómica === |
|||
La [[metagenómica]] también se usa ampliamente para estudiar comunidades microbianas. <ref name="TurnHamady2009">{{Cita publicación|título=A core gut microbiome in obese and lean twins|apellidos=Turnbaugh|nombre=P. J.|apellidos2=Hamady|nombre2=M.|publicación=Nature|volumen=457|número=7228|páginas=480–484|bibcode=2009Natur.457..480T|doi=10.1038/nature07540|pmc=2677729|pmid=19043404|apellidos3=Yatsunenko|nombre3=T.|apellidos4=Cantarel|nombre4=B. L.|apellidos5=Duncan|nombre5=A.|apellidos6=Ley|nombre6=R. E.|apellidos7=Sogin|nombre7=M. L.|apellidos8=Jones|nombre8=W. J.|apellidos9=Roe|nombre9=B. A.|año=2008}}</ref> <ref name="Qin2010">{{Cita publicación|título=A human gut microbial gene catalogue established by metagenomic sequencing|apellidos=Qin|nombre=J.|apellidos2=Li|nombre2=R.|publicación=Nature|volumen=464|número=7285|páginas=59–65|bibcode=2010Natur.464...59.|doi=10.1038/nature08821|pmc=3779803|pmid=20203603|apellidos3=Raes|nombre3=J.|apellidos4=Arumugam|nombre4=M.|apellidos5=Burgdorf|nombre5=K. S.|apellidos6=Manichanh|nombre6=C.|apellidos7=Nielsen|nombre7=T.|apellidos8=Pons|nombre8=N.|apellidos9=Levenez|nombre9=F.|año=2010}}</ref> <ref name="TringeMering2005">{{Cita publicación|título=Comparative Metagenomics of Microbial Communities|apellidos=Tringe|nombre=S. G.|apellidos2=Von Mering|nombre2=C.|publicación=Science|volumen=308|número=5721|páginas=554–557|bibcode=2005Sci...308..554T|doi=10.1126/science.1107851|pmid=15845853|apellidos3=Kobayashi|nombre3=A.|apellidos4=Salamov|nombre4=A. A.|apellidos5=Chen|nombre5=K.|apellidos6=Chang|nombre6=H. W.|apellidos7=Podar|nombre7=M.|apellidos8=Short|nombre8=J. M.|apellidos9=Mathur|nombre9=E. J.|año=2005}}</ref> En la secuenciación metagenómica, el ADN se recupera directamente de muestras ambientales de manera no dirigida con el objetivo de obtener una muestra imparcial de todos los genes de todos los miembros de la comunidad. Estudios recientes utilizan [[Método de Sanger|secuenciación de escopeta Sanger]] o [[pirosecuenciación]] para recuperar las secuencias de las lecturas. <ref name="Wooley2010">{{Cita publicación|título=A Primer on Metagenomics|apellidos=Wooley|nombre=J. C.|apellidos2=Godzik|nombre2=A.|publicación=PLOS Computational Biology|volumen=6|número=2|páginas=e1000667|apellidos-editor=Bourne|nombre-editor=Philip E.|bibcode=2010PLSCB...6E0667W|doi=10.1371/journal.pcbi.1000667|pmc=2829047|pmid=20195499|apellidos3=Friedberg|nombre3=I.|año=2010}}</ref> Luego, las lecturas se pueden ensamblar en [[Cóntigo|contigs]]. Para determinar la identidad filogenética de una secuencia, se compara con secuencias genómicas completas disponibles utilizando métodos como [[BLAST]]. Un inconveniente de este enfoque es que muchos miembros de las comunidades microbianas no tienen un genoma secuenciado representativo, pero esto también se aplica a la secuenciación de amplicón 16S rRNA y es un problema fundamental. <ref name="Kucz2012">{{Cita publicación|título=Experimental and analytical tools for studying the human microbiome|apellidos=Kuczynski|nombre=J.|apellidos2=Lauber|nombre2=C. L.|publicación=[[Nature Reviews Genetics]]|volumen=13|número=1|páginas=47–58|doi=10.1038/nrg3129|pmc=5119550|pmid=22179717|apellidos3=Walters|nombre3=W. A.|apellidos4=Parfrey|nombre4=L. W.|apellidos5=Clemente|nombre5=J. C.|apellidos6=Gevers|nombre6=D.|apellidos7=Knight|nombre7=R.|año=2011}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFKuczynskiLauberWaltersParfrey2011">Kuczynski, J.; Lauber, C. L.; Walters, W. A.; Parfrey, L. W.; Clemente, J. C.; Gevers, D.; Knight, R. (2011). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC5119550 "Experimental and analytical tools for studying the human microbiome"]. ''[[Nature Reviews Genetics]]''. '''13''' (1): 47–58. [[Identificador de objeto digital|doi]]:[[doi:10.1038/nrg3129|10.1038/nrg3129]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC5119550 5119550]</span>. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/22179717 22179717].</cite></ref> Con la secuenciación de escopeta, se puede resolver teniendo una alta cobertura (50-100x) del genoma desconocido, haciendo efectivamente un [[Montaje de secuencias|ensamblaje del genoma]] de novo. Tan pronto como se dispone de un genoma completo de un organismo desconocido, se puede comparar filogenéticamente y colocar al organismo en su lugar en el [[árbol de la vida]], creando nuevos [[Taxón|taxones]]. Un enfoque emergente es combinar la secuenciación de escopeta con datos de ligadura de proximidad ([[Método de captura de la conformación de los cromosomas|Hi-C]]) para ensamblar genomas microbianos completos sin cultivo. <ref>{{Cita publicación|título=Assembly of 913 microbial genomes from metagenomic sequencing of the cow rumen|apellidos=Watson|nombre=Mick|apellidos2=Roehe|nombre2=Rainer|fecha=2018-02-28|publicación=Nature Communications|volumen=9|número=1|páginas=870|idioma=en|bibcode=2018NatCo...9..870S|issn=2041-1723|doi=10.1038/s41467-018-03317-6|pmc=5830445|pmid=29491419|apellidos3=Walker|nombre3=Alan W.|apellidos4=Dewhurst|nombre4=Richard J.|apellidos5=Snelling|nombre5=Timothy J.|apellidos6=Ivan Liachko|apellidos7=Langford|nombre7=Kyle W.|apellidos8=Press|nombre8=Maximilian O.|apellidos9=Wiser|nombre9=Andrew H.}}</ref> |
|||
A pesar del hecho de que la metagenómica está limitada por la disponibilidad de secuencias de referencia, una ventaja significativa de la metagenómica sobre la secuenciación de amplicones dirigidos es que los datos metagenómicos pueden dilucidar el potencial funcional del ADN comunitario. <ref name="MullerSzkl2010">{{Cita publicación|título=EggNOG v2.0: Extending the evolutionary genealogy of genes with enhanced non-supervised orthologous groups, species and functional annotations|apellidos=Muller|nombre=J.|apellidos2=Szklarczyk|nombre2=D.|publicación=Nucleic Acids Research|volumen=38|número=Database issue|páginas=D190–D195|doi=10.1093/nar/gkp951|pmc=2808932|pmid=19900971|apellidos3=Julien|nombre3=P.|apellidos4=Letunic|nombre4=I.|apellidos5=Roth|nombre5=A.|apellidos6=Kuhn|nombre6=M.|apellidos7=Powell|nombre7=S.|apellidos8=Von Mering|nombre8=C.|apellidos9=Doerks|nombre9=T.|año=2009}}</ref> <ref name="KanehisaGoto2010">{{Cita publicación|título=KEGG for representation and analysis of molecular networks involving diseases and drugs|apellidos=Kanehisa|nombre=M.|apellidos2=Goto|nombre2=S.|publicación=Nucleic Acids Research|volumen=38|número=Database issue|páginas=D355–D360|doi=10.1093/nar/gkp896|pmc=2808910|pmid=19880382|apellidos3=Furumichi|nombre3=M.|apellidos4=Tanabe|nombre4=M.|apellidos5=Hirakawa|nombre5=M.|año=2009}}</ref> Las encuestas de genes dirigidos no pueden hacer esto, ya que solo revelan la relación filogenética entre el mismo gen de diferentes organismos. El análisis funcional se realiza comparando las secuencias recuperadas con bases de datos de anotaciones metagenómicas como [[KEGG]]. Las vías metabólicas en las que participan estos genes se pueden predecir con herramientas como MG-RAST, <ref name="MeyerPaar2008">{{Cita publicación|título=The metagenomics RAST server – a public resource for the automatic phylogenetic and functional analysis of metagenomes|apellidos=Meyer|nombre=F.|apellidos2=Paarmann|nombre2=D.|publicación=BMC Bioinformatics|volumen=9|páginas=386|doi=10.1186/1471-2105-9-386|pmc=2563014|pmid=18803844|apellidos3=d'Souza|nombre3=M.|apellidos4=Olson|nombre4=R.|apellidos5=Glass|nombre5=E. M.|apellidos6=Kubal|nombre6=M.|apellidos7=Paczian|nombre7=T.|apellidos8=Rodriguez|nombre8=A.|apellidos9=Stevens|nombre9=R.|año=2008}}</ref> CAMERA <ref name="SunChen2011">{{Cita publicación|título=Community cyberinfrastructure for Advanced Microbial Ecology Research and Analysis: The CAMERA resource|apellidos=Sun|nombre=S.|apellidos2=Chen|nombre2=J.|publicación=Nucleic Acids Research|volumen=39|número=Database issue|páginas=D546–D551|doi=10.1093/nar/gkq1102|pmc=3013694|pmid=21045053|apellidos3=Li|nombre3=W.|apellidos4=Altintas|nombre4=I.|apellidos5=Lin|nombre5=A.|apellidos6=Peltier|nombre6=S.|apellidos7=Stocks|nombre7=K.|apellidos8=Allen|nombre8=E. E.|apellidos9=Ellisman|nombre9=M.|año=2010}}</ref> e [[Integrated Microbial Genomes System|IMG/M]] . <ref name="MarkowitzIvan2008">{{Cita publicación|título=IMG/M: A data management and analysis system for metagenomes|apellidos=Markowitz|nombre=V. M.|apellidos2=Ivanova|nombre2=N. N.|publicación=Nucleic Acids Research|volumen=36|número=Database issue|páginas=D534–D538|doi=10.1093/nar/gkm869|pmc=2238950|pmid=17932063|apellidos3=Szeto|nombre3=E.|apellidos4=Palaniappan|nombre4=K.|apellidos5=Chu|nombre5=K.|apellidos6=Dalevi|nombre6=D.|apellidos7=Chen|nombre7=I. M. A.|apellidos8=Grechkin|nombre8=Y.|apellidos9=Dubchak|nombre9=I.|año=2007}}</ref> |
|||
=== Enfoques basados en ARN y proteínas === |
|||
Se han realizado estudios de metatranscriptómica para estudiar la expresión génica de comunidades microbianas a través de métodos como la pirosecuenciación del ARN extraído. <ref name="ShiTyson2009">{{Cita publicación|título=Metatranscriptomics reveals unique microbial small RNAs in the ocean's water column|apellidos=Shi|nombre=Y.|apellidos2=Tyson|nombre2=G. W.|publicación=Nature|volumen=459|número=7244|páginas=266–269|bibcode=2009Natur.459..266S|doi=10.1038/nature08055|pmid=19444216|apellidos3=Delong|nombre3=E. F.|año=2009}}</ref> Los estudios basados en la estructura también han identificado [[ARN no codificante|ARN no codificantes]] (ncRNA), como las ribozimas de la microbiota. <ref name="JimenezDel2011">{{Cita publicación|título=Structure-based Search Reveals Hammerhead Ribozymes in the Human Microbiome|apellidos=Jimenez|nombre=R. M.|apellidos2=Delwart|nombre2=E.|publicación=Journal of Biological Chemistry|volumen=286|número=10|páginas=7737–7743|doi=10.1074/jbc.C110.209288|pmc=3048661|pmid=21257745|apellidos3=Luptak|nombre3=A|año=2011}}</ref> La [[metaproteómica]] es un enfoque que estudia las proteínas expresadas por la microbiota, dando una idea de su potencial funcional. <ref name="MaronRan2007">{{Cita publicación|título=Metaproteomics: A New Approach for Studying Functional Microbial Ecology|apellidos=Maron|nombre=PA|apellidos2=Ranjard|nombre2=L.|publicación=Microbial Ecology|volumen=53|número=3|páginas=486–493|doi=10.1007/s00248-006-9196-8|pmid=17431707|apellidos3=Mougel|nombre3=C.|apellidos4=Lemanceau|nombre4=P.|año=2007}}</ref> |
|||
== Proyectos == |
|||
El [[Proyecto Microbioma Humano]] lanzado en 2008 fue una iniciativa de los [[Institutos Nacionales de Salud|Institutos Nacionales de Salud de]] los Estados Unidos para identificar y caracterizar los microorganismos que se encuentran tanto en humanos sanos como enfermos. <ref name="nih">{{Cita web|url=http://hmpdacc.org/overview/about.php|título=NIH Human Microbiome Project|fechaacceso=14 June 2016|fecha=2016|editorial=US National Institutes of Health, Department of Health and Human Services, US Government|urlarchivo=https://web.archive.org/web/20160611035755/http://hmpdacc.org/overview/about.php|fechaarchivo=11 June 2016|url-status=dead}}</ref> El proyecto de cinco años, mejor caracterizado como un estudio de factibilidad con un presupuesto de $115 millones, probaron cómo los cambios en el microbioma humano se asocian con la salud o la enfermedad humana. <ref name="nih" /> |
|||
El [[Proyecto Microbioma Terrestre|Earth Microbiome Project]] (EMP) es una iniciativa para recolectar muestras naturales y analizar la comunidad microbiana en todo el mundo. Los microbios son muy abundantes, diversos y tienen un papel importante en el sistema ecológico. Sin embargo, en 2010, se estimó que el esfuerzo de secuenciación del ADN ambiental global total había producido menos del 1 por ciento del ADN total encontrado en un litro de agua de mar o un gramo de suelo, <ref>{{Cita publicación|título=Meeting Report: The Terabase Metagenomics Workshop and the Vision of an Earth Microbiome Project|apellidos=Gilbert|nombre=J. A.|apellidos2=Meyer|nombre2=F.|publicación=Standards in Genomic Sciences|volumen=3|número=3|páginas=243–248|doi=10.4056/sigs.1433550|pmc=3035311|pmid=21304727|apellidos3=Antonopoulos|nombre3=D.|año=2010|número-autores=et al}}</ref> y las interacciones específicas entre los microbios son en gran parte desconocidas. El EMP tiene como objetivo procesar hasta 200.000 muestras en diferentes biomas, generando una base de datos completa de microbios en la tierra para caracterizar entornos y ecosistemas por composición e interacción microbiana. Usando estos datos, se pueden proponer y probar nuevas teorías ecológicas y evolutivas. <ref name="GilbertDor2011">{{Cita publicación|título=The importance of metagenomic surveys to microbial ecology: Or why Darwin would have been a metagenomic scientist|apellidos=Gilbert|nombre=J. A.|apellidos2=O'Dor|nombre2=R.|publicación=Microbial Informatics and Experimentation|volumen=1|número=1|páginas=5|doi=10.1186/2042-5783-1-5|pmc=3348666|pmid=22587826|apellidos3=King|nombre3=N.|apellidos4=Vogel|nombre4=T. M.|año=2011}}</ref> |
|||
== Microbiota intestinal y diabetes tipo 2 == |
|||
La microbiota intestinal es muy importante para la salud del huésped porque desempeña un papel en la degradación de los polisacáridos no digeribles (fermentación de almidón resistente, oligosacáridos, inulina) fortaleciendo la integridad intestinal o dando forma al epitelio intestinal, recolectando energía, protegiendo contra patógenos y regulando la inmunidad del huésped. <ref>{{Cita publicación|url=http://aeji.journals.ekb.eg/article_9950.html|título=Gut Microbiota and Type 2 Diabetes Mellitus : What is The Link ?|apellidos=Ibrahim|nombre=Nesma|fecha=2018-07-01|publicación=Afro-Egyptian Journal of Infectious and Endemic Diseases|volumen=6|número=2|páginas=112–119|idioma=en|issn=2090-7184|doi=10.21608/aeji.2018.9950}}</ref> <ref>{{Cita publicación|título=Introduction to the human gut microbiota|apellidos=Thursby|nombre=Elizabeth|apellidos2=Juge|nombre2=Nathalie|fecha=2017-06-01|publicación=Biochemical Journal|volumen=474|número=11|páginas=1823–1836|idioma=en|issn=0264-6021|doi=10.1042/BCJ20160510|pmc=5433529|pmid=28512250}}</ref> |
|||
Varios estudios mostraron que la composición bacteriana intestinal en pacientes diabéticos se alteró con niveles elevados de ''Lactobacillus gasseri'', ''Streptococcus mutans'' y miembros de ''Clostridiales'', con disminución de bacterias productoras de butirato como ''Roseburia intestinalis'' y ''Faecalibacterium prausnitzii'' <ref name=":1">{{Cita publicación|título=Microbiota y diabetes mellitus tipo 2|apellidos=Muñoz-Garach|nombre=Araceli|apellidos2=Diaz-Perdigones|nombre2=Cristina|fecha=December 2016|publicación=Endocrinología y Nutrición|volumen=63|número=10|páginas=560–568|idioma=es|doi=10.1016/j.endonu.2016.07.008|pmid=27633134|apellidos3=Tinahones|nombre3=Francisco J.}}</ref> <ref>{{Cita publicación|url=http://www.sciencedirect.com/science/article/pii/S1262363616303962|título=Impact of gut microbiota on diabetes mellitus|apellidos=Blandino|nombre=G.|apellidos2=Inturri|nombre2=R.|fecha=2016-11-01|publicación=Diabetes & Metabolism|volumen=42|número=5|páginas=303–315|idioma=en|issn=1262-3636|doi=10.1016/j.diabet.2016.04.004|pmid=27179626|apellidos3=Lazzara|nombre3=F.|apellidos4=Di Rosa|nombre4=M.|apellidos5=Malaguarnera|nombre5=L.}}</ref> ''.'' Esta alteración se debe a muchos factores como el abuso de antibióticos, la dieta y la edad ''.'' |
|||
La disminución en la producción de butirato está asociada con un defecto en la permeabilidad intestinal, este defecto conduce al caso de la endotoxemia, que es el aumento del nivel de lipopolisacáridos circulantes de la pared de las células bacterianas gram negativas. Se encuentra que la endotoxemia tiene asociación con el desarrollo de resistencia a la insulina. <ref name=":1">{{Cita publicación|título=Microbiota y diabetes mellitus tipo 2|apellidos=Muñoz-Garach|nombre=Araceli|apellidos2=Diaz-Perdigones|nombre2=Cristina|fecha=December 2016|publicación=Endocrinología y Nutrición|volumen=63|número=10|páginas=560–568|idioma=es|doi=10.1016/j.endonu.2016.07.008|pmid=27633134|apellidos3=Tinahones|nombre3=Francisco J.}}<cite class="citation journal cs1 cs1-prop-foreign-lang-source" data-ve-ignore="true" id="CITEREFMuñoz-GarachDiaz-PerdigonesTinahones2016">Muñoz-Garach, Araceli; Diaz-Perdigones, Cristina; Tinahones, Francisco J. (December 2016). "Microbiota y diabetes mellitus tipo 2". ''Endocrinología y Nutrición'' (in Spanish). '''63''' (10): 560–568. [[Identificador de objeto digital|doi]]:[[doi:10.1016/j.endonu.2016.07.008|10.1016/j.endonu.2016.07.008]]. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/27633134 27633134].</cite> |
|||
[[Category:CS1 Spanish-language sources (es)]]</ref> |
|||
Además, la producción de butirato afecta el nivel de serotonina. <ref name=":1">{{Cita publicación|título=Microbiota y diabetes mellitus tipo 2|apellidos=Muñoz-Garach|nombre=Araceli|apellidos2=Diaz-Perdigones|nombre2=Cristina|fecha=December 2016|publicación=Endocrinología y Nutrición|volumen=63|número=10|páginas=560–568|idioma=es|doi=10.1016/j.endonu.2016.07.008|pmid=27633134|apellidos3=Tinahones|nombre3=Francisco J.}}<cite class="citation journal cs1 cs1-prop-foreign-lang-source" data-ve-ignore="true" id="CITEREFMuñoz-GarachDiaz-PerdigonesTinahones2016">Muñoz-Garach, Araceli; Diaz-Perdigones, Cristina; Tinahones, Francisco J. (December 2016). "Microbiota y diabetes mellitus tipo 2". ''Endocrinología y Nutrición'' (in Spanish). '''63''' (10): 560–568. [[Identificador de objeto digital|doi]]:[[doi:10.1016/j.endonu.2016.07.008|10.1016/j.endonu.2016.07.008]]. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/27633134 27633134].</cite> |
|||
[[Category:CS1 Spanish-language sources (es)]]</ref> El nivel elevado de serotonina contribuye a la obesidad, que se sabe que es un factor de riesgo para el desarrollo de diabetes. |
|||
La microbiota se puede trasplantar en el cuerpo humano con fines médicos. <ref>{{Cita publicación|url=https://microbioma.it}}</ref> |
|||
== Desarrollo de la microbiota intestinal y antibióticos == |
|||
La colonización de la microbiota intestinal humana puede comenzar antes del nacimiento. <ref>Vandenplas, Y., Carnielli, V. P., Ksiazyk, J., Luna, M. S., Migacheva, N., Mosselmans, J. M., ... & Wabitsch, M. (2020), Factors affecting early-life intestinal microbiota development. Nutrition, 78, 110812.</ref> Existen múltiples factores en el entorno que afectan el desarrollo de la microbiota, siendo el modo de nacimiento uno de los más impactantes. <ref>Korpela K, Helve O, Kolho KL, Saisto T, Skogberg K, Dikareva E, Stefanovic V, Salonen A, Andersson S, de Vos WM. Maternal Fecal Microbiota Transplantation in Cesarean-Born Infants Rapidly Restores Normal Gut Microbial Development: A Proof-of-Concept Study. Cell. 2020 Oct 15;183(2):324-334.e5. doi: 10.1016/j.cell.2020.08.047. Epub 2020 Oct 1. PMID 33007265.</ref> |
|||
Otro factor que se ha observado que causa grandes cambios en la microbiota intestinal, particularmente en los niños, es el uso de antibióticos, asociado con problemas de salud como un IMC más alto, <ref>Korpela, K., Salonen, A., Saxen, H., Nikkonen, A., Peltola, V., Jaakkola, T., ... & Kolho, K. L. (2020). Antibiotics in early life associate with specific gut microbiota signatures in a prospective longitudinal infant cohort. Pediatric Research, 1-6</ref> <ref>Schei, K., Simpson, M. R., Avershina, E., Rudi, K., Øien, T., Júlíusson, P. B., ... & Ødegård, R. A. (2020). Early Gut Fungal and Bacterial Microbiota and Childhood Growth. Frontiers in pediatrics, 8, 658</ref> y un mayor riesgo de enfermedades metabólicas como obesidad. <ref>Korpela, K., Salonen, A., Virta, L. J., Kekkonen, R. A., Forslund, K., Bork, P., & De Vos, W. M. (2016). Intestinal microbiome is related to lifetime antibiotic use in Finnish pre-school children. Nature communications, 7, 10410</ref> En lactantes se observó que la amoxicilina y los macrólidos provocan cambios significativos en la microbiota intestinal caracterizados por un cambio en las clases bacterianas Bifidobacteria, Enterobacteria y Clostridia. <ref>Korpela, K., Salonen, A., Saxen, H., Nikkonen, A., Peltola, V., Jaakkola, T., ... & Kolho, K. L. (2020). Antibiotics in early life associate with specific gut microbiota signatures in a prospective longitudinal infant cohort. Pediatric Research, 1-6.</ref> Un solo curso de antibióticos en adultos provoca cambios en la microbiota bacteriana y fúngica, con cambios aún más persistentes en las comunidades fúngicas. <ref name="Seelbinder, B. 2020">Seelbinder, B., Chen, J., Brunke, S., Vazquez-Uribe, R., Santhaman, R., Meyer, A. C., ... & Panagiotou, G. (2020). Antibiotics create a shift from mutualism to competition in human gut communities with a longer-lasting impact on fungi than bacteria. Microbiome, 8(1), 1-20</ref> Las bacterias y los hongos viven juntos en el intestino y lo más probable es que exista una competencia por las fuentes de nutrientes presentes. <ref>Cabral, D. J., Penumutchu, S., Norris, C., Morones-Ramirez, J. R., & Belenky, P. (2018). Microbial competition between Escherichia coli and Candida albicans reveals a soluble fungicidal factor. Microbial cell, 5(5), 249</ref> <ref>Peleg, A. Y., Hogan, D. A., & Mylonakis, E. (2010). Medically important bacterial–fungal interactions. Nature Reviews Microbiology, 8(5), 340-349</ref> Se encontró que las bacterias comensales en el intestino regulan el crecimiento y patogenicidad de ''Candida albicans'' por sus metabolitos, particularmente por propionato, ácido acético y 5-dodecenoato. <ref name="Seelbinder, B. 2020" /> <ref>Rebecka Ventin-Holmberg, Anja Eberl, Schahzad Saqib, Katri Korpela, Seppo Virtanen, Taina Sipponen, Anne Salonen, Päivi Saavalainen, Eija Nissilä, Bacterial and Fungal Profiles as Markers of Infliximab Drug Response in Inflammatory Bowel Disease, Journal of Crohn's and Colitis, 2020;, jjaa252, https://doi.org/10.1093/ecco-jcc/jjaa252</ref> El propionato y el ácido acético son ácidos grasos de cadena corta (AGCC) que se ha observado que son beneficiosos para la salud de la microbiota intestinal. <ref>El Hage, R., Hernandez-Sanabria, E., Calatayud Arroyo, M., Props, R., & Van de Wiele, T. (2019). Propionate-producing consortium restores antibiotic-induced dysbiosis in a dynamic in vitro model of the human intestinal microbial ecosystem. Frontiers in microbiology, 10, 1206.</ref> <ref>Tian, X., Hellman, J., Horswill, A. R., Crosby, H. A., Francis, K. P., & Prakash, A. (2019). Elevated gut microbiome-derived propionate levels are associated with reduced sterile lung inflammation and bacterial immunity in mice. Frontiers in microbiology, 10, 159.</ref> <ref>Li, Y., Faden, H. S., & Zhu, L. (2020). The response of the gut microbiota to dietary changes in the first two years of life. Frontiers in pharmacology, 11, 334.</ref> Cuando los antibióticos afectan el crecimiento de bacterias en el intestino, puede haber un crecimiento excesivo de ciertos hongos, que pueden ser patógenos cuando no están regulados. <ref name="Seelbinder, B. 2020" /> |
|||
== Problemas de privacidad == |
|||
El ADN microbiano que habita en el cuerpo humano de una persona puede identificar de manera única a la persona. La privacidad de una persona puede verse comprometida si la persona donó datos de ADN de microbios de forma anónima. Su condición médica e identidad podrían ser reveladas. <ref>{{Cita web|url=http://www.scientificamerican.com/article/microbial-dna-in-human-body-can-be-used-to-identify-individuals|título=Microbial DNA in Human Body Can Be Used to Identify Individuals|fechaacceso=2015-05-17|autor=magazine|nombre=Ewen|sitioweb=[[Scientific American]]}}</ref> <ref>{{Cita publicación|título=Microbiomes raise privacy concerns|apellidos=Callaway|nombre=Ewen|publicación=Nature|volumen=521|número=7551|páginas=136|bibcode=2015Natur.521..136C|doi=10.1038/521136a|pmid=25971486|año=2015}}</ref> <ref>{{Cita publicación|url=http://phenomena.nationalgeographic.com/2015/05/11/can-the-microbes-you-leave-behind-be-used-to-identify-you/|título=Can The Microbes You Leave Behind Be Used to Identify You?|apellidos=Yong|nombre=Ed|fecha=2015-05-11|publicación=National Geographic|fechaacceso=2015-05-17}}</ref> |
|||
== Véase también == |
|||
== Referencias == |
|||
{{Microbioma Humano}} |
|||
[[Categoría:Bacteria]] |
|||
[[Categoría:Bacteriología]] |
|||
[[Categoría:Microbiología]] |
|||
[[Categoría:Wikipedia:Páginas con traducciones sin revisar]] |
|||
Revisión del 01:44 2 ago 2022

La microbiota es la gama de microorganismos que pueden ser comensales, simbióticos o patógenos que se encuentran en y sobre todos los organismos multicelulares, incluidas las plantas. La microbiota incluye bacterias, arqueas, protistas, hongos y virus, [2] [3] y se ha descubierto que son cruciales para la homeostasis inmunológica, hormonal y metabólica de su huésped.
El término microbioma describe los genomas colectivos de los microbios que residen en un nicho ecológico o dentro de los mismos microbios. [4] [5] [6]
El microbioma y el huésped surgieron durante la evolución como una unidad sinérgica a partir de la epigenética y las características genéticas, a veces denominadas colectivamente holobionte. [7] [8] La presencia de microbiota en intestinos humanos y de otros metazoos ha sido fundamental para comprender la coevolución entre metazoos y bacterias. [9] [10] La microbiota juega un papel clave en las respuestas inmunitarias y metabólicas intestinales a través de su producto de fermentación (ácido graso de cadena corta), el acetato. [11]
Introducción
Todas las plantas y animales, desde formas de vida simples hasta humanos, viven en estrecha asociación con organismos microbianos. [12] Varios avances han impulsado la percepción de los microbiomas, entre ellos:[13]
- La capacidad de realizar análisis genómicos y de expresión génica de células individuales y de comunidades microbianas completas en las disciplinas de metagenómica y metatranscriptómica
- Bases de datos accesibles para investigadores de múltiples disciplinas
- Métodos de análisis matemático adecuados para conjuntos de datos complejos
Los biólogos han llegado a apreciar que los microbios constituyen una parte importante del fenotipo de un organismo, mucho más allá del estudio de caso simbiótico ocasional. [13]
Tipos de relaciones microbio-huésped
El comensalismo, un concepto desarrollado por Pierre-Joseph van Beneden (1809–1894), un profesor belga de la Universidad de Lovaina durante el siglo XIX [14] es fundamental para el microbioma, donde la microbiota coloniza un huésped en una coexistencia no dañina. La relación con su huésped se denomina mutualista cuando los organismos realizan tareas que se sabe que son útiles para el huésped, [15] [16] parásito, cuando es desventajoso para el huésped. Otros autores definen una situación como mutualista donde ambos se benefician y comensal, donde el huésped no afectado beneficia al simbionte. [17] Un intercambio de nutrientes puede ser bidireccional o unidireccional, puede depender del contexto y puede ocurrir de diversas maneras. [17] La microbiota que se espera que esté presente y que, en circunstancias normales, no causa enfermedad, se considera flora normal o microbiota normal ; [15] la flora normal no solo puede ser inofensiva, sino que también puede proteger al huésped. [18]
Adquisición y cambio
La adquisición inicial de la microbiota en los animales, desde los mamíferos hasta las esponjas marinas, se produce al nacer, e incluso puede ocurrir a través de la línea de células germinales. En las plantas, el proceso de colonización puede iniciarse bajo tierra en la zona de la raíz, alrededor de la semilla en germinación, la espermósfera, u originarse en las partes de la superficie, la filosfera y la zona de la flor o antósfera. [19] La estabilidad de la microbiota de la rizosfera a lo largo de las generaciones depende del tipo de planta, pero aún más de la composición del suelo, es decir, del entorno vivo y no vivo. [20] Clínicamente, se puede adquirir nueva microbiota a través del trasplante de microbiota fecal para tratar infecciones como la infección crónica por C. difficile. [21]
Microbiota por huésped

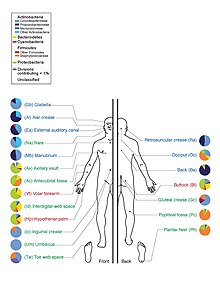
Humanos
La microbiota humana incluye bacterias, hongos, arqueas y virus. Se excluyen los microanimales que viven en el cuerpo humano. El microbioma humano se refiere a sus genomas colectivos. [15]
Los seres humanos están colonizados por muchos microorganismos; la estimación tradicional era que los humanos viven con diez veces más células no humanas que células humanas; estimaciones más recientes han reducido esto a 3:1 e incluso a aproximadamente 1:1. [22] [23] [24]
De hecho, estos son tan pequeños que hay alrededor de 100 billones de microbiota en el cuerpo humano. [25]
El Proyecto Microbioma Humano secuenció el genoma de la microbiota humana, centrándose particularmente en la microbiota que normalmente habita en la piel, la boca, la nariz, el tracto digestivo y la vagina. [15] Alcanzó un hito en 2012 cuando publicó los resultados iniciales. [26]
Animales
- Los anfibios tienen microbiota en la piel. [27] Algunas especies son capaces de portar un hongo llamado Batrachochytrium dendrobatidis, que en otras puede causar una infección mortal llamada Quitridiomicosis dependiendo de su microbioma, resistiendo la colonización de patógenos o inhibiendo su crecimiento con péptidos cutáneos antimicrobianos. [28]
- En los mamíferos, los herbívoros como el ganado dependen de su microbioma ruminal para convertir la celulosa en proteínas, ácidos grasos de cadena corta y gases. Los métodos de cultivo no pueden proporcionar información sobre todos los microorganismos presentes. Los estudios metagenómicos comparativos arrojaron el sorprendente resultado de que el ganado individual posee estructuras comunitarias, fenotipo predicho y potenciales metabólicos marcadamente diferentes, [29] a pesar de que fueron alimentados con dietas idénticas, fueron alojados juntos y aparentemente fueron funcionalmente idénticos en su utilización de recursos de la pared celular vegetal.
- Los ratones se han convertido en los mamíferos más estudiados en cuanto a sus microbiomas. La microbiota intestinal se ha estudiado en relación con la enfermedad alérgica de las vías respiratorias, la obesidad, las enfermedades gastrointestinales y la diabetes. El cambio perinatal de la microbiota a través de dosis bajas de antibióticos puede tener efectos duraderos sobre la susceptibilidad futura a la enfermedad alérgica de las vías respiratorias. La frecuencia de ciertos subconjuntos de microbios se ha relacionado con la gravedad de la enfermedad. La presencia de microbios específicos al principio de la vida posnatal instruye futuras respuestas inmunitarias. [30] [31] En ratones gnotobióticos, se descubrió que ciertas bacterias intestinales transmitían un fenotipo particular a los ratones receptores libres de gérmenes, lo que promovía la acumulación de células T reguladoras del colon y cepas que modulaban la adiposidad del ratón y las concentraciones de metabolitos cecales. [32] Este enfoque combinatorio permite una comprensión a nivel de sistemas de las contribuciones microbianas a la biología humana. [33] Pero también se han estudiado otros tejidos mucoides como el pulmón y la vagina en relación con enfermedades como el asma, la alergia y la vaginosis. [34]
- Los insectos tienen sus propios microbiomas. Por ejemplo, las hormigas cortadoras de hojas forman enormes colonias subterráneas que cosechan cientos de kilogramos de hojas cada año y no pueden digerir la celulosa de las hojas directamente. Mantienen jardines de hongos como principal fuente de alimento de la colonia. Si bien el hongo en sí no digiere la celulosa, sí lo hace una comunidad microbiana que contiene una diversidad de bacterias. El análisis del genoma de la población microbiana reveló muchos genes que intervienen en la digestión de la celulosa. El perfil enzimático de degradación de carbohidratos predicho de este microbioma es similar al del rumen bovino, pero la composición de especies es casi completamente diferente. [35] La microbiota intestinal de la mosca de la fruta puede afectar la apariencia de su intestino, al afectar la tasa de renovación epitelial, el espacio celular y la composición de diferentes tipos de células en el epitelio. [36] Cuando la polilla Spodoptera exigua se infecta con baculovirus, los genes relacionados con el sistema inmunológico se regulan a la baja y la cantidad de su microbiota intestinal aumenta. [37] En el intestino de los dípteros, las células enteroendocrinas detectan los metabolitos derivados de la microbiota intestinal y coordinan las ramas antibacteriana, mecánica y metabólica de la respuesta inmunitaria innata del intestino del huésped a la microbiota comensal. [38]
- Los peces tienen sus propios microbiomas, incluida la especie de vida corta Nothobranchius furzeri (killis turquesa). La transferencia de la microbiota intestinal de los killis jóvenes a los killis de mediana edad prolonga significativamente la vida útil de los killis de mediana edad. [39]
Plantas

Recientemente, se descubrió que el microbioma de la planta se origina a partir de la semilla. [41] Los microorganismos que se transmiten a través de la semilla migran a la plántula en desarrollo en una ruta específica en la que una comunidad se mueve hacia las hojas y otra hacia las raíces. [41] En el diagrama de la derecha, la microbiota que coloniza la rizosfera, ingresa a las raíces y coloniza la próxima generación de tubérculos a través de los estolones, se visualiza con un color rojo. Las bacterias presentes en el tubérculo madre, que pasan a través de los estolones y migran a la planta, así como a la próxima generación de tubérculos, se muestran en azul.
- El suelo es el principal reservorio de bacterias que colonizan los tubérculos de papa.
- Las bacterias se reclutan del suelo más o menos independientemente de la variedad de patata.
- Las bacterias pueden colonizar los tubérculos predominantemente desde el interior de las plantas a través del estolón.
- La microbiota bacteriana de los tubérculos de patata consiste en bacterias transmitidas de una generación de tubérculos a la siguiente y bacterias reclutadas del suelo que colonizan las plantas de patata a través de la raíz.

Plantilla:Clear leftLas plantas son anfitriones atractivos para los microorganismos ya que proporcionan una variedad de nutrientes. Los microorganismos en las plantas pueden ser epífitos (que se encuentran en las plantas) o endófitos (que se encuentran dentro del tejido vegetal). [42] [43] Los oomicetos y los hongos, a través de la evolución convergente, han desarrollado una morfología similar y ocupan nichos ecológicos similares. Desarrollan hifas, estructuras parecidas a hilos que penetran en la célula huésped. En situaciones mutualistas, la planta a menudo intercambia azúcares de hexosa por fosfato inorgánico del simbionte fúngico. Se especula que asociaciones tan antiguas ayudaron a las plantas cuando colonizaron la tierra por primera vez. [17] [44] Las bacterias promotoras del crecimiento vegetal (PGPB) brindan a la planta servicios esenciales como la fijación de nitrógeno, la solubilización de minerales como el fósforo, la síntesis de hormonas vegetales, la mejora directa de la absorción de minerales y la protección contra patógenos. [45] [46] Los PGPB pueden proteger a las plantas de los patógenos compitiendo con el patógeno por un nicho ecológico o un sustrato, produciendo aleloquímicos inhibidores o induciendo una resistencia sistémica en las plantas huésped al patógeno [19]Plantilla:Clear left
Investigación
La relación simbiótica entre un huésped y su microbiota está bajo investigación de laboratorio para determinar cómo puede dar forma al sistema inmunológico de los mamíferos. [47] [48] En muchos animales, el sistema inmunitario y la microbiota pueden participar en una "conversación cruzada" mediante el intercambio de señales químicas, lo que puede permitir que la microbiota influya en la reactividad y la orientación inmunitarias. [49] Las bacterias se pueden transferir de madre a hijo a través del contacto directo y después del nacimiento. [50] A medida que se establece el microbioma infantil, las bacterias comensales pueblan rápidamente el intestino, lo que provoca una variedad de respuestas inmunitarias y "programa" el sistema inmunitario con efectos duraderos. [49] Las bacterias pueden estimular el tejido linfoide asociado con la mucosa intestinal, lo que permite que el tejido produzca anticuerpos contra los patógenos que pueden ingresar al intestino. [49]
El microbioma humano puede desempeñar un papel en la activación de los receptores tipo toll en los intestinos, un tipo de receptor de reconocimiento de patrones que las células huésped utilizan para reconocer peligros y reparar daños. Los patógenos pueden influir en esta coexistencia, lo que conduce a una desregulación inmunitaria, incluida la susceptibilidad a enfermedades, mecanismos de inflamación, tolerancia inmunitaria y enfermedades autoinmunes. [51] [52]
Coevolución de la microbiota

Los organismos evolucionan dentro de los ecosistemas de modo que el cambio de un organismo afecta el cambio de los demás. La teoría de la evolución del hologenoma propone que un objeto de la selección natural no es el organismo individual, sino el organismo junto con sus organismos asociados, incluidas sus comunidades microbianas.
Arrecifes de coral. La teoría del hologenoma se originó en estudios sobre arrecifes de coral. [53] Los arrecifes de coral son las estructuras más grandes creadas por organismos vivos y contienen comunidades microbianas abundantes y altamente complejas. Durante las últimas décadas, se han producido importantes disminuciones en las poblaciones de coral. El cambio climático, la contaminación del agua y la pesca excesiva son tres factores de estrés que se han descrito como causantes de la susceptibilidad a las enfermedades. Se han descrito más de veinte enfermedades coralinas diferentes, pero de estas, solo unas pocas han tenido sus agentes causales aislados y caracterizados. El blanqueamiento de corales es la más grave de estas enfermedades. En el mar Mediterráneo, el blanqueamiento de Oculina patagonica se describió por primera vez en 1994 y pronto se determinó que se debía a una infección por Vibrio shiloi. De 1994 a 2002, el blanqueamiento bacteriano de O. patagonica ocurrió cada verano en el Mediterráneo oriental. Sorprendentemente, sin embargo, después de 2003, O. patagonica en el Mediterráneo oriental ha sido resistente a la infección por V. shiloi, aunque otras enfermedades todavía causan blanqueamiento. La sorpresa proviene del conocimiento de que los corales son longevos, con vidas del orden de décadas, [54] y no tienen sistemas inmunológicos adaptativos. Su sistema inmunitario innato no produce anticuerpos, y aparentemente no deberían ser capaces de responder a nuevos desafíos, excepto en escalas de tiempo evolutivas.
El enigma de cómo los corales lograron adquirir resistencia a un patógeno específico llevó a una propuesta de 2007, que existe una relación dinámica entre los corales y sus comunidades microbianas simbióticas. Se cree que al alterar su composición, el holobionte puede adaptarse a las condiciones ambientales cambiantes mucho más rápidamente que solo mediante la mutación y la selección genéticas. La extrapolación de esta hipótesis a otros organismos, incluidas plantas y animales superiores, condujo a la propuesta de la teoría de la evolución del hologenoma. [53]
A 2007 todavía se estaba debatiendo la teoría del hologenoma.[55] Una de las principales críticas ha sido la afirmación de que V. shiloi se identificó erróneamente como el agente causante del blanqueamiento de corales y que su presencia en O. patagonica blanqueada era simplemente una colonización oportunista.[56] Si esto es cierto, la observación básica que conduce a la teoría no sería válida. La teoría ha ganado una popularidad significativa como una forma de explicar los cambios rápidos en la adaptación que de otro modo no pueden explicarse mediante los mecanismos tradicionales de selección natural. Dentro de la teoría del hologenoma, el holobionte no sólo se ha convertido en la unidad principal de la selección natural sino también en el resultado de otro paso de integración que también se observa a nivel celular (simbiogénesis, endosimbiosis) y genómico.[7]
Métodos de búsqueda
Secuenciación de amplicones dirigidos
La secuenciación de amplicones dirigidos se basa en tener algunas expectativas sobre la composición de la comunidad que se está estudiando. En la secuenciación del amplicón diana, se apunta a un marcador filogenéticamente informativo para la secuenciación. Tal marcador debería estar presente idealmente en todos los organismos esperados. También debería evolucionar de tal manera que se conserve lo suficiente como para que los cebadores puedan apuntar a genes de una amplia gama de organismos mientras evoluciona lo suficientemente rápido como para permitir una resolución más fina a nivel taxonómico. Un marcador común para los estudios del microbioma humano es el gen del ARNr 16S bacteriano ( es decir, "ADNr 16S", la secuencia de ADN que codifica la molécula de ARN ribosómico). [57] Dado que los ribosomas están presentes en todos los organismos vivos, el uso de 16S rDNA permite amplificar el ADN de muchos más organismos que si se usara otro marcador. El gen 16S rRNA contiene regiones de evolución lenta y 9 regiones de evolución rápida, también conocidas como regiones hipervariables (HVR); [58] el primero se puede utilizar para diseñar cebadores amplios, mientras que el último permite una distinción taxonómica más precisa. Sin embargo, la resolución a nivel de especie no suele ser posible con el ADNr 16S. La selección de cebadores es un paso importante, ya que cualquier cosa que no pueda ser objetivo del cebador no se amplificará y, por lo tanto, no se detectará; además, se pueden seleccionar diferentes conjuntos de cebadores para amplificar diferentes HVR en el gen, o pares de ellos. La elección adecuada de qué HVR amplificar debe hacerse de acuerdo con los grupos taxonómicos de interés, ya que se ha demostrado que las diferentes regiones objetivo influyen en la clasificación taxonómica. [59]
Los estudios específicos de comunidades eucariotas y virales son limitados [60] y están sujetos al desafío de excluir el ADN del huésped de la amplificación y la reducción de la biomasa eucariota y viral en el microbioma humano. [61]
Después de secuenciar los amplicones, se utilizan métodos filogenéticos moleculares para inferir la composición de la comunidad microbiana. Esto se puede hacer a través de metodologías de agrupamiento, agrupando los amplicones en unidades taxonómicas operativas (OTU); o alternativamente con metodologías de eliminación de ruido, identificando variantes de secuencia de amplicón (ASV).
Luego se infieren las relaciones filogenéticas entre las secuencias. Debido a la complejidad de los datos, las medidas de distancia, como las distancias UniFrac, generalmente se definen entre muestras de microbioma, y los métodos multivariantes posteriores se llevan a cabo en las matrices de distancia. Un punto importante es que la escala de los datos es extensa y se deben adoptar enfoques adicionales para identificar patrones a partir de la información disponible. Las herramientas utilizadas para analizar los datos incluyen VAMPS, [62] QIIME, [63] mothur [64] y DADA2 [65] o UNOISE3 [66] para la eliminación de ruido.
Secuenciación metagenómica
La metagenómica también se usa ampliamente para estudiar comunidades microbianas. [67] [68] [69] En la secuenciación metagenómica, el ADN se recupera directamente de muestras ambientales de manera no dirigida con el objetivo de obtener una muestra imparcial de todos los genes de todos los miembros de la comunidad. Estudios recientes utilizan secuenciación de escopeta Sanger o pirosecuenciación para recuperar las secuencias de las lecturas. [70] Luego, las lecturas se pueden ensamblar en contigs. Para determinar la identidad filogenética de una secuencia, se compara con secuencias genómicas completas disponibles utilizando métodos como BLAST. Un inconveniente de este enfoque es que muchos miembros de las comunidades microbianas no tienen un genoma secuenciado representativo, pero esto también se aplica a la secuenciación de amplicón 16S rRNA y es un problema fundamental. [57] Con la secuenciación de escopeta, se puede resolver teniendo una alta cobertura (50-100x) del genoma desconocido, haciendo efectivamente un ensamblaje del genoma de novo. Tan pronto como se dispone de un genoma completo de un organismo desconocido, se puede comparar filogenéticamente y colocar al organismo en su lugar en el árbol de la vida, creando nuevos taxones. Un enfoque emergente es combinar la secuenciación de escopeta con datos de ligadura de proximidad (Hi-C) para ensamblar genomas microbianos completos sin cultivo. [71]
A pesar del hecho de que la metagenómica está limitada por la disponibilidad de secuencias de referencia, una ventaja significativa de la metagenómica sobre la secuenciación de amplicones dirigidos es que los datos metagenómicos pueden dilucidar el potencial funcional del ADN comunitario. [72] [73] Las encuestas de genes dirigidos no pueden hacer esto, ya que solo revelan la relación filogenética entre el mismo gen de diferentes organismos. El análisis funcional se realiza comparando las secuencias recuperadas con bases de datos de anotaciones metagenómicas como KEGG. Las vías metabólicas en las que participan estos genes se pueden predecir con herramientas como MG-RAST, [74] CAMERA [75] e IMG/M . [76]
Enfoques basados en ARN y proteínas
Se han realizado estudios de metatranscriptómica para estudiar la expresión génica de comunidades microbianas a través de métodos como la pirosecuenciación del ARN extraído. [77] Los estudios basados en la estructura también han identificado ARN no codificantes (ncRNA), como las ribozimas de la microbiota. [78] La metaproteómica es un enfoque que estudia las proteínas expresadas por la microbiota, dando una idea de su potencial funcional. [79]
Proyectos
El Proyecto Microbioma Humano lanzado en 2008 fue una iniciativa de los Institutos Nacionales de Salud de los Estados Unidos para identificar y caracterizar los microorganismos que se encuentran tanto en humanos sanos como enfermos. [80] El proyecto de cinco años, mejor caracterizado como un estudio de factibilidad con un presupuesto de $115 millones, probaron cómo los cambios en el microbioma humano se asocian con la salud o la enfermedad humana. [80]
El Earth Microbiome Project (EMP) es una iniciativa para recolectar muestras naturales y analizar la comunidad microbiana en todo el mundo. Los microbios son muy abundantes, diversos y tienen un papel importante en el sistema ecológico. Sin embargo, en 2010, se estimó que el esfuerzo de secuenciación del ADN ambiental global total había producido menos del 1 por ciento del ADN total encontrado en un litro de agua de mar o un gramo de suelo, [81] y las interacciones específicas entre los microbios son en gran parte desconocidas. El EMP tiene como objetivo procesar hasta 200.000 muestras en diferentes biomas, generando una base de datos completa de microbios en la tierra para caracterizar entornos y ecosistemas por composición e interacción microbiana. Usando estos datos, se pueden proponer y probar nuevas teorías ecológicas y evolutivas. [82]
Microbiota intestinal y diabetes tipo 2
La microbiota intestinal es muy importante para la salud del huésped porque desempeña un papel en la degradación de los polisacáridos no digeribles (fermentación de almidón resistente, oligosacáridos, inulina) fortaleciendo la integridad intestinal o dando forma al epitelio intestinal, recolectando energía, protegiendo contra patógenos y regulando la inmunidad del huésped. [83] [84]
Varios estudios mostraron que la composición bacteriana intestinal en pacientes diabéticos se alteró con niveles elevados de Lactobacillus gasseri, Streptococcus mutans y miembros de Clostridiales, con disminución de bacterias productoras de butirato como Roseburia intestinalis y Faecalibacterium prausnitzii [85] [86] . Esta alteración se debe a muchos factores como el abuso de antibióticos, la dieta y la edad .
La disminución en la producción de butirato está asociada con un defecto en la permeabilidad intestinal, este defecto conduce al caso de la endotoxemia, que es el aumento del nivel de lipopolisacáridos circulantes de la pared de las células bacterianas gram negativas. Se encuentra que la endotoxemia tiene asociación con el desarrollo de resistencia a la insulina. [85]
Además, la producción de butirato afecta el nivel de serotonina. [85] El nivel elevado de serotonina contribuye a la obesidad, que se sabe que es un factor de riesgo para el desarrollo de diabetes.
La microbiota se puede trasplantar en el cuerpo humano con fines médicos. [87]
Desarrollo de la microbiota intestinal y antibióticos
La colonización de la microbiota intestinal humana puede comenzar antes del nacimiento. [88] Existen múltiples factores en el entorno que afectan el desarrollo de la microbiota, siendo el modo de nacimiento uno de los más impactantes. [89]
Otro factor que se ha observado que causa grandes cambios en la microbiota intestinal, particularmente en los niños, es el uso de antibióticos, asociado con problemas de salud como un IMC más alto, [90] [91] y un mayor riesgo de enfermedades metabólicas como obesidad. [92] En lactantes se observó que la amoxicilina y los macrólidos provocan cambios significativos en la microbiota intestinal caracterizados por un cambio en las clases bacterianas Bifidobacteria, Enterobacteria y Clostridia. [93] Un solo curso de antibióticos en adultos provoca cambios en la microbiota bacteriana y fúngica, con cambios aún más persistentes en las comunidades fúngicas. [94] Las bacterias y los hongos viven juntos en el intestino y lo más probable es que exista una competencia por las fuentes de nutrientes presentes. [95] [96] Se encontró que las bacterias comensales en el intestino regulan el crecimiento y patogenicidad de Candida albicans por sus metabolitos, particularmente por propionato, ácido acético y 5-dodecenoato. [94] [97] El propionato y el ácido acético son ácidos grasos de cadena corta (AGCC) que se ha observado que son beneficiosos para la salud de la microbiota intestinal. [98] [99] [100] Cuando los antibióticos afectan el crecimiento de bacterias en el intestino, puede haber un crecimiento excesivo de ciertos hongos, que pueden ser patógenos cuando no están regulados. [94]
Problemas de privacidad
El ADN microbiano que habita en el cuerpo humano de una persona puede identificar de manera única a la persona. La privacidad de una persona puede verse comprometida si la persona donó datos de ADN de microbios de forma anónima. Su condición médica e identidad podrían ser reveladas. [101] [102] [103]
Véase también
Referencias
- ↑ Dastogeer, K.M., Tumpa, F.H., Sultana, A., Akter, M.A. and Chakraborty, A. (2020) "Plant microbiome–an account of the factors that shape community composition and diversity". Current Plant Biology, 23: 100161. doi 10.1016/j.cpb.2020.100161.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ↑ De Sordi, Luisa; Lourenço, Marta; Debarbieux, Laurent (2019). «The battle within: interactions of bacteriophages and bacteria in the gastrointestinal tract». Cell Host & Microbe 25 (2): 210-18. PMID 30763535. doi:10.1016/j.chom.2019.01.018.
- ↑ Peterson, J; Garges, S (2009). «The NIH Human Microbiome Project». Genome Research (NIH HMP Working Group) 19 (12): 2317-23. PMC 2792171. PMID 19819907. doi:10.1101/gr.096651.109.
- ↑ Backhed, F.; Ley, R. E.; Sonnenburg, J. L.; Peterson, D. A.; Gordon, J. I. (2005). «Host-Bacterial Mutualism in the Human Intestine». Science 307 (5717): 1915-20. Bibcode:2005Sci...307.1915B. PMID 15790844. doi:10.1126/science.1104816.
- ↑ Turnbaugh, P. J.; Ley, R. E.; Hamady, M.; Fraser-Liggett, C. M.; Knight, R.; Gordon, J. I. (2007). «The Human Microbiome Project». Nature 449 (7164): 804-10. Bibcode:2007Natur.449..804T. PMC 3709439. PMID 17943116. doi:10.1038/nature06244.
- ↑ Ley, R. E.; Peterson, D. A.; Gordon, J. I. (2006). «Ecological and Evolutionary Forces Shaping Microbial Diversity in the Human Intestine». Cell 124 (4): 837-48. PMID 16497592. doi:10.1016/j.cell.2006.02.017.
- ↑ a b Salvucci, E. (2016). «Microbiome, holobiont and the net of life». Critical Reviews in Microbiology 42 (3): 485-94. PMID 25430522. doi:10.3109/1040841X.2014.962478.
- ↑ Guerrero, R.; Margulis, Lynn; Berlanga, M. (2013). «Symbiogenesis: The holobiont as a unit of evolution». International Microbiology 16 (3): 133-43. PMID 24568029. doi:10.2436/20.1501.01.188.
- ↑ Davenport, Emily R et al. "The human microbiome in evolution". BMC Biology. vol. 15,1 127. 27 Dec. 2017, doi:10.1186/s12915-017-0454-7
- ↑ "Evolution of the human gut flora". Andrew H. Moeller, Yingying Li, Eitel Mpoudi Ngole, Steve Ahuka-Mundeke, Elizabeth V. Lonsdorf, Anne E. Pusey, Martine Peeters, Beatrice H. Hahn, Howard Ochman. Proceedings of the National Academy of Sciences. Nov 2014, 111 (46) 16431-35; doi: 10.1073/pnas.1419136111
- ↑ Jugder, Bat-Erdene; Kamareddine, Layla; Watnick, Paula I. (2021). «Microbiota-derived acetate activates intestinal innate immunity via the Tip60 histone acetyltransferase complex». Immunity 54 (8): 1683-97.e3. ISSN 1074-7613. PMC 8363570. PMID 34107298. doi:10.1016/j.immuni.2021.05.017.
- ↑ Mendes, R.; Raaijmakers, J.M. (2015). «Cross-kingdom similarities in microbiome functions». The ISME Journal 9 (9): 1905-1907. PMC 4542044. PMID 25647346. doi:10.1038/ismej.2015.7.
- ↑ a b Bosch, T. C. G.; McFall-Ngai, M. J. (2011). «Metaorganisms as the new frontier». Zoology 114 (4): 185-190. PMC 3992624. PMID 21737250. doi:10.1016/j.zool.2011.04.001.
- ↑ Poreau B., Biologie et complexité : histoire et modèles du commensalisme. PhD Dissertation, University of Lyon, France, 2014.
- ↑ a b c d Sherwood, Linda; Willey, Joanne; Woolverton, Christopher (2013). Prescott's Microbiology (9th edición). New York: McGraw Hill. pp. 713-721. ISBN 9780073402406. OCLC 886600661.
- ↑ Quigley, E. M. (Sep 2013). «Gut bacteria in health and disease». Gastroenterol Hepatol (N Y) 9 (9): 560-9. PMC 3983973. PMID 24729765.
- ↑ a b c «Four hundred-million-year-old vesicular arbuscular mycorrhizae». Proc. Natl. Acad. Sci. USA 91 (25): 11841-3. 1994. Bibcode:1994PNAS...9111841R. PMC 45331. PMID 11607500. doi:10.1073/pnas.91.25.11841.
- ↑ Copeland, CS (Sep–Oct 2017). «The World Within Us». Healthcare Journal of New Orleans.
- ↑ a b «Use of Plant Growth-Promoting Bacteria for Biocontrol of Plant Diseases: Principles, Mechanisms of Action, and Future Prospects». Appl Environ Microbiol 71 (9): 4951-9. 2005. Bibcode:2005ApEnM..71.4951C. PMC 1214602. PMID 16151072. doi:10.1128/AEM.71.9.4951-4959.2005.
- ↑ Tkacz, Andrzej; Cheema, Jitender; Chandra, Govind; Grant, Alastair; Poole, Philip S. (Nov 2015). «Stability and succession of the rhizosphere microbiota depends upon plant type and soil composition». ISME J. 9 (11): 2349-2359. PMC 4611498. PMID 25909975. doi:10.1038/ismej.2015.41.
- ↑ Copeland, CS (19 April 2019). «What is Clostridium difficile?». Vitalacy.
- ↑ Judah L. Rosner for Microbe Magazine, Feb 2014. Ten Times More Microbial Cells than Body Cells in Humans?
- ↑ Alison Abbott for Nature News. Jan 8 2016 Scientists bust myth that our bodies have more bacteria than human cells
- ↑ Sender, R; Fuchs, S; Milo, R (Jan 2016). «Are We Really Vastly Outnumbered? Revisiting the Ratio of Bacterial to Host Cells in Humans». Cell 164 (3): 337-40. PMID 26824647. doi:10.1016/j.cell.2016.01.013.
- ↑ "On and in You." Micropia, www.micropia.nl/en/discover/stories/on-and-in-you/#:~:text=They're%20on%20you%2C%20in,re%20known%20as%20human%20microbiota.
- ↑ «NIH Human Microbiome Project defines normal bacterial makeup of the body». NIH News. 13 June 2012.
- ↑ Bataille, A; Lee-Cruz, L; Tripathi, B; Kim, H; Waldman, B (Jan 2016). «Microbiome Variation Across Amphibian Skin Regions: Implications for Chytridiomycosis Mitigation Efforts». Microb. Ecol. 71 (1): 221-32. PMID 26271741. doi:10.1007/s00248-015-0653-0.
- ↑ «Innate immune defenses of amphibian skin: antimicrobial peptides and more». Animal Conservation 10 (4): 425-8. 2007. doi:10.1111/j.1469-1795.2007.00150.x.
- ↑ Brulc JM; Antonopoulos DA; Miller MEB (2009). «Gene-centric metagenomics of the fiber-adherent bovine rumen microbiome reveals forage specific glycoside hydrolases». Proc. Natl. Acad. Sci. USA 106 (6): 1948-53. Bibcode:2009PNAS..106.1948B. PMC 2633212. PMID 19181843. doi:10.1073/pnas.0806191105.
- ↑ Russell SL, Gold MJ (May 2012). «Early life antibiotic-driven changes in microbiota enhance susceptibility to allergic asthma». EMBO Rep. 13 (5): 440-7. PMC 3343350. PMID 22422004. doi:10.1038/embor.2012.32.
- ↑ «Perinatal antibiotic-induced shifts in gut microbiota have differential effects on inflammatory lung diseases». J Allergy Clin Immunol 135 (1): 100-9. Aug 2014. PMID 25145536. doi:10.1016/j.jaci.2014.06.027.
- ↑ «An obesity-associated gut microbiome with increased capacity for energy harvest». Nature 444 (7122): 1027-31. Dec 2006. Bibcode:2006Natur.444.1027T. PMID 17183312. doi:10.1038/nature05414.
- ↑ «Identifying gut microbe-host phenotype relationships using combinatorial communities in gnotobiotic mice.». Sci. Transl. Med. 6 (220): 220. Jan 2014. PMC 3973144. PMID 24452263. doi:10.1126/scitranslmed.3008051.
- ↑ Barfod, KK; Roggenbuck, M; Hansen, LH; Schjørring, S; Larsen, ST; Sørensen, SJ; Krogfelt, KA (2013). «The murine lung microbiome in relation to the intestinal and vaginal bacterial communities». BMC Microbiol 13: 303. PMC 3878784. PMID 24373613. doi:10.1186/1471-2180-13-303.
- ↑ Suen; Scott JJ; Aylward FO (2010). «An Insect Herbivore Microbiome with High Plant Biomass-Degrading Capacity». En Sonnenburg, Justin, ed. PLOS Genet 6 (9): e1001129. PMC 2944797. PMID 20885794. doi:10.1371/journal.pgen.1001129.
- ↑ Broderick, Nichole A.; Buchon, Nicolas; Lemaitre, Bruno (2014). «Microbiota-Induced Changes in Drosophila melanogaster Host Gene Expression and Gut Morphology». mBio 5 (3): e01117-14. PMC 4045073. PMID 24865556. doi:10.1128/mBio.01117-14.
- ↑ Jakubowska, Agata K.; Vogel, Heiko; Herrero, Salvador (May 2013). «Increase in Gut Microbiota after Immune Suppression in Baculovirus-infected Larvae». PLOS Pathog 9 (5): e1003379. PMC 3662647. PMID 23717206. doi:10.1371/journal.ppat.1003379.
- ↑ Watnick, Paula I.; Jugder, Bat-Erdene (1 de febrero de 2020). «Microbial Control of Intestinal Homeostasis via Enteroendocrine Cell Innate Immune Signaling». Trends in Microbiology (en inglés) 28 (2): 141-149. ISSN 0966-842X. PMC 6980660. PMID 31699645. doi:10.1016/j.tim.2019.09.005.
- ↑ «The influence of the microbiota on immune development, chronic inflammation, and cancer in the context of aging». Microbial Cell 6 (8): 324-334. 2019. PMC 6685047. PMID 31403049. doi:10.15698/mic2019.08.685.
- ↑ Buchholz, F., Antonielli, L., Kostić, T., Sessitsch, A. and Mitter, B. (2019) "The bacterial community in potato is recruited from soil and partly inherited across generations". PLOS One, 14(11): e0223691. doi 10.1371/journal.pone.0223691.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ↑ a b Abdelfattah, Ahmed; Wisniewski, Michael; Schena, Leonardo; Tack, Ayco J. M. (2021). «Experimental evidence of microbial inheritance in plants and transmission routes from seed to phyllosphere and root». Environmental Microbiology (en inglés) 23 (4): 2199-2214. ISSN 1462-2920. PMID 33427409. doi:10.1111/1462-2920.15392.
- ↑ Berlec, Aleš (1 de septiembre de 2012). «Novel techniques and findings in the study of plant microbiota: Search for plant probiotics». Plant Science. 193–194: 96-102. PMID 22794922. doi:10.1016/j.plantsci.2012.05.010.
- ↑ Whipps, J.m.; Hand, P.; Pink, D.; Bending, G.d. (1 de diciembre de 2008). «Phyllosphere microbiology with special reference to diversity and plant genotype». Journal of Applied Microbiology (en inglés) 105 (6): 1744-1755. ISSN 1365-2672. PMID 19120625. doi:10.1111/j.1365-2672.2008.03906.x.
- ↑ «Common themes in nutrient acquisition by plant symbiotic microbes, described by the Gene Ontology». BMC Microbiology. 9(Suppl 1): S6. 2009. PMC 2654666. PMID 19278554. doi:10.1186/1471-2180-9-S1-S6.
- ↑ Kloepper, J. W (1993). «Plant growth-promoting rhizobacteria as biological control agents». En Metting, F. B. Jr, ed. Soil microbial ecology: applications in agricultural and environmental management. New York: Marcel Dekker Inc. pp. 255-274. ISBN 978-0-8247-8737-0.
- ↑ Bloemberg, G. V.; Lugtenberg, B. J. J. (2001). «Molecular basis of plant growth promotion and biocontrol by rhizobacteria». Current Opinion in Plant Biology 4 (4): 343-350. PMID 11418345. doi:10.1016/S1369-5266(00)00183-7.
- ↑ Palm, Noah W.; de Zoete, Marcel R.; Flavell, Richard A. (30 June 2015). «Immune–microbiota interactions in health and disease». Clinical Immunology 159 (2): 122-127. ISSN 1521-6616. PMC 4943041. PMID 26141651. doi:10.1016/j.clim.2015.05.014.
- ↑ Round, June L.; O'Connell, Ryan M.; Mazmanian, Sarkis K. (2010). «Coordination of tolerogenic immune responses by the commensal microbiota». Journal of Autoimmunity 34 (3): J220-J225. PMC 3155383. PMID 19963349. doi:10.1016/j.jaut.2009.11.007.
- ↑ a b c Cahenzli, Julia; Balmer, Maria L.; McCoy, Kathy D. (2012). «Microbial-immune cross-talk and regulation of the immune system». Immunology 138 (1): 12-22. PMC 3533697. PMID 22804726. doi:10.1111/j.1365-2567.2012.03624.x.
- ↑ Rosenberg, Eugene; Zilber-Rosenberg, Ilana (2016). «Microbes drive evolution of animals and plants: the hologenome concept». mBio 7 (2): e01395-15. PMC 4817260. PMID 27034283. doi:10.1128/mbio.01395-15.
- ↑ Blander, J Magarian; Longman, Randy S; Iliev, Iliyan D; Sonnenberg, Gregory F; Artis, David (19 July 2017). «Regulation of inflammation by microbiota interactions with the host». Nature Immunology 18 (8): 851-860. ISSN 1529-2908. PMC 5800875. PMID 28722709. doi:10.1038/ni.3780.
- ↑ Nikoopour, E; Singh, B (2014). «Reciprocity in microbiome and immune system interactions and its implications in disease and health». Inflamm Allergy Drug Targets 13 (2): 94-104. PMID 24678760. doi:10.2174/1871528113666140330201056.
- ↑ a b «The role of microorganisms in coral health, disease and evolution». Nature Reviews Microbiology 5 (5): 355-362. 2007. PMID 17384666. doi:10.1038/nrmicro1635.
- ↑ «Coral bleaching: the role of the host». Trends in Ecology and Evolution 24 (1): 16-20. 2009. PMID 19022522. doi:10.1016/j.tree.2008.09.005.
- ↑ «The hologenome theory disregards the coral holobiont». Nature Reviews Microbiology 5 (10): Online Correspondence. 2007. doi:10.1038/nrmicro1635-c1.
- ↑ «Bacteria are not the primary cause of bleaching in the Mediterranean coral Oculina patagonica». The ISME Journal 2 (1): 67-73. 2008. PMID 18059488. doi:10.1038/ismej.2007.88.
- ↑ a b Kuczynski, J.; Lauber, C. L.; Walters, W. A.; Parfrey, L. W.; Clemente, J. C.; Gevers, D.; Knight, R. (2011). «Experimental and analytical tools for studying the human microbiome». Nature Reviews Genetics 13 (1): 47-58. PMC 5119550. PMID 22179717. doi:10.1038/nrg3129. Error en la cita: Etiqueta
<ref>no válida; el nombre «Kucz2012» está definido varias veces con contenidos diferentes - ↑ Chakravorty, Soumitesh; Helb, Danica; Burday, Michele; Connell, Nancy; Alland, David (May 2007). «A detailed analysis of 16S ribosomal RNA gene segments for the diagnosis of pathogenic bacteria». Journal of Microbiological Methods (en inglés) 69 (2): 330-339. PMC 2562909. PMID 17391789. doi:10.1016/j.mimet.2007.02.005.
- ↑ Soriano-Lerma, Ana; Pérez-Carrasco, Virginia; Sánchez-Marañón, Manuel; Ortiz-González, Matilde; Sánchez-Martín, Victoria; Gijón, Juan; Navarro-Mari, José María; García-Salcedo, José Antonio et al. (December 2020). «Influence of 16S rRNA target region on the outcome of microbiome studies in soil and saliva samples». Scientific Reports (en inglés) 10 (1): 13637. Bibcode:2020NatSR..1013637S. ISSN 2045-2322. PMC 7423937. PMID 32788589. doi:10.1038/s41598-020-70141-8.
- ↑ Marchesi, J. R. (2010). «Prokaryotic and Eukaryotic Diversity of the Human Gut». Advances in Applied Microbiology Volume 72. Advances in Applied Microbiology 72. pp. 43-62. ISBN 9780123809896. PMID 20602987. doi:10.1016/S0065-2164(10)72002-5.
- ↑ Vestheim, H.; Jarman, S. N. (2008). «Blocking primers to enhance PCR amplification of rare sequences in mixed samples – a case study on prey DNA in Antarctic krill stomachs». Frontiers in Zoology 5: 12. PMC 2517594. PMID 18638418. doi:10.1186/1742-9994-5-12.
- ↑ «VAMPS: The Visualization and Analysis of Microbial Population Structures». Bay Paul Center, MBL, Woods Hole. Consultado el 11 March 2012.
- ↑ Caporaso, J. G.; Kuczynski, J.; Stombaugh, J.; Bittinger, K.; Bushman, F. D.; Costello, E. K.; Fierer, N.; Peña, A. G. et al. (2010). «QIIME allows analysis of high-throughput community sequencing data». Nature Methods 7 (5): 335-336. PMC 3156573. PMID 20383131. doi:10.1038/nmeth.f.303.
- ↑ Schloss, P. D.; Westcott, S. L.; Ryabin, T.; Hall, J. R.; Hartmann, M.; Hollister, E. B.; Lesniewski, R. A.; Oakley, B. B. et al. (2009). «Introducing mothur: Open-Source, Platform-Independent, Community-Supported Software for Describing and Comparing Microbial Communities». Applied and Environmental Microbiology 75 (23): 7537-7541. Bibcode:2009ApEnM..75.7537S. PMC 2786419. PMID 19801464. doi:10.1128/AEM.01541-09.
- ↑ Callahan, Benjamin J.; McMurdie, Paul J.; Rosen, Michael J.; Han, Andrew W.; Johnson, Amy Jo A.; Holmes, Susan P. (July 2016). «DADA2: High-resolution sample inference from Illumina amplicon data». Nature Methods (en inglés) 13 (7): 581-583. ISSN 1548-7105. PMC 4927377. PMID 27214047. doi:10.1038/nmeth.3869.
- ↑ Edgar, Robert C. (15 de octubre de 2016). UNOISE2: improved error-correction for Illumina 16S and ITS amplicon sequencing (en inglés). p. 081257. doi:10.1101/081257.
- ↑ Turnbaugh, P. J.; Hamady, M.; Yatsunenko, T.; Cantarel, B. L.; Duncan, A.; Ley, R. E.; Sogin, M. L.; Jones, W. J. et al. (2008). «A core gut microbiome in obese and lean twins». Nature 457 (7228): 480-484. Bibcode:2009Natur.457..480T. PMC 2677729. PMID 19043404. doi:10.1038/nature07540.
- ↑ Qin, J.; Li, R.; Raes, J.; Arumugam, M.; Burgdorf, K. S.; Manichanh, C.; Nielsen, T.; Pons, N. et al. (2010). «A human gut microbial gene catalogue established by metagenomic sequencing». Nature 464 (7285): 59-65. Bibcode:2010Natur.464...59.. PMC 3779803. PMID 20203603. doi:10.1038/nature08821.
- ↑ Tringe, S. G.; Von Mering, C.; Kobayashi, A.; Salamov, A. A.; Chen, K.; Chang, H. W.; Podar, M.; Short, J. M. et al. (2005). «Comparative Metagenomics of Microbial Communities». Science 308 (5721): 554-557. Bibcode:2005Sci...308..554T. PMID 15845853. doi:10.1126/science.1107851.
- ↑ Wooley, J. C.; Godzik, A.; Friedberg, I. (2010). «A Primer on Metagenomics». En Bourne, Philip E., ed. PLOS Computational Biology 6 (2): e1000667. Bibcode:2010PLSCB...6E0667W. PMC 2829047. PMID 20195499. doi:10.1371/journal.pcbi.1000667.
- ↑ Watson, Mick; Roehe, Rainer; Walker, Alan W.; Dewhurst, Richard J.; Snelling, Timothy J.; Ivan Liachko; Langford, Kyle W.; Press, Maximilian O. et al. (28 de febrero de 2018). «Assembly of 913 microbial genomes from metagenomic sequencing of the cow rumen». Nature Communications (en inglés) 9 (1): 870. Bibcode:2018NatCo...9..870S. ISSN 2041-1723. PMC 5830445. PMID 29491419. doi:10.1038/s41467-018-03317-6.
- ↑ Muller, J.; Szklarczyk, D.; Julien, P.; Letunic, I.; Roth, A.; Kuhn, M.; Powell, S.; Von Mering, C. et al. (2009). «EggNOG v2.0: Extending the evolutionary genealogy of genes with enhanced non-supervised orthologous groups, species and functional annotations». Nucleic Acids Research 38 (Database issue): D190-D195. PMC 2808932. PMID 19900971. doi:10.1093/nar/gkp951.
- ↑ Kanehisa, M.; Goto, S.; Furumichi, M.; Tanabe, M.; Hirakawa, M. (2009). «KEGG for representation and analysis of molecular networks involving diseases and drugs». Nucleic Acids Research 38 (Database issue): D355-D360. PMC 2808910. PMID 19880382. doi:10.1093/nar/gkp896.
- ↑ Meyer, F.; Paarmann, D.; d'Souza, M.; Olson, R.; Glass, E. M.; Kubal, M.; Paczian, T.; Rodriguez, A. et al. (2008). «The metagenomics RAST server – a public resource for the automatic phylogenetic and functional analysis of metagenomes». BMC Bioinformatics 9: 386. PMC 2563014. PMID 18803844. doi:10.1186/1471-2105-9-386.
- ↑ Sun, S.; Chen, J.; Li, W.; Altintas, I.; Lin, A.; Peltier, S.; Stocks, K.; Allen, E. E. et al. (2010). «Community cyberinfrastructure for Advanced Microbial Ecology Research and Analysis: The CAMERA resource». Nucleic Acids Research 39 (Database issue): D546-D551. PMC 3013694. PMID 21045053. doi:10.1093/nar/gkq1102.
- ↑ Markowitz, V. M.; Ivanova, N. N.; Szeto, E.; Palaniappan, K.; Chu, K.; Dalevi, D.; Chen, I. M. A.; Grechkin, Y. et al. (2007). «IMG/M: A data management and analysis system for metagenomes». Nucleic Acids Research 36 (Database issue): D534-D538. PMC 2238950. PMID 17932063. doi:10.1093/nar/gkm869.
- ↑ Shi, Y.; Tyson, G. W.; Delong, E. F. (2009). «Metatranscriptomics reveals unique microbial small RNAs in the ocean's water column». Nature 459 (7244): 266-269. Bibcode:2009Natur.459..266S. PMID 19444216. doi:10.1038/nature08055.
- ↑ Jimenez, R. M.; Delwart, E.; Luptak, A (2011). «Structure-based Search Reveals Hammerhead Ribozymes in the Human Microbiome». Journal of Biological Chemistry 286 (10): 7737-7743. PMC 3048661. PMID 21257745. doi:10.1074/jbc.C110.209288.
- ↑ Maron, PA; Ranjard, L.; Mougel, C.; Lemanceau, P. (2007). «Metaproteomics: A New Approach for Studying Functional Microbial Ecology». Microbial Ecology 53 (3): 486-493. PMID 17431707. doi:10.1007/s00248-006-9196-8.
- ↑ a b «NIH Human Microbiome Project». US National Institutes of Health, Department of Health and Human Services, US Government. 2016. Archivado desde el original el 11 June 2016. Consultado el 14 June 2016. Parámetro desconocido
|url-status=ignorado (ayuda) - ↑ Gilbert, J. A.; Meyer, F.; Antonopoulos, D. (2010). «Meeting Report: The Terabase Metagenomics Workshop and the Vision of an Earth Microbiome Project». Standards in Genomic Sciences 3 (3): 243-248. PMC 3035311. PMID 21304727. doi:10.4056/sigs.1433550.
- ↑ Gilbert, J. A.; O'Dor, R.; King, N.; Vogel, T. M. (2011). «The importance of metagenomic surveys to microbial ecology: Or why Darwin would have been a metagenomic scientist». Microbial Informatics and Experimentation 1 (1): 5. PMC 3348666. PMID 22587826. doi:10.1186/2042-5783-1-5.
- ↑ Ibrahim, Nesma (1 de julio de 2018). «Gut Microbiota and Type 2 Diabetes Mellitus : What is The Link ?». Afro-Egyptian Journal of Infectious and Endemic Diseases (en inglés) 6 (2): 112-119. ISSN 2090-7184. doi:10.21608/aeji.2018.9950.
- ↑ Thursby, Elizabeth; Juge, Nathalie (1 de junio de 2017). «Introduction to the human gut microbiota». Biochemical Journal (en inglés) 474 (11): 1823-1836. ISSN 0264-6021. PMC 5433529. PMID 28512250. doi:10.1042/BCJ20160510.
- ↑ a b c Muñoz-Garach, Araceli; Diaz-Perdigones, Cristina; Tinahones, Francisco J. (December 2016). «Microbiota y diabetes mellitus tipo 2». Endocrinología y Nutrición 63 (10): 560-568. PMID 27633134. doi:10.1016/j.endonu.2016.07.008. Error en la cita: Etiqueta
<ref>no válida; el nombre «:1» está definido varias veces con contenidos diferentes - ↑ Blandino, G.; Inturri, R.; Lazzara, F.; Di Rosa, M.; Malaguarnera, L. (1 de noviembre de 2016). «Impact of gut microbiota on diabetes mellitus». Diabetes & Metabolism (en inglés) 42 (5): 303-315. ISSN 1262-3636. PMID 27179626. doi:10.1016/j.diabet.2016.04.004.
- ↑ https://microbioma.it. Falta el
|título=(ayuda) - ↑ Vandenplas, Y., Carnielli, V. P., Ksiazyk, J., Luna, M. S., Migacheva, N., Mosselmans, J. M., ... & Wabitsch, M. (2020), Factors affecting early-life intestinal microbiota development. Nutrition, 78, 110812.
- ↑ Korpela K, Helve O, Kolho KL, Saisto T, Skogberg K, Dikareva E, Stefanovic V, Salonen A, Andersson S, de Vos WM. Maternal Fecal Microbiota Transplantation in Cesarean-Born Infants Rapidly Restores Normal Gut Microbial Development: A Proof-of-Concept Study. Cell. 2020 Oct 15;183(2):324-334.e5. doi: 10.1016/j.cell.2020.08.047. Epub 2020 Oct 1. PMID 33007265.
- ↑ Korpela, K., Salonen, A., Saxen, H., Nikkonen, A., Peltola, V., Jaakkola, T., ... & Kolho, K. L. (2020). Antibiotics in early life associate with specific gut microbiota signatures in a prospective longitudinal infant cohort. Pediatric Research, 1-6
- ↑ Schei, K., Simpson, M. R., Avershina, E., Rudi, K., Øien, T., Júlíusson, P. B., ... & Ødegård, R. A. (2020). Early Gut Fungal and Bacterial Microbiota and Childhood Growth. Frontiers in pediatrics, 8, 658
- ↑ Korpela, K., Salonen, A., Virta, L. J., Kekkonen, R. A., Forslund, K., Bork, P., & De Vos, W. M. (2016). Intestinal microbiome is related to lifetime antibiotic use in Finnish pre-school children. Nature communications, 7, 10410
- ↑ Korpela, K., Salonen, A., Saxen, H., Nikkonen, A., Peltola, V., Jaakkola, T., ... & Kolho, K. L. (2020). Antibiotics in early life associate with specific gut microbiota signatures in a prospective longitudinal infant cohort. Pediatric Research, 1-6.
- ↑ a b c Seelbinder, B., Chen, J., Brunke, S., Vazquez-Uribe, R., Santhaman, R., Meyer, A. C., ... & Panagiotou, G. (2020). Antibiotics create a shift from mutualism to competition in human gut communities with a longer-lasting impact on fungi than bacteria. Microbiome, 8(1), 1-20
- ↑ Cabral, D. J., Penumutchu, S., Norris, C., Morones-Ramirez, J. R., & Belenky, P. (2018). Microbial competition between Escherichia coli and Candida albicans reveals a soluble fungicidal factor. Microbial cell, 5(5), 249
- ↑ Peleg, A. Y., Hogan, D. A., & Mylonakis, E. (2010). Medically important bacterial–fungal interactions. Nature Reviews Microbiology, 8(5), 340-349
- ↑ Rebecka Ventin-Holmberg, Anja Eberl, Schahzad Saqib, Katri Korpela, Seppo Virtanen, Taina Sipponen, Anne Salonen, Päivi Saavalainen, Eija Nissilä, Bacterial and Fungal Profiles as Markers of Infliximab Drug Response in Inflammatory Bowel Disease, Journal of Crohn's and Colitis, 2020;, jjaa252, https://doi.org/10.1093/ecco-jcc/jjaa252
- ↑ El Hage, R., Hernandez-Sanabria, E., Calatayud Arroyo, M., Props, R., & Van de Wiele, T. (2019). Propionate-producing consortium restores antibiotic-induced dysbiosis in a dynamic in vitro model of the human intestinal microbial ecosystem. Frontiers in microbiology, 10, 1206.
- ↑ Tian, X., Hellman, J., Horswill, A. R., Crosby, H. A., Francis, K. P., & Prakash, A. (2019). Elevated gut microbiome-derived propionate levels are associated with reduced sterile lung inflammation and bacterial immunity in mice. Frontiers in microbiology, 10, 159.
- ↑ Li, Y., Faden, H. S., & Zhu, L. (2020). The response of the gut microbiota to dietary changes in the first two years of life. Frontiers in pharmacology, 11, 334.
- ↑ magazine, Ewen. «Microbial DNA in Human Body Can Be Used to Identify Individuals». Scientific American. Consultado el 17 de mayo de 2015.
- ↑ Callaway, Ewen (2015). «Microbiomes raise privacy concerns». Nature 521 (7551): 136. Bibcode:2015Natur.521..136C. PMID 25971486. doi:10.1038/521136a.
- ↑ Yong, Ed (11 de mayo de 2015). «Can The Microbes You Leave Behind Be Used to Identify You?». National Geographic. Consultado el 17 de mayo de 2015.
